- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Инертные газы презентация
Содержание
- 1. Инертные газы
- 3. Название «Инертные
- 5. Химических соединений гелий не образует
- 7. Уникальный хладагент в экспериментальной физике Компонент
- 8. Нахождение в природе: в
- 9. Неоновые трубки В газовых лазерах В
- 10. В морской воде
- 11. Заполнение электрических лампочек Получение сверхчистых материалов
- 12. Нахождение в природе: в
- 13. Изотопный индикатор при исследованиях коррозии
- 14. 1962 год Нил Бартлетт (Канада)
- 15. +2
- 16. +6 3XeF4 +
- 17. Для диагностики в медицине В
- 18. Нахождение в природе: Содержание
- 19. Индикатор газовых потоков в доменных печах
- 20. www.themegallery.com Спасибо за работу!
Слайд 3
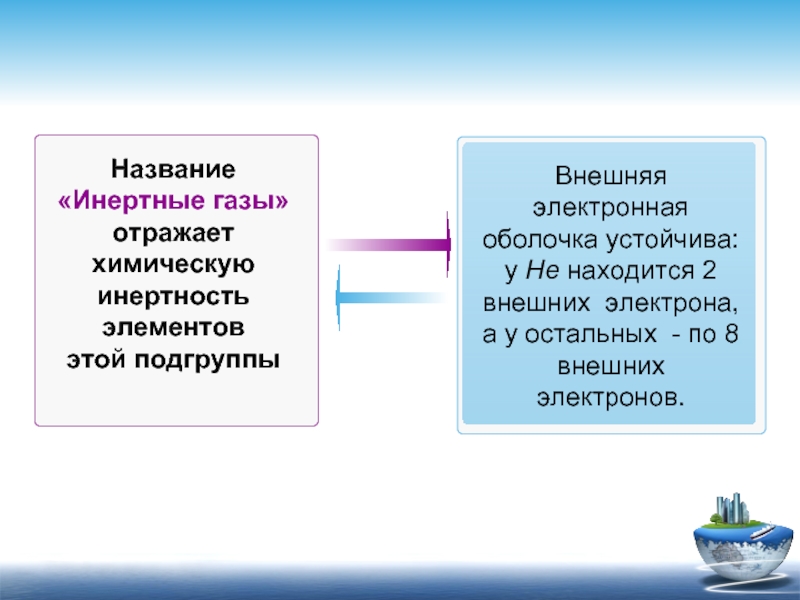
Название «Инертные газы» отражает химическую инертность элементов
этой подгруппы
Внешняя электронная оболочка
а у остальных - по 8 внешних электронов.
Слайд 4
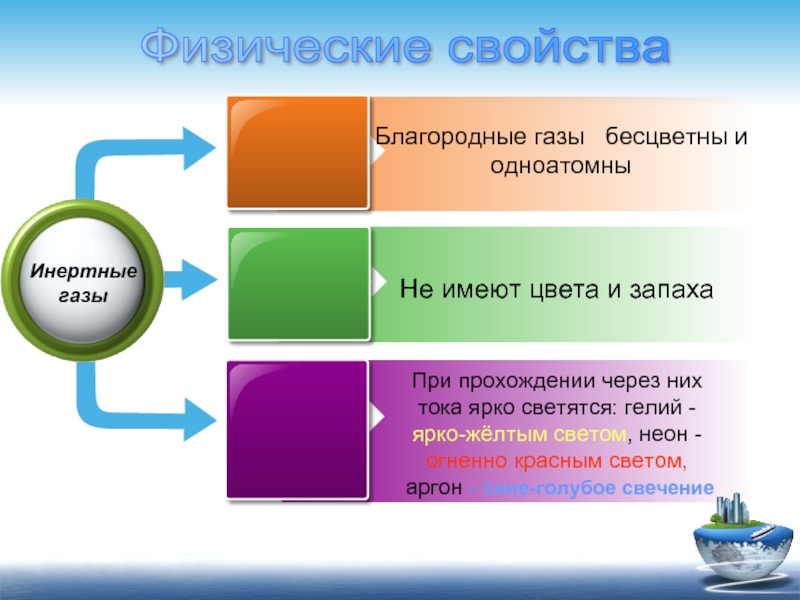
Благородные газы бесцветны и одноатомны
Не имеют цвета и запаха
При прохождении
аргон - сине-голубое свечение
Инертные газы
Физические свойства
Слайд 5 Химических соединений гелий не образует
Гелий
выделяют
из
природных
гелионосных
газов
Гелий
содержится
в минералах:
монацит,
торианит
Гелий
Слайд 6
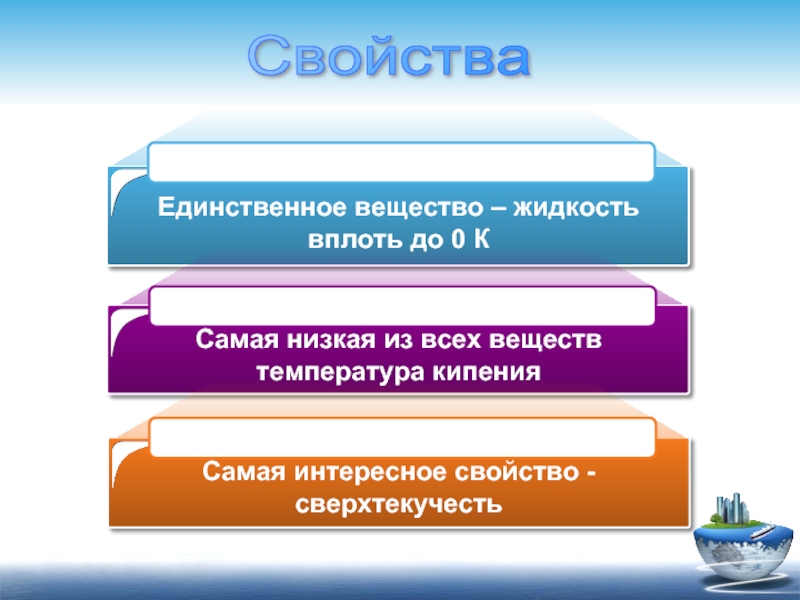
Единственное вещество – жидкость вплоть до 0 К
Самая низкая из всех
Самая интересное свойство - сверхтекучесть
Свойства
Слайд 7
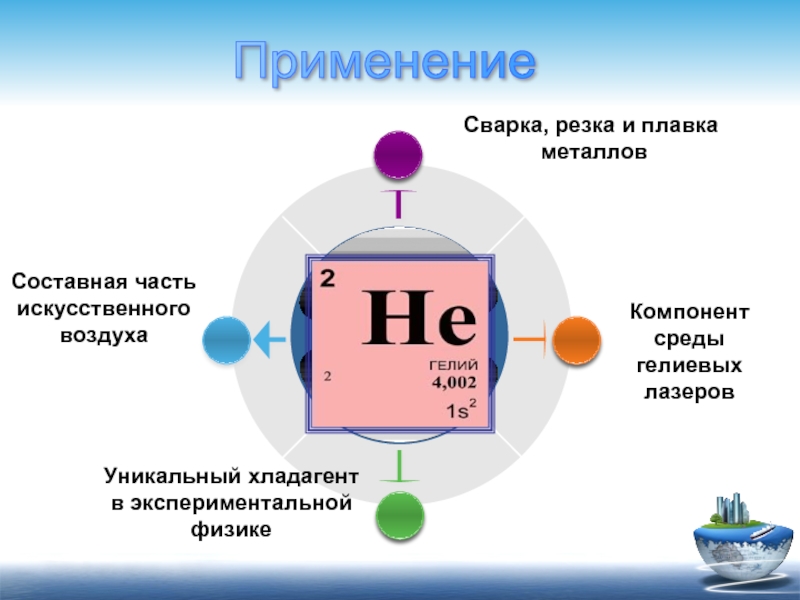
Уникальный хладагент в экспериментальной физике
Компонент среды гелиевых лазеров
Составная часть искусственного воздуха
Сварка,
металлов
Применение
Слайд 8
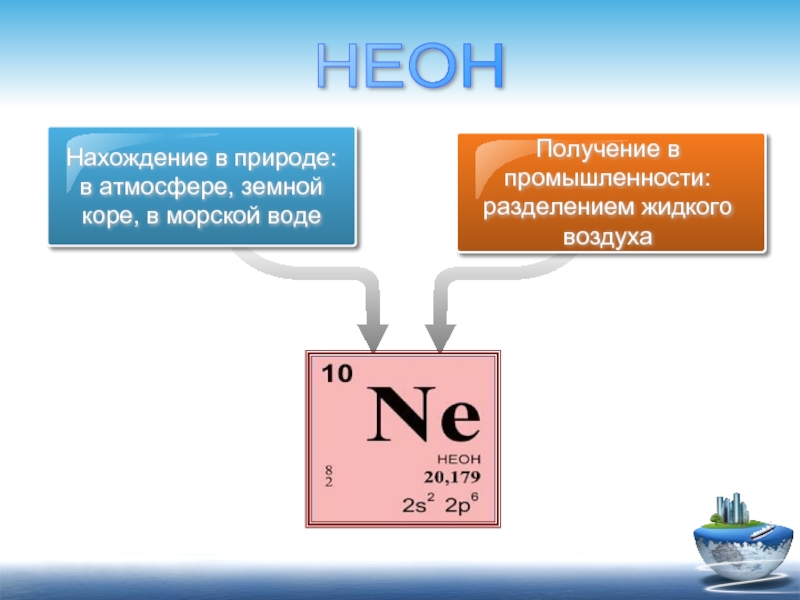
Нахождение в природе:
в атмосфере, земной коре, в морской воде
Получение в
НЕОН
Слайд 9
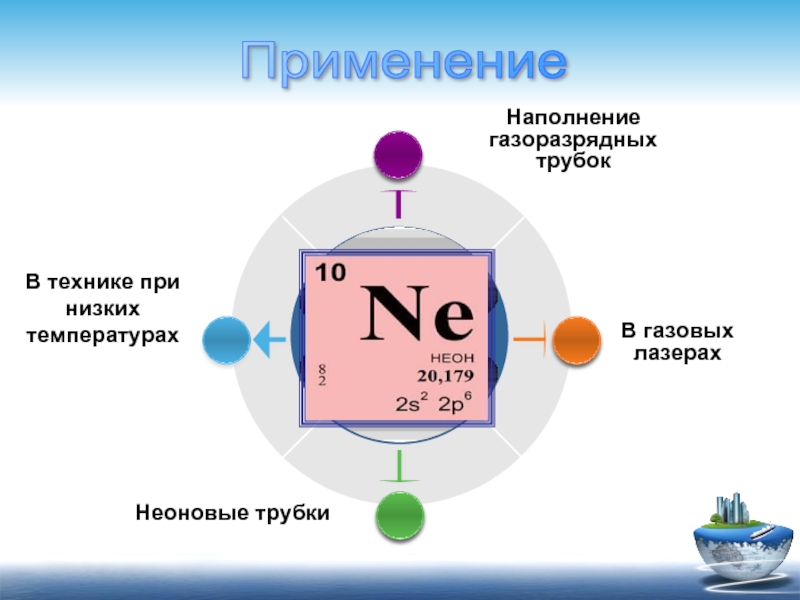
Неоновые трубки
В газовых лазерах
В технике при низких температурах
Наполнение
газоразрядных
трубок
Применение
Слайд 10
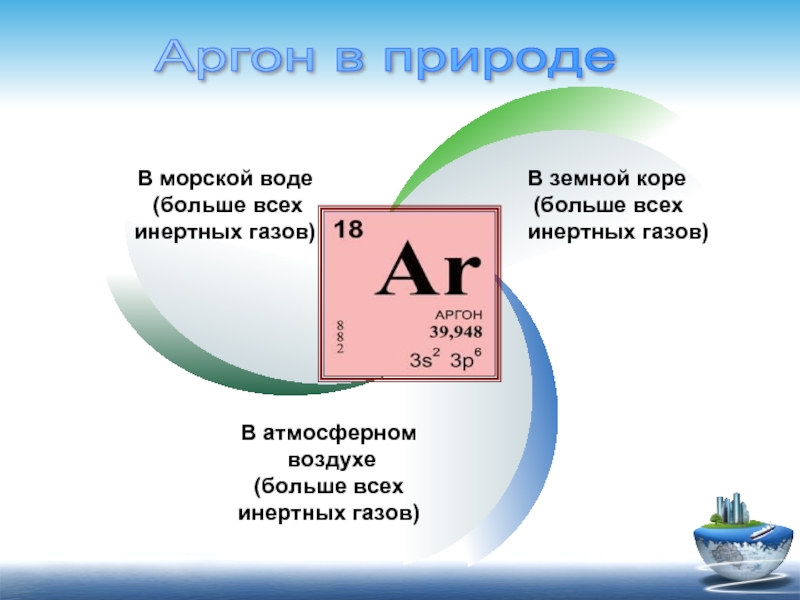
В морской воде
(больше всех
инертных газов)
В земной коре
(больше
инертных газов)
В атмосферном
воздухе
(больше всех
инертных газов)
Аргон в природе
Слайд 11
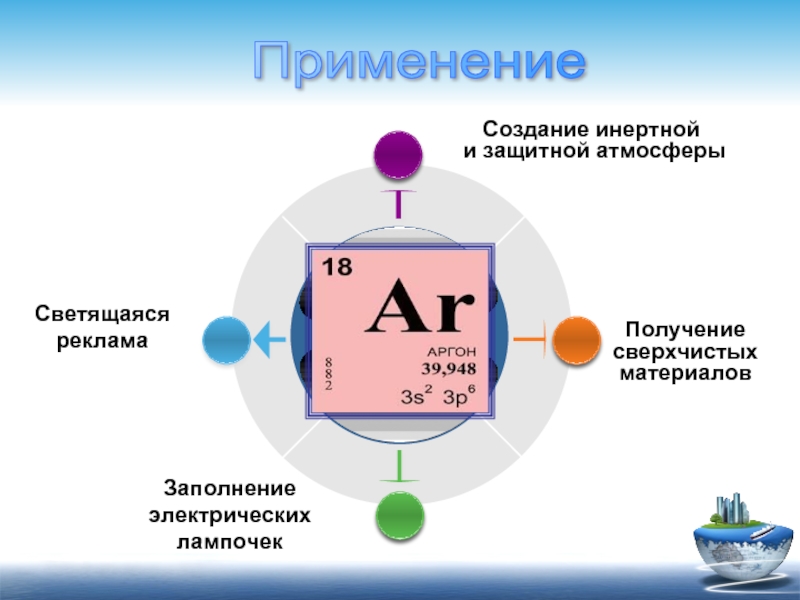
Заполнение электрических лампочек
Получение сверхчистых материалов
Светящаяся реклама
Создание инертной
и защитной атмосферы
Применение
Слайд 12
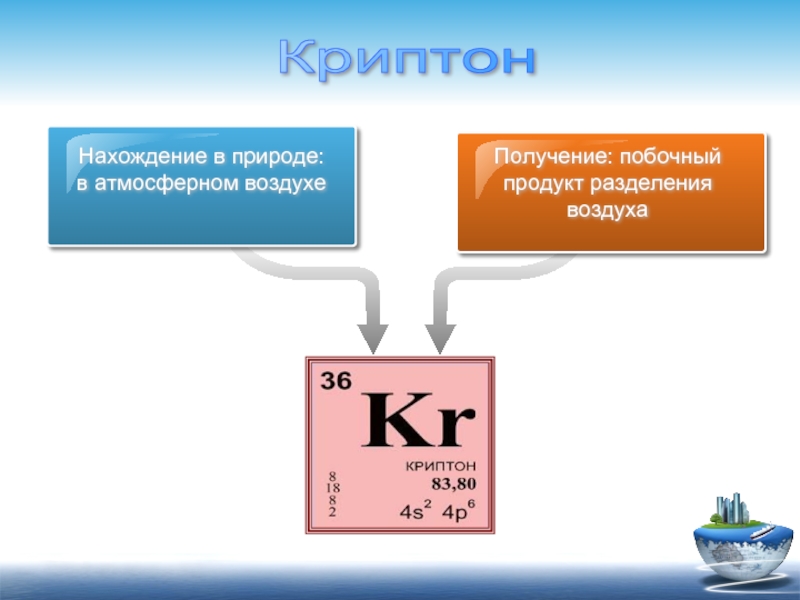
Нахождение в природе:
в атмосферном воздухе
Получение: побочный продукт разделения воздуха
Криптон
Слайд 13
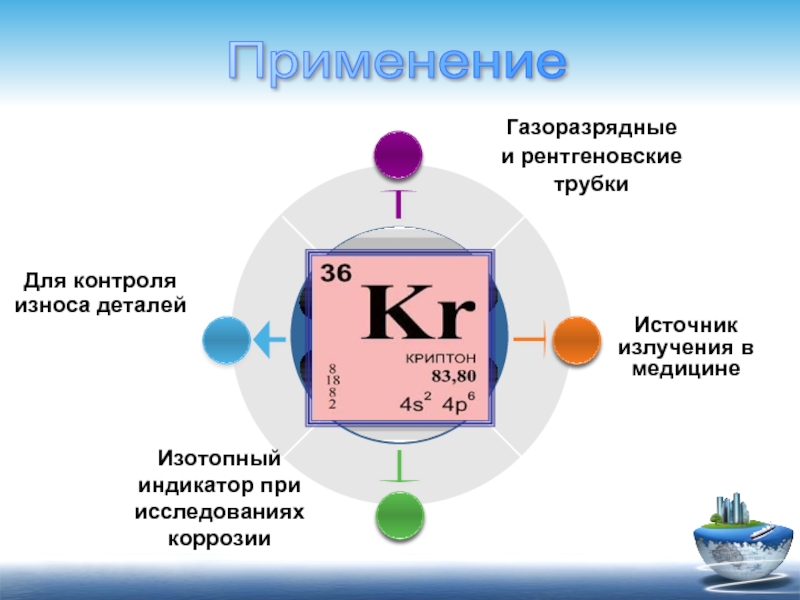
Изотопный
индикатор при исследованиях коррозии
Источник излучения в медицине
Для контроля износа деталей
Газоразрядные
и рентгеновские
трубки
Применение
Слайд 15
+2
+6
+8
Xe + F2 XeF2
2XeF2 + 4KOH
Xe + 2F2 XeF4
XeF4 + 2H2O 4HF + Xe + O2
Xe + 3F2 XeF6
XeF6 + 6KI 3I2 + Xe + 6KF
свет
400С0
60 атм
Фториды ксенона (+2, +4, +6)
Слайд 16
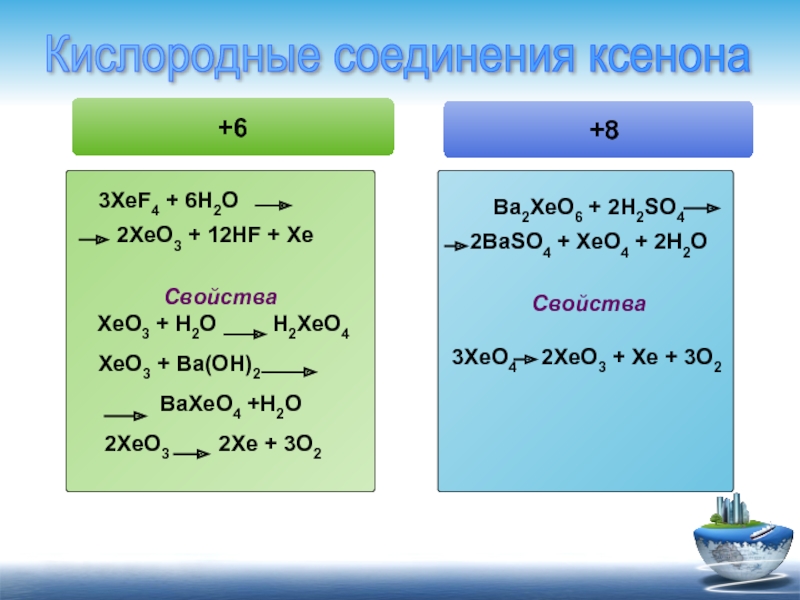
+6
3XeF4 + 6H2O
Свойства
XeO3 + H2O H2XeO4
XeO3 + Ba(OH)2
BaXeO4 +H2O
2XeO3 2Xe + 3O2
Ba2XeO6 + 2H2SO4 2BaSO4 + XeO4 + 2H2O
Свойства
3XeO4 2XeO3 + Xe + 3O2
+8
Кислородные соединения ксенона
Слайд 17
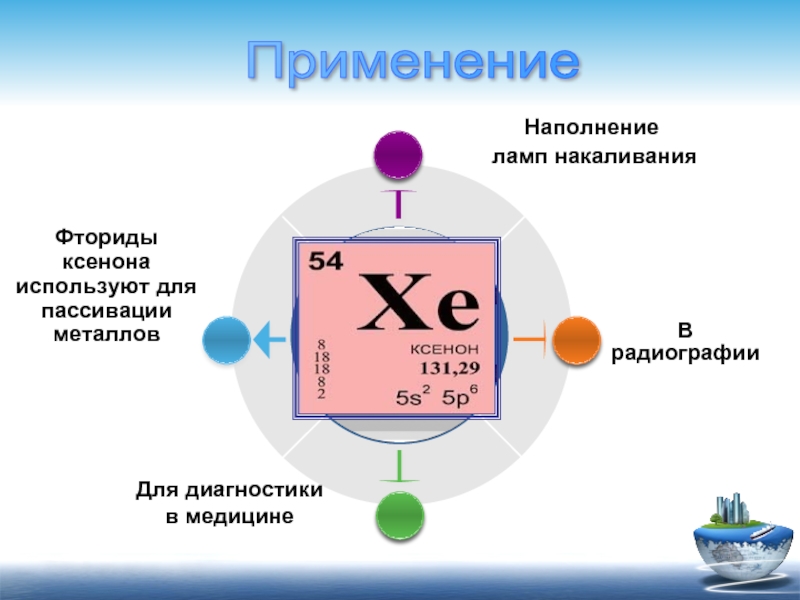
Для диагностики
в медицине
В радиографии
Фториды ксенона используют для пассивации металлов
Наполнение
Применение
Слайд 18
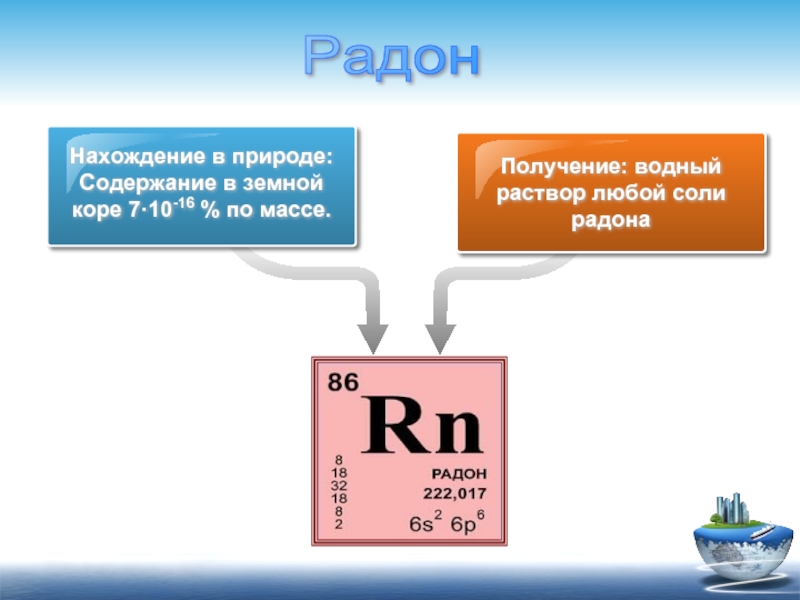
Нахождение в природе:
Содержание в земной коре 7·10-16 % по массе.
Получение:
Радон
Слайд 19
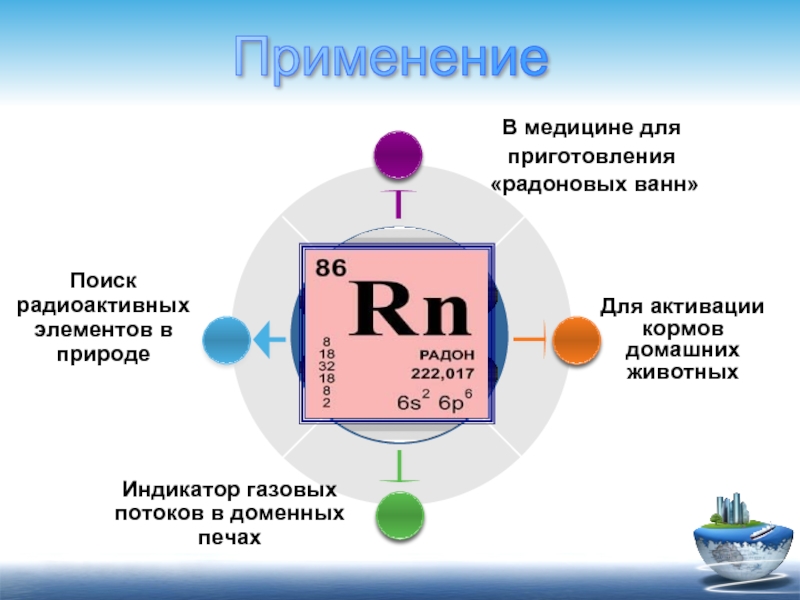
Индикатор газовых потоков в доменных печах
Для активации кормов домашних животных
Поиск радиоактивных
В медицине для
приготовления
«радоновых ванн»
Применение