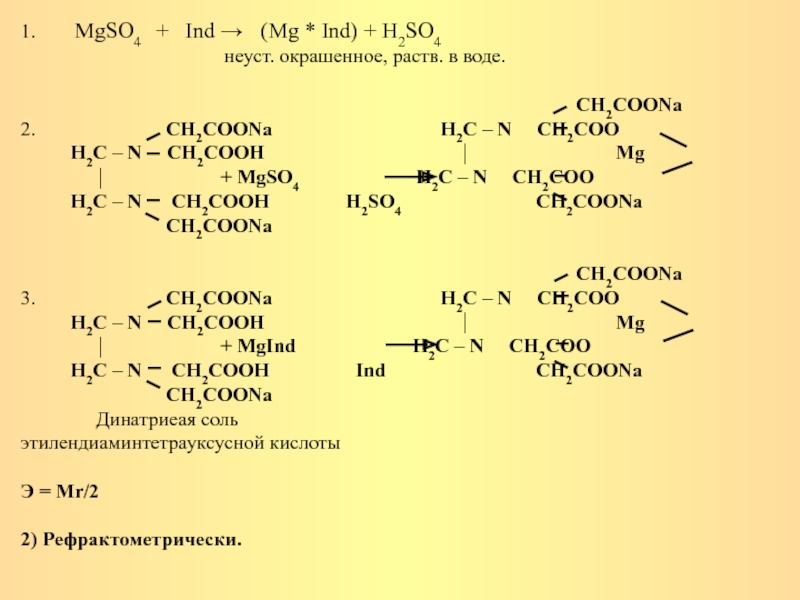- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
II группа периодической системы Д. И. Менделеева. Магния сульфат. Кальция хлорид презентация
Содержание
- 2. МАГНИЯ СУЛЬФАТ. MAGNESII SULFAS. MgSO4 • 7 H2O
- 3. Магния сульфат впервые был получен в 1695
- 4. Подлинность: Определяется по катиону Mg 2+
- 5. Количественное определение: 1) Комплексонометрический метод. Этим методом
- 7. Применение: Слабительное – внутрь 15,0 -
- 8. КАЛЬЦИЯ ХЛОРИД CALCII CHLORIDUM CaCl2• 6H2O
- 9. Получение: Получают в результате обработки карбоната
- 10. Подлинность: Соли кальция окрашивают бесцветное
- 12. Возможные методы: 2.
- 13. ЦИНКА СУЛЬФАТ. ZINCI SULFAS. ZnSO4 • 7H2O
- 14. Получение: Получают путем растворения цинка или
- 15. Подлинность: 1. С
- 17. Применение: В глазных каплях 0,25% и
- 18. Общая характеристика главной подгруппы III группы периодической
Слайд 3Магния сульфат впервые был получен в 1695 году. Как лечебное средство
его начали применять в конце XVIII в в Англии (отсюда его первоначальное название – горькая или английская соль).
В природе встречается в виде различных минералов, магнезит MgСO3 , доломит MgСO3 • CaCO3 , кизерит MgSO4 • 7 H2O или эмпосит, залежи которых встречаются в Сибири, на Кавказе, Кубани. Богаты сульфатом магния воды Каспийского моря. В промышленности получают из магнезита:
MgСO3 + H2SO4 → MgSO4 + H2O + CO2 ↑
Добавляют избыток серной кислоты во избежание гидролиза магния сульфата и образования основных солей.
Свойства:
Бесцветные призматические кристаллы или белый кристаллический порошок выветривающийся на воздухе, без запаха, горько – соленого вкуса. Хорошо растворяется в воде, практически не растворим в спирте 950 . рН нейтральная.
В природе встречается в виде различных минералов, магнезит MgСO3 , доломит MgСO3 • CaCO3 , кизерит MgSO4 • 7 H2O или эмпосит, залежи которых встречаются в Сибири, на Кавказе, Кубани. Богаты сульфатом магния воды Каспийского моря. В промышленности получают из магнезита:
MgСO3 + H2SO4 → MgSO4 + H2O + CO2 ↑
Добавляют избыток серной кислоты во избежание гидролиза магния сульфата и образования основных солей.
Свойства:
Бесцветные призматические кристаллы или белый кристаллический порошок выветривающийся на воздухе, без запаха, горько – соленого вкуса. Хорошо растворяется в воде, практически не растворим в спирте 950 . рН нейтральная.
Слайд 4Подлинность:
Определяется по катиону Mg 2+ и аниону SO42- .
HCl
1. MgSO4 + BaCl2 → BaSO4 ↓ + MgCl2
белый осадок,
не растворим в кислотах и щелочах
2. К раствору препарата прибавляют раствор хлорид аммония, раствор гидрофосфат натрия, раствор гидроксида аммония, образуется белый кристаллический осадок, растворимый в уксусной кислоте.
NH4Cl
MgSO4 + NH4OH + Na2HPO4 → MgNH4PO4 ↓ + Na2SO4 + H2O
белый осадок
Чистота:
Не должно быть посторонних примесей. Определяется кислотность или щелочность.
Хлориды, тяжелые металлы, железо, мышьяк в пределе эталона. Потеря в весе при прокаливании не более 52% (не менее 48%).
1. MgSO4 + BaCl2 → BaSO4 ↓ + MgCl2
белый осадок,
не растворим в кислотах и щелочах
2. К раствору препарата прибавляют раствор хлорид аммония, раствор гидрофосфат натрия, раствор гидроксида аммония, образуется белый кристаллический осадок, растворимый в уксусной кислоте.
NH4Cl
MgSO4 + NH4OH + Na2HPO4 → MgNH4PO4 ↓ + Na2SO4 + H2O
белый осадок
Чистота:
Не должно быть посторонних примесей. Определяется кислотность или щелочность.
Хлориды, тяжелые металлы, железо, мышьяк в пределе эталона. Потеря в весе при прокаливании не более 52% (не менее 48%).
Слайд 5Количественное определение:
1) Комплексонометрический метод.
Этим методом определяются препараты, содержащие в своем составе
катионы двух, трех- валентных элементов, с которыми трилон Б (рабочий раствор) образует комплексы устойчивые, не окрашенные и растворимые в воде.
Титрование проводят в среде аммиачного буфера (гидроксид аммония и хлорид аммония).
Индикаторы, применяющиеся при комплексонометрическом титровании называются металл – индикаторами. К ним относятся: кислотный хром темно – синий, кислотный хром черный специальный (эриохром черный Т), мурексид и т. д. Эти вещества обладают способностью образовывать с определенными металлами окрашенные комплексные соединения, неустойчивые, растворимые в воде.
Методика:
Навеску препарата растворяют в воде, прибавляют аммиачный буфер, затем несколько кристалликов кислотного хром черного – образуется хорошо растворимое в воде, окрашенное в красный цвет комплексное соединение. В точке эквивалентности комплекс катиона с индикатором, как менее стойкий, полностью распадается и раствор приобретает окраску свободного индикатора – синий цвет.
Титрование проводят в среде аммиачного буфера (гидроксид аммония и хлорид аммония).
Индикаторы, применяющиеся при комплексонометрическом титровании называются металл – индикаторами. К ним относятся: кислотный хром темно – синий, кислотный хром черный специальный (эриохром черный Т), мурексид и т. д. Эти вещества обладают способностью образовывать с определенными металлами окрашенные комплексные соединения, неустойчивые, растворимые в воде.
Методика:
Навеску препарата растворяют в воде, прибавляют аммиачный буфер, затем несколько кристалликов кислотного хром черного – образуется хорошо растворимое в воде, окрашенное в красный цвет комплексное соединение. В точке эквивалентности комплекс катиона с индикатором, как менее стойкий, полностью распадается и раствор приобретает окраску свободного индикатора – синий цвет.
Слайд 7Применение:
Слабительное – внутрь 15,0 - 30,0 на прием.
При парентеральном введении оказывает
успокаивающее действие на ЦНС, при увеличении концентрации в крови оказывает снотворное действие. Большие концентрации могут вызвать угнетение дыхания. Принимают также как спазмолитическое средство при гипертонической болезни подкожно – 5% раствор.
Как желчегонное внутрь 20-25% раствор.
Хранение:
в хорошо укупоренной таре.
Как желчегонное внутрь 20-25% раствор.
Хранение:
в хорошо укупоренной таре.
Слайд 9Получение:
Получают в результате обработки карбоната кальция (мрамора) соляной кислотой.
CaCO3 +
2HCl → CaCl2 + CO2↑ + H2O
Очищают путем перекристаллизации из водного раствора.
Свойства:
Бесцветные призматические кристаллы без запаха, горько – соленого вкуса. Очень гигроскопичен, на воздухе расплывается. Очень легко растворим в воде, вызывая при этом сильное охлаждение раствора, легко растворим в 95% спирте. рН – нейтральная. Крайняя гигроскопичность препарата, способность его расплываться под влиянием влаги делают состав соли непостоянным, что может привести к неточной дозировке при изготовлении лекарств с хлоридом кальция. Учитывая это в аптеке готовят 50% концентрат.
Очищают путем перекристаллизации из водного раствора.
Свойства:
Бесцветные призматические кристаллы без запаха, горько – соленого вкуса. Очень гигроскопичен, на воздухе расплывается. Очень легко растворим в воде, вызывая при этом сильное охлаждение раствора, легко растворим в 95% спирте. рН – нейтральная. Крайняя гигроскопичность препарата, способность его расплываться под влиянием влаги делают состав соли непостоянным, что может привести к неточной дозировке при изготовлении лекарств с хлоридом кальция. Учитывая это в аптеке готовят 50% концентрат.
Слайд 10Подлинность:
Соли кальция окрашивают бесцветное пламя горелки в кирпично- красный цвет.
С оксалатом аммония.
NH4OH
CaCl2 + (NH4)2C2O4 → CaC2O4↓ + 2NH4Cl
белый осадок,
растворим в минеральных кислотах,
не растворим в уксусной кислоте
На Cl-
HNO3
CaCl2 + 2AgNO3 → 2AgCl↓ + Ca(NO3)2
белый осадок,
растворим в растворе
аммиака
Слайд 12Возможные методы:
2. Метод Мора
3. Метод Фаянса
4. Меркуриметрический метод
5. Метод Фольгарда
6. Рефрактометрический метод
Применение:
Источник ионов кальция, антиаллергическое средство.
Проивовоспалительное средство, кровоостанавливающее, угнетает процесс свертывания крови.
Внутрь 5-10% раствор, в/в 10%
Хранение:
В хорошо укупоренных стеклянных банках, с пробками, залитыми парафином, с сухом месте.
Срок годности: 5 лет.
4. Меркуриметрический метод
5. Метод Фольгарда
6. Рефрактометрический метод
Применение:
Источник ионов кальция, антиаллергическое средство.
Проивовоспалительное средство, кровоостанавливающее, угнетает процесс свертывания крови.
Внутрь 5-10% раствор, в/в 10%
Хранение:
В хорошо укупоренных стеклянных банках, с пробками, залитыми парафином, с сухом месте.
Срок годности: 5 лет.
Слайд 14Получение:
Получают путем растворения цинка или его оксида в разбавленной серной
кислоте. Затем производят соответствующую очистку.
Zn + H2SO4 → ZnSO4 + H2
ZnО + H2SO4 → ZnSO4 + H2О
Свойства:
Бесцветные, прозрачные кристаллы или мелкокристаллический порошок, вяжущего вкуса, без запаха, при нагревании плавится, при дальнейшем нагревании переходит в твердую массу. Очень легко растворимый в воде, медленно в глицерине, нерастворим в спирте. Водный раствор имеет слабокислую реакцию. На воздухе выветривается.
Zn + H2SO4 → ZnSO4 + H2
ZnО + H2SO4 → ZnSO4 + H2О
Свойства:
Бесцветные, прозрачные кристаллы или мелкокристаллический порошок, вяжущего вкуса, без запаха, при нагревании плавится, при дальнейшем нагревании переходит в твердую массу. Очень легко растворимый в воде, медленно в глицерине, нерастворим в спирте. Водный раствор имеет слабокислую реакцию. На воздухе выветривается.
Слайд 15Подлинность:
1. С ферроцианидом калия образует белый студенистый
осадок, не
растворяется в разведенной хлороводородной кислоте.
3 ZnSO4 + 2 K4[Fe(CN)6] → K2Zn3[Fe(CN)6]2↓+ 3 K2SO4
желтая кровяная соль
2. С сульфидом натрия образует белый осадок, нерастворимый в уксусной
кислоте, легко растворим в разведенной хлороводородной кислоте.
ZnSO4 + Na2S → ZnS↓ + Na2SO4
3. С хлоридом бария образует белый осадок, нерастворимый в разведенных
кислотах и щелочах.
ZnSO4 + BaCI2 → BaSO4 ↓ + ZnCI2
Чистота:
Не должно быть нитратов, солей алюминия, железа, меди, кальция, хлориды
и мышьяк в пределе эталона.
растворяется в разведенной хлороводородной кислоте.
3 ZnSO4 + 2 K4[Fe(CN)6] → K2Zn3[Fe(CN)6]2↓+ 3 K2SO4
желтая кровяная соль
2. С сульфидом натрия образует белый осадок, нерастворимый в уксусной
кислоте, легко растворим в разведенной хлороводородной кислоте.
ZnSO4 + Na2S → ZnS↓ + Na2SO4
3. С хлоридом бария образует белый осадок, нерастворимый в разведенных
кислотах и щелочах.
ZnSO4 + BaCI2 → BaSO4 ↓ + ZnCI2
Чистота:
Не должно быть нитратов, солей алюминия, железа, меди, кальция, хлориды
и мышьяк в пределе эталона.
Слайд 17Применение:
В глазных каплях 0,25% и 0,5% растворы, как антисептическое и вяжущее
средство применяется вместе с борной кислотой. В гинекологической практике 0,1% и 0,5% растворы для спринцеваний.
Хранение:
Сп. Б. В хорошо укупоренной таре, предохраняющей от выветривания.
Хранение:
Сп. Б. В хорошо укупоренной таре, предохраняющей от выветривания.
Слайд 18Общая характеристика главной подгруппы III группы периодической системы .
В главную подгруппу
III группы входят пять элементов: бор, алюминий, галий, индий и таллий. Элементы этой подгруппы имеют на внешнем электронном слое по 3 электрона. В соединениях они максимально трехвалентны, но могут быть так же одно- и двухвалентны. Металлические свойства нарастают от бора к галию. Бор типичный неметалл, алюминий, галий, индий – амфотерные соединения, а окись таллия имеет только основной характер. Наиболее широко в медицине применяются соединения бора: к-та борная и натрия тетраборат.