- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Хімічні властивості кислот презентация
Содержание
- 1. Хімічні властивості кислот
- 2. Завдання уроку: Закріпити і узагальнити
- 3. Запитання для повторення: Що називається кислотами?
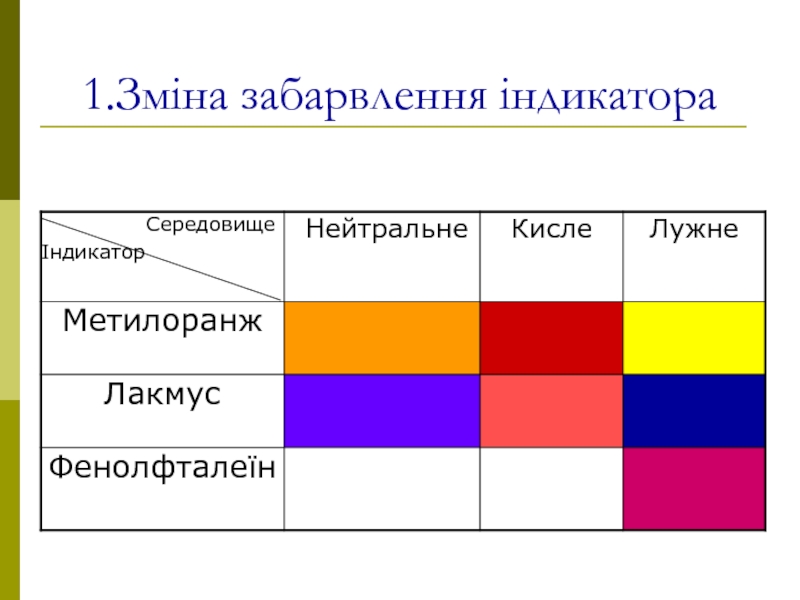
- 4. 1.Зміна забарвлення індикатора
- 5. 2.Взаємодія з металами При взаємодії кислот
- 6. 3. Взаємодія кислот з лугами:
- 7. 4. Взаємодія кислот з солями: При
- 8. 5. Взаємодія кислот з оксидами металів:
- 9. Виконати завдання : Визначити масу солі,
Слайд 2Завдання уроку:
Закріпити і узагальнити знання про властивості класів неорганічних сполук;
Вивчати
хімічні властивості кислот;
Удосконалювати вміння узагальнювати вивчений матеріл та робити висновки.
Удосконалювати вміння узагальнювати вивчений матеріл та робити висновки.
Слайд 3Запитання для повторення:
Що називається кислотами?
Які види класифікації кислот ви знаєте?
Які фізичні
властивості притаманні кислотам?
Слайд 52.Взаємодія з металами
При взаємодії кислот з металами виділяється водень та утворюється
сіль.
Неактивні метали водень з кислот не витісняють, їх можна визначити за таблицею активності металів.
Zn + H2SO4 → H2↑ + ZnSO4
Cu + HCl ≠неактивний метал не реагує.
Неактивні метали водень з кислот не витісняють, їх можна визначити за таблицею активності металів.
Zn + H2SO4 → H2↑ + ZnSO4
Cu + HCl ≠неактивний метал не реагує.
Слайд 63. Взаємодія кислот з лугами:
При взаємодії кислот з основами утворюється
сіль та вода (обов'язковий продукт) реакція проходить в присутності індикатора.
NaOH + HCl → NaCl + H2O
NaOH + HCl → NaCl + H2O
Слайд 74. Взаємодія кислот з солями:
При взаємодії кислот з солями утворюється нова
сіль та кислота (слабка, яка іноді розкладається).
Na2CO3+HCl →NaCl + +CO2↑+H2O
Na2CO3+HCl →NaCl + +CO2↑+H2O
Слайд 85. Взаємодія кислот з оксидами металів:
При взаємодії кислот з оксидами металів
(основними), утворюється сіль та вода (обов'язковий продукт), реакція відбувається при нагріванні.
CuO + H2SO4 t→ CuSO4 + H2O
CuO + H2SO4 t→ CuSO4 + H2O
Слайд 9Виконати завдання :
Визначити масу солі, що утворюється при взаємодії цинку масою
130 г з хлоридною кислотою.