- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химиялық байланыстың табиғаты презентация
Содержание
- 1. Химиялық байланыстың табиғаты
- 2. Жоспар: Химиялық байланыстардың түрлері Иондық байланыс Ковалентті байланыс Сутектік байланыс Металдық байланыс
- 3. Химиялық байланыс түзілген кезде атомдардың электрондық құрылымы
- 4. Сыртқы электрондық қабаты ns2np6 типті болған жағдайда
- 5. Иондық химиялық байланыс электртерістілігі
- 6. Иондық байланыс теориясын 1916 жылы неміс
- 8. Иондар түзілу арқылы жүзеге асатын байланыстарды иондық
- 9. натрий атом
- 11. Ковалентті байланыс – бұл атомдар арасында
- 12. Джильбер Льюис
- 13. Полюссіз ковалентті химиялық байланысты молекулада электрон жұбы
- 14. Сутек атомының электрондық формуласы 1s1. Сутектің
- 15. Сутегі молекуласындағы атомдардың ұсталып тұрған күштерінің табиғатын
- 16. H +1 ) 1
- 17. H- -H H2 Сутек молекуласындағы байланыстың түзілуі:
- 19. Полюсті коваленттік байланыс дегеніміз байланыстырушы электрон жұбының
- 20. Cl +17 ) ) )
- 22. Металдық байланыстың түзілу схемасы
- 23. Химиялық байланыстың негізгі сипаттамалары: байланыс
- 24. Элементтің валенттілігі - бұл берілген молекуладағы
Слайд 2Жоспар:
Химиялық байланыстардың түрлері
Иондық байланыс
Ковалентті байланыс
Сутектік байланыс
Металдық байланыс
Слайд 3Химиялық байланыс түзілген кезде атомдардың электрондық құрылымы өзгеріске ұшырайды.
Атомдардың
Химиялық байланыс түзілуде ең басты рольді электрондар атқарады.
Слайд 4Сыртқы электрондық қабаты ns2np6 типті болған жағдайда электронды октет және 1
Басқа элементтің атомдары химиялық байланыс түзу кезінде осындай электрондық құрылым түзуге ұмтылады. Атомдар арасында тұрақты (аяқталған) электрондық құрылымда болатын ең маңызды екі түрлі химиялық байланыстың түрі иондық (электровалентті) және ковалентті байланыс бар.
Слайд 5 Иондық химиялық байланыс электртерістілігі бойынша айырмашылығы үлкен металл
Иондық химиялық байланыс қарама –қарсы зарядталған иондардың электростатикалық тартылысы нәтижесінде жүзеге асады.
Иондық байланыс
Слайд 6Иондық байланыс теориясын 1916 жылы неміс ғалымы
В. Коссель ұсынған
КОССЕЛЬ (Kossel),
Вальтер
1888 – 1956 ж.ж.
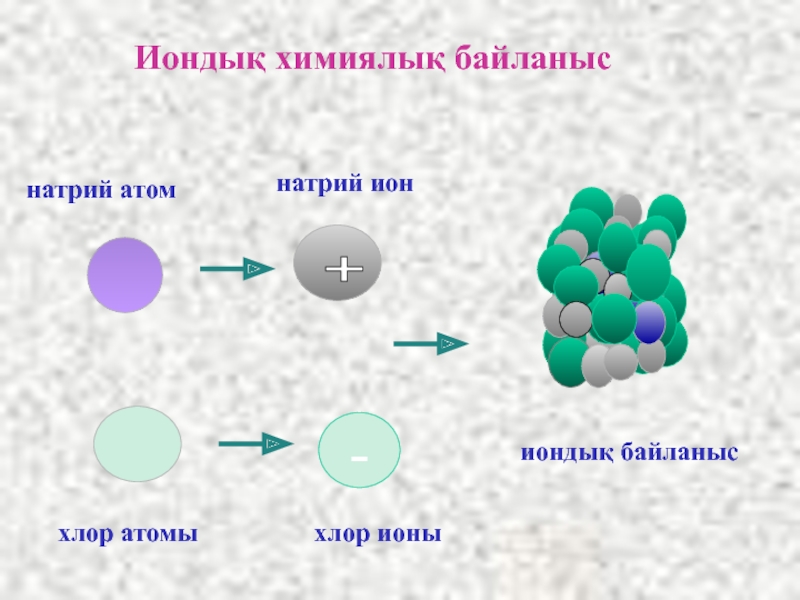
Слайд 8Иондар түзілу арқылы жүзеге асатын байланыстарды иондық байланыс, қосылыстың өзін иондық
+
Na
Cl
NaCl
Слайд 11Ковалентті байланыс – бұл атомдар арасында ортақ электрондық жұп есебінен
Ковалентті байланыс
Ковалентті химиялық байланыста электрон жұбының атомдардың арасында орналасуына қарай полюсті және полюссіз деп екіге бөлінеді.
Слайд 13Полюссіз ковалентті химиялық байланысты молекулада электрон жұбы атомға ауыспай, симметриялы түрде
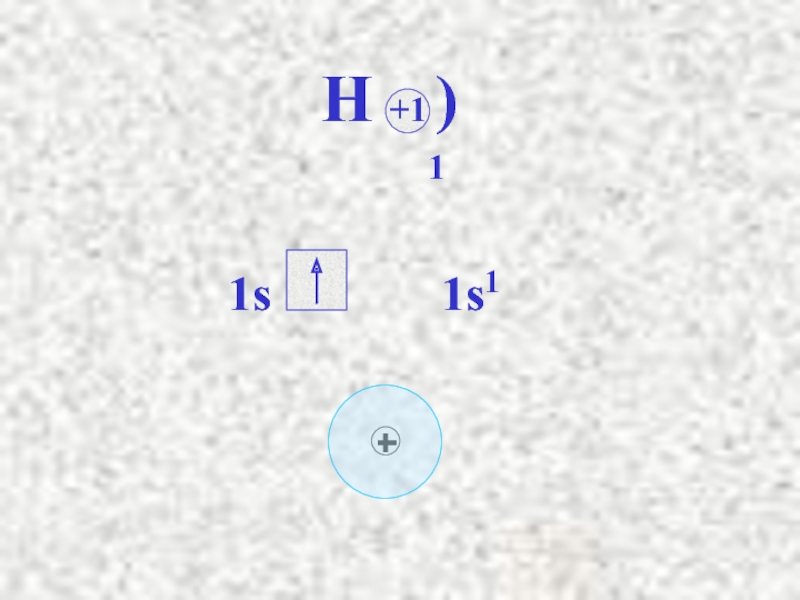
Слайд 14Сутек атомының электрондық формуласы 1s1.
Сутектің электртерістілігі 2,1.
S – электрондарының
тәрізді, олардың өзара әсерлесуін былай көрсетуге болады:
сонда s электрондарының бұлттары өзара қабысып,
екі электрон екі ядроға да ортақ, олардан бірдей
қашықтықта орналасады.
Слайд 15Сутегі молекуласындағы атомдардың ұсталып тұрған күштерінің табиғатын алғаш 1927 жылы ағылшын
байланыстың екі сипатын - энергия мен ядро аралық ұзындықты есептеді. Сутегі молекуласы төрт микробөлшектен тұрады. Екі атом бір – біріне жақындаған кезде тартылыс күші, ал екі ядро мен екі электрон арасында тебілу күші пайда болады. Осы тартылыс және тебілу күші теңескен жағдайда молекула тұрақты күйге келеді.
Слайд 19Полюсті коваленттік байланыс дегеніміз байланыстырушы электрон жұбының бұлты электртерістігі басым элемент
Слайд 22 Металдық байланыстың түзілу схемасы (М – металл):
Мұндай қабілетті металдар бос күйде де, химиялық әрекеттесу кезінде де көрсетеді. Бос күйдегі металдың белгілі физикалық қасиеттері: электр және жылу өткізгіштігі, қаттылығы, иілімділігі, созылғыштығы, өзіне тән жылтыры, т.б. бұлардың барлығы да металдық байланысқа тәуелді.
_
Металдық байланыс
Металдық кристалл торының түйіндерінде атомдар немесе
олардың иондары орналасатыны белгілі.
Металдық тордағы бостау күйдегі делокальданған
электрондар көптеген ядролардың арасында өзара тарту
күштерін тудырып, металдық байланыс түзеді.
Слайд 23Химиялық байланыстың негізгі сипаттамалары:
байланыс энергиясы
байланыс ұзындығы
валенттік бұрыш
Байланыс энергиясы –
Байланыс ұзындығы – химиялық байланыстағы
атомдар ядроларының арасындағы қашықтық, валенттік бұрыш – байланысқан атомдар ядролары арқылы жүргізілетін жорамал сызықтар арасындағы бұрыш.
Бұл көрсеткіштер зат молекуласының құрылысын, пішінін және беріктігін сипаттайды.
Слайд 24Элементтің валенттілігі - бұл берілген молекуладағы атомның басқа атоммен
Көптеген элемент атомдары өздерінің валенттілігін (жұптаспаған электрон санын) қалыпты жағдайдан қозған жағдайға ауысқан жағдайда көбейте алады. Атомның қозған жағдайы - бұл қалыпты жағдаймен салыстырғанда жоғары энергиясы мөлшерімен ерекшелінеді.