- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химия неметаллов презентация
Содержание
- 1. Химия неметаллов
- 2. Химия неметаллов
- 3. Проверь себя Характеристика
- 4. R2O RO R2O3 RO2 R2O5 RO3 R2O7
- 5. R2O RO R2O3 RO2 R2O5 RO3 R2O7
- 6. Cтроение
- 7. Окислительно-восстановительные возможности атомов неметаллов НеМе0 +
- 8. НеМе0 – ne
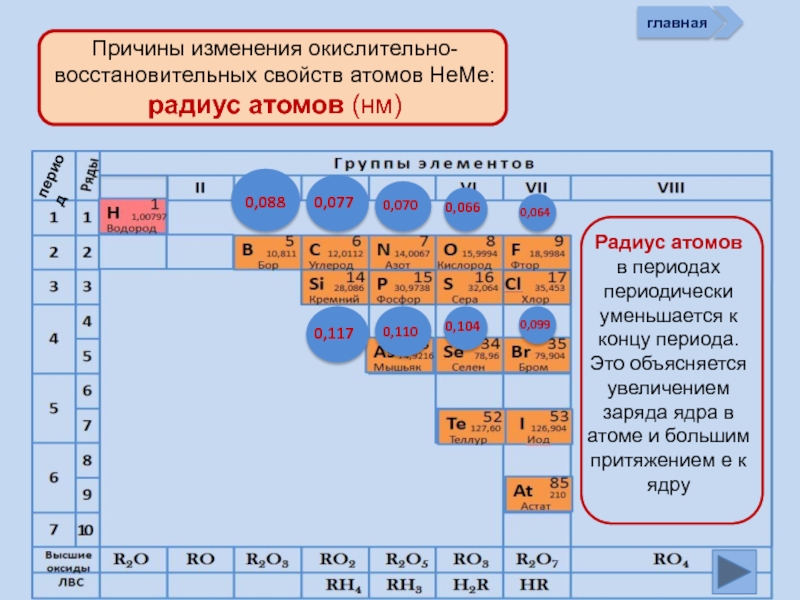
- 9. главная период
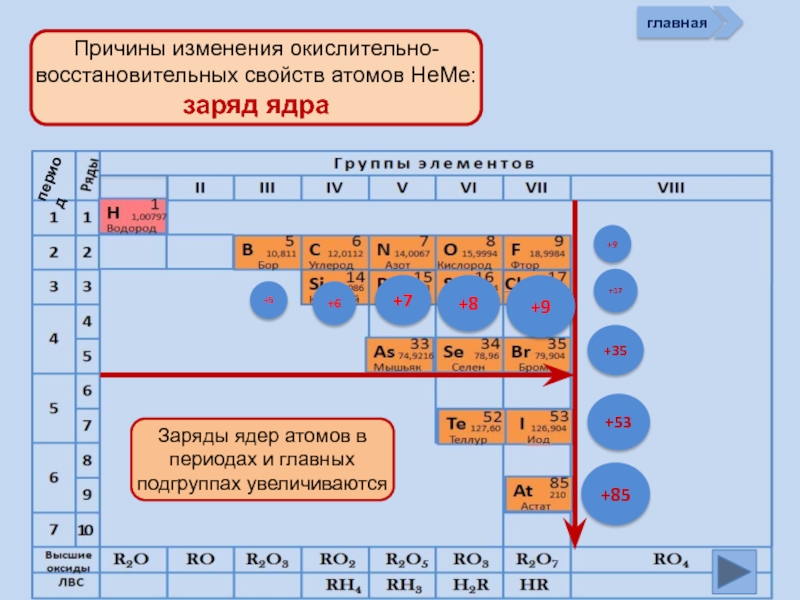
- 10. главная период
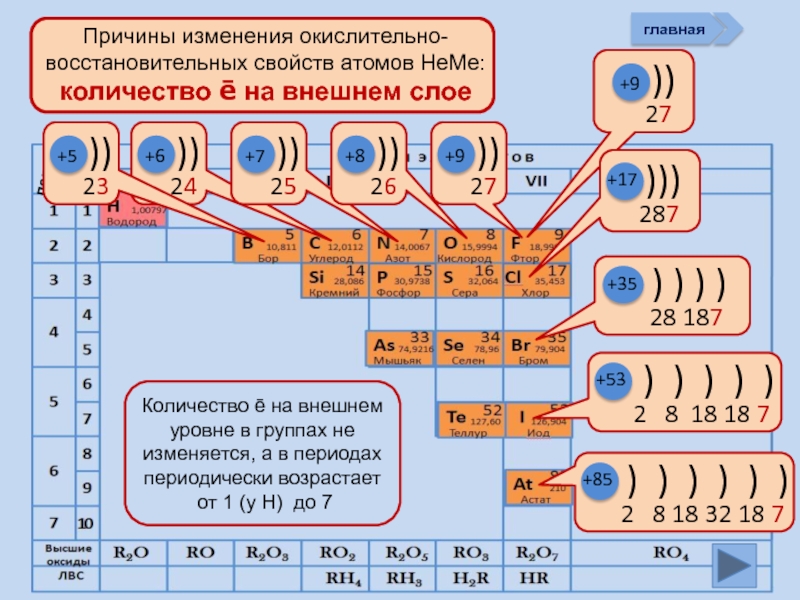
- 11. +5 +6 +7 +8 +9 +85 +17 +9 +53 +35 главная период
- 12. период
- 13. Изменение свойств атомов неметаллов В периоде
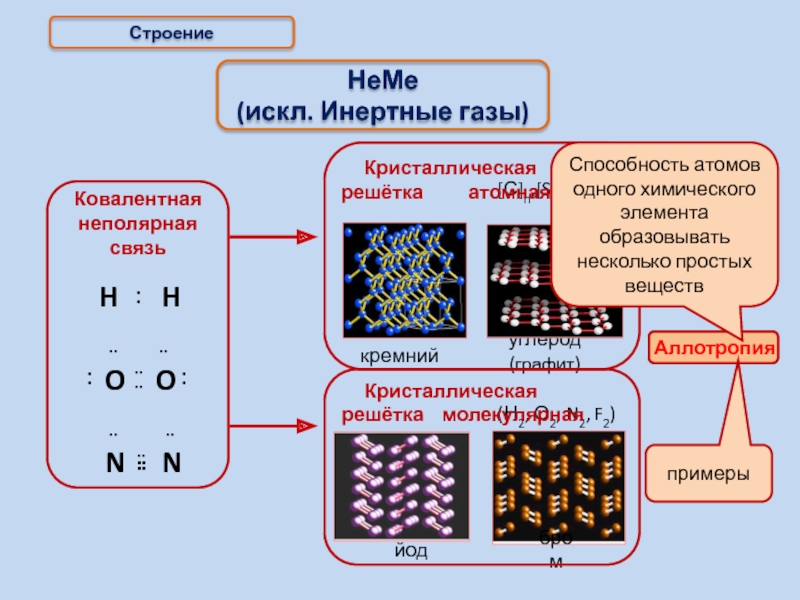
- 14. Строение НеМе (искл. Инертные газы) примеры
- 15. Аллотропия [Р]n а.кр.р. [Р]4 м.кр.р.
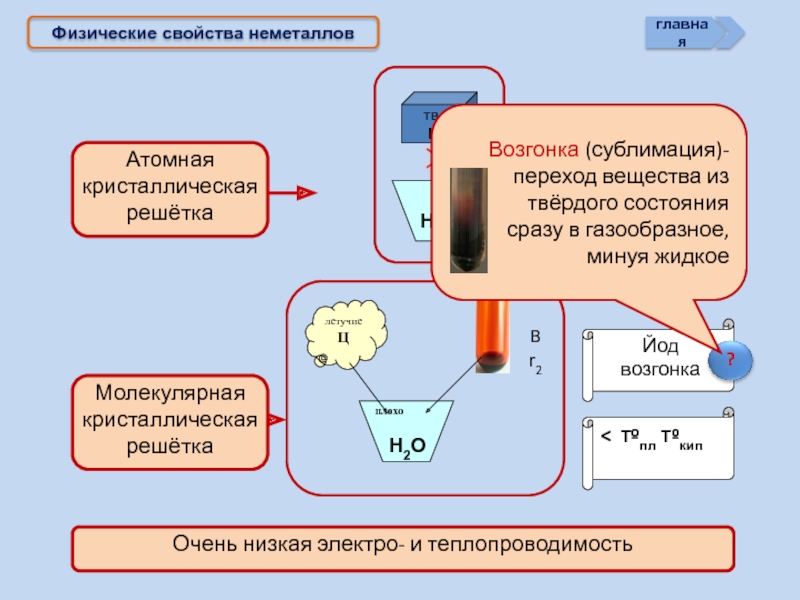
- 16. Физические свойства неметаллов > Tºпл Tºкип < Tºпл Tºкип Йод возгонка Н2О Н2О
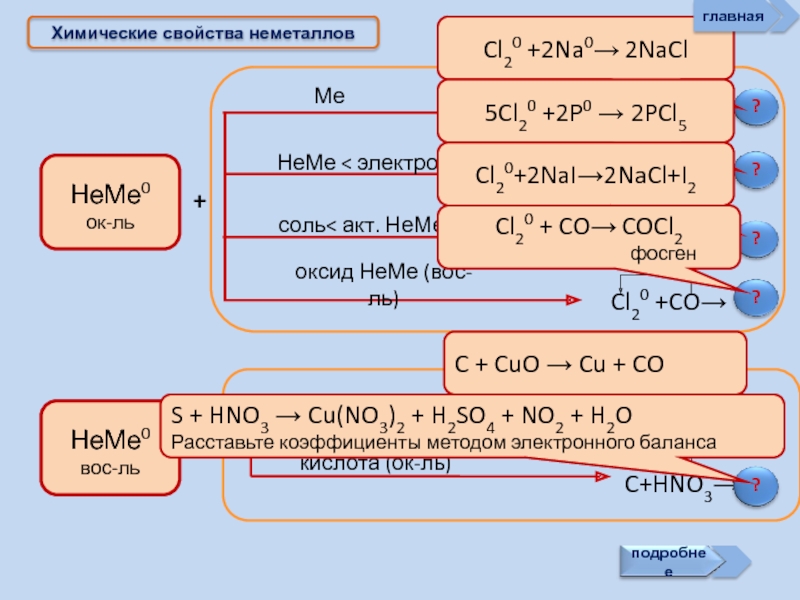
- 17. Химические свойства неметаллов + + Cl20
- 18. Химические свойства неметаллов Неметаллы могут: главная
- 19. ? Химические свойства неметаллов Неметаллы способны:
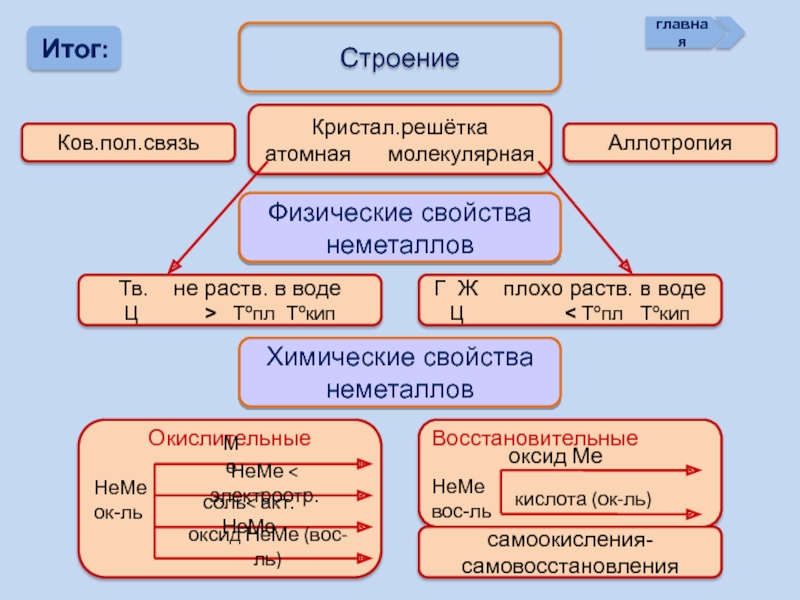
- 20. Итог: Строение Ков.пол.связь Кристал.решётка
- 21. Соединения неметаллов Изменение свойств в периодах Изменение
- 22. Периодическая система химических
- 23. Периодическая система химических
- 24. Процесс растворения кислот в воде Н О
- 25. Периодическая система химических
- 26. Процесс растворения аммиака в воде Н О
- 27. Периодическая система химических
- 28. Периодическая система химических
- 29. Периодическая система химических
- 30. Периодическая система химических
- 31. Периодическая система химических
- 32. Периодическая система химических
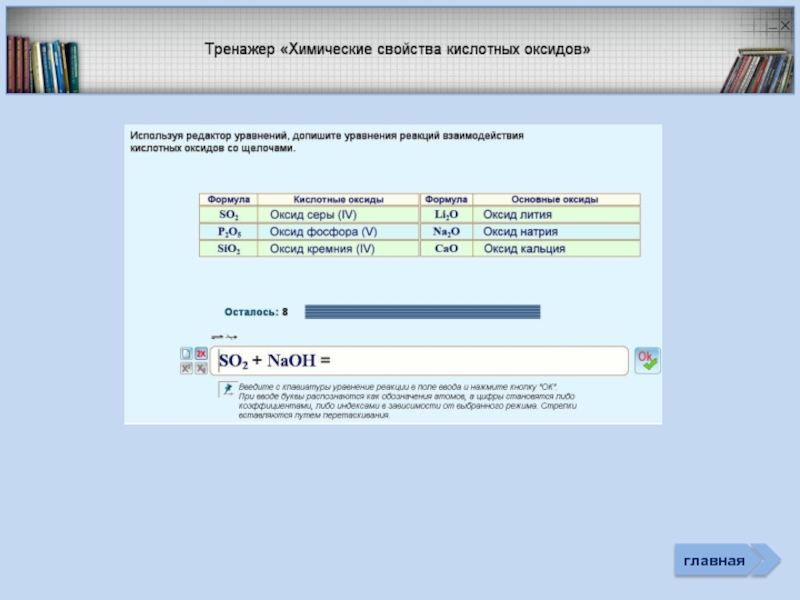
- 33. Неметалл кислотный оксид растворимая
- 34. Неметалл кислотный оксид соль
- 35. Интерактив. Положение неметаллов в ПСХЭ Д.И. Менделеева:
- 36. Для удобства работы с электронными образовательными ресурсами
- 38. ошибка ошибка ошибка
Слайд 2 Химия неметаллов
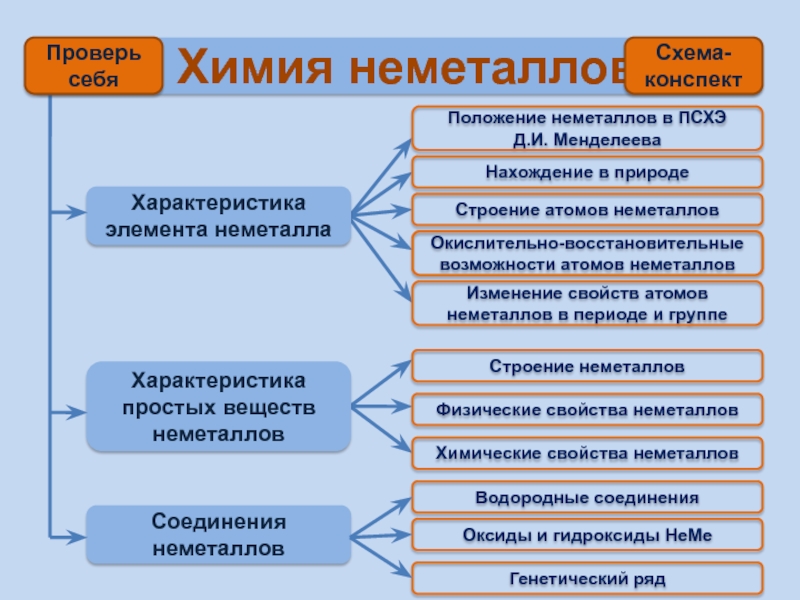
Характеристика элемента неметалла
Характеристика простых веществ
Соединения неметаллов
Положение неметаллов в ПСХЭ Д.И. Менделеева
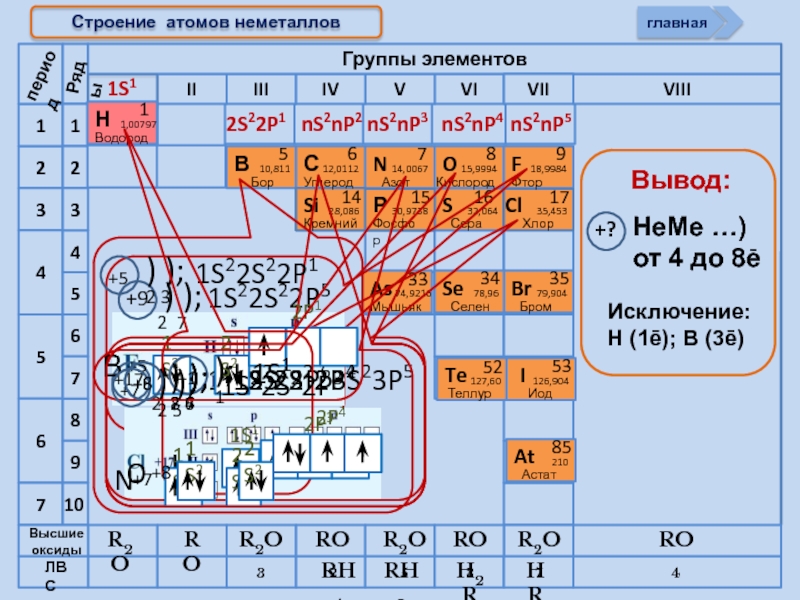
Строение атомов неметаллов
Окислительно-восстановительные возможности атомов неметаллов
Изменение свойств атомов неметаллов в периоде и группе
Строение неметаллов
Химические свойства неметаллов
Физические свойства неметаллов
Водородные соединения
Проверь себя
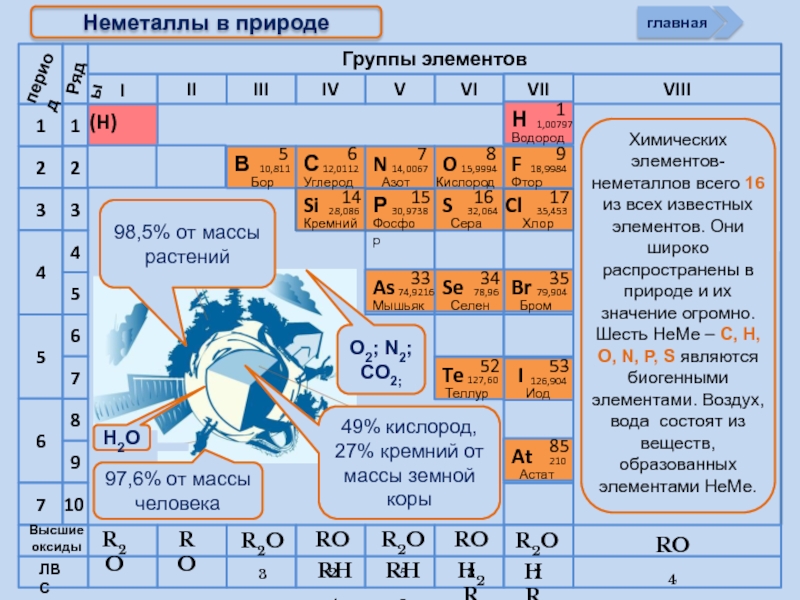
Нахождение в природе
Оксиды и гидроксиды НеМе
Генетический ряд
Схема- конспект
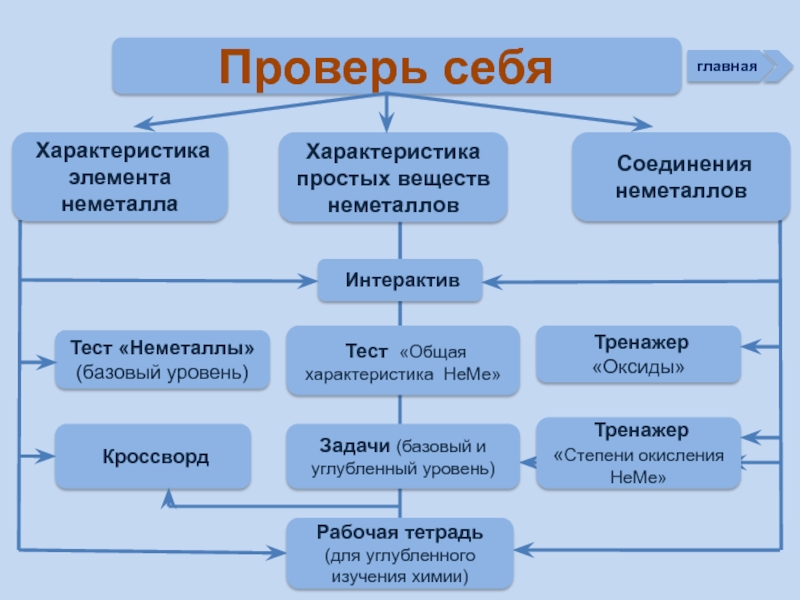
Слайд 3 Проверь себя
Характеристика простых веществ неметаллов
Характеристика элемента
Тест «Неметаллы» (базовый уровень)
Соединения неметаллов
Тренажер «Оксиды»
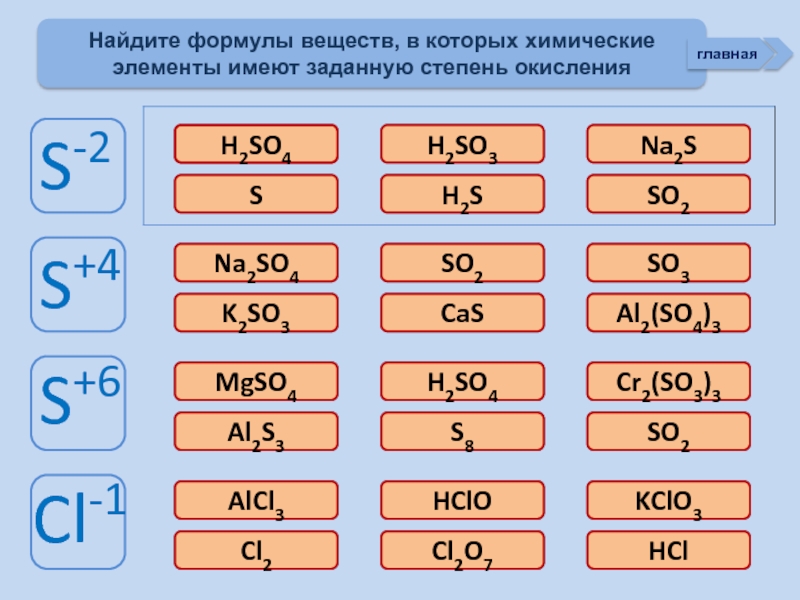
Тренажер «Степени окисления НеМе»
Интерактив
Тест «Общая характеристика НеМе»
Рабочая тетрадь (для углубленного изучения химии)
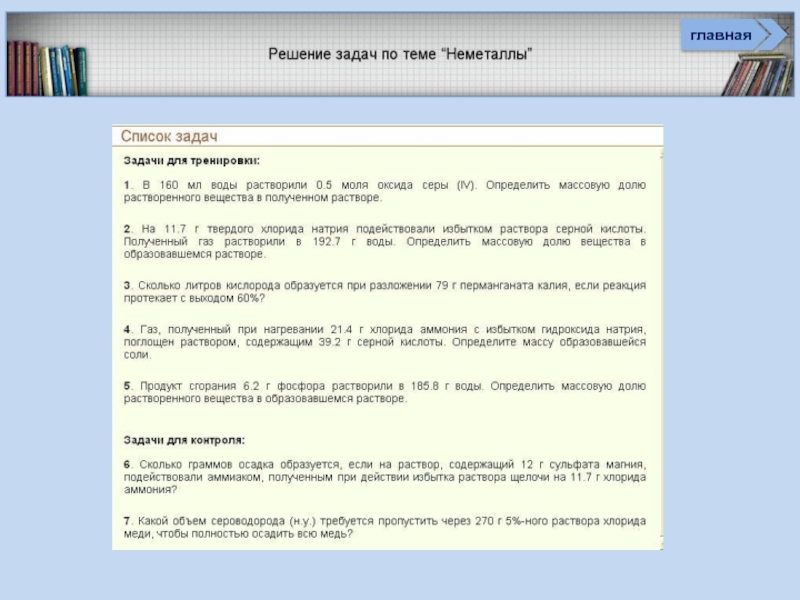
Задачи (базовый и углубленный уровень)
Кроссворд
Слайд 5R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
RH4
RH3
H2R
HR
Высшие оксиды
ЛВС
Неметаллы в природе
98,5% от массы растений
97,6% от массы человека
49% кислород,
O2; N2; CO2;
Н2О
период
Слайд 7
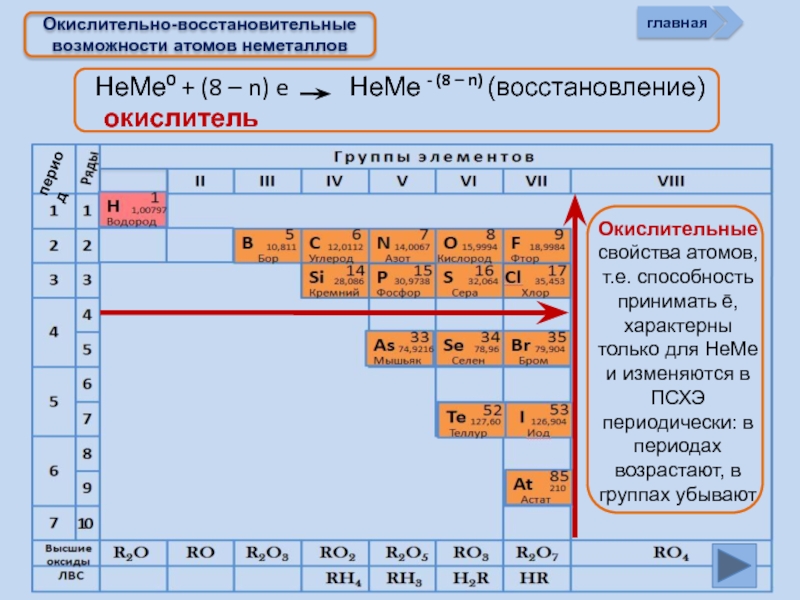
Окислительно-восстановительные возможности атомов неметаллов
НеМе0 + (8 – n) e
окислитель
главная
период
Слайд 8
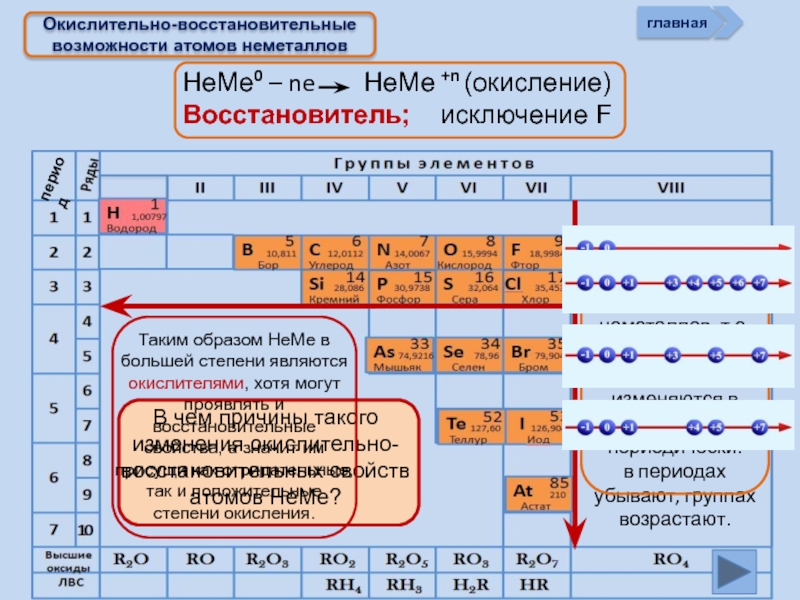
НеМе0 – ne НеМе +n (окисление)
Восстановитель; исключение
Окислительно-восстановительные возможности атомов неметаллов
главная
период
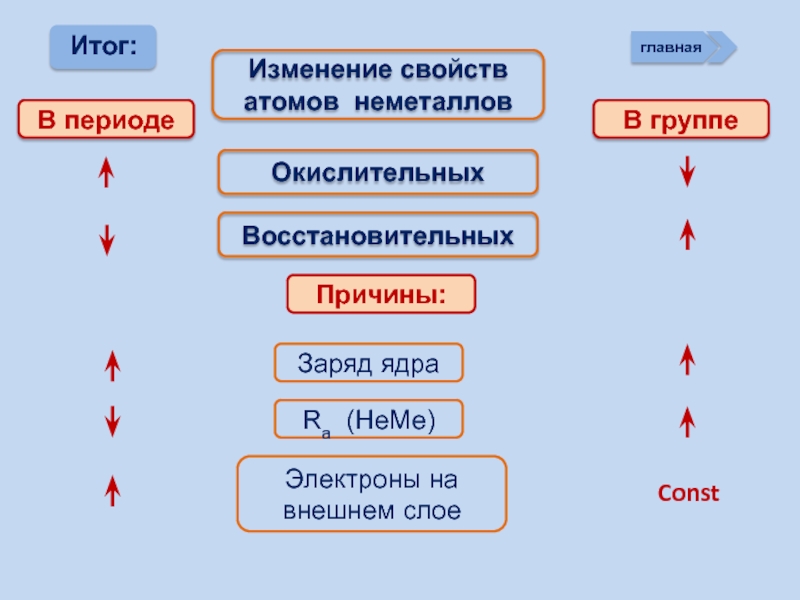
Слайд 13Изменение свойств
атомов неметаллов
В периоде
В группе
Окислительных
Восстановительных
Причины:
Заряд ядра
Ra (НеМе)
Электроны на
внешнем
Const
Слайд 14Строение
НеМе
(искл. Инертные газы)
примеры
(Н2, О2, N2, F2)
йод
бром
Способность атомов одного химического
Слайд 17Химические свойства неметаллов
+
+
Cl20 +2Na0→ 2NaCl
5Cl20 +2P0 → 2PCl5
Cl20+2NaI→2NaCl+I2
Cl20 + CO→ COCl2
C + CuO → Cu + CO
S + HNO3 → Cu(NO3)2 + H2SO4 + NO2 + H2O
Расставьте коэффициенты методом электронного баланса
главная
Слайд 19?
Химические свойства неметаллов
Неметаллы способны:
Сl2 + Н2О = НСl
?
Хлор в левой части уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала -1 (в НСl), у других +1 (в хлорноватистой кислоте НОСl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования
См. окислять другие неметаллы (менее склонные принимать электроны):
главная
Слайд 20
Итог:
Строение
Ков.пол.связь
Кристал.решётка
атомная молекулярная
Аллотропия
Физические свойства
неметаллов
Тв. не раств.
Ц > Tºпл Tºкип
Г Ж плохо раств. в воде
Ц < Tºпл Tºкип
Химические свойства
неметаллов
самоокисления-самовосстановления
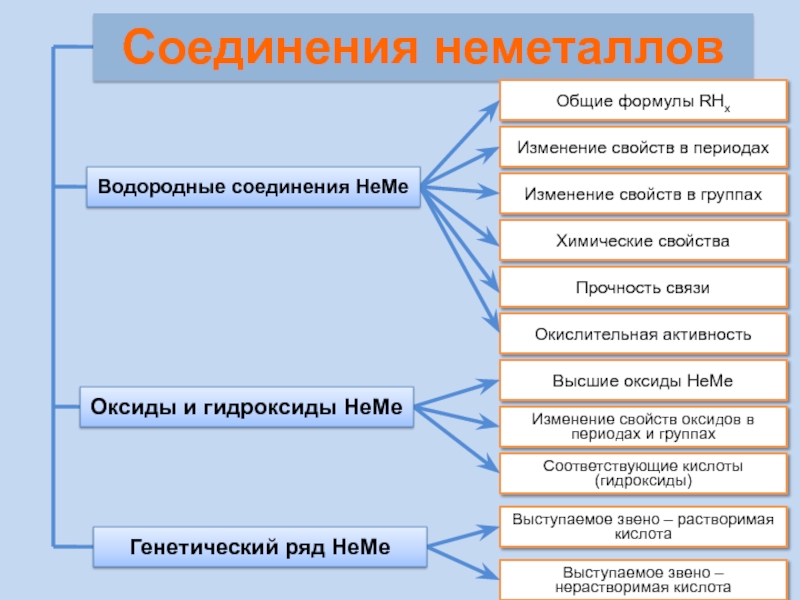
Слайд 21Соединения неметаллов
Изменение свойств в периодах
Изменение свойств в группах
Общие формулы RHx
Химические свойства
Прочность
Окислительная активность
Водородные соединения НеМе
Изменение свойств оксидов в периодах и группах
Высшие оксиды НеМе
Выступаемое звено – растворимая кислота
Выступаемое звено – нерастворимая кислота
Соответствующие кислоты (гидроксиды)
Оксиды и гидроксиды НеМе
Генетический ряд НеМе
Слайд 22
Периодическая система химических элементов Д.И. Менделеева
Н
Водород
1
1.008
Периоды
B
C
N
As
He
Se
Te
F
Br
I
At
Ne
Kr
Xe
Rn
Бор
Углерод
Азот
Мышьяк
Селен
Теллур
Фтор
Бром
Иод
Астат
Криптон
Ксенон
Радон
5
6
7
9
2
10
Нелетучие водородные соединения
Летучие водородные соединения
ЛВС
33
35
36
52
53
54
85
86
10,811
12,011
14,00
74,922
15,998
78,96
127,60
18,998
79,904
126,906
(210)
4,003
20,179
83,80
131,30
(222)
Гелий
Неон
RH4
RH3
H2R
HR
RH
RH2
RH3
R+1Н-1
R+2Н2-1
R+3Н3-1
R-4Н4+1
R-3Н3+1
Н2+1R-2
Н+1R-1
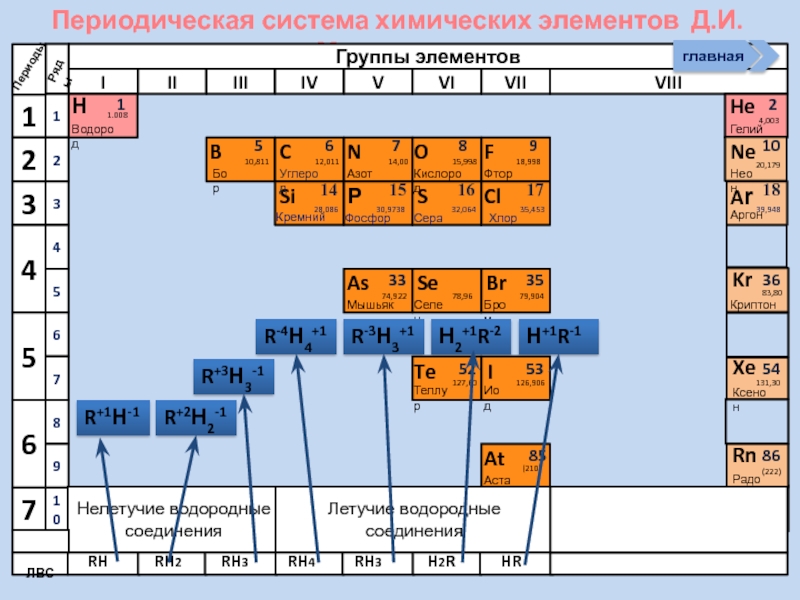
Слайд 23
Периодическая система химических элементов Д.И. Менделеева
Н
Водород
1
1.008
Периоды
B
C
N
As
He
Se
Te
F
Br
I
At
Ne
Kr
Xe
Rn
Бор
Углерод
Азот
Мышьяк
Селен
Теллур
Фтор
Бром
Иод
Астат
Криптон
Ксенон
Радон
5
6
7
9
2
10
ВО
ЛВС
33
35
36
52
53
54
85
86
10,811
12,011
14,00
74,922
15,998
78,96
127,60
18,998
79,904
126,906
(210)
4,003
20,179
83,80
131,30
(222)
Гелий
Неон
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
RO4
RH4
RH3
H2R
HR
В периодах слева направо с возрастанием
NН3- основные свойства
НF- кислотные свойства
НCl-сильная кислота
РН3- основные свойства
Слайд 24Процесс растворения кислот в воде
Н
О
Н
+
Н
F
Н
Н
O
Н
+
F
[
]
-2
-1
-1
:
:
:
:
:
:
:
:
:
:
:
:
:
:
:
:
Или сокращенно
Н2О-2
+
НF-1
Н3О+
+
F-1
Фтороводород в водном растворе отщепляет положительные
Атом кислорода имеет неподеленную электронную пару, а атом водорода – свободную орбиталь, благодаря чему образуется дополнительная ковалентная полярная связь (донорно-акцепторная).
+
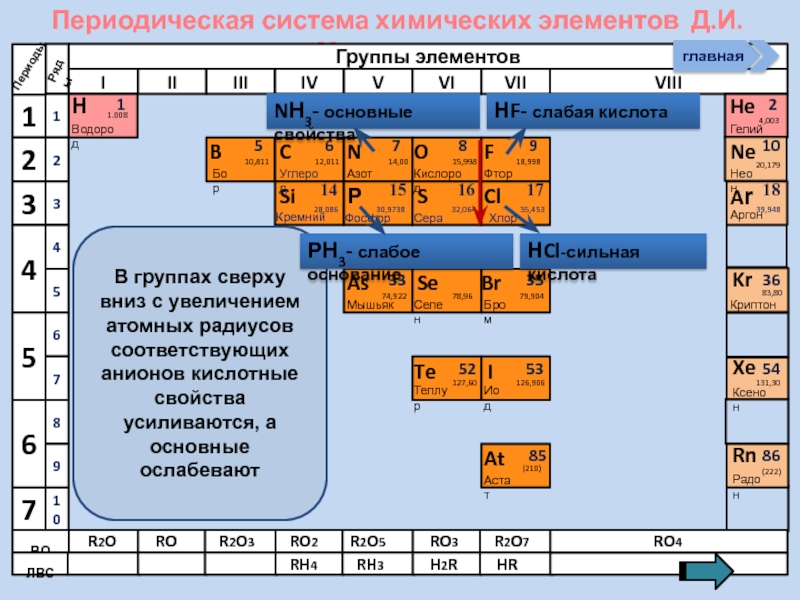
Слайд 25
Периодическая система химических элементов Д.И. Менделеева
Н
Водород
1
1.008
Периоды
B
C
N
As
He
Se
Te
F
Br
I
At
Ne
Kr
Xe
Rn
Бор
Углерод
Азот
Мышьяк
Селен
Теллур
Фтор
Бром
Иод
Астат
Криптон
Ксенон
Радон
5
6
7
9
2
10
ВО
ЛВС
33
35
36
52
53
54
85
86
10,811
12,011
14,00
74,922
15,998
78,96
127,60
18,998
79,904
126,906
(210)
4,003
20,179
83,80
131,30
(222)
Гелий
Неон
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
RO4
RH4
RH3
H2R
HR
В группах сверху вниз с увеличением
NН3- основные свойства
НF- слабая кислота
НCl-сильная кислота
РН3- слабое основание
Слайд 26Процесс растворения аммиака в воде
Н
О
Н
+
Н
N
Н
Н
N
Н
+
[
]
-2
-3
:
:
:
:
:
:
:
:
:
:
:
:
:
:
:
:
Или сокращенно
Н2О-2
+
Н3N-3
NН4+
+
OH-
+
Н
Н
[
]
-
Н
Н
О
Атом азота имеет неподеленную электронную пару,
Слайд 27
Периодическая система химических элементов Д.И. Менделеева
Н
Водород
1
1.008
Периоды
B
C
N
As
He
Se
Te
F
Br
I
At
Ne
Kr
Xe
Rn
Бор
Углерод
Азот
Мышьяк
Селен
Теллур
Фтор
Бром
Иод
Астат
Криптон
Ксенон
Радон
5
6
7
9
2
10
ВО
ЛВС
33
35
36
52
53
54
85
86
10,811
12,011
14,00
74,922
15,998
78,96
127,60
18,998
79,904
126,906
(210)
4,003
20,179
83,80
131,30
(222)
Гелий
Неон
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
RO4
RH4
RH3
H2R
HR
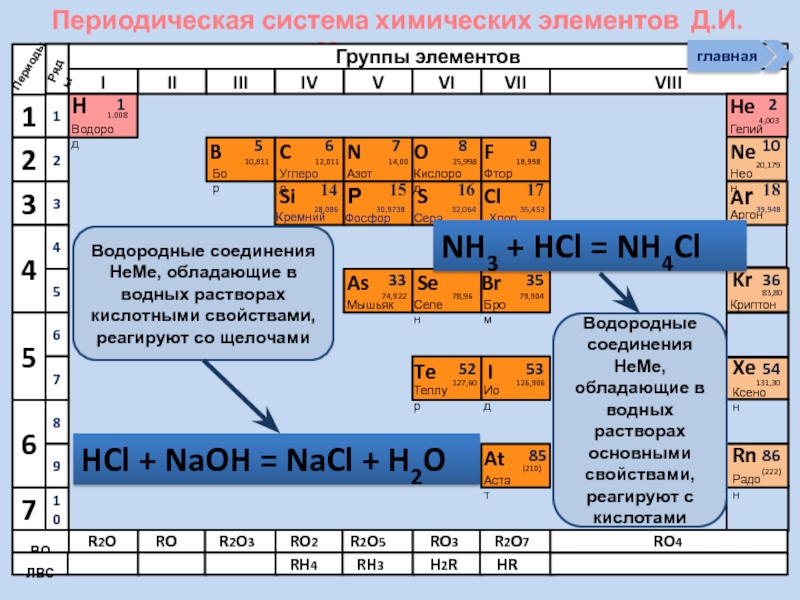
Водородные соединения НеМе, обладающие в водных
Водородные соединения НеМе, обладающие в водных растворах основными свойствами, реагируют с кислотами
HCl + NaOH = NaCl + H2O
NH3 + HCl = NH4Cl
Слайд 28
Периодическая система химических элементов Д.И. Менделеева
Н
Водород
1
1.008
Периоды
B
C
N
As
He
Se
Te
F
Br
I
At
Ne
Kr
Xe
Rn
Бор
Углерод
Азот
Мышьяк
Селен
Теллур
Фтор
Бром
Иод
Астат
Криптон
Ксенон
Радон
5
6
7
9
2
10
ВО
ЛВС
33
35
36
52
53
54
85
86
10,811
12,011
14,00
74,922
15,998
78,96
127,60
18,998
79,904
126,906
(210)
4,003
20,179
83,80
131,30
(222)
Гелий
Неон
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
RO4
RH4
RH3
H2R
HR
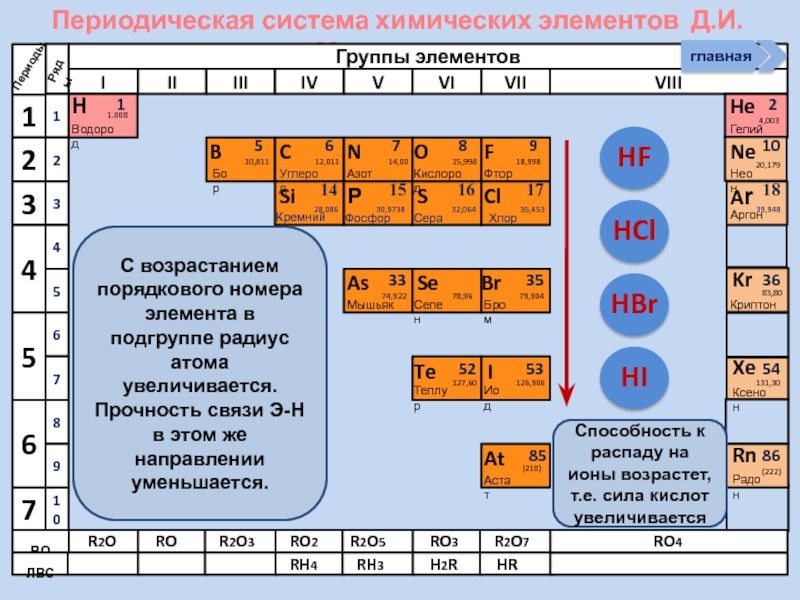
С возрастанием порядкового номера элемента в
Способность к распаду на ионы возрастет, т.е. сила кислот увеличивается
Слайд 29
Периодическая система химических элементов Д.И. Менделеева
Н
Водород
1
1.008
Периоды
B
C
N
As
He
Se
Te
F
Br
I
At
Ne
Kr
Xe
Rn
Бор
Углерод
Азот
Мышьяк
Селен
Теллур
Фтор
Бром
Иод
Астат
Криптон
Ксенон
Радон
5
6
7
9
2
10
ВО
ЛВС
33
35
36
52
53
54
85
86
10,811
12,011
14,00
74,922
15,998
78,96
127,60
18,998
79,904
126,906
(210)
4,003
20,179
83,80
131,30
(222)
Гелий
Неон
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
RO4
RH4
RH3
H2R
HR
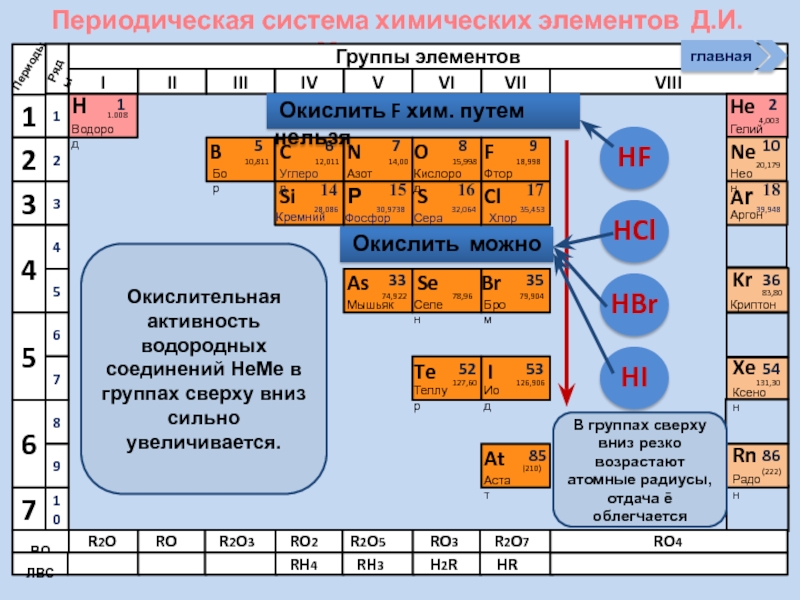
Окислительная активность водородных соединений НеМе в
В группах сверху вниз резко возрастают атомные радиусы, отдача ē облегчается
Окислить F хим. путем нельзя
Окислить можно
Слайд 30
Периодическая система химических элементов Д.И. Менделеева
Н
Водород
1
1.008
Периоды
B
C
N
As
He
Se
Te
F
Br
I
At
Ne
Kr
Xe
Rn
Бор
Углерод
Азот
Мышьяк
Селен
Теллур
Фтор
Бром
Иод
Астат
Криптон
Ксенон
Радон
5
6
7
9
2
10
ВО
ЛВС
33
35
36
52
53
54
85
86
10,811
12,011
14,00
74,922
15,998
78,96
127,60
18,998
79,904
126,906
(210)
4,003
20,179
83,80
131,30
(222)
Гелий
Неон
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
RO4
RH4
RH3
H2R
HR
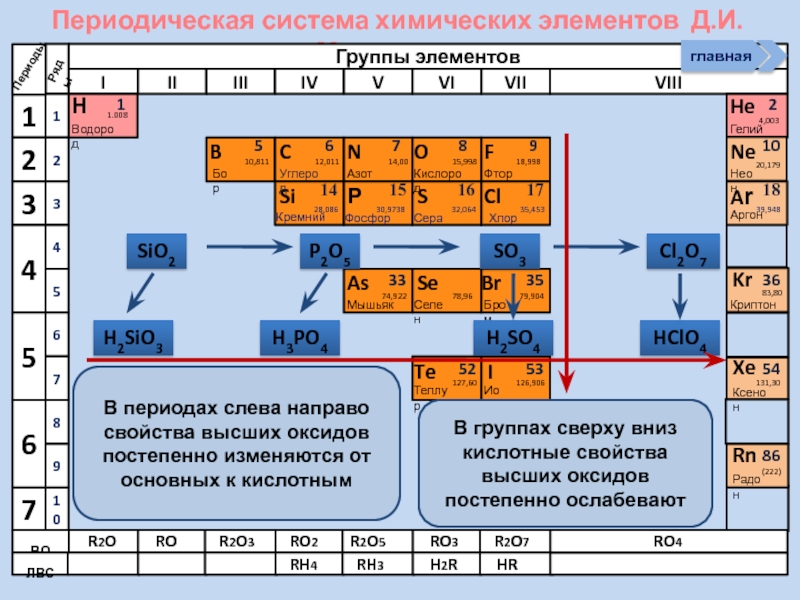
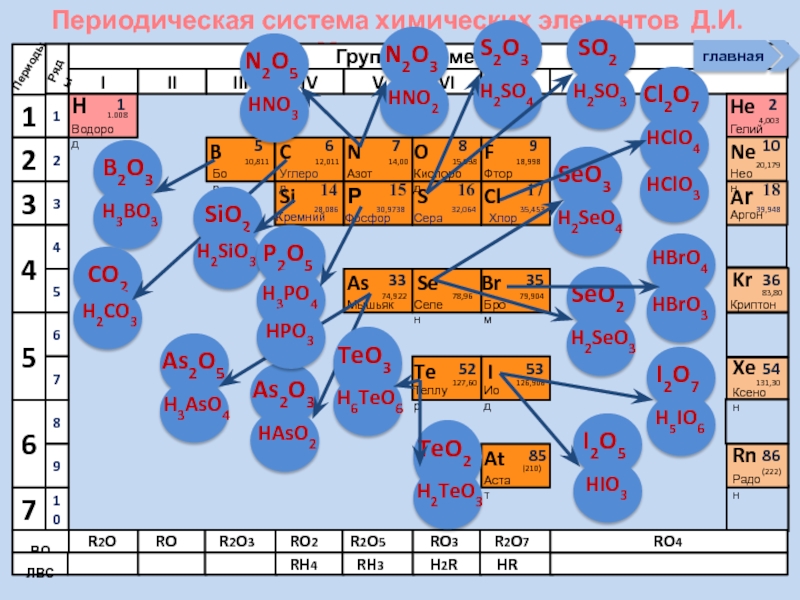
В периодах слева направо свойства высших
SiO2
P2O5
SO3
Cl2O7
H2SiO3
H3PO4
H2SO4
HClO4
В группах сверху вниз кислотные свойства высших оксидов постепенно ослабевают
Слайд 31
Периодическая система химических элементов Д.И. Менделеева
Н
Водород
1
1.008
Периоды
B
C
N
As
He
Se
Te
F
Br
I
At
Ne
Kr
Xe
Rn
Бор
Углерод
Азот
Мышьяк
Селен
Теллур
Фтор
Бром
Иод
Астат
Криптон
Ксенон
Радон
5
6
7
9
2
10
ВО
ЛВС
33
35
36
52
53
54
85
86
10,811
12,011
14,00
74,922
15,998
78,96
127,60
18,998
79,904
126,906
(210)
4,003
20,179
83,80
131,30
(222)
Гелий
Неон
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
RO4
RH4
RH3
H2R
HR
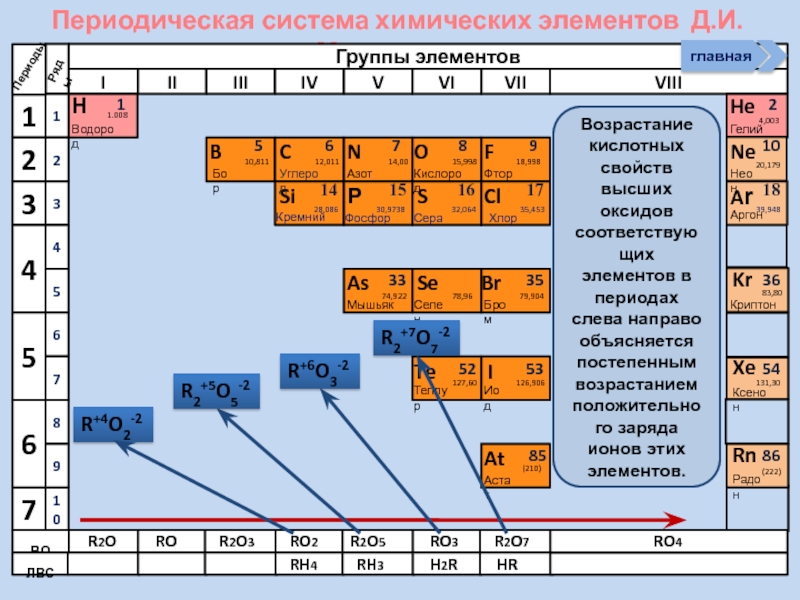
Возрастание кислотных свойств высших оксидов соответствующих
R+4O2-2
R2+5O5-2
R+6O3-2
R2+7O7-2
Слайд 32
Периодическая система химических элементов Д.И. Менделеева
Н
Водород
1
1.008
Периоды
B
C
N
As
He
Se
Te
F
Br
I
At
Ne
Kr
Xe
Rn
Бор
Углерод
Азот
Мышьяк
Селен
Теллур
Фтор
Бром
Иод
Астат
Криптон
Ксенон
Радон
5
6
7
9
2
10
ВО
ЛВС
33
35
36
52
53
54
85
86
10,811
12,011
14,00
74,922
15,998
78,96
127,60
18,998
79,904
126,906
(210)
4,003
20,179
83,80
131,30
(222)
Гелий
Неон
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
RO4
RH4
RH3
H2R
HR
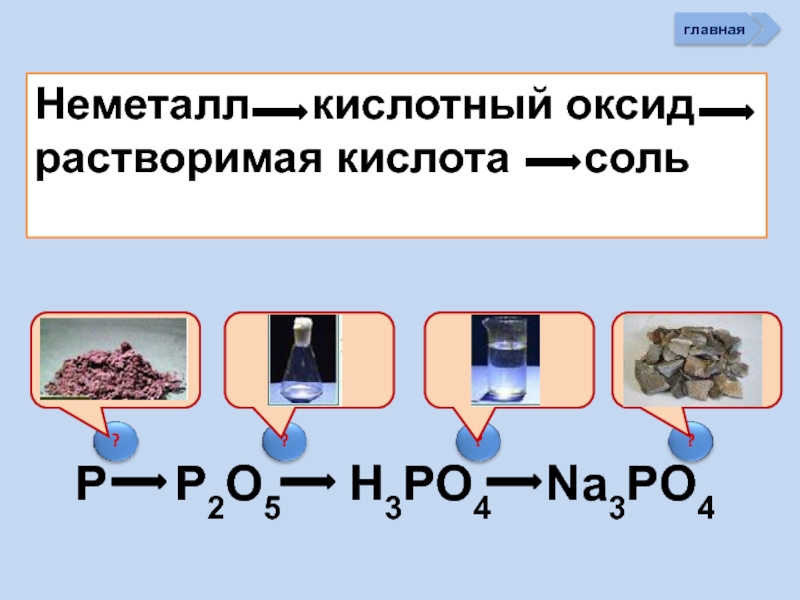
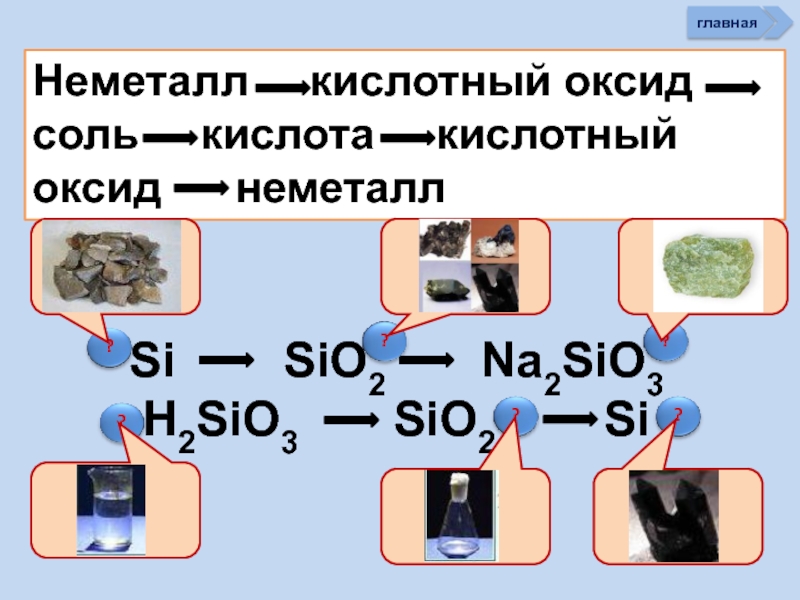
Слайд 34Неметалл кислотный оксид соль кислота
Si SiO2 Na2SiO3 H2SiO3 SiO2 Si
Слайд 35Интерактив. Положение неметаллов в ПСХЭ Д.И. Менделеева:
http://school-collection.edu.ru/catalog/res/d77a57b7-8cff-11db-b606-0800200c9a66/view/
Интерактив. Особенности строения атомов неметаллов:
http://school-collection.edu.ru/catalog/res/d77a30ca-8cff-11db-b606-0800200c9a66/view/
Интерактив.
http://school-collection.edu.ru/catalog/res/d77a57b8-8cff-11db-b606-0800200c9a66/view/
Интерактив. Оксиды и гидроксиды неметаллов:
http://school-collection.edu.ru/catalog/res/d77a57ba-8cff-11db-b606-0800200c9a66/view/
Проверь себя
Слайд 36Для удобства работы с электронными образовательными ресурсами рекомендуем вам обновить существующую
Скачать дистрибутив плеера ОМС. ftp://ftp.fcior.edu.ru/oms/OMS.exe



![Аллотропия[Р]n а.кр.р.[Р]4 м.кр.р.](/img/tmb/5/488609/5a69889ab8233b7e012027dca62d9722-800x.jpg)



![Процесс растворения кислот в водеНОН+НFННOН+F[]-2-1-1::::::::::::::::Или сокращенноН2О-2+НF-1Н3О++F-1Фтороводород в водном растворе отщепляет положительные ионы водорода, т.е. проявляет](/img/tmb/5/488609/f898c32ded72100bc0c863d4df3d509c-800x.jpg)
![Процесс растворения аммиака в водеНОН+НNННNН+[]-2-3::::::::::::::::Или сокращенноН2О-2+Н3N-3NН4++OH-+НН[]-ННОАтом азота имеет неподеленную электронную пару, а атом водорода –](/img/tmb/5/488609/daaeaeae364e2a4509ae8e9eea6403b1-800x.jpg)