- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химические свойства алкадиенов и алкинов презентация
Содержание
- 1. Химические свойства алкадиенов и алкинов
- 2. Диеновые углеводороды (алкадиены) Диеновыми углеводородами или
- 3. Номенклатура и классификация Индивидуальные углеводороды с
- 4. Задание 1 Напишите формулы углеводородов диенового ряда
- 5. Диеновые углеводороды, в которых две двойные
- 6. Диеновые углеводороды, в молекулах которых две
- 7. Особое значение имеют этиленовые углеводороды, в
- 8. Ненасыщенные углеводороды ряда ацетилена (алкины) Углеводородами
- 9. Гомология, изомерия и номенклатура Состав каждого
- 10. Изомерия. Возможны два типа ацетиленовых соединений R—C
- 11. Номенклатура Международная заместительная номенклатура. Ацетиленовые углеводороды
- 12. Напишите формулы углеводородов алкинового ряда от
- 13. Свойства ацетиленовых углеводородов (алкинов) Физические свойства.
- 14. Химические свойства. Ацетиленовым углеводородам, так же
- 15. Присоединение водорода (реакция гидрирования) В присутствии
- 17. Присоединение галогенов При взаимодействии ацетиленовых углеводородов
- 18. Присоединение галогеноводородов Присоединение галогеноводородов протекает ступенчато.
- 19. Присоединение воды (реакция гидратации) Эта реакция
- 20. Образующееся соединение – виниловый спирт –
- 22. Замещение водорода при атомах углерода с
- 24. Присоединение СО Присоединение СО (реакция В.
- 27. Темы для сообщений Промышленное использование алкинов Ацетилен,
Слайд 2Диеновые углеводороды (алкадиены)
Диеновыми углеводородами или алкадиенами, называются ненасыщенные углеводороды с открытой
Слайд 3Номенклатура и классификация
Индивидуальные углеводороды с двумя двойными связями называют, пользуясь
Слайд 4Задание 1
Напишите формулы углеводородов диенового ряда от С=3 до С=10. К
Слайд 5
Диеновые углеводороды, в которых две двойные связи находятся рядом и не
1 2 3
СН2=С=СН2 1,2-пропадиен (аллен)
Слайд 6
Диеновые углеводороды, в молекулах которых две двойные связи разделены двумя или
Слайд 7
Особое значение имеют этиленовые углеводороды, в молекулах которых двойные связи разделены
Слайд 8Ненасыщенные углеводороды ряда ацетилена (алкины)
Углеводородами ряда ацетилена или ацетиленовыми углеводородами
Слайд 9Гомология, изомерия и номенклатура
Состав каждого члена гомологического ряда ацетиленовых углеводородов может
Н—С≡С—Н и СН≡СН
Гомологи ацетилена можно рассматривать как его производные, образовавшиеся в результате замещения одного или обоих атомов водорода в молекуле ацетилена на углеводородные радикалы.
Слайд 10Изомерия.
Возможны два типа ацетиленовых соединений R—C ≡C—Н и R—C≡C—R'. (Линейная геометрия
В соединениях первого типа при углероде с тройной связью имеется водород, в соединения второго типа при атомах углерода с тройной связью водорода нет. Изомерия ацетиленовых углеводородов, так же как и этиленовых, обусловлена изомерией углеродного скелета и изомерией положения кратной связи. Интересно отметить, что общая формула состава ацетиленовых углеводородов СnH2n-2 аналогична общей формуле состава диеновых углеводородов. Иначе говоря, непредельные углеводороды с двумя двойными связями изомерны непредельным углеводородам с одной тройной связью.
Слайд 11Номенклатура
Международная заместительная номенклатура. Ацетиленовые углеводороды называют по заместительной номенклатуре так же,
Слайд 12
Напишите формулы углеводородов алкинового ряда от С=3 до С=10. К каждому
Слайд 13Свойства ацетиленовых углеводородов (алкинов)
Физические свойства.
Зависимости изменения физических свойств в гомологических
Слайд 14Химические свойства.
Ацетиленовым углеводородам, так же как этиленовым, свойственны реакции присоединения по
Тройная связь, так же как и двойная, по характеру отличается от простой связи. Она осуществляется тремя парами обобщенных электронов. Из них, как и в случае двойной связи, одна пара осуществляет простую связь (σ-связь), а две другие электронные пары находятся в особом состоянии (π-связи); осуществляемые ими связи проявляют повышенную склонность к поляризации. Этим обуславливаются реакции присоединения по месту тройной связи. Последние идут ступенчато: вначале тройная связь разрывается в двойную, и образуются производные этиленовых углеводородов. Затем разрывается и двойная связь, превращаясь в простую с образованием производных предельных углеводородов. При энергичном химическом воздействии возможен распад молекул с разрывом углеродной цепи по месту тройной связи.
Слайд 15Присоединение водорода (реакция гидрирования)
В присутствии катализаторов (например, Pt или Pd) водород
Слайд 17Присоединение галогенов
При взаимодействии ацетиленовых углеводородов с галогенами последние присоединяются по месту
Слайд 18Присоединение галогеноводородов
Присоединение галогеноводородов протекает ступенчато. Вначале образуется моногалогенпроизводное этиленового ряда
К последнему
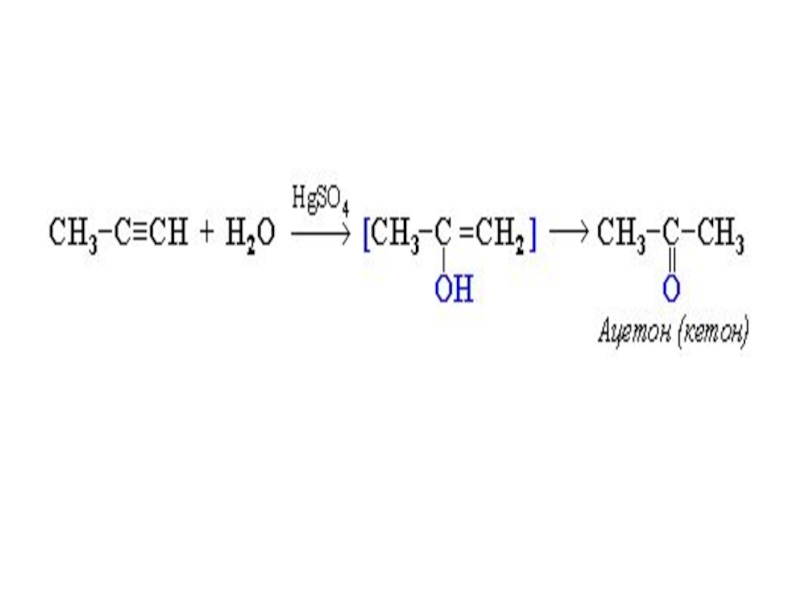
Слайд 19Присоединение воды (реакция гидратации)
Эта реакция была открыта в 1881г. М.Г. Кучеровым.
Слайд 20
Образующееся соединение – виниловый спирт – относится к непредельным спиртам, в
Слайд 22 Замещение водорода при атомах углерода с тройной связью на металл
Все рассмотренные до сих пор реакции ацетиленовых углеводородов аналогичны реакциям углеводородов ряда этилена. Отличительной особенностью ацетиленовых углеводородов является подвижность атомов водорода, соединенных с углеродными атомами при тройной связи. Под влиянием последней атомы водорода в присутствии сильного основания (амида натрия NaNH2,металлоорганического соединения, иногда концентрированных растворов щелочей) проявляют способность замещаться на металл. При этом образуется металлические производные – ацетилениды
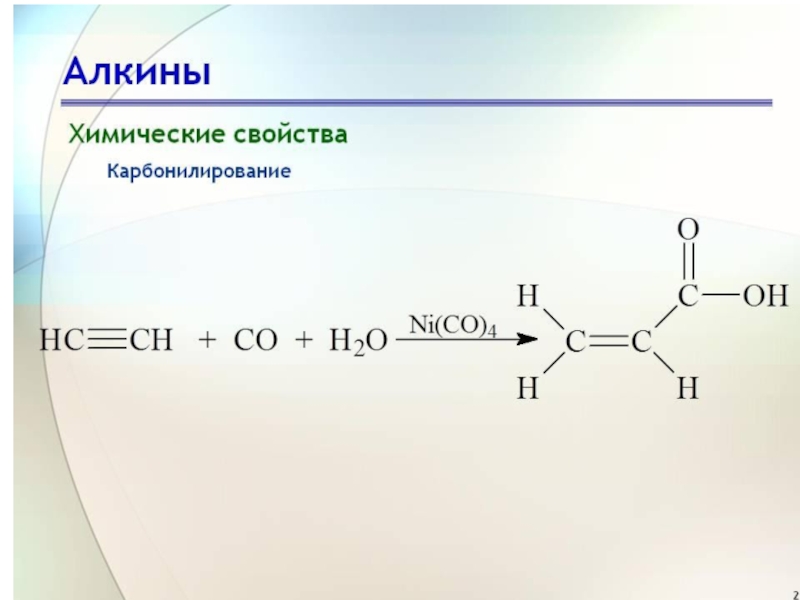
Слайд 24Присоединение СО
Присоединение СО (реакция В. Реппе). Идет в присутствии никелевых катализаторов
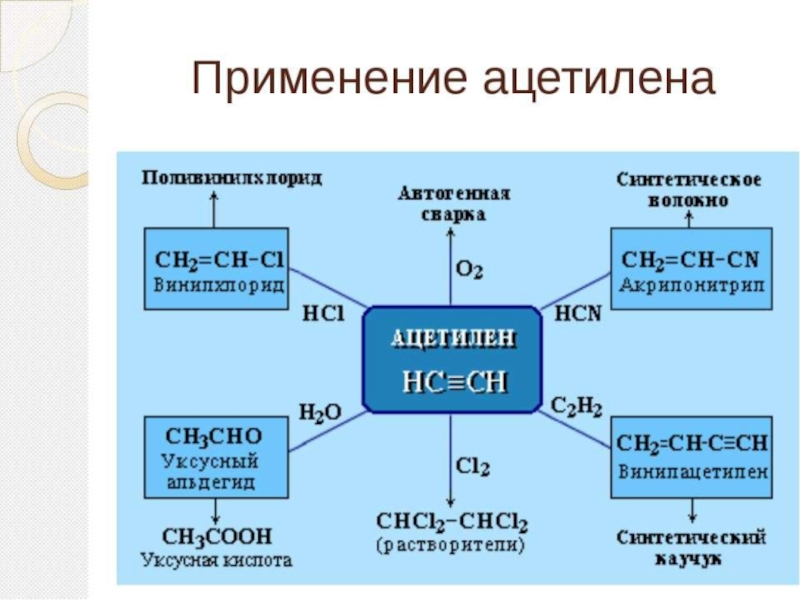
Слайд 27Темы для сообщений
Промышленное использование алкинов
Ацетилен, его открытие, свойства и использование в
Ароматические углеводороды, их применение, физико-химические и пожаровзрывоопасные свойства.
Современное представление о строении молекулы бензола. Гомологический ряд бензола, номенклатура, изомерия. Токсичность аренов.