- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь. Взаимное влияние атомов в молекуле презентация
Содержание
- 1. Химическая связь. Взаимное влияние атомов в молекуле
- 4. π-связь - ковалентная связь, возникающая при «боковом»
- 5. Типы химических связей Ковалентная связь. Характеристики
- 7. Типы химических связей Ковалентная связь. Характеристики
- 11. 2. Сопряжение. Сопряженные системы
- 17. 2. Сопряжение. Сопряженные системы. Ароматичность
- 19. 2. Сопряжение. Сопряженные системы. Ароматичность
- 25. +М-эффектом обладают
- 26. - М-эффект проявляют заместители, которые понижают электронную
- 30. КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ. КИСЛОТНЫЕ И
- 31. Основные закономерности протекания реакций Термины
- 32. Основные закономерности протекания реакций Термины
- 33. Основные закономерности протекания реакций Механизм реакции
- 34. 2. Классификация реакций и реагентов Типы реагентов
- 35. 2. Классификация реакций и реагентов Типы реагентов
- 36. 2. Классификация реакций и реагентов Типы реагентов
- 37. 2. Классификация реакций и реагентов Типы реакций
- 38. 2. Классификация реакций и реагентов Типы реакций
- 39. 2. Классификация реакций и реагентов Типы реакций
- 40. 2. Классификация реакций и реагентов Типы реакций
- 41. 2. Классификация реакций и реагентов Типы реакций
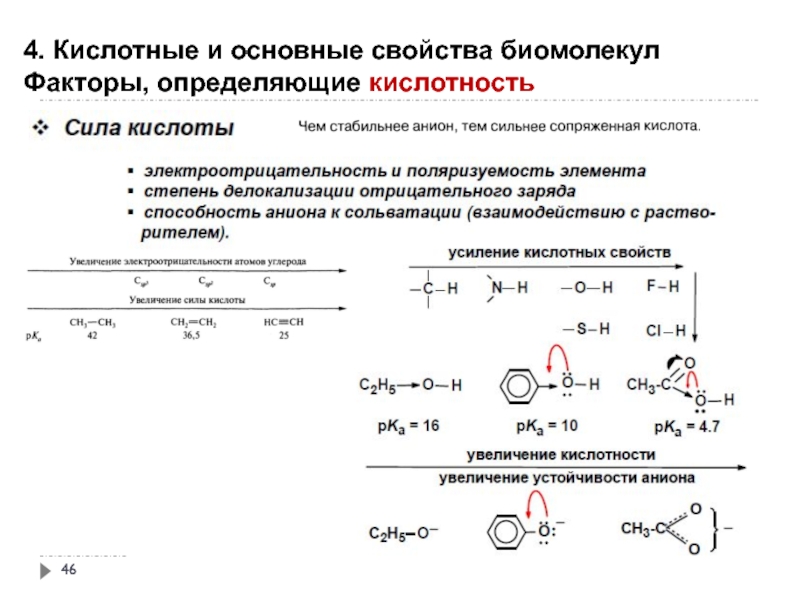
- 42. 4. Кислотные и основные свойства биомолекул Кислотность
- 46. 4. Кислотные и основные свойства биомолекул Факторы,
- 47. РЕАКЦИОННАЯ СПОСОБНОСТЬ УГЛЕВОДОРОДОВ СТРУКТУРА И ФУНКЦИИ БИОЛЕКУЛ. ЛЕКЦИЯ 3.
- 50. 1. Реакционная способность насыщенных углеводородов
- 51. 1. Реакционная способность насыщенных углеводородов
- 52. 1. Реакционная способность насыщенных углеводородов
- 53. 1. Реакционная способность насыщенных углеводородов
- 54. 1. Реакционная способность насыщенных углеводородов
- 55. 1. Реакционная способность насыщенных углеводородов
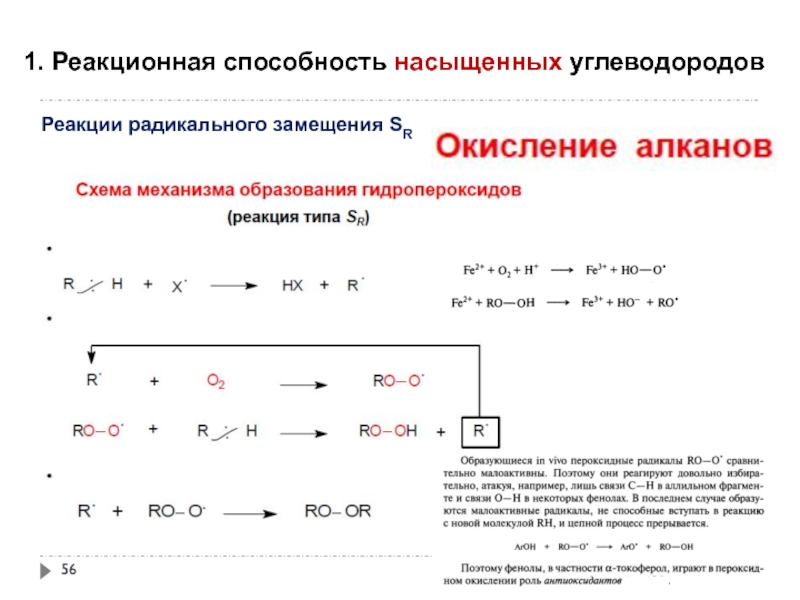
- 56. 1. Реакционная способность насыщенных углеводородов
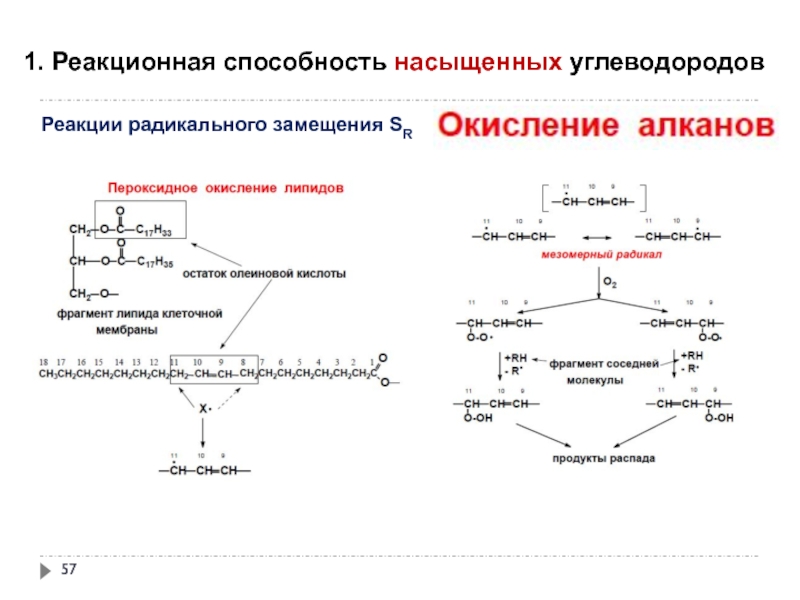
- 57. 1. Реакционная способность насыщенных углеводородов
- 58. 2. Реакционная способность ненасыщенных углеводородов
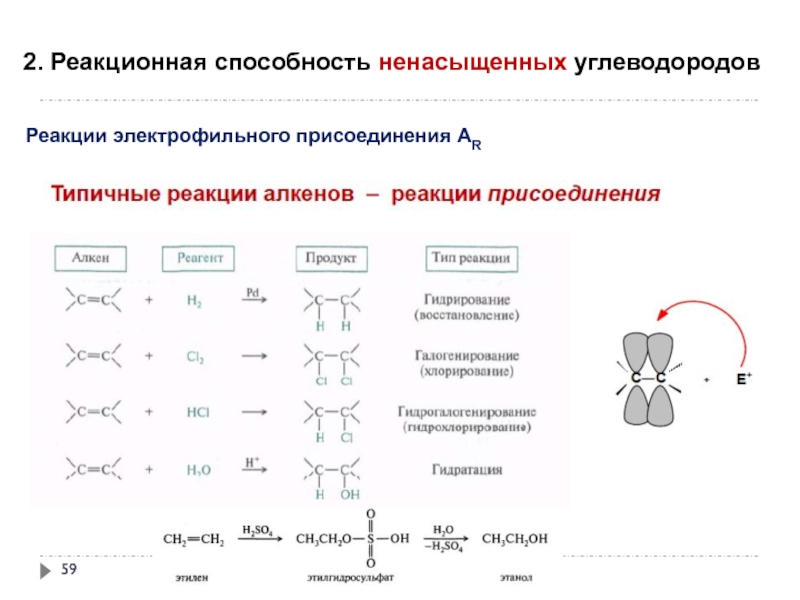
- 59. 2. Реакционная способность ненасыщенных углеводородов
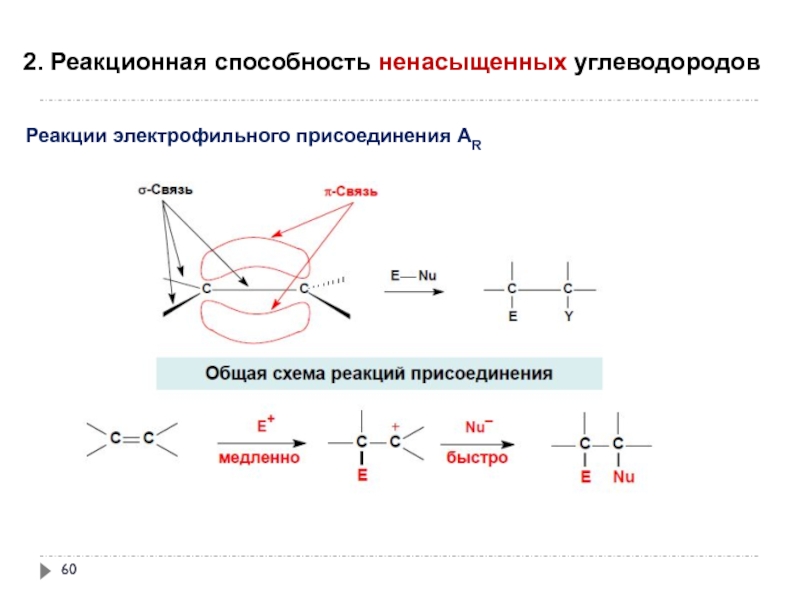
- 60. 2. Реакционная способность ненасыщенных углеводородов
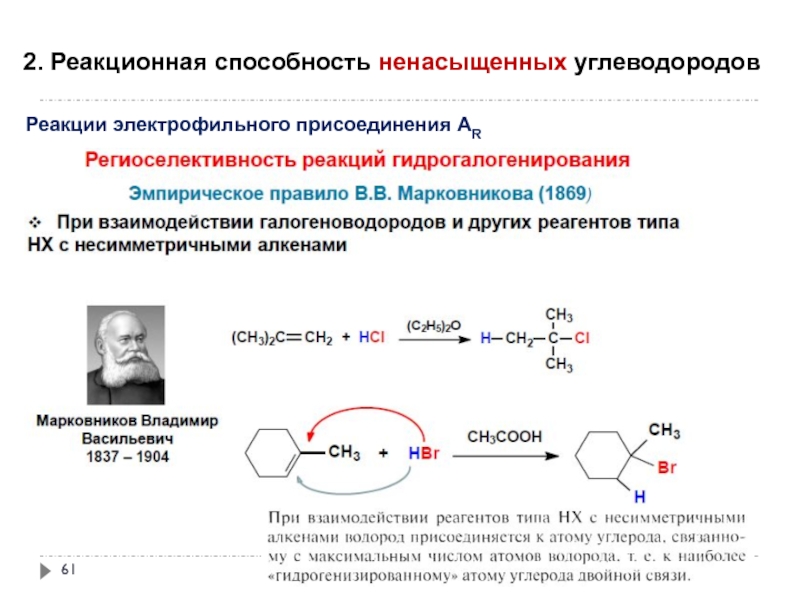
- 61. 2. Реакционная способность ненасыщенных углеводородов
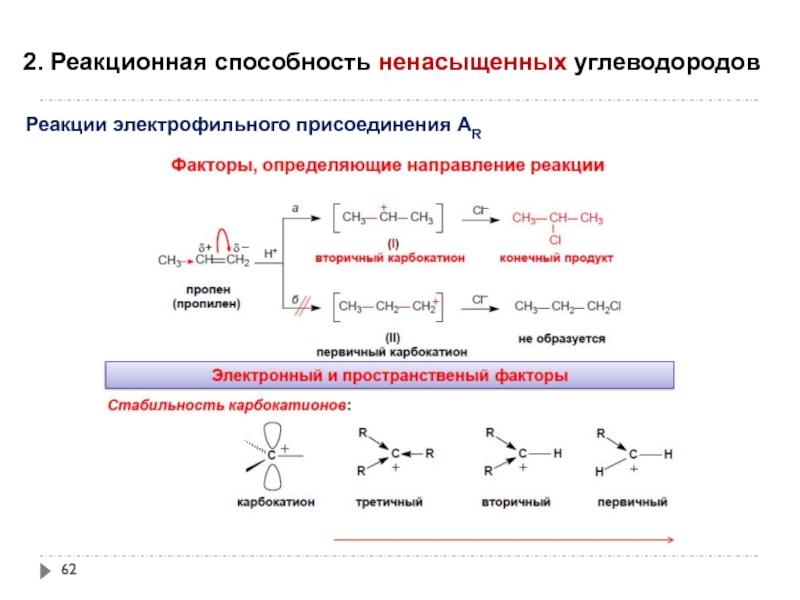
- 62. 2. Реакционная способность ненасыщенных углеводородов
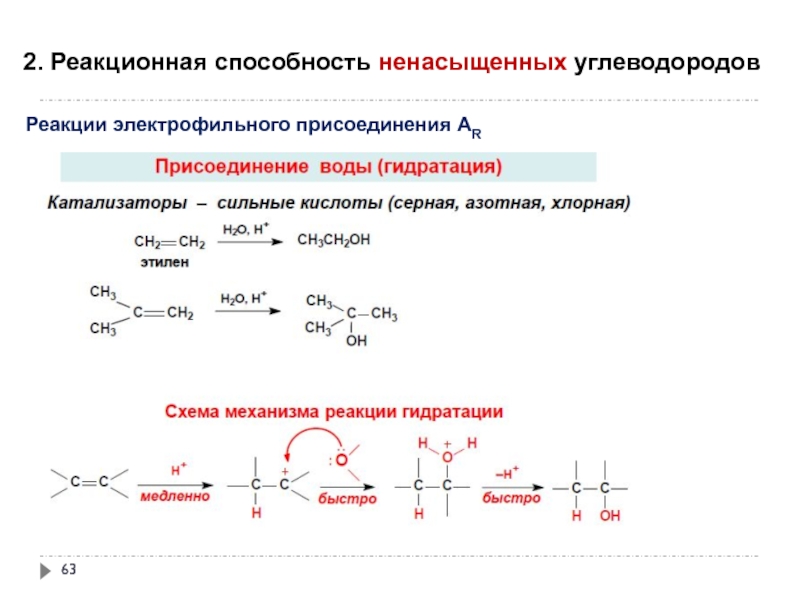
- 63. 2. Реакционная способность ненасыщенных углеводородов
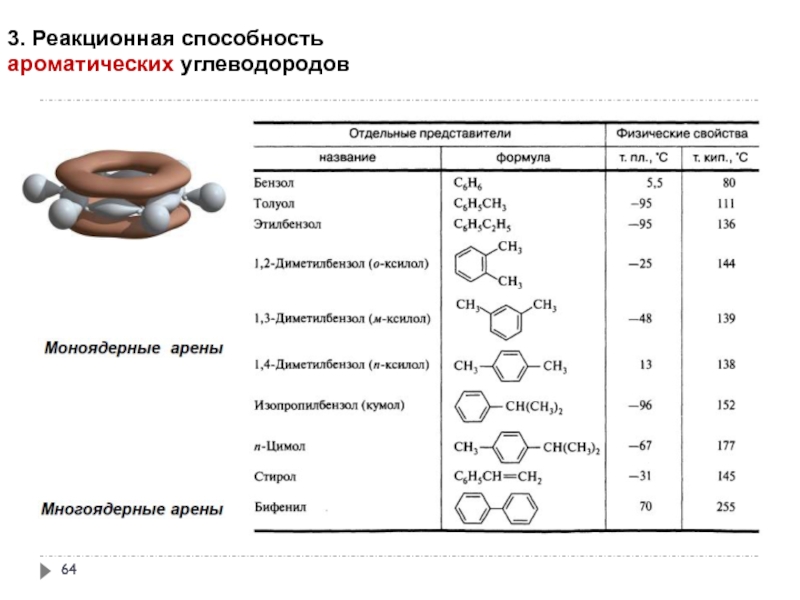
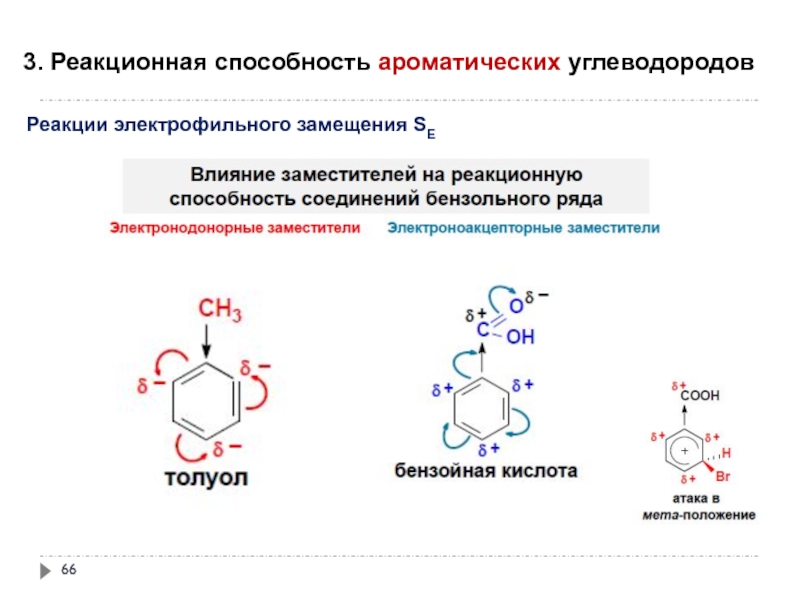
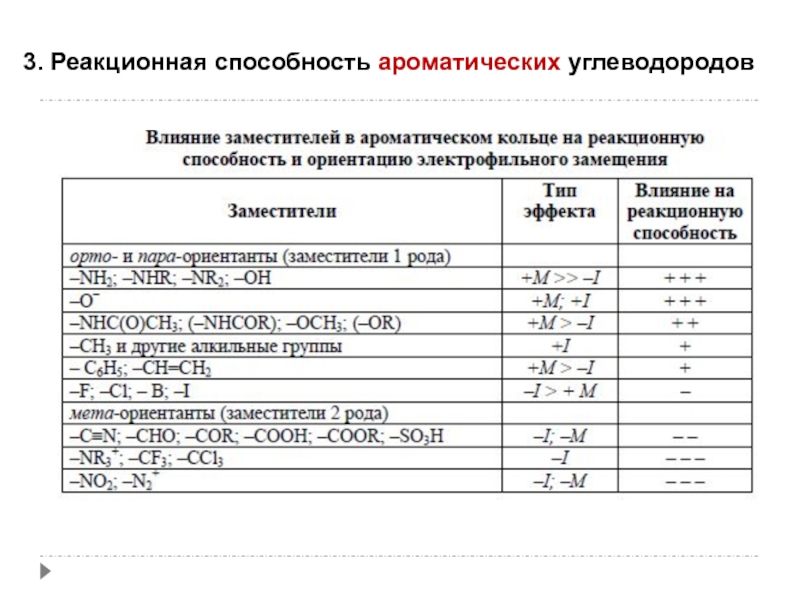
- 64. 3. Реакционная способность ароматических углеводородов
- 65. 3. Реакционная способность ароматических углеводородов
- 66. 3. Реакционная способность ароматических углеводородов
- 67. 3. Реакционная способность ароматических углеводородов
- 68. 3. Реакционная способность ароматических углеводородов
- 69. 3. Реакционная способность ароматических углеводородов
- 70. БИОЛОГИЧЕСКИ ВАЖНЫЕ РЕАКЦИИ МОНОФУНКЦИОНАЛЬНЫХ СОЕДИНЕНИЙ. РЕАКЦИОННАЯ СПОСОБНОСТЬ
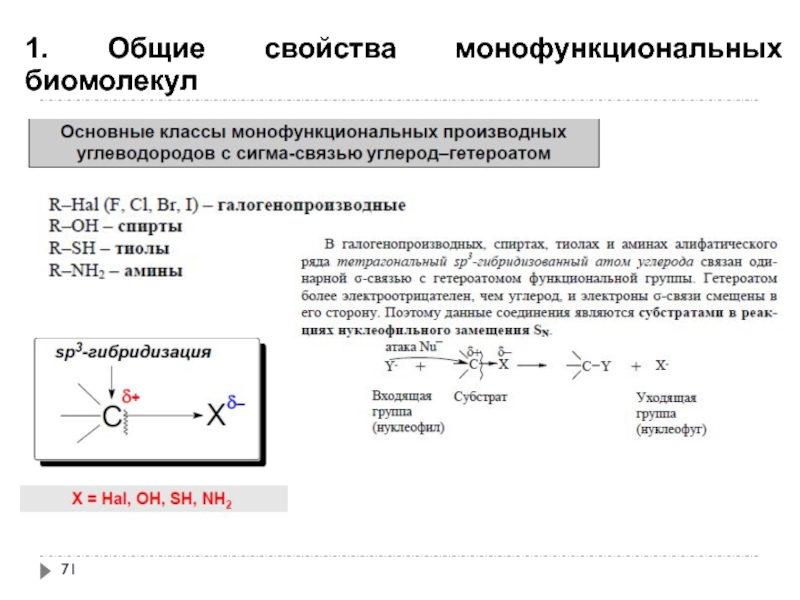
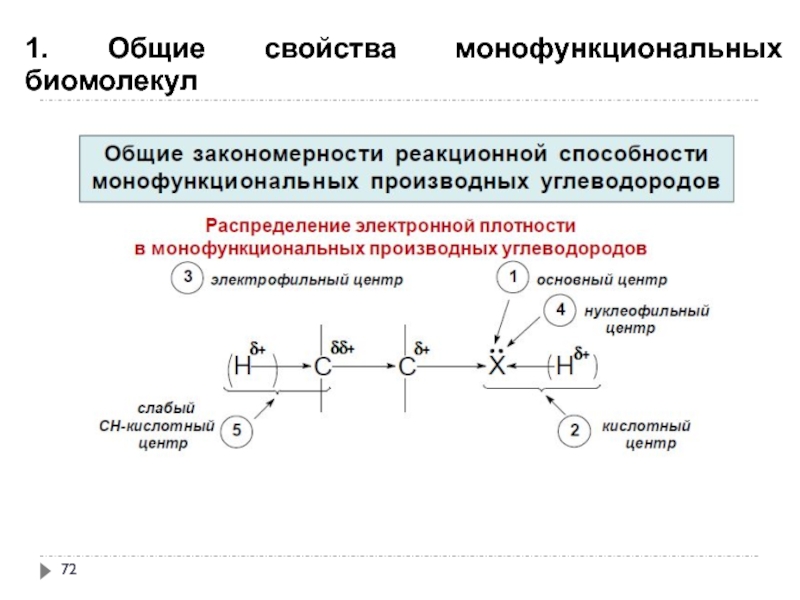
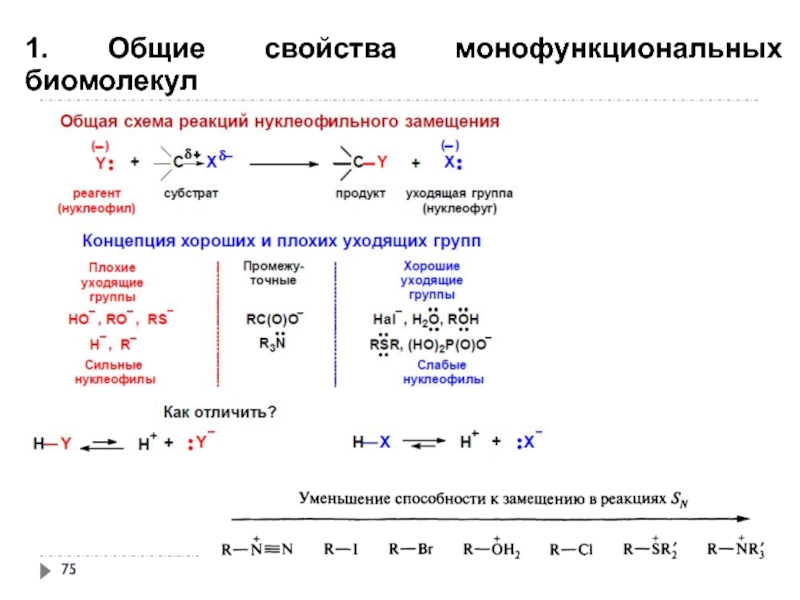
- 71. 1. Общие свойства монофункциональных биомолекул
- 72. 1. Общие свойства монофункциональных биомолекул
- 73. 1. Общие свойства монофункциональных биомолекул
- 74. 1. Общие свойства монофункциональных биомолекул
- 75. 1. Общие свойства монофункциональных биомолекул
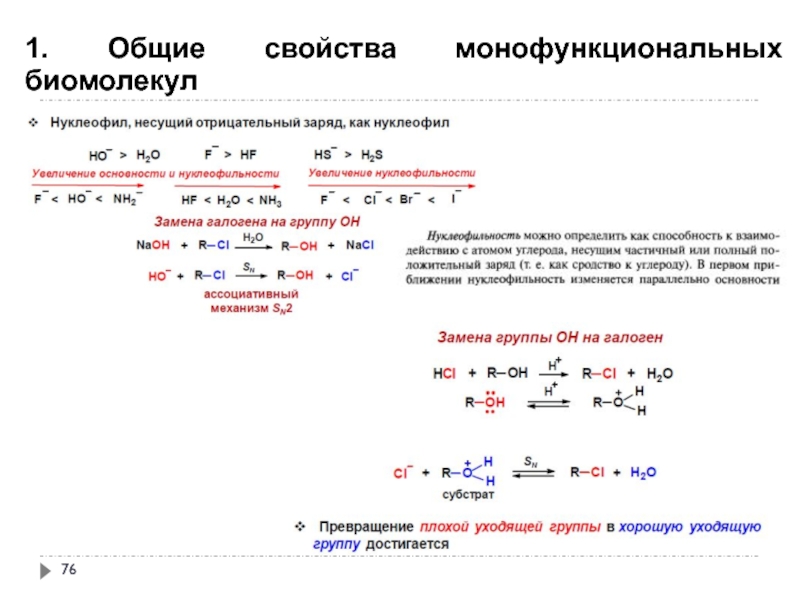
- 76. 1. Общие свойства монофункциональных биомолекул
- 77. 1. Общие свойства монофункциональных биомолекул
- 78. 1. Общие свойства монофункциональных биомолекул
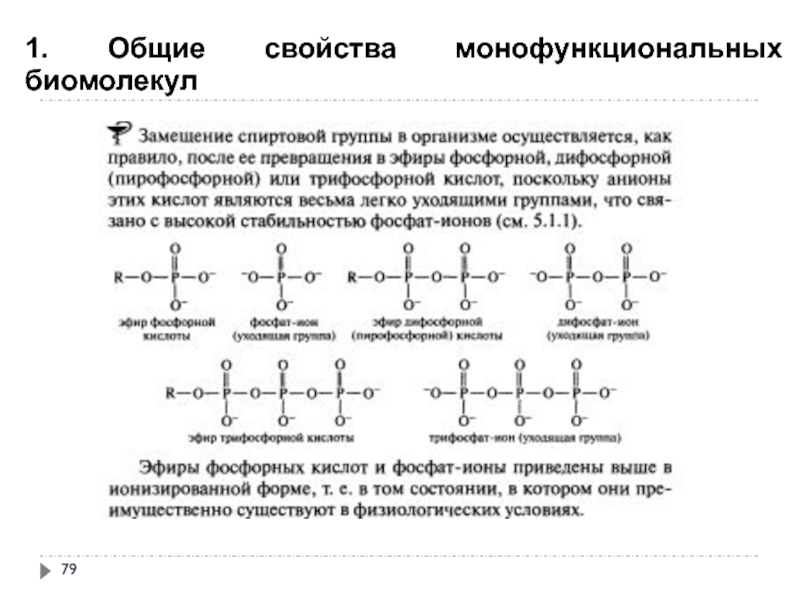
- 79. 1. Общие свойства монофункциональных биомолекул
- 80. 2. Галогенопроизводные
- 81. 3. Спирты, фенолы
- 82. 3. Спирты, фенолы
- 83. 3. Спирты, фенолы
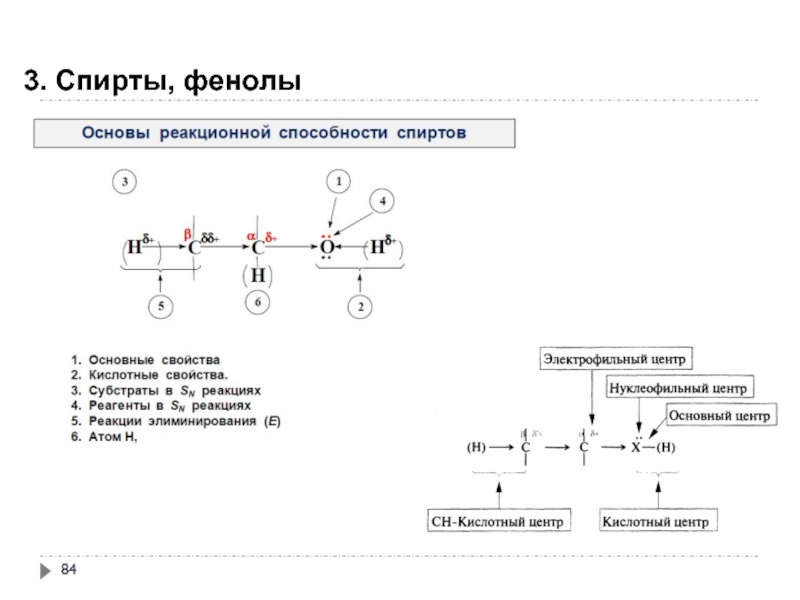
- 84. 3. Спирты, фенолы
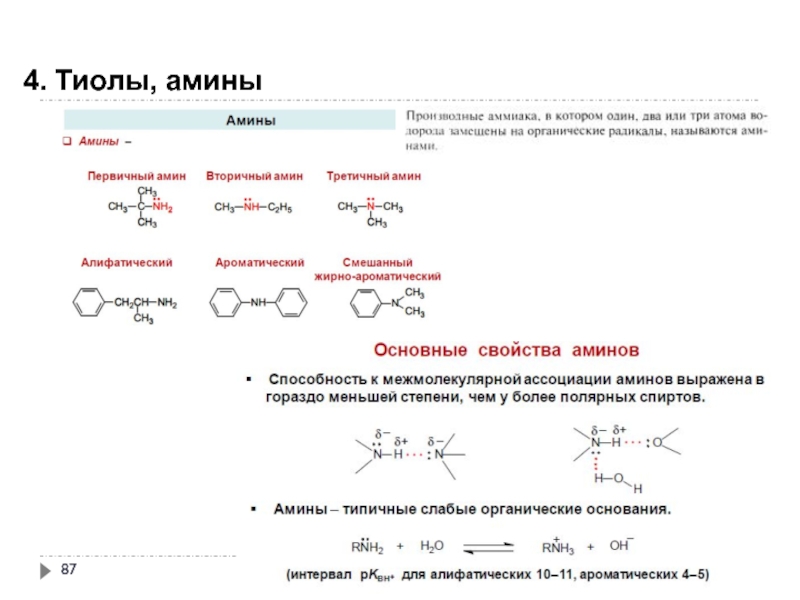
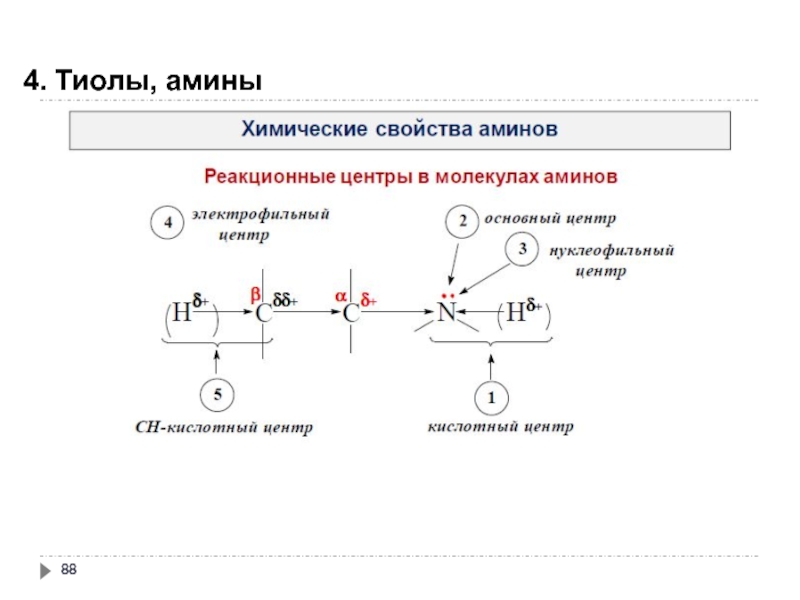
- 85. 4. Тиолы, амины
- 86. 4. Тиолы, амины
- 87. 4. Тиолы, амины
- 88. 4. Тиолы, амины
- 89. БИОЛОГИЧЕСКИ ВАЖНЫЕ РЕАКЦИИ МОНОФУНКЦИОНАЛЬНЫХ СОЕДИНЕНИЙ. РЕАКЦИОННАЯ СПОСОБНОСТЬ
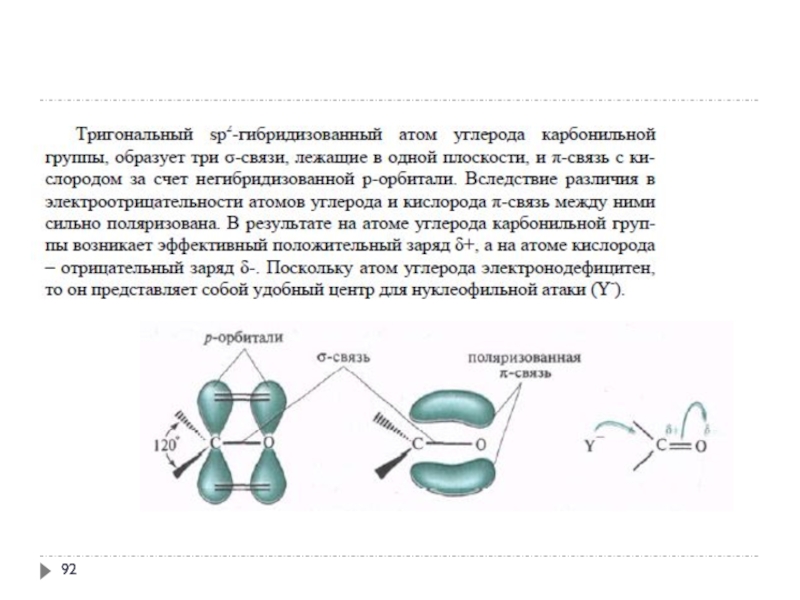
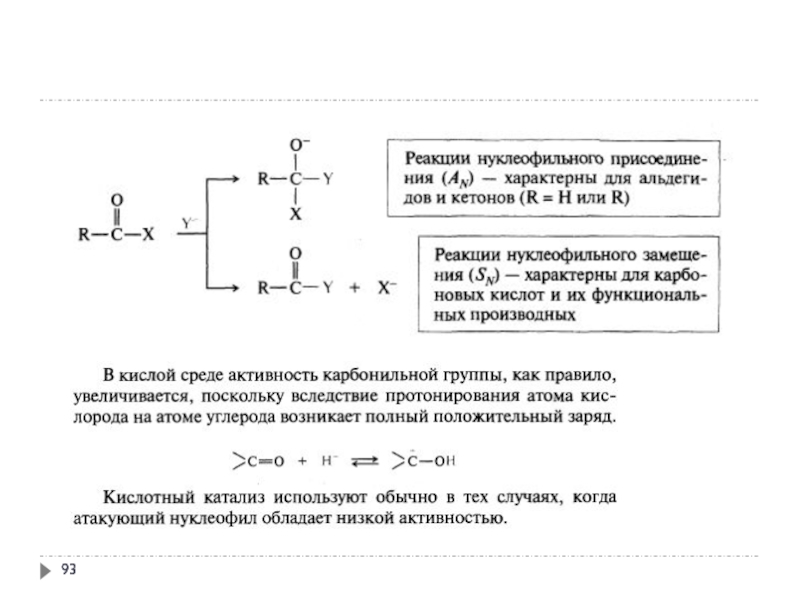
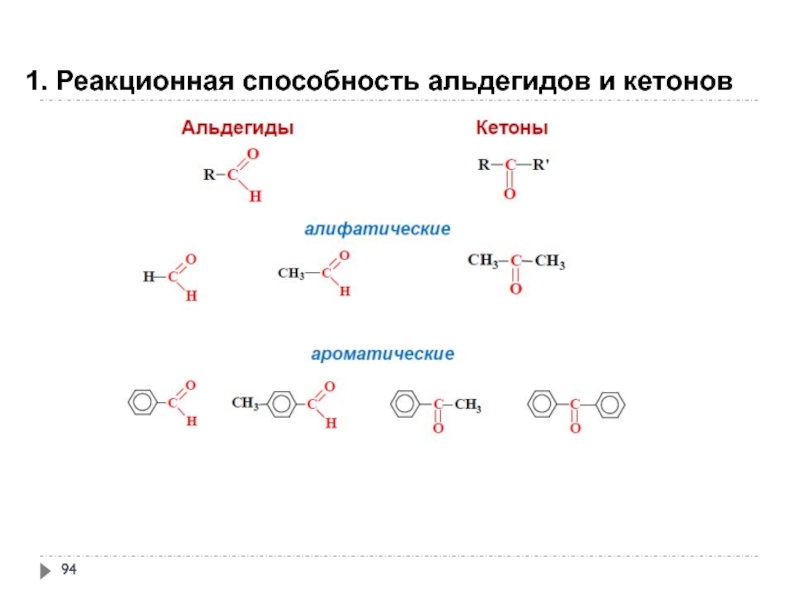
- 94. 1. Реакционная способность альдегидов и кетонов
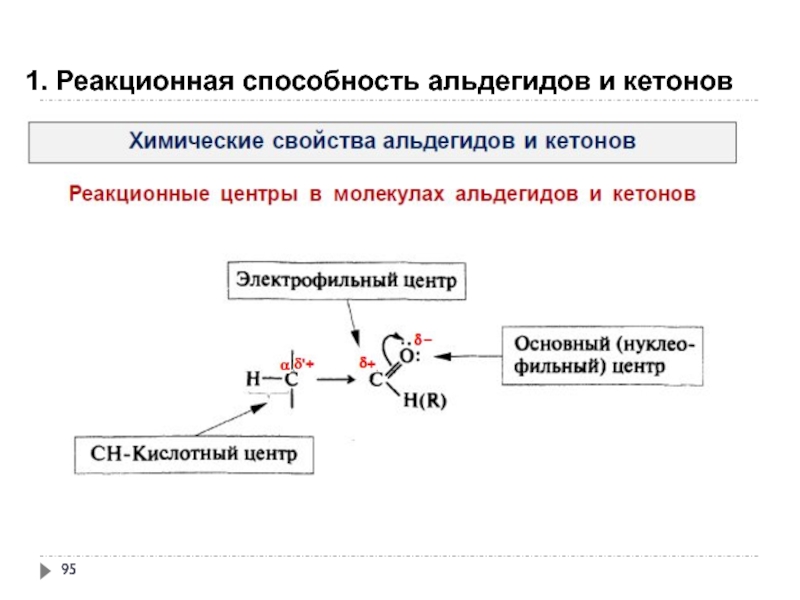
- 95. 1. Реакционная способность альдегидов и кетонов
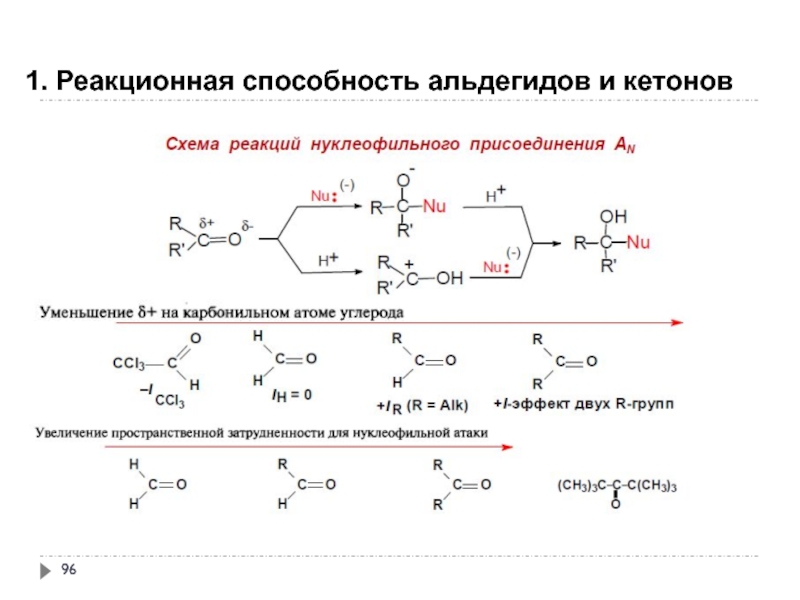
- 96. 1. Реакционная способность альдегидов и кетонов
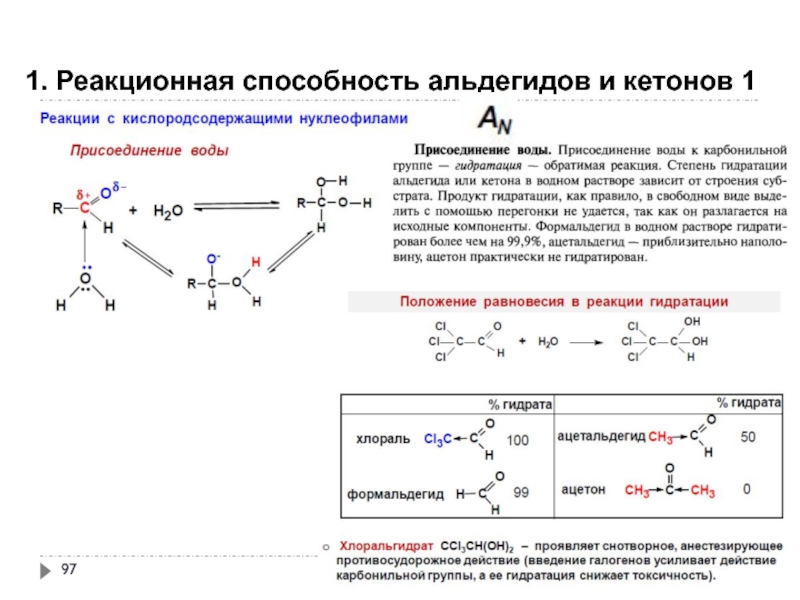
- 97. 1. Реакционная способность альдегидов и кетонов 1
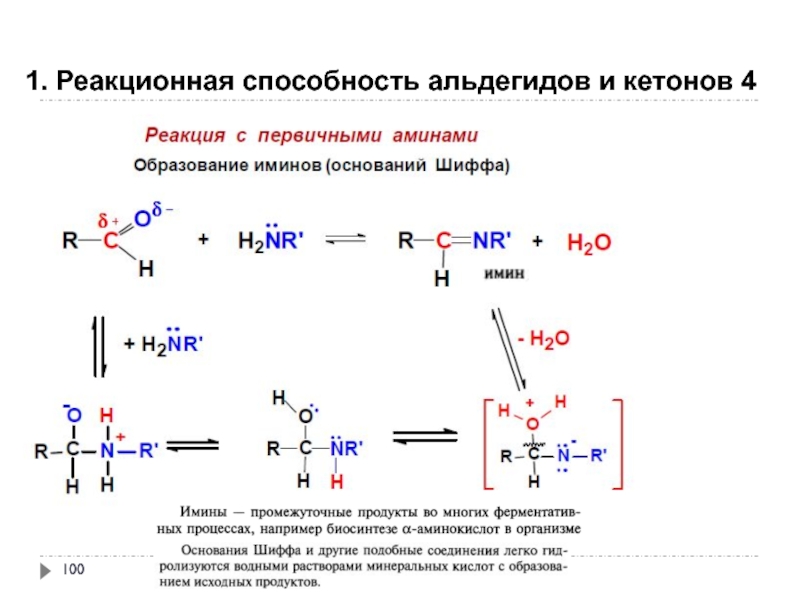
- 100. 1. Реакционная способность альдегидов и кетонов 4
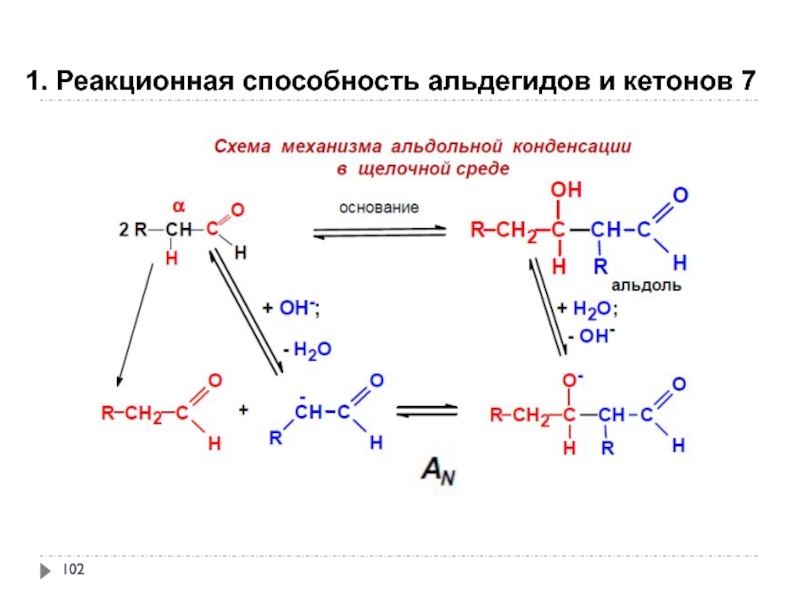
- 101. 1. Реакционная способность альдегидов и кетонов 7
- 102. 1. Реакционная способность альдегидов и кетонов 7
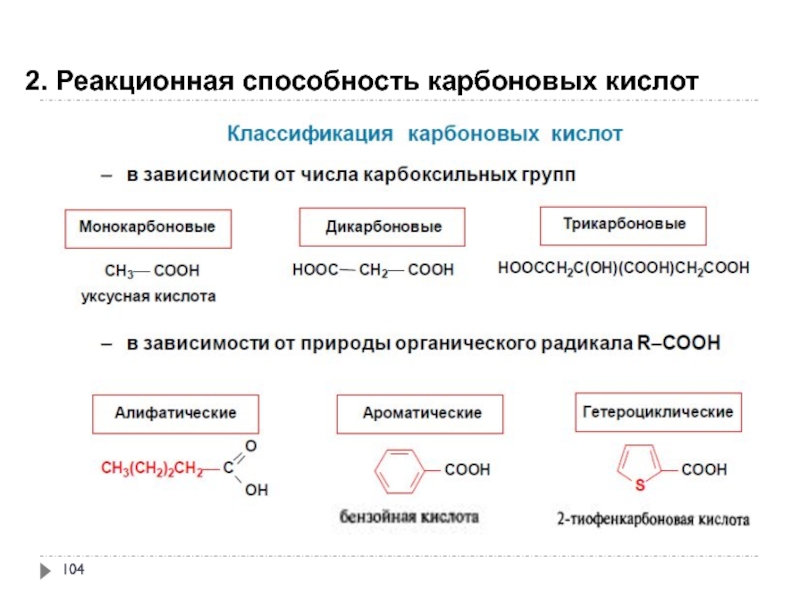
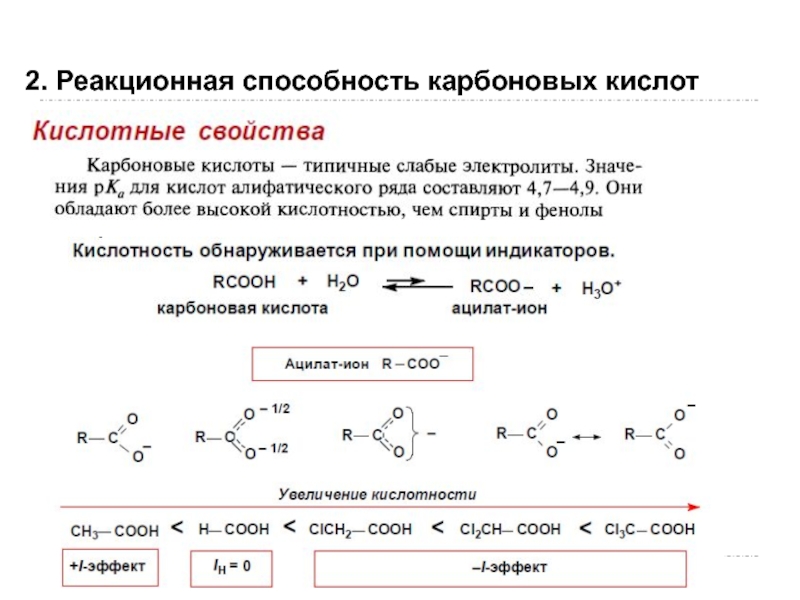
- 103. 2. Реакционная способность карбоновых кислот
- 104. 2. Реакционная способность карбоновых кислот
- 105. 2. Реакционная способность карбоновых кислот
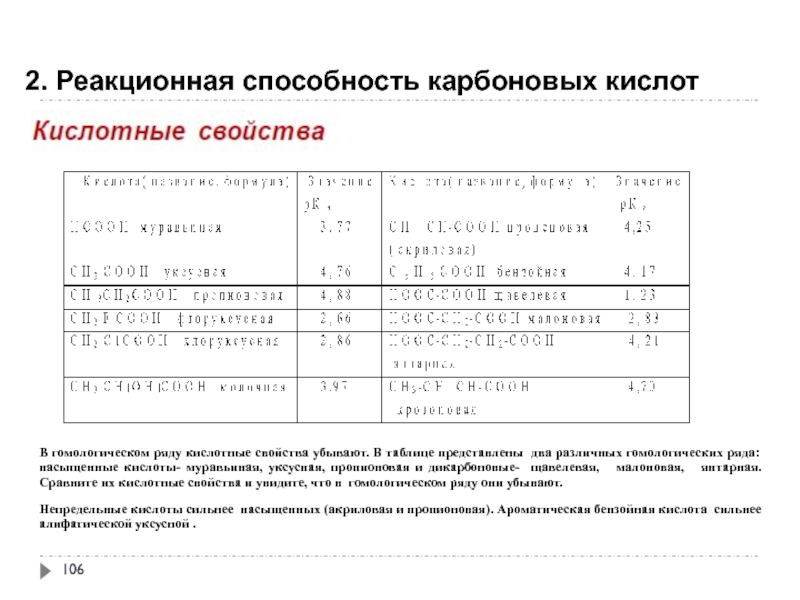
- 107. 2. Реакционная способность карбоновых кислот
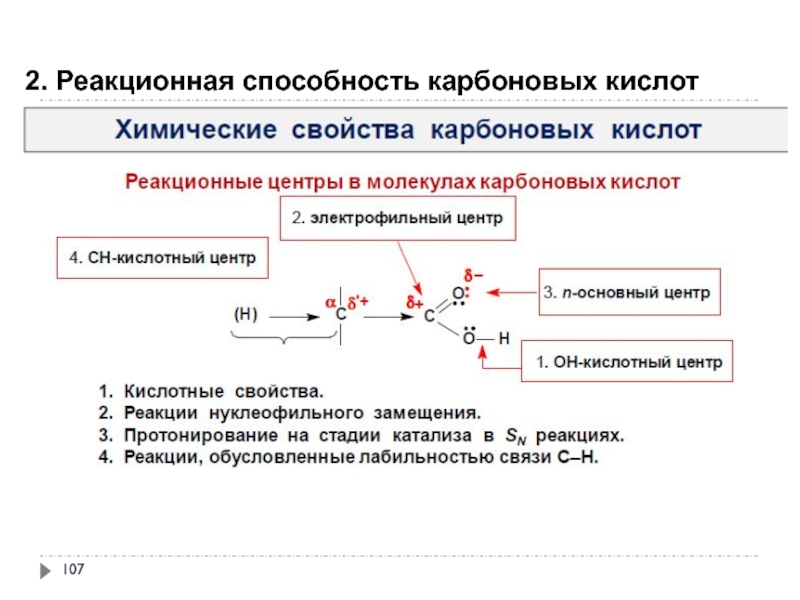
- 108. 2. Реакционная способность карбоновых кислот
- 109. 2. Реакционная способность карбоновых кислот
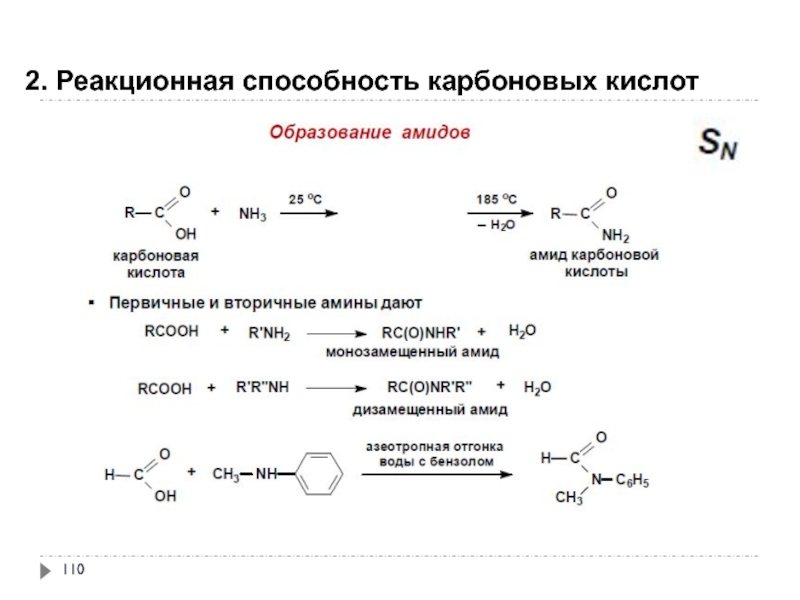
- 110. 2. Реакционная способность карбоновых кислот
Слайд 2
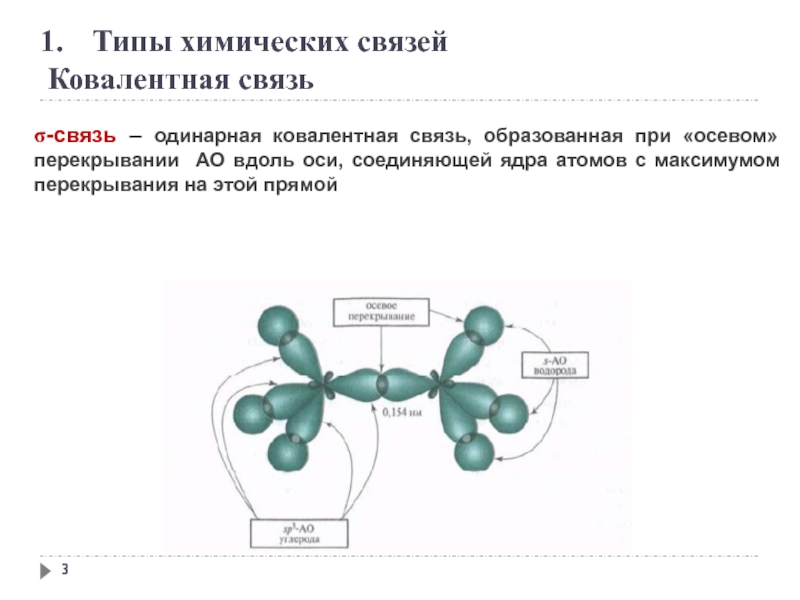
образуется путём обобществления пары электронов двух связываемых атомов.
1. Типы химических связей
Ковалентная связь
Слайд 3
Типы химических связей
Ковалентная связь
σ-связь – одинарная ковалентная связь, образованная при
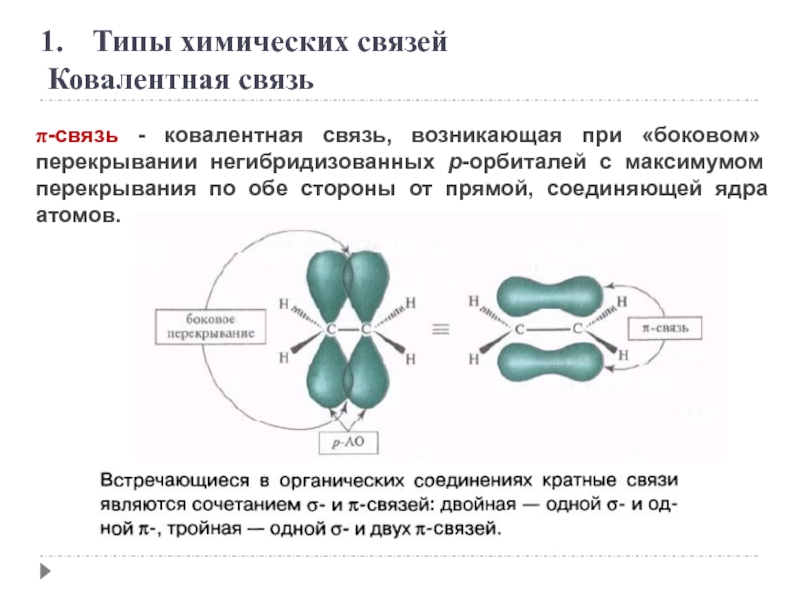
Слайд 4π-связь - ковалентная связь, возникающая при «боковом» перекрывании негибридизованных p-орбиталей с
Типы химических связей
Ковалентная связь
Слайд 8
Типы химических связей
Ковалентная связь. Механизмы образования
обменный механизм
донорно-акцепторная связь
носители неподеленных пар
Слайд 12
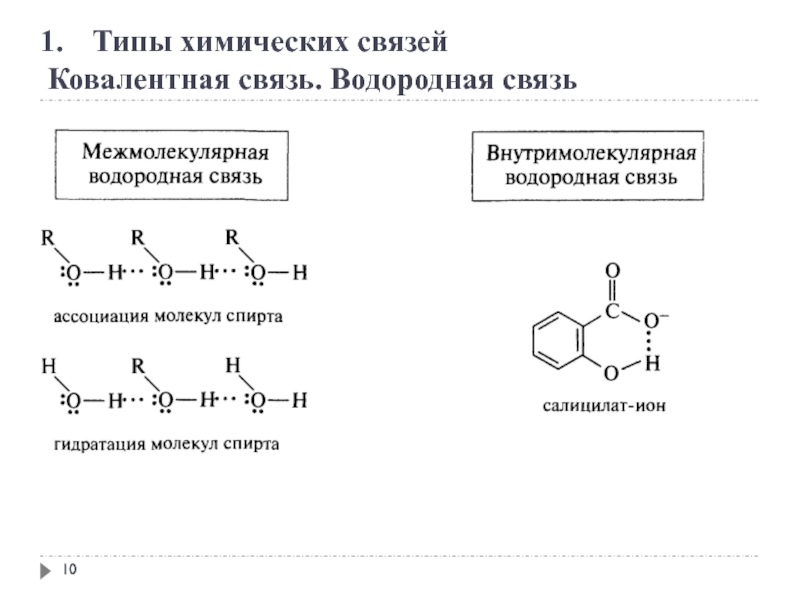
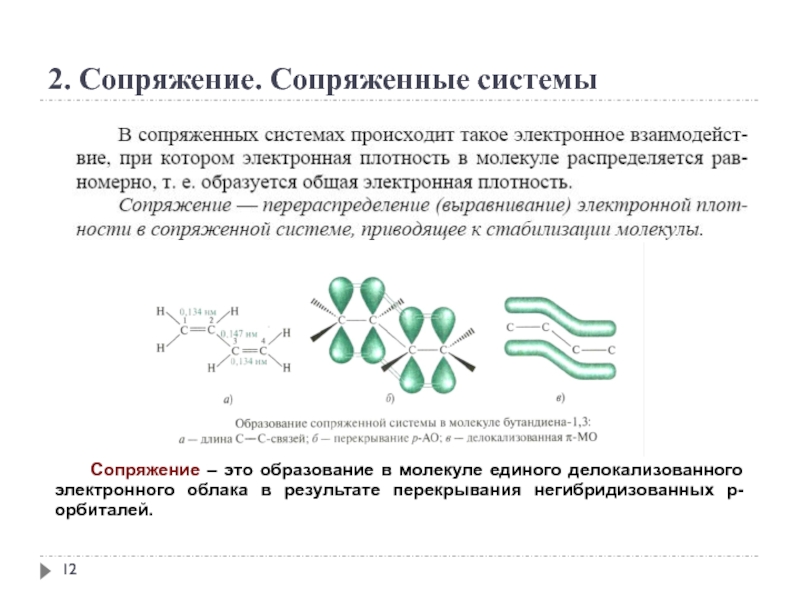
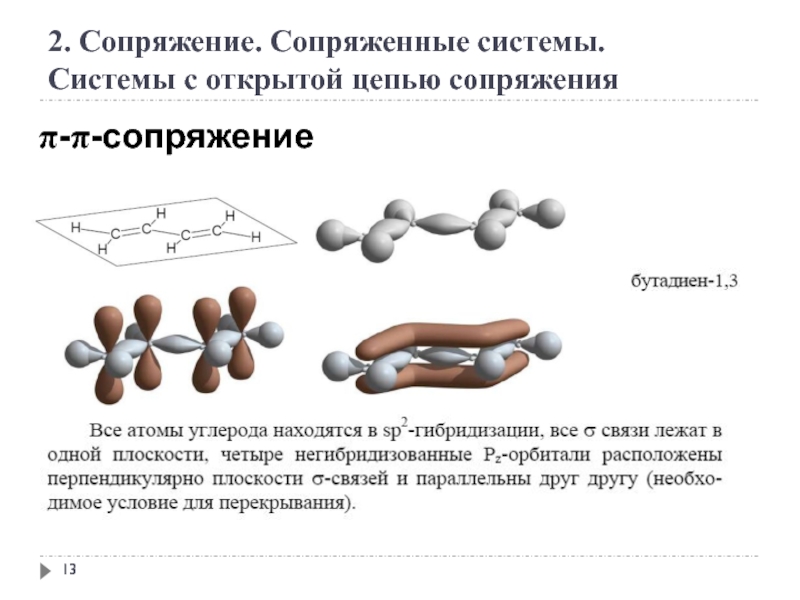
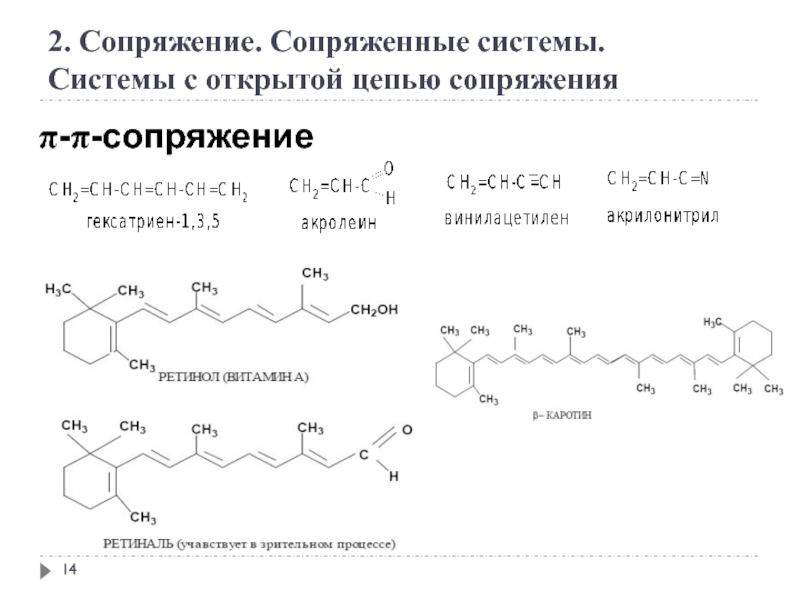
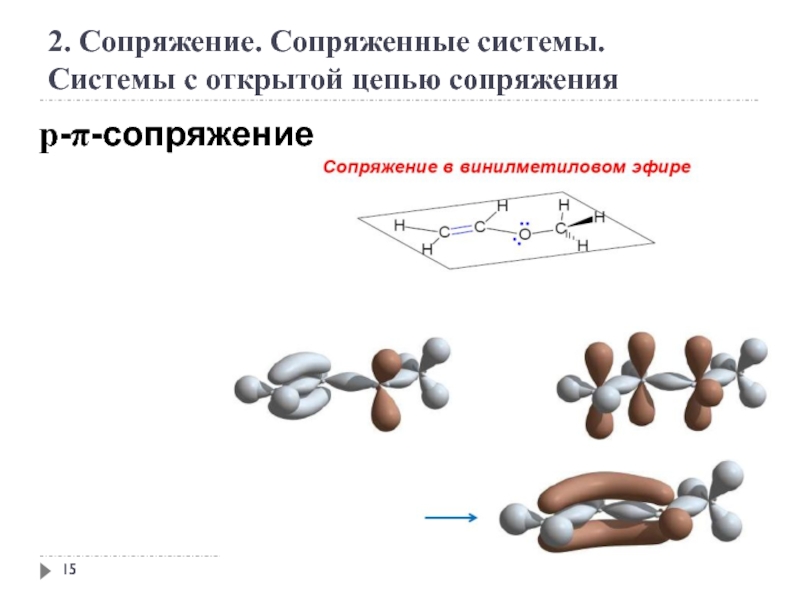
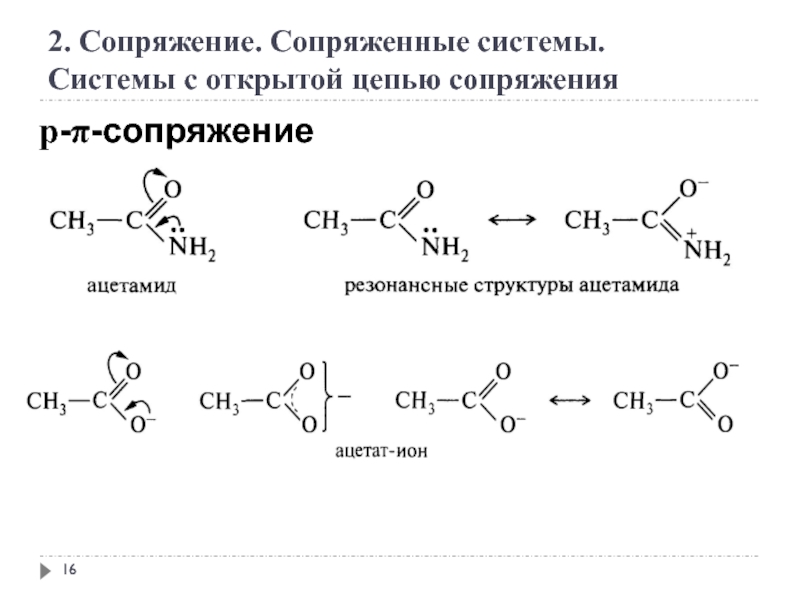
2. Сопряжение. Сопряженные системы
Сопряжение – это образование в
Слайд 18
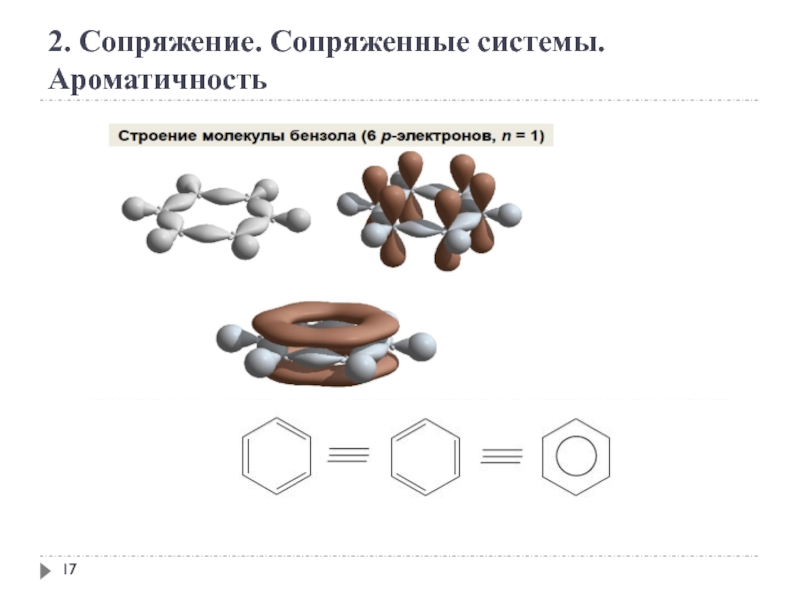
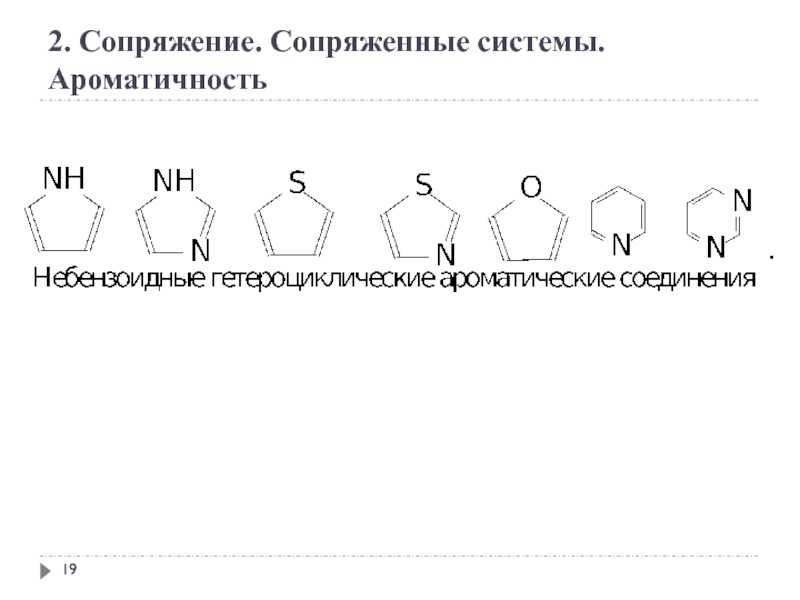
2. Сопряжение. Сопряженные системы. Ароматичность
Ароматичность — особое свойство некоторых химических соединений,
Правило Хюккеля.
Система ароматична, если она обладает совокупностью следующих признаков:
а) все атомы в цикле находятся в sр2-гибридизации (следовательно, σ-скелет плоскостной);
б) молекула имеет циклическую систему сопряжения;
в) в сопряжении участвует (4n+2) - π -электронов, где n — целое число (n=0,1,2,3,4...).
Слайд 21
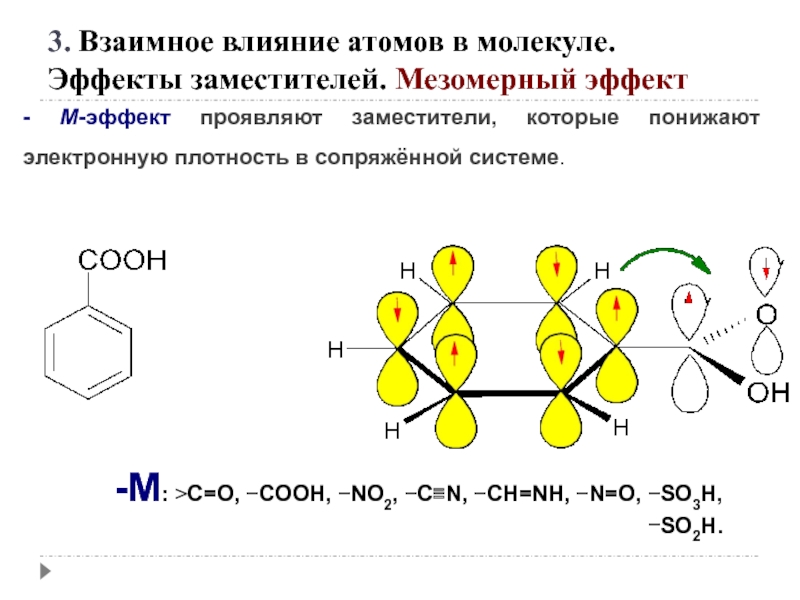
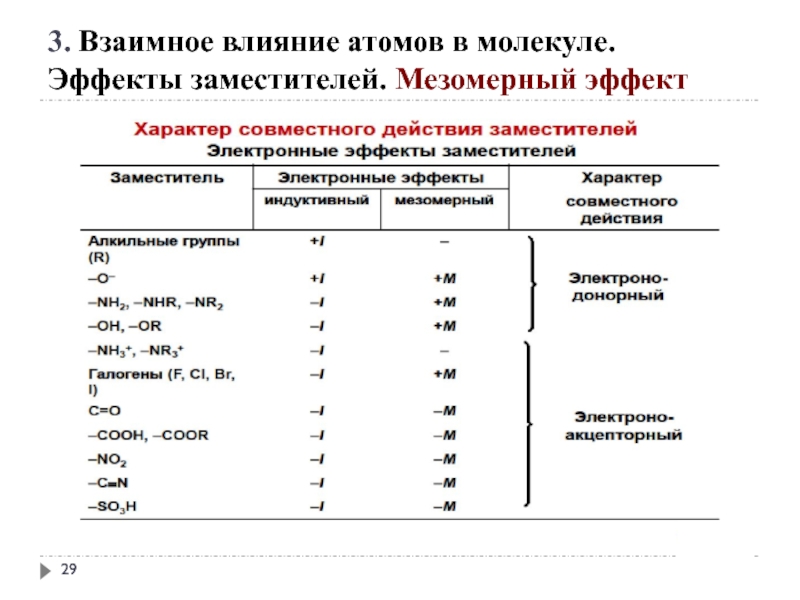
3. Взаимное влияние атомов в молекуле.
Эффекты заместителей. Индуктивный эффект
Электроноакцепторные заместители X,
C X
Электронодонорные заместители X, т. е. атом или группа атомов, смещающие электронную плотность к атому углерода, проявляют положительный индуктивный эффект (+I-эффект).
C Y
Слайд 23
3. Взаимное влияние атомов в молекуле.
Эффекты заместителей. Индуктивный эффект
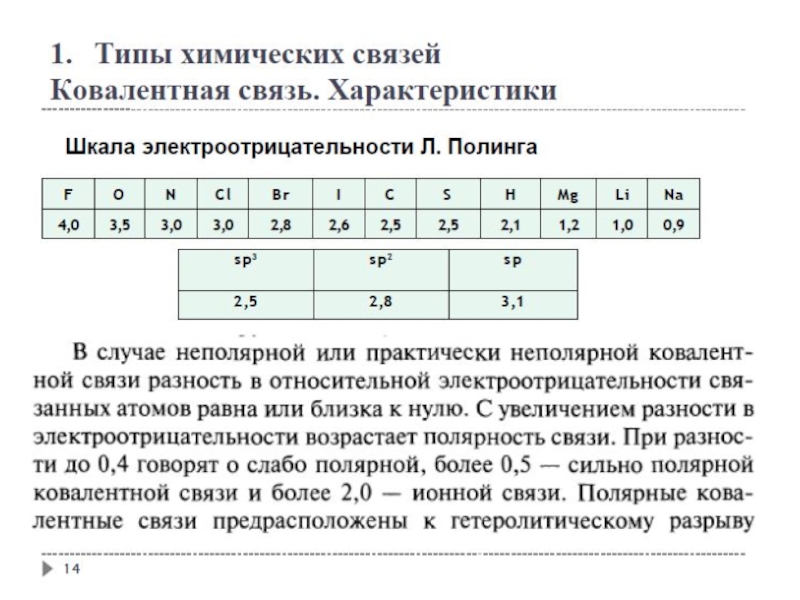
1. заместители, которые содержат атомы с большей ЭО, чем у углерода:
-F, -Cl, -Br, -OH, -NH2, -NO2, >C=O, -COOH и др.;
2. катионы.
+I эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью:
1. - насыщенные углеводородные радикалы
(-CH3, -C2H5) и т.п.,
(СН3)3С- > (СН3)2 СН- > СН3 — СН2 - > CН3-
трет.бутил изопропил этил метил
2. -металлы (-Mg-, -Li);
3. - анионы
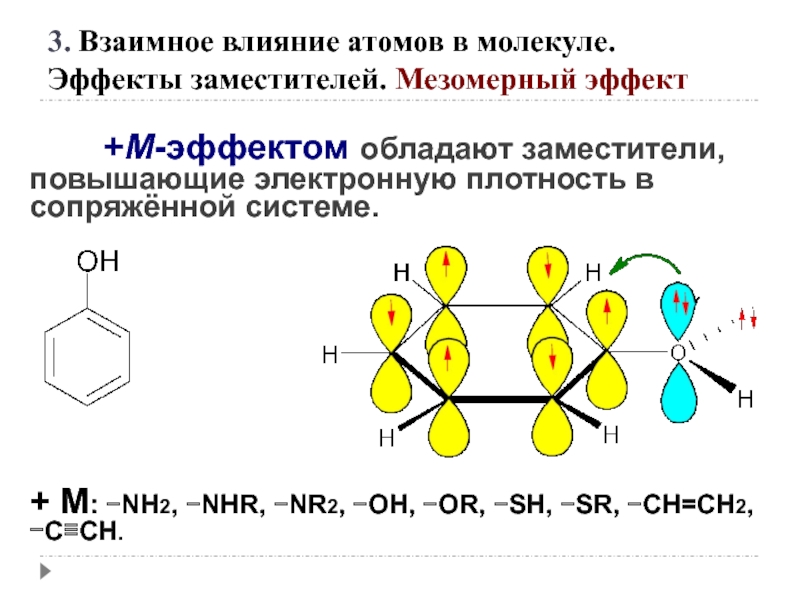
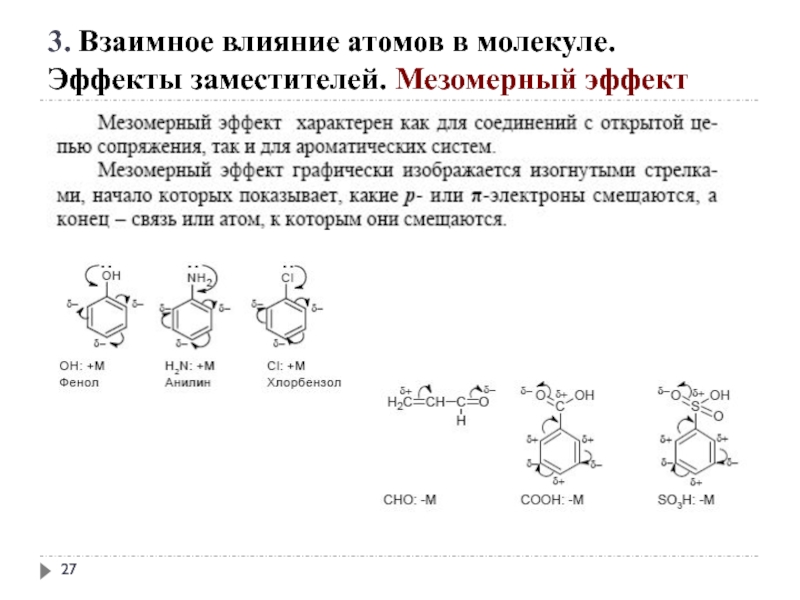
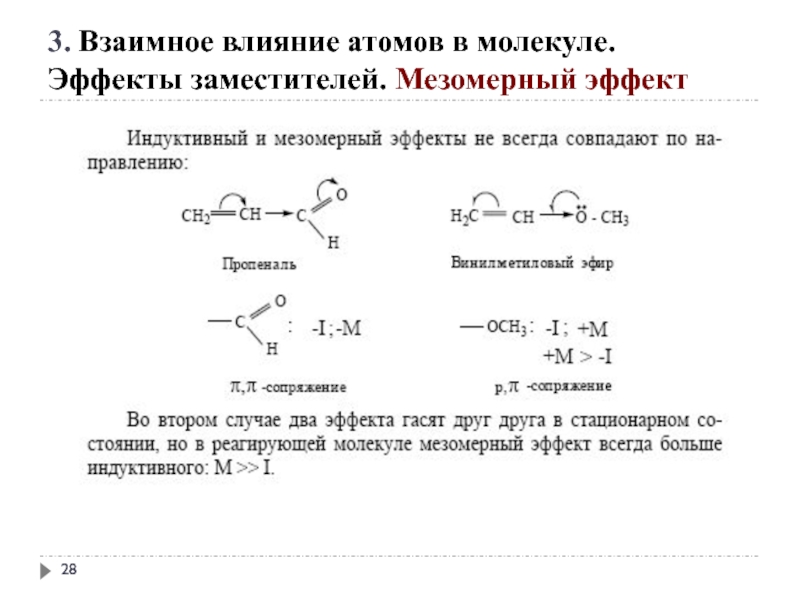
Слайд 25 +М-эффектом обладают заместители, повышающие электронную плотность
+ М: −NH2, −NHR, −NR2, −OH, −OR, −SH, −SR, −CH=CH2, −C≡CH.
3. Взаимное влияние атомов в молекуле.
Эффекты заместителей. Мезомерный эффект
+ М: −NH2, −NHR, −NR2, −OH, −OR, −SH, −SR, −CH=CH2, −C≡CH.
Слайд 26- М-эффект проявляют заместители, которые понижают электронную плотность в сопряжённой системе.
-M: >C=O, −COOH, −NO2, −C≡N, −CH=NH, −N=O, −SO3H, −SO2H.
3. Взаимное влияние атомов в молекуле.
Эффекты заместителей. Мезомерный эффект
Слайд 30
КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ.
КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА БИОМОЛЕКУЛ
СТРУКТУРА И ФУНКЦИИ БИОЛЕКУЛ.
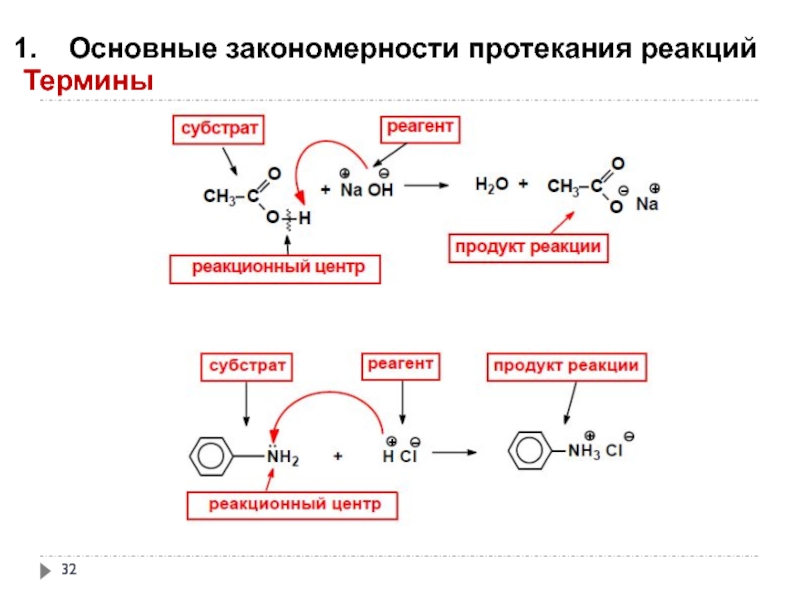
Слайд 31Основные закономерности протекания реакций
Термины
Реакционная способность – способность вещества вступать в химическую
Субстрат – вещество, вступающее в реакцию.
Как правило, это вещество, в котором у атома углерода происходит разрыв старой и образование новой связи.
Реагент – соединение, действующее на субстрат
Реакционный центр – это атом или группа атомов, непосредственно участвующие в данной химической реакции.
В биохимических процессах реагентами считают ферменты (биокатализаторы), а вещества, подвергающиеся их действию, называют субстратами.
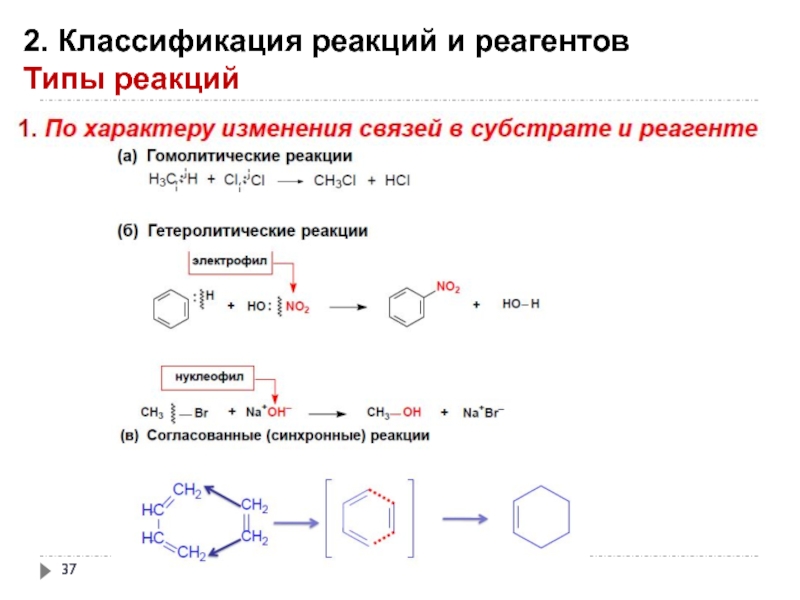
Слайд 412. Классификация реакций и реагентов
Типы реакций
Мономолекулярные (диссоциативные)
Бимолекулярные (ассоциативные)
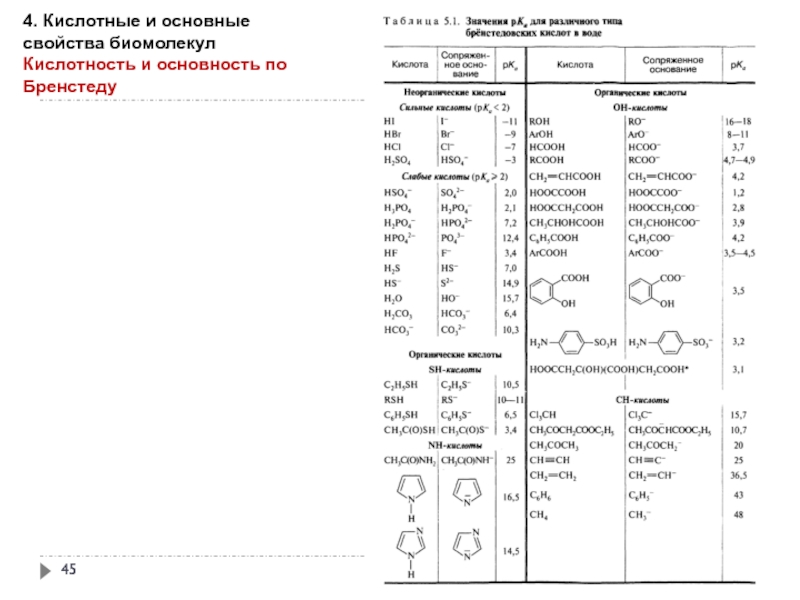
Слайд 43
Чем сильнее кислота, тем слабее сопряженное ей основание
4. Кислотные и основные
Кислотность и основность по Бренстеду
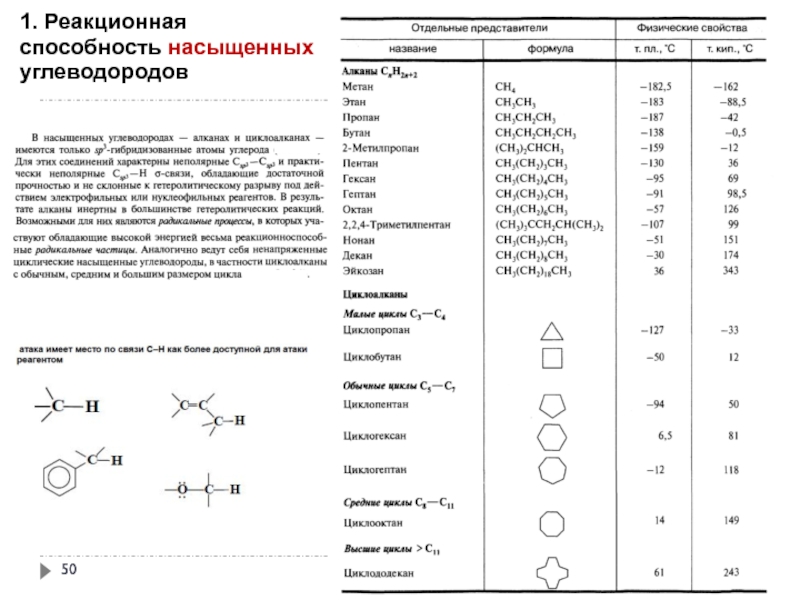
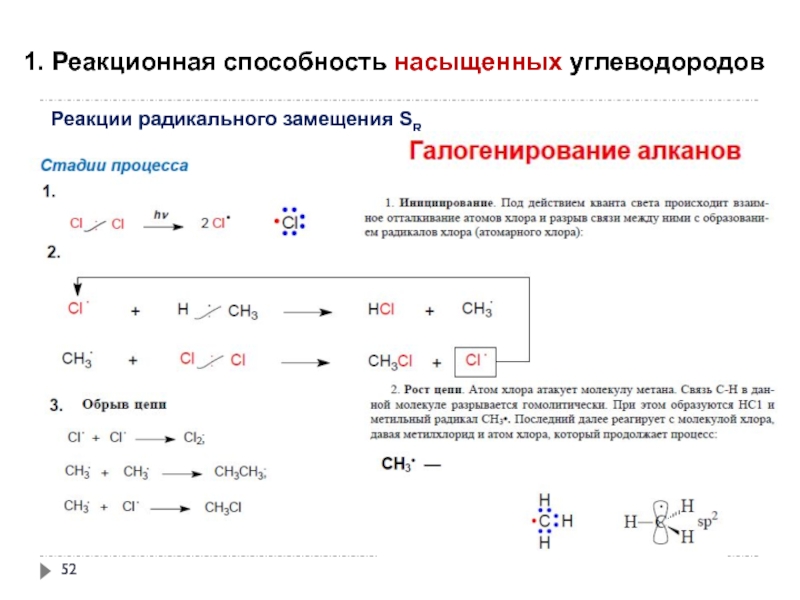
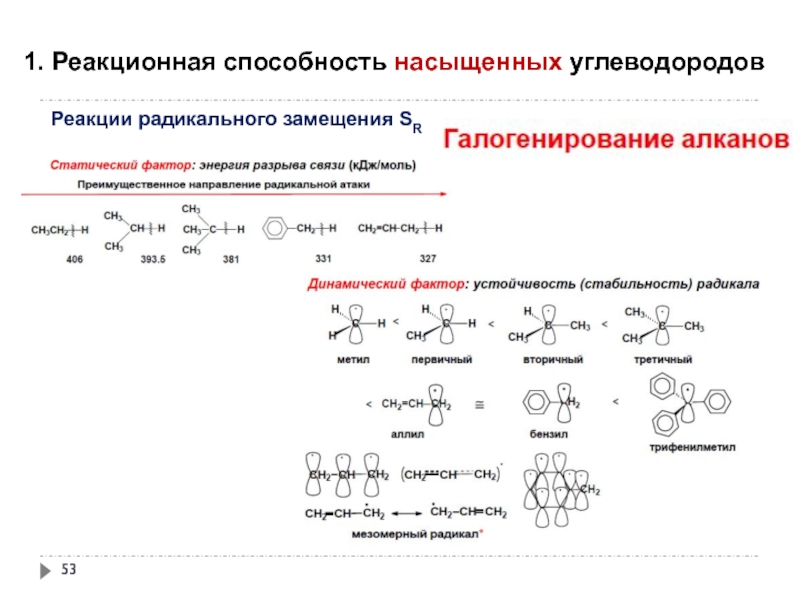
Слайд 551. Реакционная способность насыщенных углеводородов
Реакции радикального замещения SR
окисление под действием атмосферного
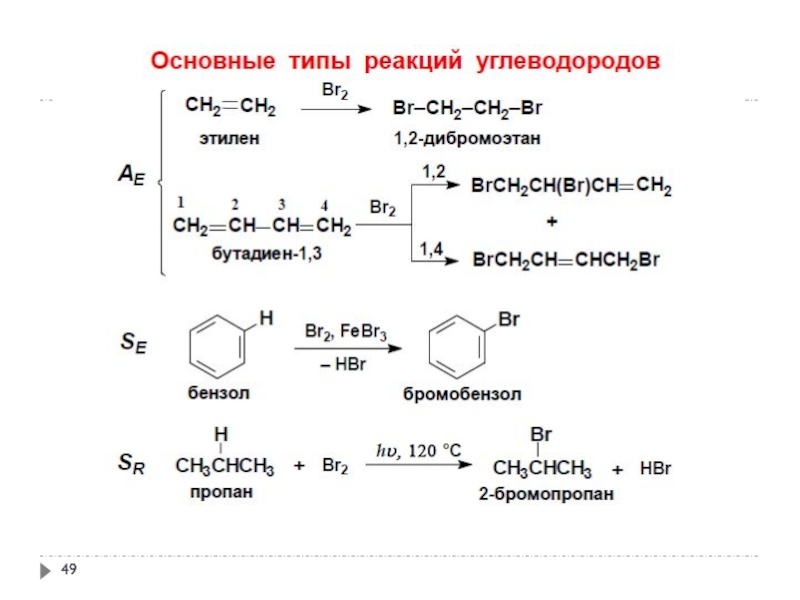
Слайд 592. Реакционная способность ненасыщенных углеводородов
Реакции электрофильного присоединения АR
Слайд 602. Реакционная способность ненасыщенных углеводородов
Реакции электрофильного присоединения АR
Слайд 612. Реакционная способность ненасыщенных углеводородов
Реакции электрофильного присоединения АR
Слайд 622. Реакционная способность ненасыщенных углеводородов
Реакции электрофильного присоединения АR
Слайд 632. Реакционная способность ненасыщенных углеводородов
Реакции электрофильного присоединения АR
Слайд 70БИОЛОГИЧЕСКИ ВАЖНЫЕ РЕАКЦИИ МОНОФУНКЦИОНАЛЬНЫХ СОЕДИНЕНИЙ.
РЕАКЦИОННАЯ СПОСОБНОСТЬ
СПИРТОВ, ФЕНОЛОВ, ТИОЛОВ, АМИНОВ
СТРУКТУРА И
Слайд 89БИОЛОГИЧЕСКИ ВАЖНЫЕ РЕАКЦИИ МОНОФУНКЦИОНАЛЬНЫХ СОЕДИНЕНИЙ.
РЕАКЦИОННАЯ СПОСОБНОСТЬ
АЛЬДЕГИДОВ, КЕТОНОВ, КАРБОНОВЫХ КИСЛОТ
СТРУКТУРА И
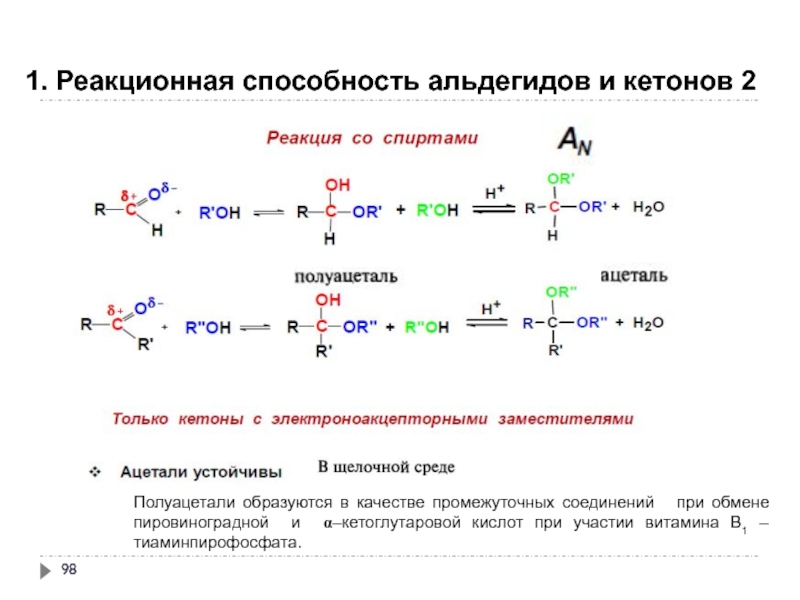
Слайд 98
1. Реакционная способность альдегидов и кетонов 2
Полуацетали образуются в качестве промежуточных
Слайд 99
1. Реакционная способность альдегидов и кетонов 3
Реакция исключительно важна для понимания
R—СН = О + Н —SR <=> R—СН – ОН
АN |
SR
тиополуацеталь
Образование тиополуацеталей in vivo необходимо в процессе реакций биологического окисления
Слайд 106
2. Реакционная способность карбоновых кислот
В гомологическом ряду кислотные свойства убывают. В
Непредельные кислоты сильнее насыщенных (акриловая и пропионовая). Ароматическая бензойная кислота сильнее алифатической уксусной .