- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь презентация
Содержание
- 1. Химическая связь
- 2. Ионная связь Возникает за счет электростатического притяжения
- 4. Запомни! Бериллий приобрел ē-оболочку благородного газа гелия,
- 5. Рассмотрим образование иона магния Mg Є III
- 6. 2 способ Если у атома много ē
- 7. Атом водорода приобрел ē-оболочку благородного газа Не.У него ē>,чем р+→заряд частицы
- 8. +7 2 5 +7 2
- 9. Встречаются атомы Na и Cl Na Є
- 10. 8 2 1 +11 8
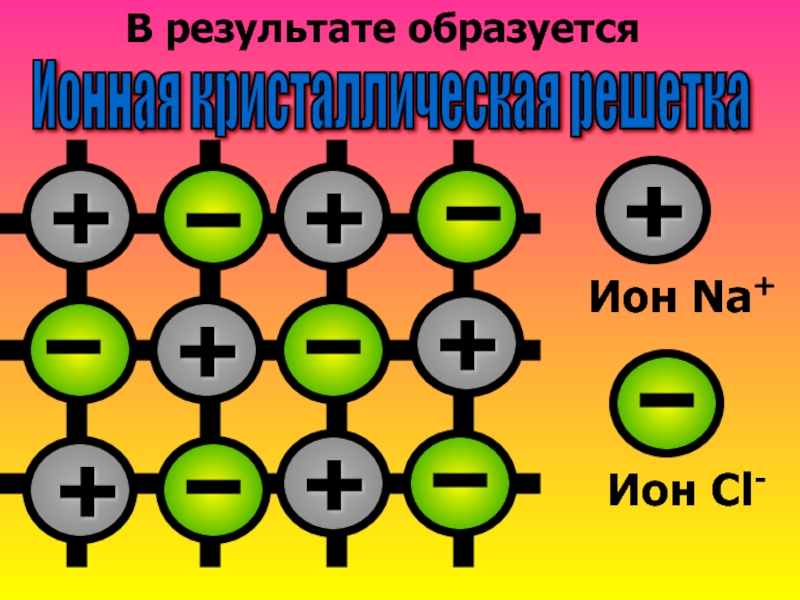
- 11. В результате образуется Ионная кристаллическая решетка
- 12. Встречаются атомы Ca и Cl Ca Є
- 13. Запомни! Ионная связь образуется по принципу «отдай-возьми
- 14. Запомни! «+» заряженный ион называется катион,
- 15. Ковалентная связь Возникает за счет образования общих
- 16. Встречаются атомы Cl Cl Є 7 группе→7ē
- 17. Запомни! Атом неметалла способен образовывать столько общих
- 18. Встречаются атомы О (О) Є 6 группе→6ē
- 19. У простых веществ атомы одинаковые→общие ē-пары Є
- 20. У сложных веществ атомы разные→общие ē-пары Є
- 21. электроотрицательность Это способность атомов притягивать к себе
- 22. Встречаются атомы Н и Сl ЭО (Сl)>ЭО(Н)
- 23. Встречаются атомы Н и О (О) Є
- 24. Запомни! Для удобства расчетов как в случае
- 25. NaCl CaCl2 Li3N K2S PCl3 NH3 P2O5
- 26. Кристаллические решетки веществ с ковалентной связью решетки
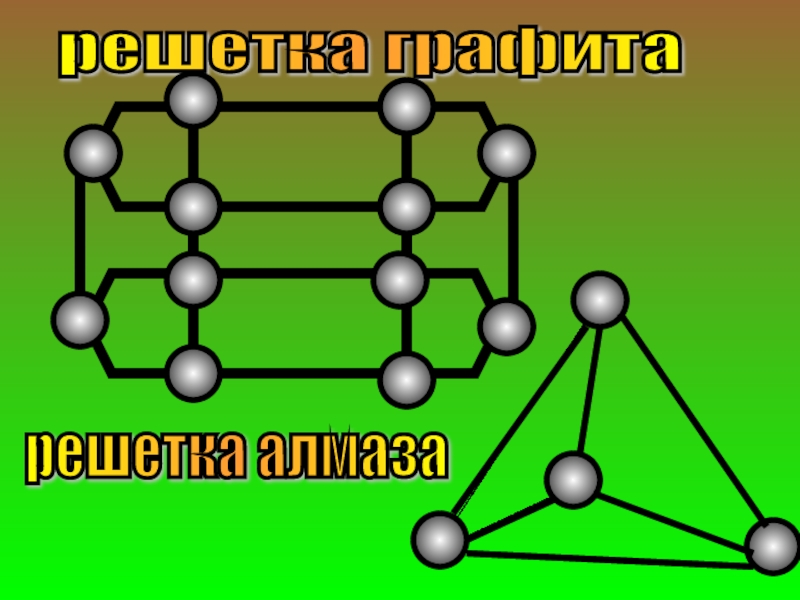
- 27. решетка графита
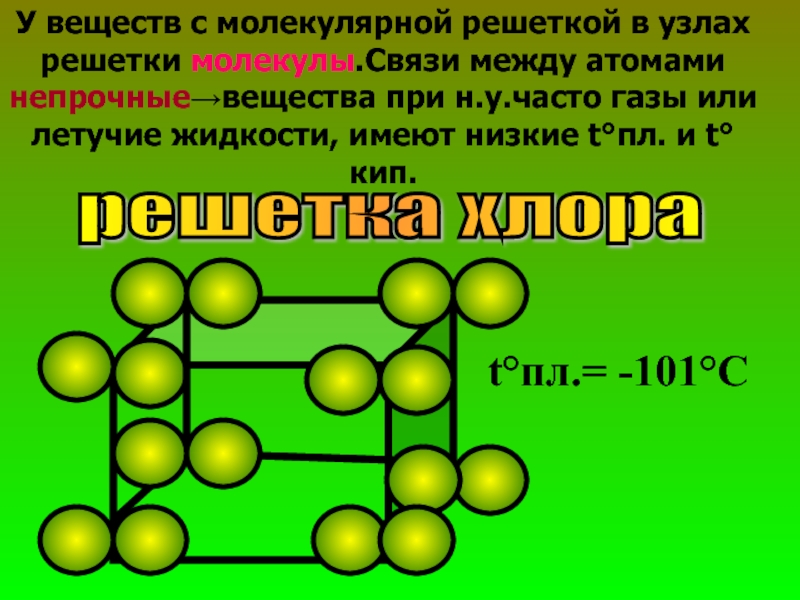
- 28. У веществ с молекулярной решеткой в узлах
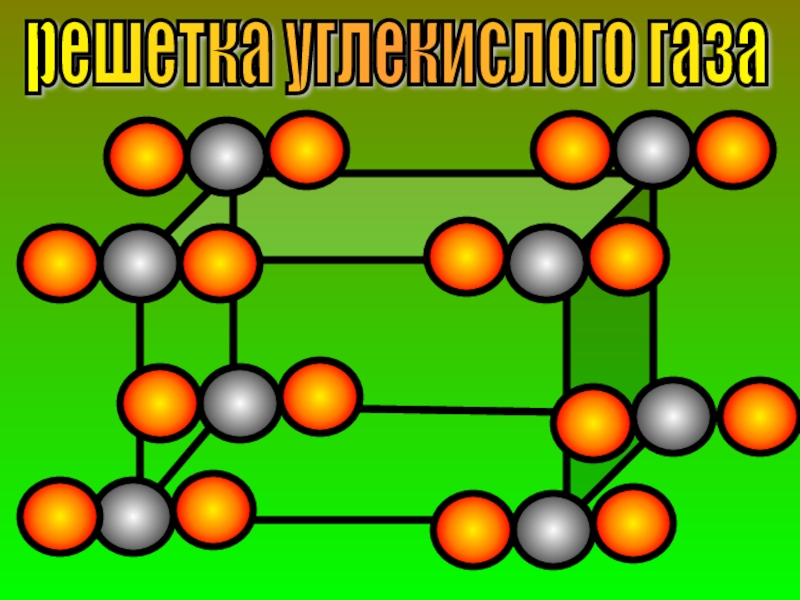
- 29. решетка углекислого газа
Слайд 1химическая связь
Химическая связь-те силы,которые способствуют созданию многоатомной системы.
При образовании разных типов
Слайд 2Ионная связь
Возникает за счет электростатического притяжения + и – ионов друг
Рассмотрим,как образуются ионы.
1 способ
Если у атома мало ē на внешнем ē-слое ,то легче их кому-то “отдать”.Это происходит у атомов металлов.
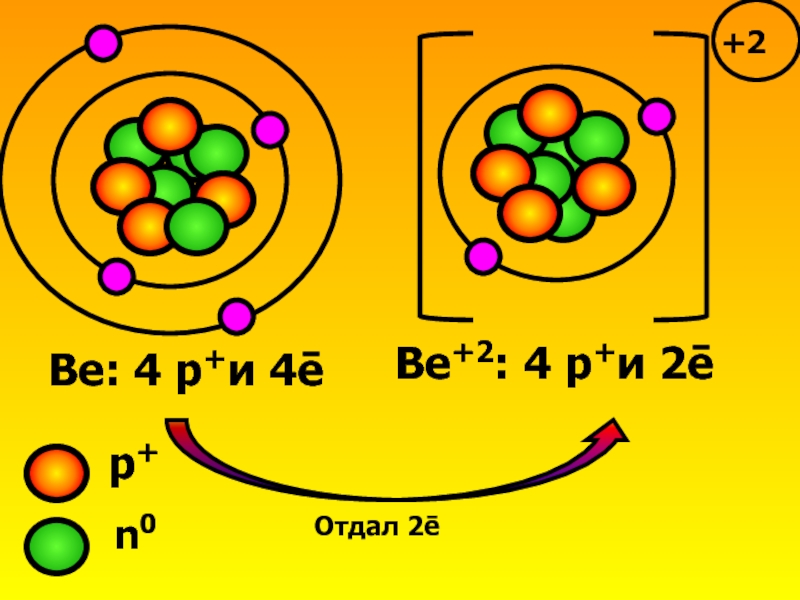
Рассмотрим образование иона бериллия.
Слайд 4Запомни!
Бериллий приобрел ē-оболочку благородного газа гелия, но сам гелием не стал!
Ве0-2ē→Ве+2
Нейтральный атом
Ион бериллия
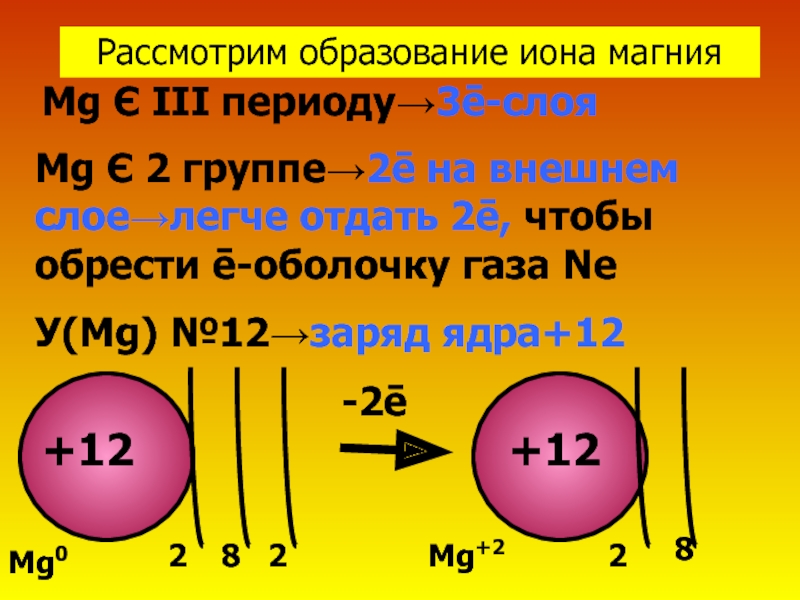
Слайд 5Рассмотрим образование иона магния
Mg Є III периоду→3ē-слоя
Mg Є 2 группе→2ē на
У(Mg) №12→заряд ядра+12
8
2
2
+12
+12
2
8
Mg0
Mg+2
-2ē
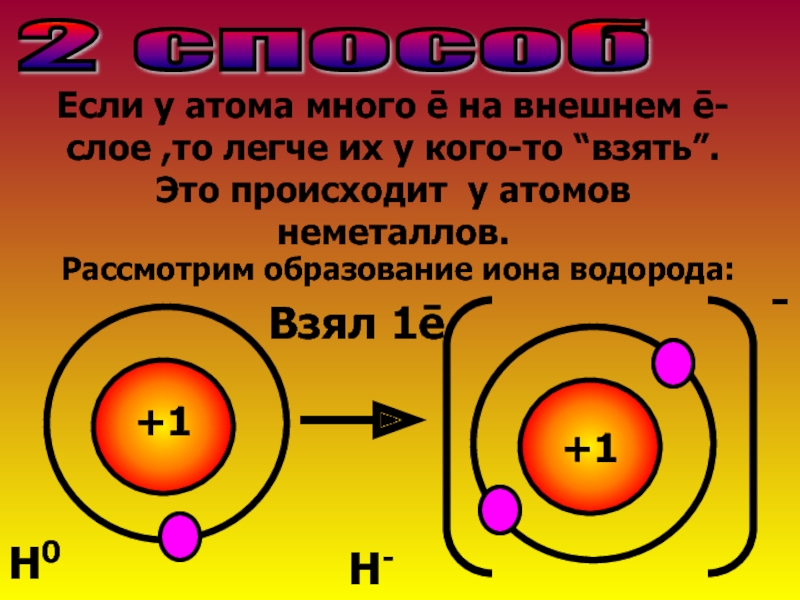
Слайд 62 способ
Если у атома много ē на внешнем ē-слое ,то легче
Рассмотрим образование иона водорода:
+1
+1
Взял 1ē
-
Н0
Н-
Слайд 7Атом водорода приобрел ē-оболочку благородного газа Не.У него ē>,чем р+→заряд частицы
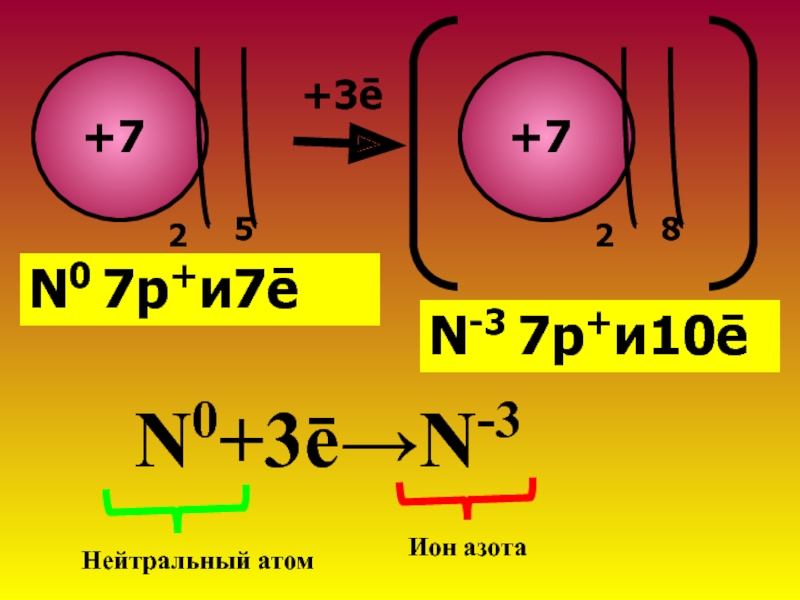
N Є II периоду→2ē-слоя
N Є 5 группе→5ē на внешнем слое→легче взять 3ē, чтобы обрести ē-оболочку газа Ne
У(N) №7→заряд ядра+7
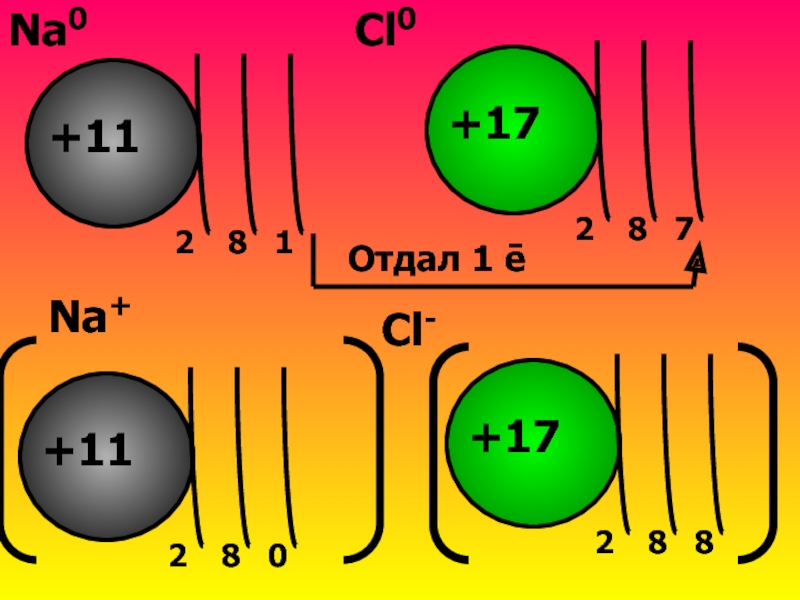
Слайд 9Встречаются атомы Na и Cl
Na Є III периоду→3ē-слоя
Na Є 1 группе→1ē
У(Na) №11→заряд ядра+11
Cl Є III периоду→3ē-слоя
Cl Є 7 группе→7ē на внешнем слое→легче взять 1ē, чтобы обрести ē-оболочку газа Ar
У(Cl) №17→заряд ядра+17
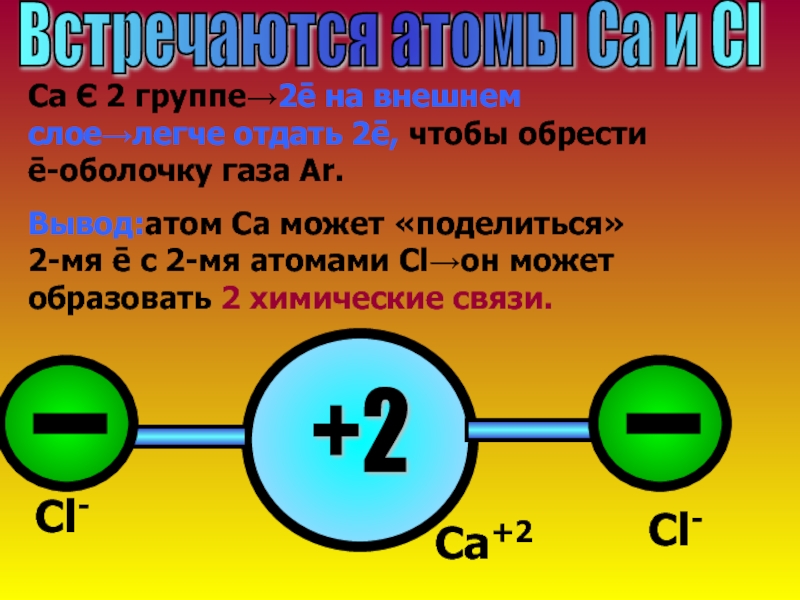
Слайд 12Встречаются атомы Ca и Cl
Ca Є 2 группе→2ē на внешнем слое→легче
Вывод:атом Са может «поделиться» 2-мя ē с 2-мя атомами Cl→он может образовать 2 химические связи.
+2
Cl-
Cl-
Cа+2
Слайд 13Запомни!
Ионная связь образуется по принципу «отдай-возьми ē»→атом может образовать столько химических
Этот тип связи образуется между атомами металлов и неметаллов
Слайд 14Запомни!
«+» заряженный ион называется катион, а «-»заряженный ион называется анион.
Для двух
Ион взвалил себе на спину.
Для Кати он несет свой плюс,
Для Ани он несет свой минус.
Слайд 15Ковалентная связь
Возникает за счет образования общих электронных пар.
Запомни!
Такой вид связи возникает
Слайд 16Встречаются атомы Cl
Cl Є 7 группе→7ē на внешнем слое→ не хватает
Cl
Cl
Cl
Cl
+
Слайд 17Запомни!
Атом неметалла способен образовывать столько общих ē-пар(→химических связей), сколько у него
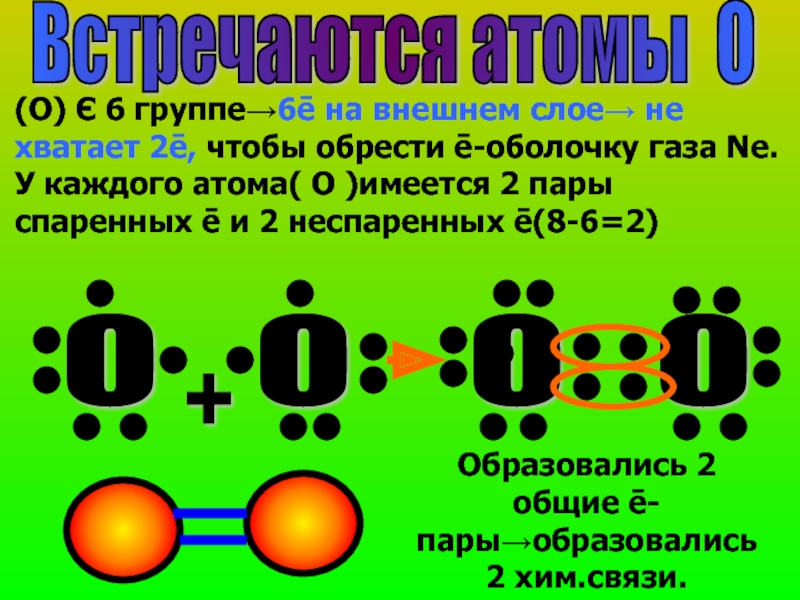
Слайд 18Встречаются атомы О
(О) Є 6 группе→6ē на внешнем слое→ не хватает
О
О
О
О
+
Образовались 2 общие ē-пары→образовались 2 хим.связи.
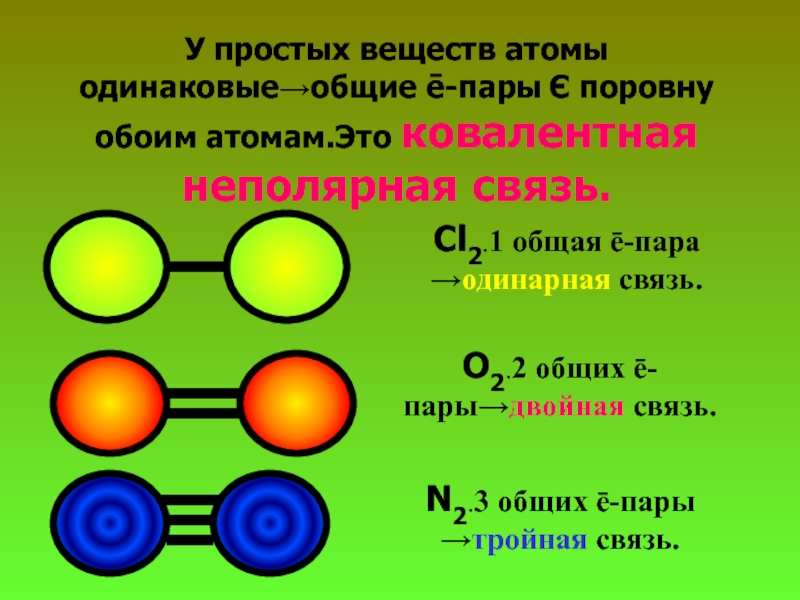
Слайд 19У простых веществ атомы одинаковые→общие ē-пары Є поровну обоим атомам.Это ковалентная
Cl2.1 общая ē-пара →одинарная связь.
О2.2 общих ē-пары→двойная связь.
N2.3 общих ē-пары →тройная связь.
Слайд 20У сложных веществ атомы разные→общие ē-пары Є непоровну обоим атомам.Это ковалентная
Запомни!
Для того, чтобы узнать, куда сместятся общие ē-пары,надо знать такое свойство атомов, как электроотрицательность.
Слайд 21электроотрицательность
Это способность атомов притягивать к себе общие ē-пары.Полинг разработал шкалу ЭО
H, As, I, Si, P, Se, C, S, Br, Cl, N, O, F.
Усиление электроотрицательности.
фтор
Самый ЭО неметалл.
Слайд 22Встречаются атомы Н и Сl
ЭО (Сl)>ЭО(Н) →общая ē-пара будет смещена к
Н→Cl
+δ
-δ
Слайд 23Встречаются атомы Н и О
(О) Є 6 группе→6ē на внешнем слое→
Атом (Н) имеет единственный ē →способен образовать 1 хим. связь.ЭО атома(О) >ЭО атомов(Н) →общие ē-пары смещены к атому(О) от атомов(Н).
Н→О←Н
δ+
δ+
σ-
Слайд 24Запомни!
Для удобства расчетов как в случае ионной, так и в случае
степень окисления
Это число ē-нов отданных(или принятых )атомами при образовании хим.связи.Ст.Ок-я простых веществ=0.
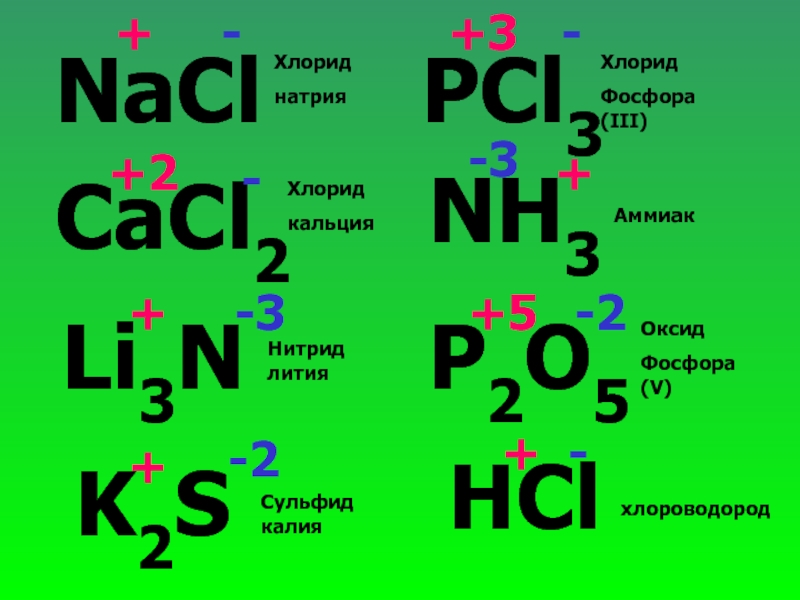
Слайд 25NaCl
CaCl2
Li3N
K2S
PCl3
NH3
P2O5
HCl
+
+
+2
+
+
+
+3
+5
-
-
-3
-2
-
-3
-2
-
Хлорид
натрия
Хлорид
кальция
Хлорид
Фосфора(III)
Нитрид лития
Сульфид калия
Аммиак
Оксид
Фосфора(V)
хлороводород
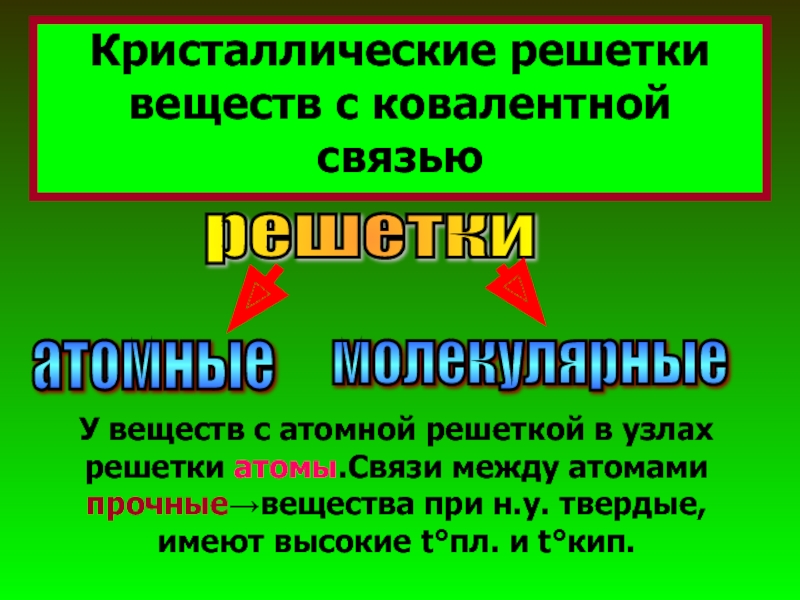
Слайд 26Кристаллические решетки веществ с ковалентной связью
решетки
атомные
молекулярные
У веществ с атомной решеткой в
Слайд 28У веществ с молекулярной решеткой в узлах решетки молекулы.Связи между атомами
решетка хлора
t°пл.= -101°С