- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая кинетика. (Лекция 11) презентация
Содержание
- 1. Химическая кинетика. (Лекция 11)
- 2. Основные понятия и определения Химическая кинетика –
- 3. Основные понятия и определения Механизм р-ции – Лимитирующая стадия –
- 4. Основные понятия и определения Химические реакции (по
- 5. Основные понятия и определения Молекулярность –
- 6. Основные понятия и определения Сложные реакции Последовательные Параллельные Сопряженные
- 7. Основные понятия и определения Цепные реакции (Н.Н.
- 8. Основные понятия и определения Элементарный акт хим.
- 9. Скорость химической реакции Скорость изменения конц-ий реагентов
- 10. Факторы, влияющие на скорость химической реакции Скорость
- 11. Зависимость СХР от концентрации реагентов 1867 г.
- 12. Зависимость СХР от концентрации aA + bB
- 13. Константа скорости химической реакции k - константа
- 14. Зависимость скорости от температуры 1884 г. Вант-Гофф
- 15. Теория активных столкновений Для протекания р-ции необходимо:
- 16. Энергия активации Еа – это избыточная Е,
- 17. Энергия активации Уравнение Аррениуса (1889 г.)
- 18. Расчет энергии активации Ea для многих
- 19. Катализ Катализ – это явление измения СХР
- 20. Катализ Гомогенный катализ – катал-тор и реагенты
Слайд 2Основные понятия и определения
Химическая кинетика – это раздел химии, изучающий скорости
Химические реакции
гомогенные
гетерогенные
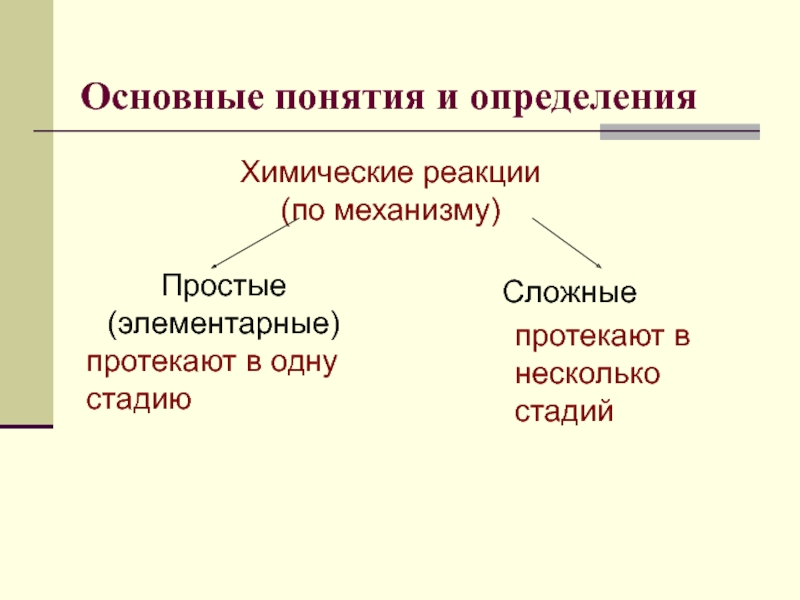
Слайд 4Основные понятия и определения
Химические реакции
(по механизму)
Простые (элементарные)
Сложные
протекают в одну стадию
протекают в
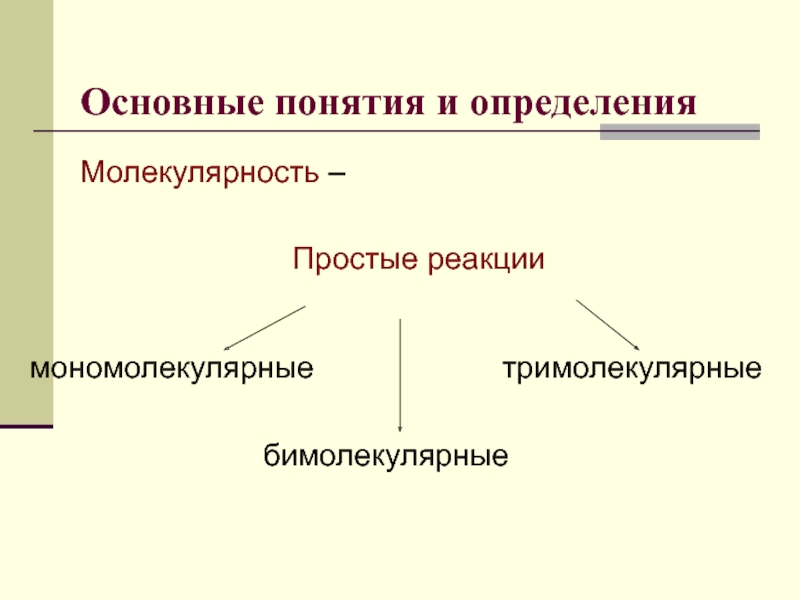
Слайд 5Основные понятия и определения
Молекулярность –
Простые реакции
мономолекулярные
бимолекулярные
тримолекулярные
Слайд 7Основные понятия и определения
Цепные реакции
(Н.Н. Семенов)
1 стадия: зарождение цепи
2 стадия:
3 стадия: обрыв цепи
Слайд 8Основные понятия и определения
Элементарный акт хим. р-ции –
СХР –
СХР – изменение
υ = ±
ΔС
Δt
Слайд 9Скорость химической реакции
Скорость изменения конц-ий реагентов и продуктов р-ции связаны:
аА +
-
1
a
dCa
dt
=
-
1
b
dCb
dt
= …
=
dCc
dt
=
dCd
dt
= …
1
c
d
1
расходуются
накапливаюются
Слайд 10Факторы, влияющие на скорость химической реакции
Скорость хим. р-ции зависит от:
природы реагирующих
конц. реаг. в-в
T
агрегатного сост. реагентов
удельной поверхности (для гетерогенных р-ций)
катализатора
…
Слайд 11Зависимость СХР от концентрации
реагентов
1867 г. Гульдберг и Вааге
Закон действующих масс
СХР прямо
Слайд 12Зависимость СХР от концентрации
aA + bB = cC + dD
Применим к
для простой р-ции:
для сложной р-ции:
Слайд 13Константа скорости химической реакции
k - константа скорости хим. р-ции
Физический смысл k
то
k не зависит от конц-ий реагентов, но зависит от T, природы реагентов, катализатора
υ = k∙CA ∙ CB
a
β
Слайд 14Зависимость скорости от температуры
1884 г. Вант-Гофф
Эмпирическое правило:
Повышение температуры на 10о увеличиваетет
γ - температурный коэфф-нт скорости
Слайд 15Теория активных столкновений
Для протекания р-ции необходимо:
столкновение молекул
наличие у молекул достаточной
благоприятная ориентация молекул
Слайд 16Энергия активации
Еа – это избыточная Е, кот. должны обладать молекулы, чтобы
Слайд 18Расчет энергии активации
Ea для многих р-ций изм-ся в пределах от
Если Ea < 60 кДж/моль, то р-ции идут очень быстро.
Если Ea > 105 кДж/моль, то р-ции практически не протекают при tкомн..
Слайд 19Катализ
Катализ – это явление измения СХР при участии катализатора.
Катализаторы – в-ва,
Слайд 20Катализ
Гомогенный катализ – катал-тор и реагенты находятся в одной фазе.
Гетерогенный
Ферментативный катализ – катал-ром явялются сложные белковые образования