- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гидролиз органических и неорганических веществ презентация
Содержание
- 1. Гидролиз органических и неорганических веществ
- 2. Гидролиз Гидролиз – это один из видов
- 3. Классификация гидролиза
- 4. Гидролиз органических веществ В ходе гидролиза при
- 5. 5. Гидролиз галогеналканов: R-Cl + H2O
- 6. Гидролиз неорганических веществ Гидролиз солей – разновидность
- 8. Соли образованные сильным основанием и слабой кислотой:
- 9. Соли образованные слабым основанием и сильной кислотой:
- 10. Соли образованные слабым основанием и слабой кислотой:
- 11. Соли образованные сильным основанием и сильной кислотой:
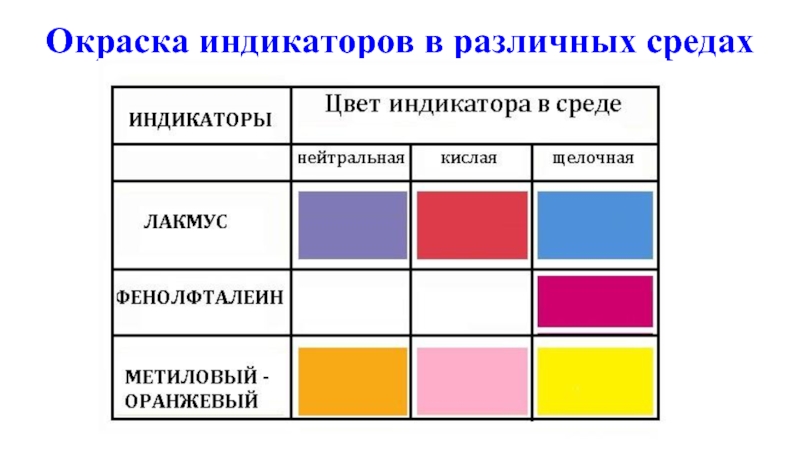
- 12. Окраска индикаторов в различных средах
Слайд 2Гидролиз
Гидролиз – это один из видов химических реакций, где при взаимодействии
веществ с водой происходит разложение исходного вещества с образованием новых соединений.
Слайд 4Гидролиз органических веществ
В ходе гидролиза при участии пищеварительных ферментов:
БЕЛКИ расщепляются на
АМИНОКИСЛОТЫ.
ЖИРЫ — на ГЛИЦЕРИН и ЖИРНЫЕ КИСЛОТЫ.
ПОЛИСАХАРИДЫ ( например, крахмал и целлюлоза) — на МОНОСАХАРИДЫ (например, на ГЛЮКОЗУ ).
НУКЛЕИНОВЫЕ КИСЛОТЫ — на свободные НУКЛЕОТИДЫ.
ЖИРЫ — на ГЛИЦЕРИН и ЖИРНЫЕ КИСЛОТЫ.
ПОЛИСАХАРИДЫ ( например, крахмал и целлюлоза) — на МОНОСАХАРИДЫ (например, на ГЛЮКОЗУ ).
НУКЛЕИНОВЫЕ КИСЛОТЫ — на свободные НУКЛЕОТИДЫ.
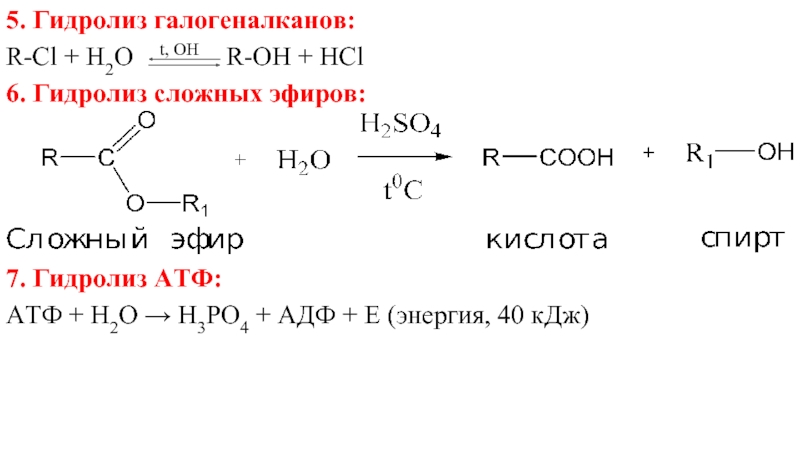
Слайд 55. Гидролиз галогеналканов:
R-Cl + H2O t, OH R-OH +
HCl
6. Гидролиз сложных эфиров:
7. Гидролиз АТФ:
АТФ + H2O → H3PO4 + АДФ + Е (энергия, 40 кДж)
6. Гидролиз сложных эфиров:
7. Гидролиз АТФ:
АТФ + H2O → H3PO4 + АДФ + Е (энергия, 40 кДж)
Слайд 6Гидролиз неорганических веществ
Гидролиз солей – разновидность реакций гидролиза, обусловленного протеканием реакций
ионного обмена в растворах (водных) растворимых солей-электролитов.
Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или молекулярном виде («связывание ионов»).
Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или молекулярном виде («связывание ионов»).
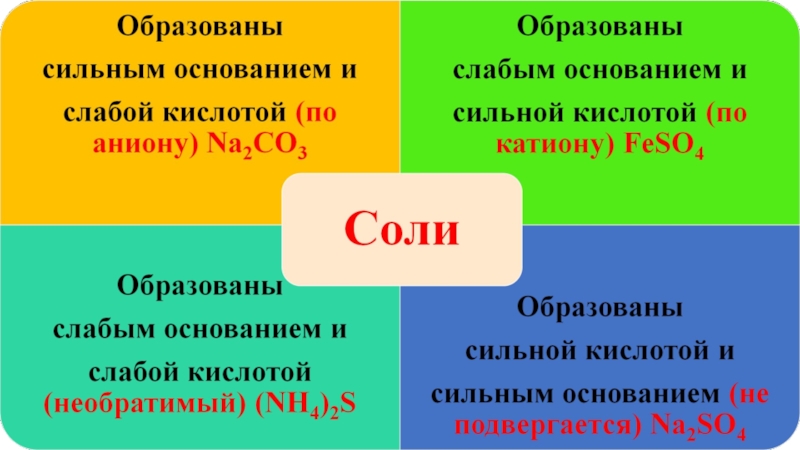
Слайд 8Соли образованные сильным основанием и слабой кислотой:
1. Ацетат калия:
CH3COOK + H2O
↔ CH3COOH + KOH
CH3COO- + K+ + H2O ↔ CH3COOH + K+ + OH-
CH3COO- + H2O ↔ CH3COOH + OH-
2. Карбонат натрия:
1 ступень: K2CO3 + H2O ↔ 2KHCO3 + KOH
2K+ + CO32- + H2O ↔ K+ + HCO3- + K+ + OH-
CO32- + H2O ↔ HCO3- + OH-
2 ступень: KHCO3 + H2O ↔ H2CO3 + KOH
K+ + HCO3- + H2O ↔ H2CO3 + K+ + OH-
HCO3- + H2O ↔ OH- + H2CO3 (H2O + CO2)
CH3COO- + K+ + H2O ↔ CH3COOH + K+ + OH-
CH3COO- + H2O ↔ CH3COOH + OH-
2. Карбонат натрия:
1 ступень: K2CO3 + H2O ↔ 2KHCO3 + KOH
2K+ + CO32- + H2O ↔ K+ + HCO3- + K+ + OH-
CO32- + H2O ↔ HCO3- + OH-
2 ступень: KHCO3 + H2O ↔ H2CO3 + KOH
K+ + HCO3- + H2O ↔ H2CO3 + K+ + OH-
HCO3- + H2O ↔ OH- + H2CO3 (H2O + CO2)
Слайд 9Соли образованные слабым основанием и сильной кислотой:
1. Хлорид аммония:
NH4Cl + H2O
↔ NH3 ∙ H2O + HCl
NH4+ + Cl- + H2O ↔ NH3 ∙ H2O + H+ + Cl-
NH4+ + H2O ↔ NH3 ∙ H2O + H+
2. Сульфат меди (II):
1 ступень: 2CuSO4 + 2H2O ↔ (CuOH)2SO4 + H2SO4
2Cu2+ + 2SO42- + H2O ↔ 2(CuOH)+ + 2SO42- + 2H+
Cu2+ + H2O ↔ (CuOH)+ + H+
2 ступень: (CuOH)2SO4 + 2H2O ↔ Cu(OH)2 + H2SO4
2(CuOH)+ + SO42- + 2H2O ↔ 2Cu(OH)2 + 2H+ + SO42-
(CuOH)+ + H2O ↔ Cu(OH)2 + H+
NH4+ + Cl- + H2O ↔ NH3 ∙ H2O + H+ + Cl-
NH4+ + H2O ↔ NH3 ∙ H2O + H+
2. Сульфат меди (II):
1 ступень: 2CuSO4 + 2H2O ↔ (CuOH)2SO4 + H2SO4
2Cu2+ + 2SO42- + H2O ↔ 2(CuOH)+ + 2SO42- + 2H+
Cu2+ + H2O ↔ (CuOH)+ + H+
2 ступень: (CuOH)2SO4 + 2H2O ↔ Cu(OH)2 + H2SO4
2(CuOH)+ + SO42- + 2H2O ↔ 2Cu(OH)2 + 2H+ + SO42-
(CuOH)+ + H2O ↔ Cu(OH)2 + H+
Слайд 10Соли образованные слабым основанием и слабой кислотой:
Ацетат аммония:
CH3COONH4 + H2O ↔
CH3COOH + NH3 ∙ H2O
CH3COO- + NH4+ + H2O ↔ CH3COOH + NH3 ∙ H2O
2. Ацетат алюминия:
Al(CH3COO)3 + H2O ↔ AlOH(CH3COO)2 + CH3COOH
Al3+ + 3CH3COO- + H2O ↔ AlOH2+ + 2CH3COO- + CH3COOH
Al3+ + CH3COO- + H2O ↔ AlOH2+ + CH3COOH
CH3COO- + NH4+ + H2O ↔ CH3COOH + NH3 ∙ H2O
2. Ацетат алюминия:
Al(CH3COO)3 + H2O ↔ AlOH(CH3COO)2 + CH3COOH
Al3+ + 3CH3COO- + H2O ↔ AlOH2+ + 2CH3COO- + CH3COOH
Al3+ + CH3COO- + H2O ↔ AlOH2+ + CH3COOH
Слайд 11Соли образованные сильным основанием и сильной кислотой:
Гидролизу не подвергаются (NaCl, K2SO4,
LiBr и так далее)