- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гетероциклические соединения презентация
Содержание
- 1. Гетероциклические соединения
- 2. Классификация и номенклатура Циклы классифицируют: 1.
- 3. 2. По характеру гетероатома В
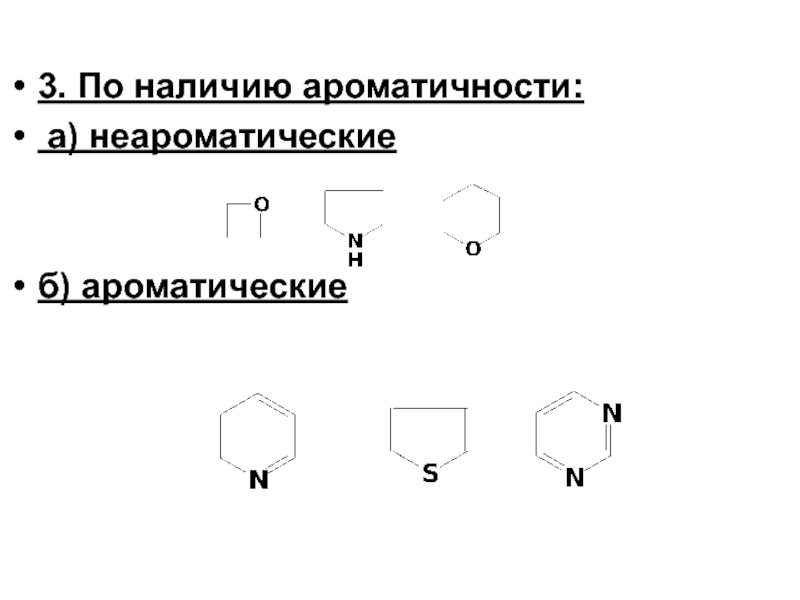
- 4. 3. По наличию ароматичности: а) неароматические б) ароматические
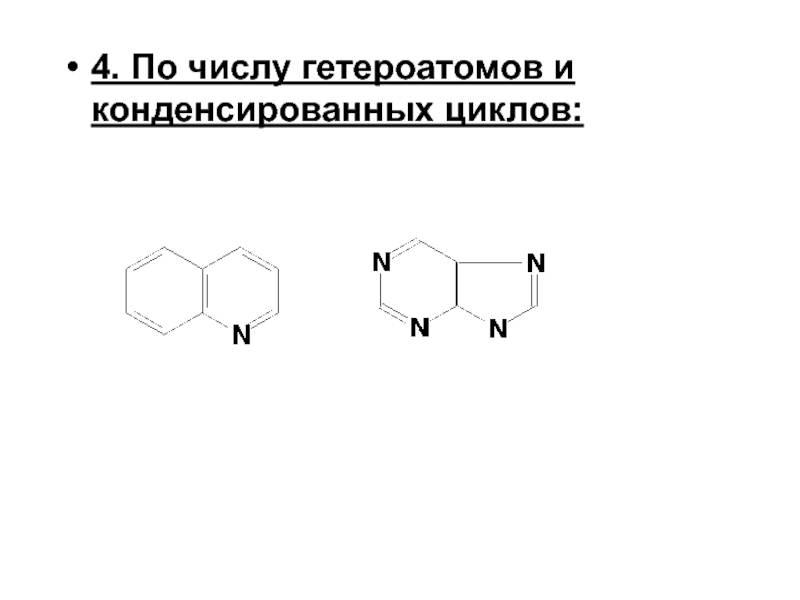
- 5. 4. По числу гетероатомов и конденсированных циклов:
- 6. Номенклатура Размер цикла обозначается соответствующим корнем и
- 7. Когда в цикле присутствуют разные гетероатомы, они
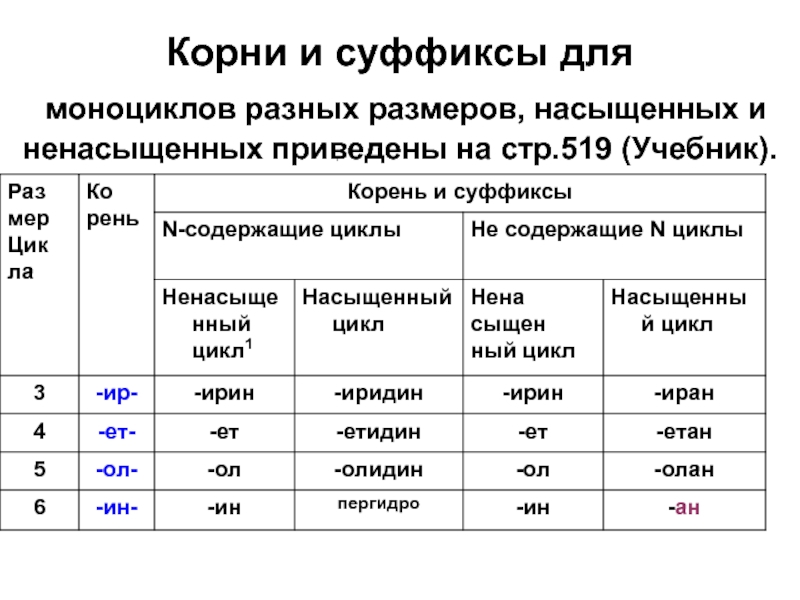
- 8. Корни и суффиксы для моноциклов разных размеров, насыщенных и ненасыщенных приведены на стр.519 (Учебник).
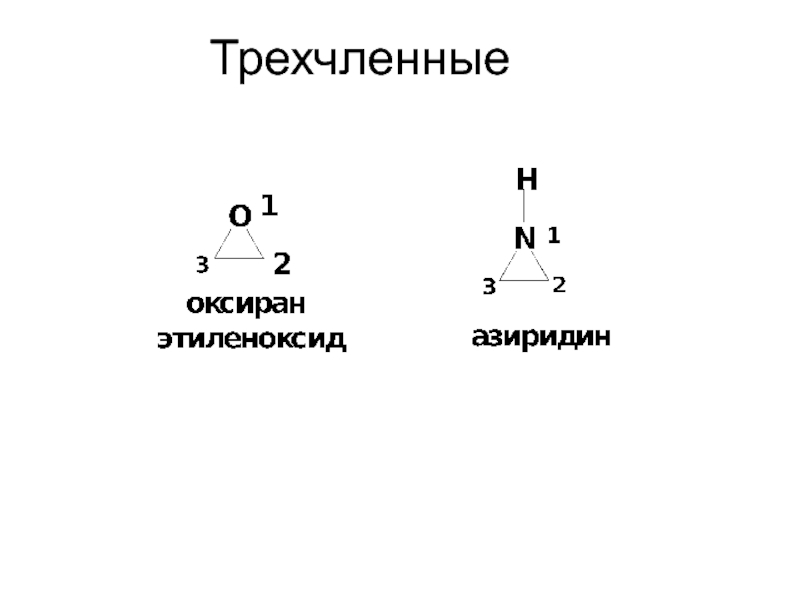
- 9. Трехчленные
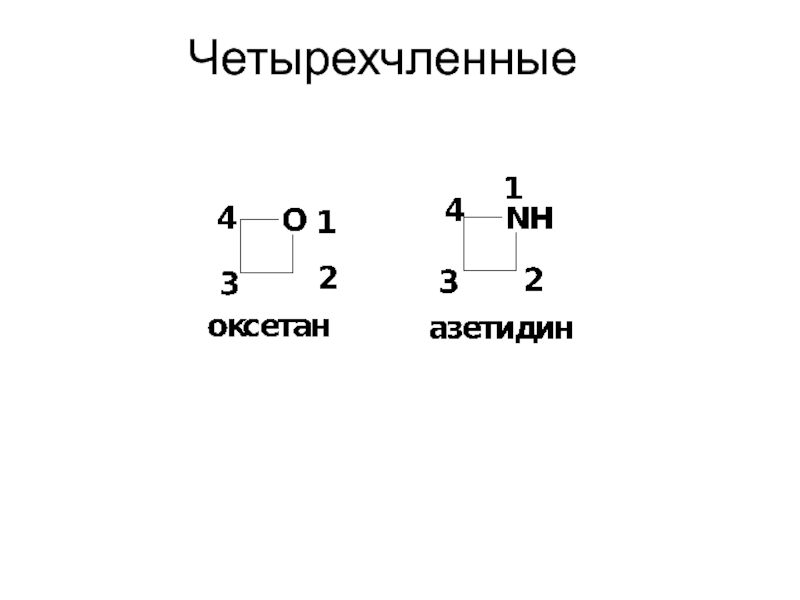
- 10. Четырехчленные
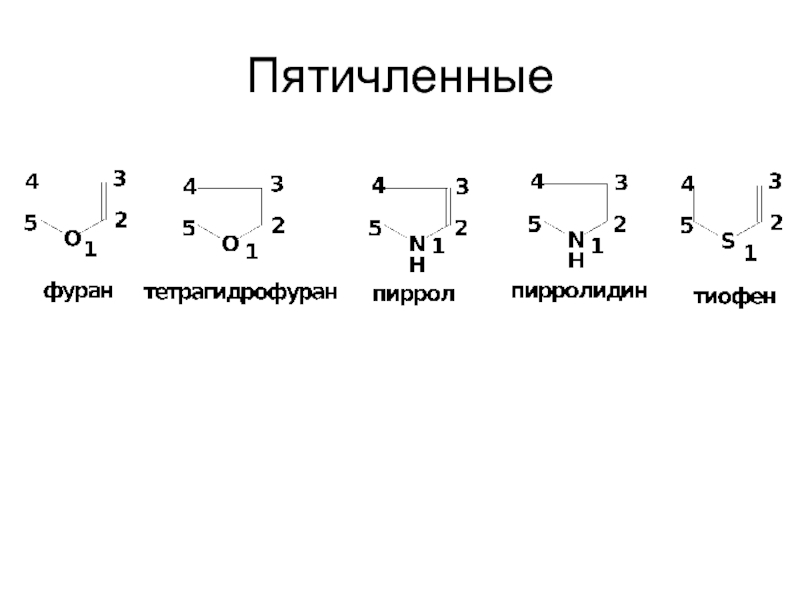
- 11. Пятичленные
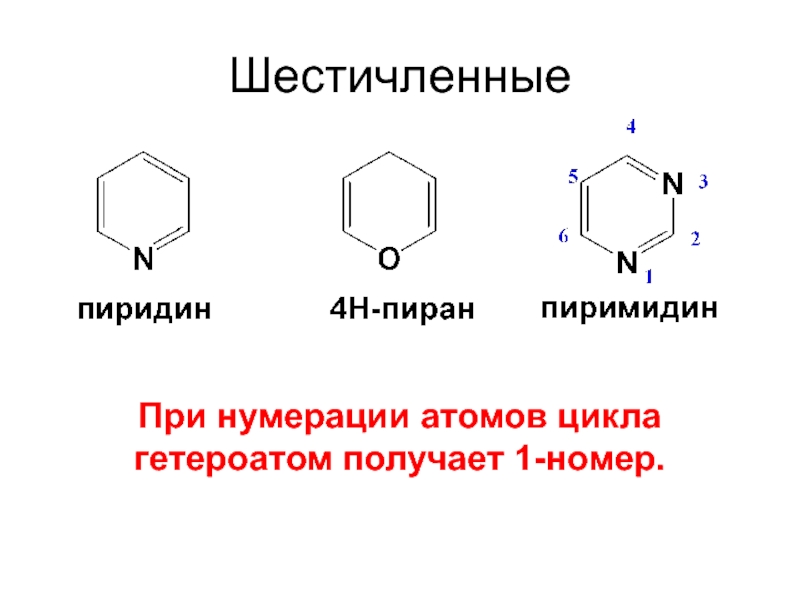
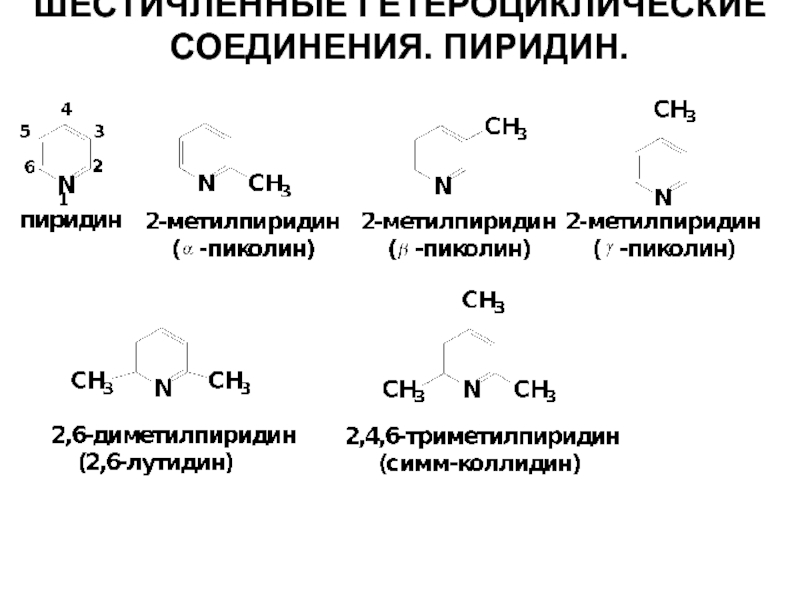
- 12. Шестичленные При нумерации атомов цикла гетероатом получает 1-номер.
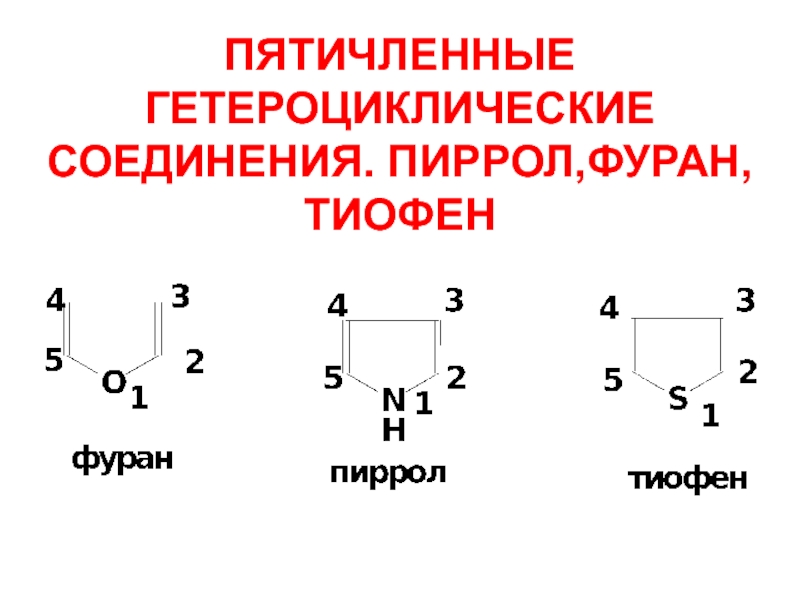
- 13. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. ПИРРОЛ,ФУРАН,ТИОФЕН
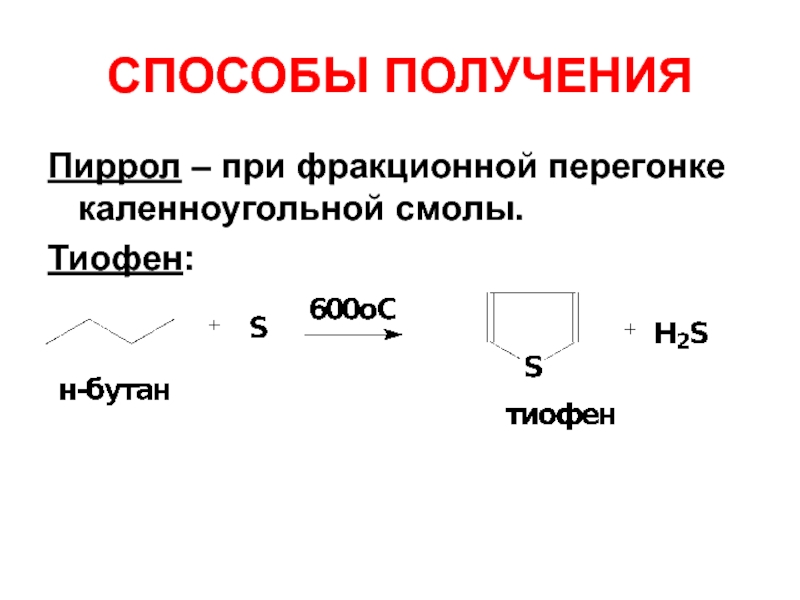
- 14. СПОСОБЫ ПОЛУЧЕНИЯ Пиррол – при фракционной перегонке каленноугольной смолы. Тиофен:
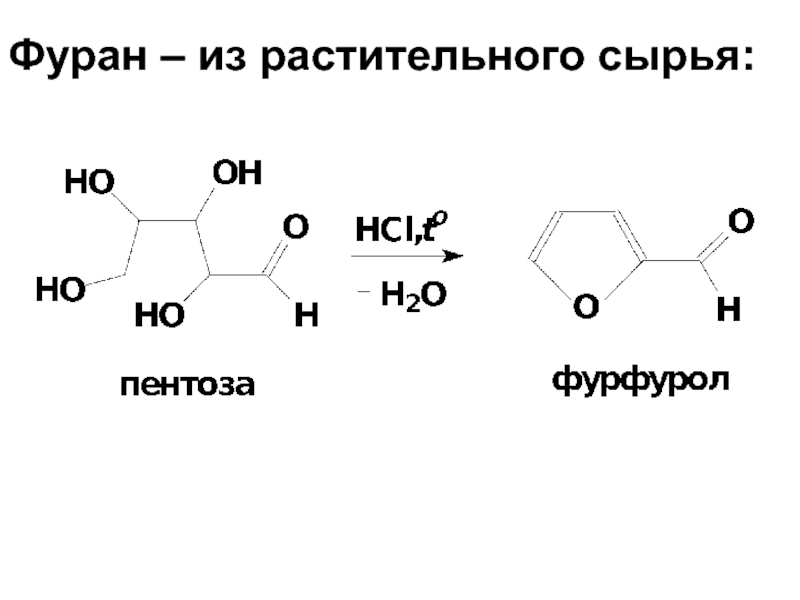
- 15. Фуран – из растительного сырья:
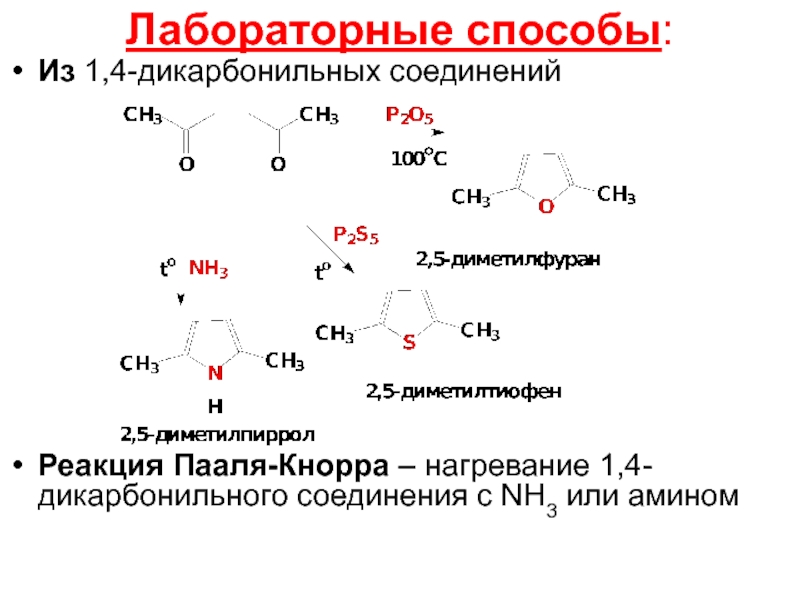
- 16. Лабораторные способы: Из 1,4-дикарбонильных соединений
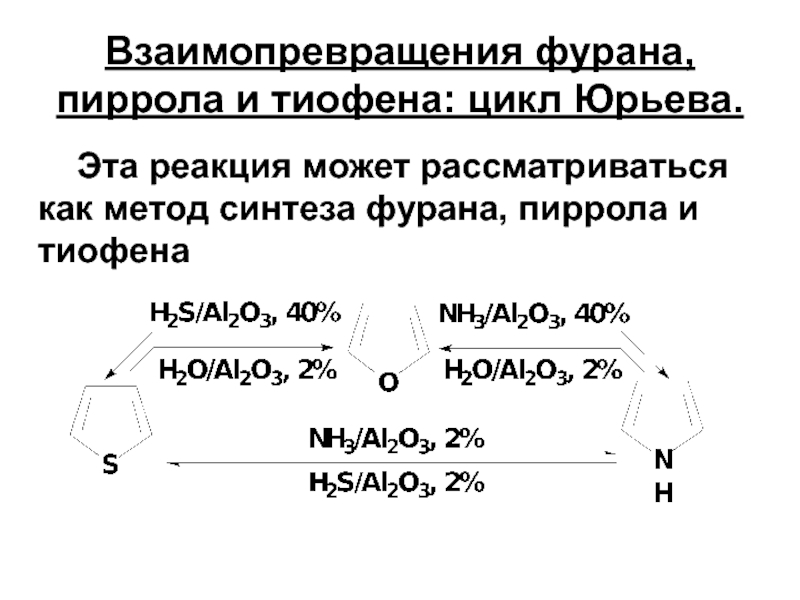
- 17. Взаимопревращения фурана, пиррола и тиофена: цикл Юрьева.
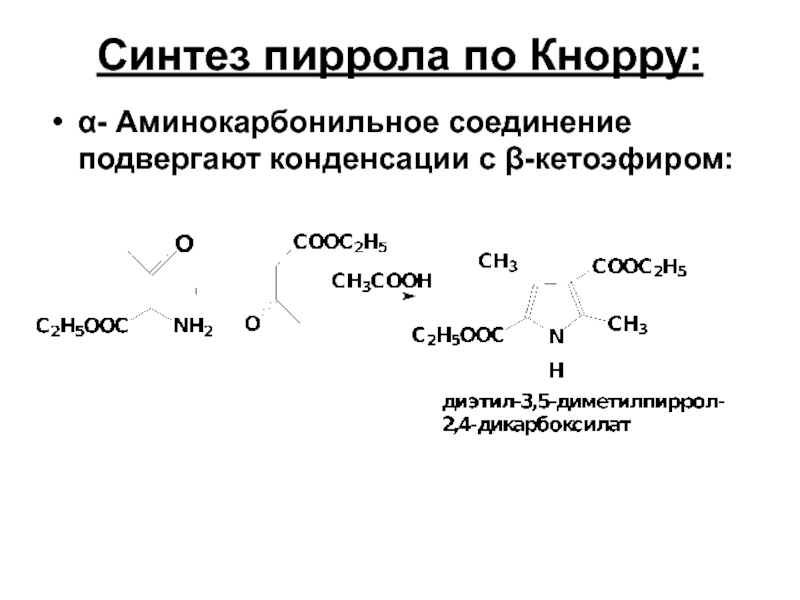
- 18. Синтез пиррола по Кнорру: α- Aминокарбонильное соединение подвергают конденсации с β-кетоэфиром:
- 19. ФИЗИЧЕСКИЕ СВОЙСТВА И СТРОЕНИЕ Молекулы всех
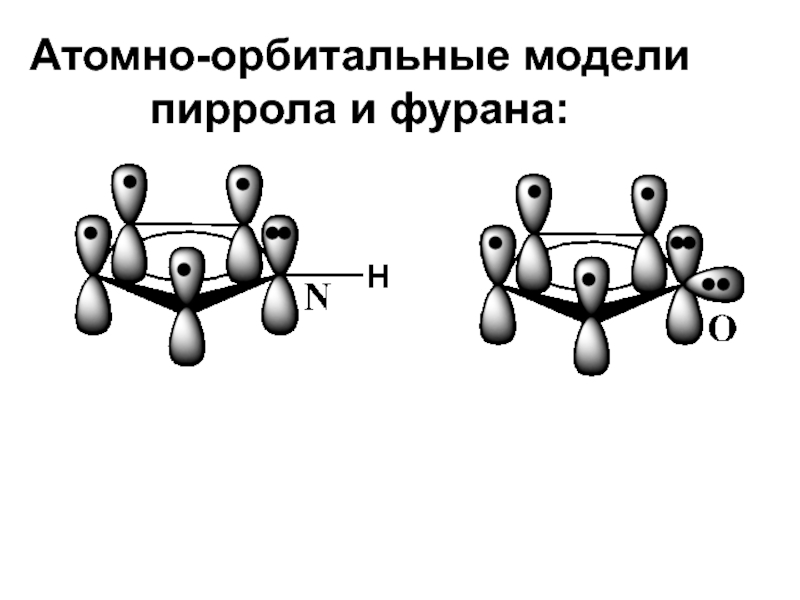
- 20. Атомно-орбитальные модели пиррола и фурана:
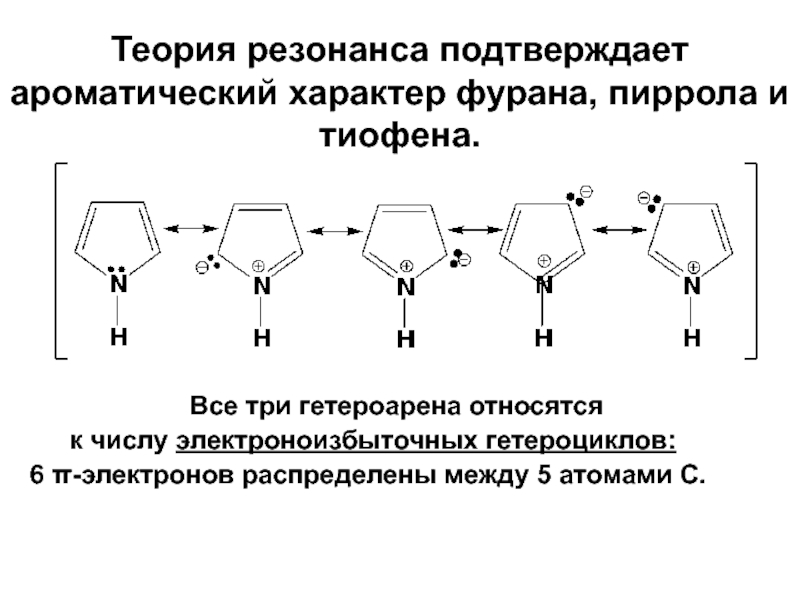
- 21. Теория резонанса подтверждает ароматический характер фурана, пиррола
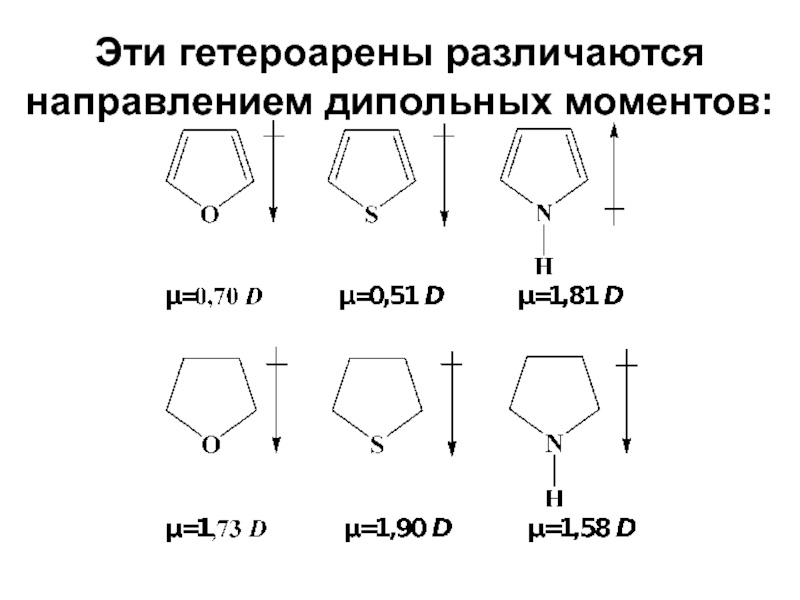
- 22. Эти гетероарены различаются направлением дипольных моментов:
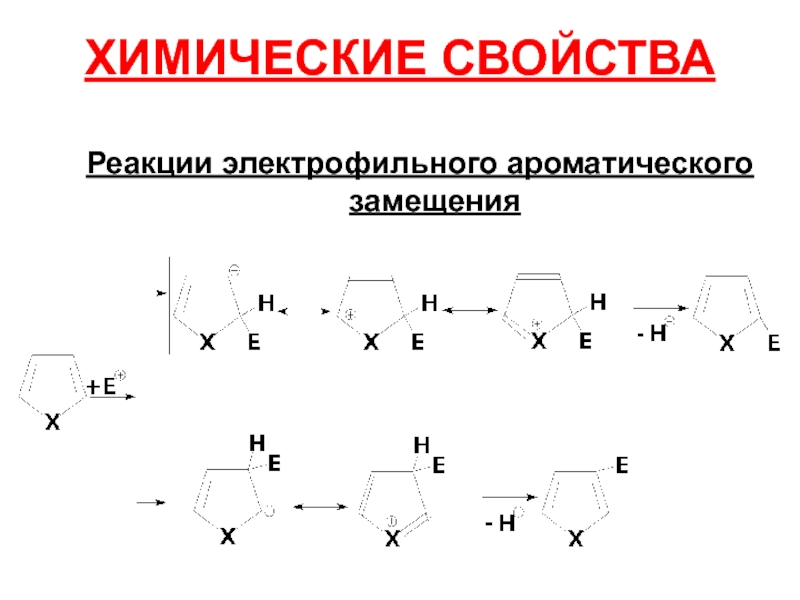
- 23. ХИМИЧЕСКИЕ СВОЙСТВА Реакции электрофильного ароматического замещения
- 24. Относительная активность гетероаренов в SE реакциях:
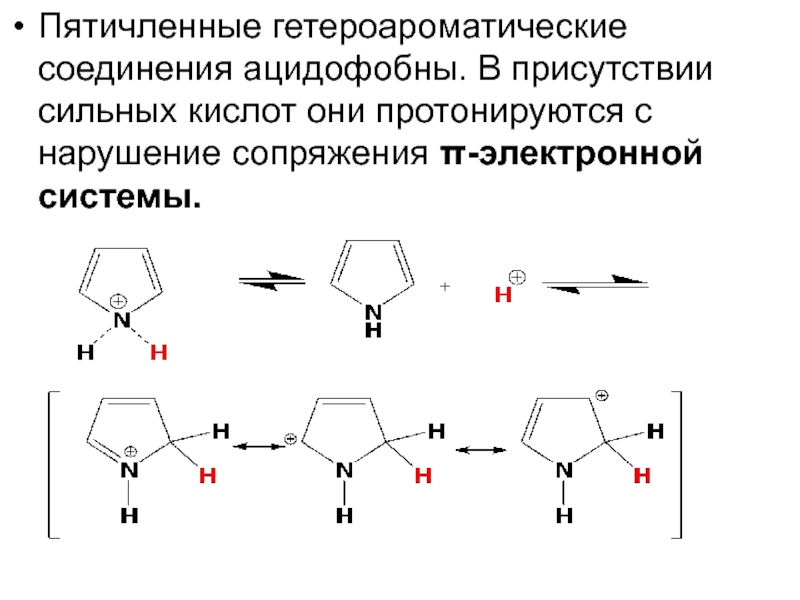
- 25. Пятичленные гетероароматические соединения ацидофобны. В присутствии сильных
- 26. Поскольку протонированию подвергается сопряженная π-система пиррола, основность
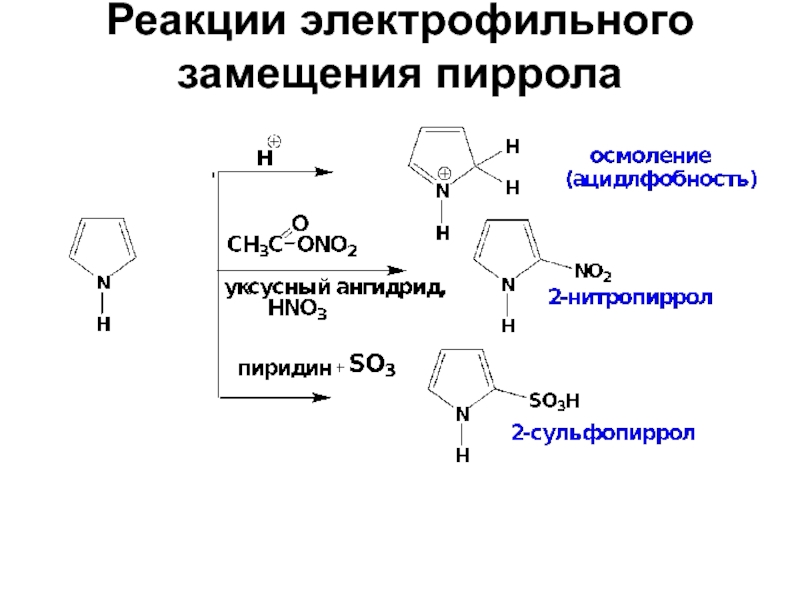
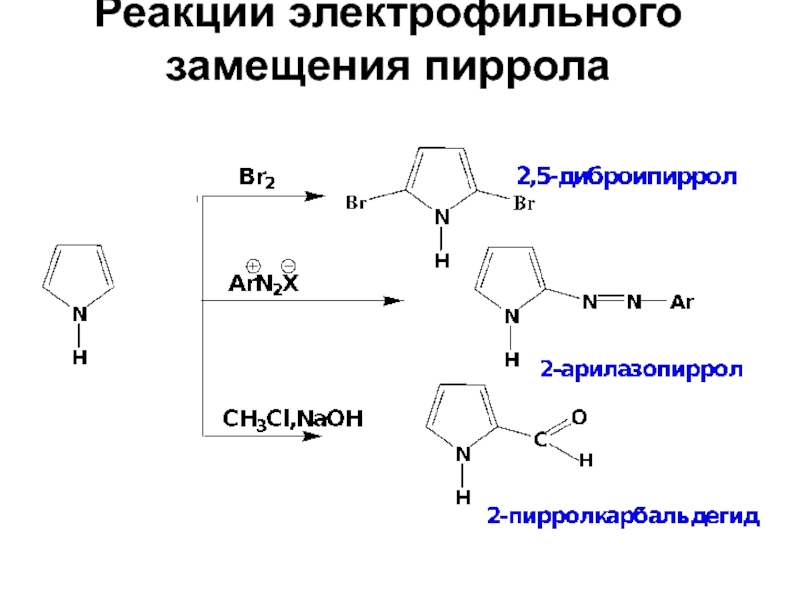
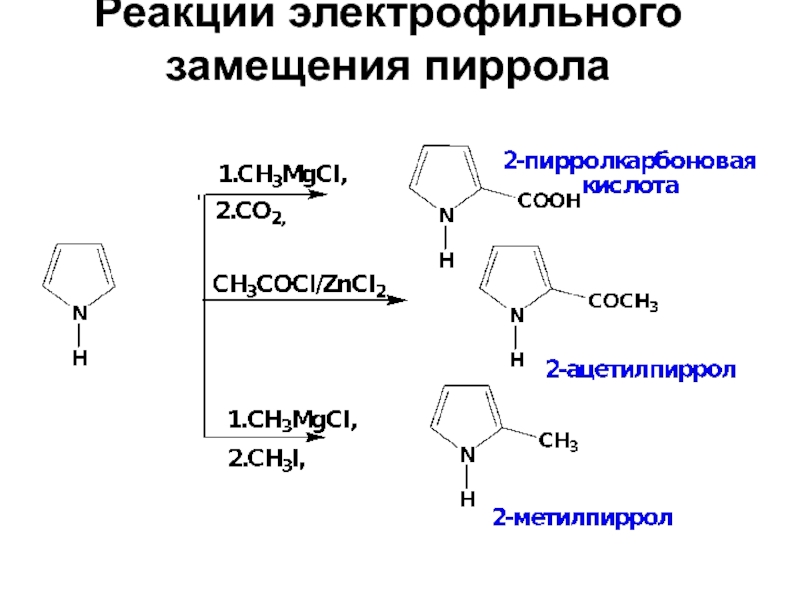
- 27. Реакции электрофильного замещения пиррола
- 28. Реакции электрофильного замещения пиррола
- 29. Реакции электрофильного замещения пиррола
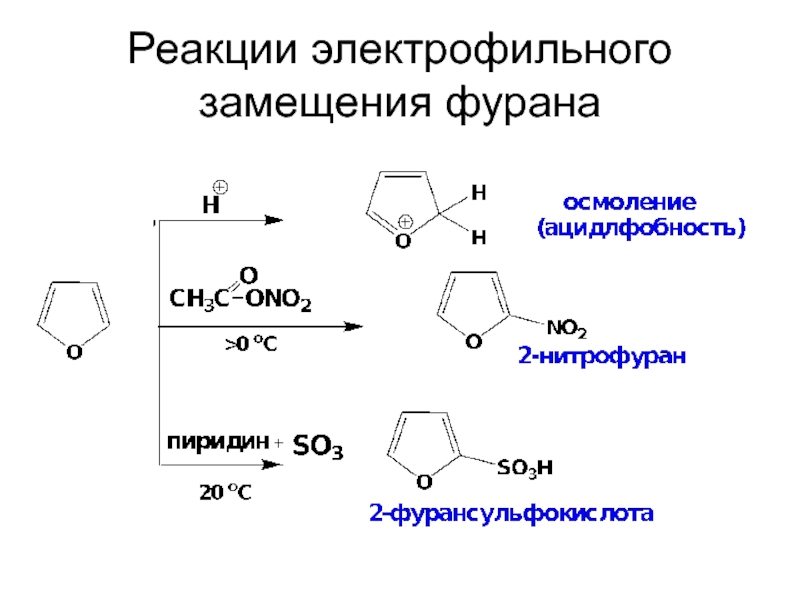
- 30. Реакции электрофильного замещения фурана
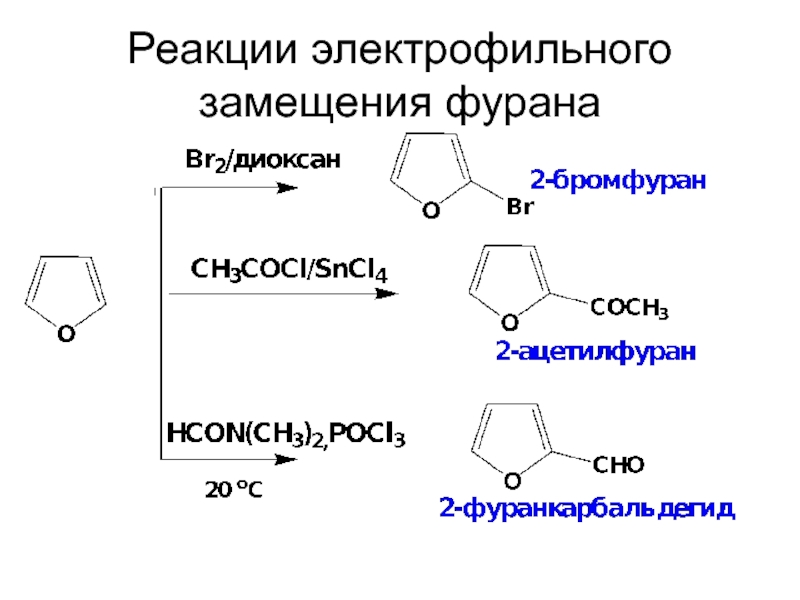
- 31. Реакции электрофильного замещения фурана
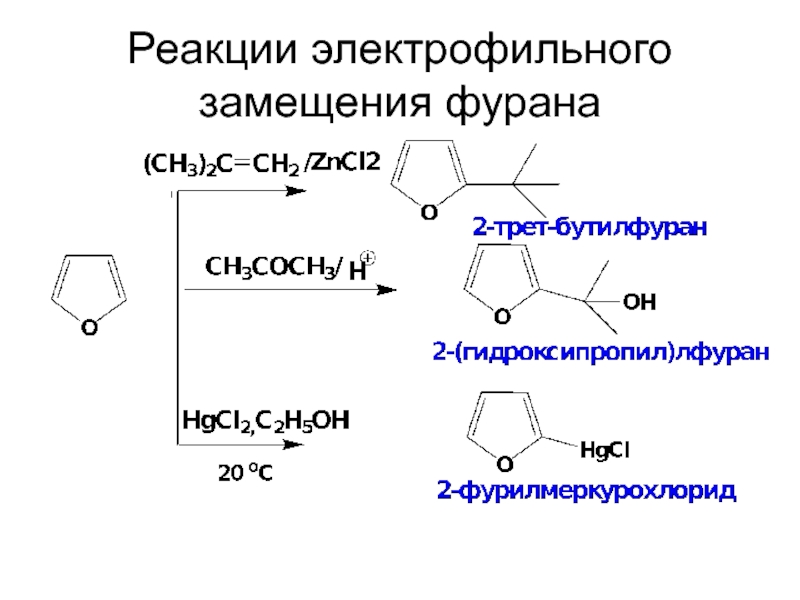
- 32. Реакции электрофильного замещения фурана
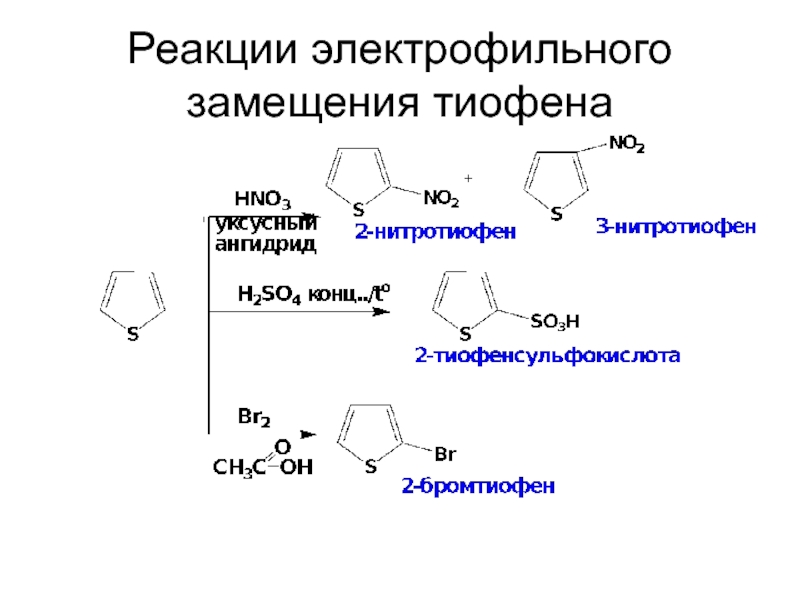
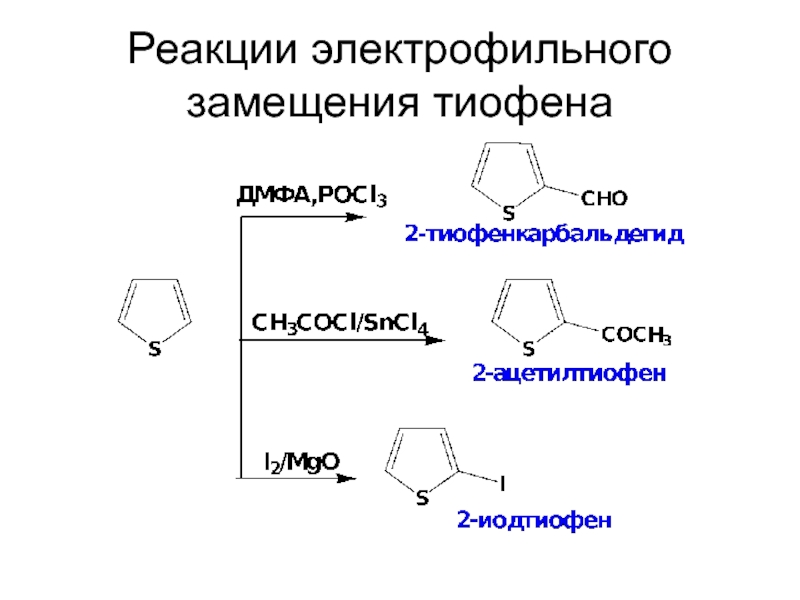
- 33. Реакции электрофильного замещения тиофена
- 34. Реакции электрофильного замещения тиофена
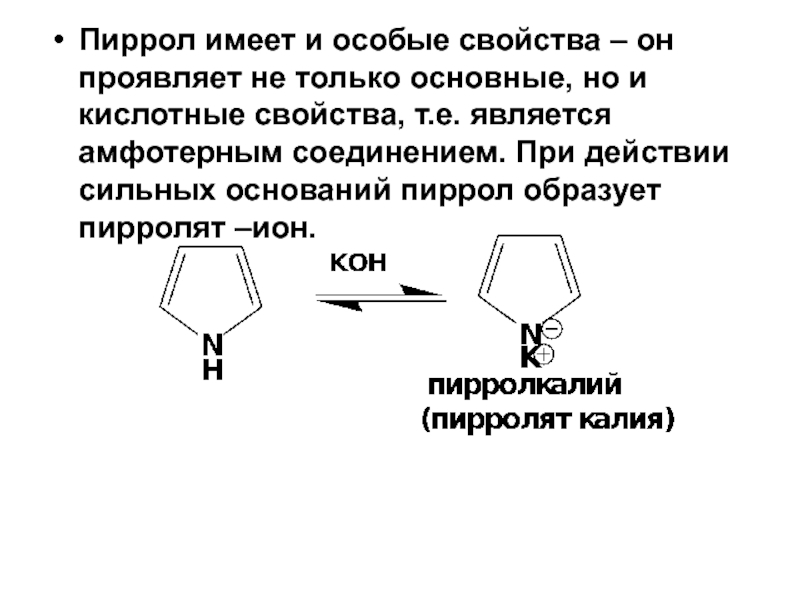
- 35. Пиррол имеет и особые свойства – он
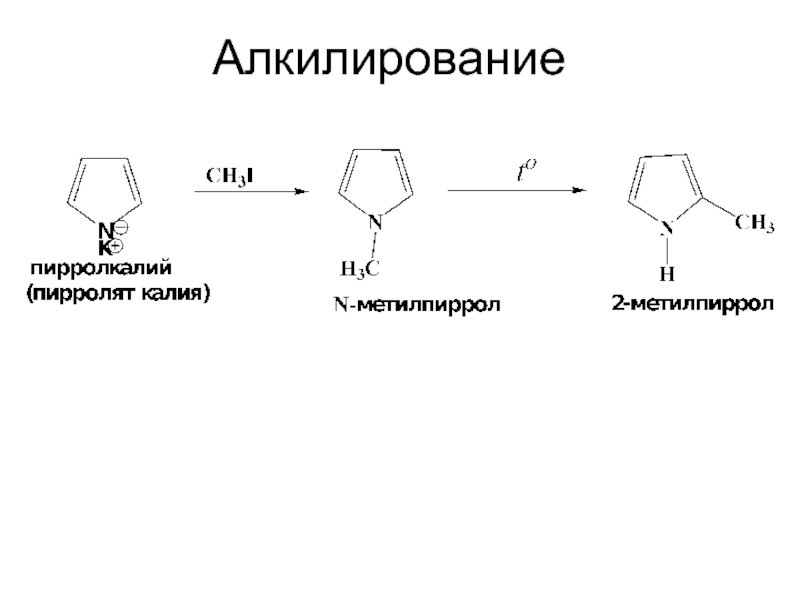
- 36. Алкилирование
- 37. РЕАКЦИИ РАЗРУШЕНИЕМ АРОМАТИЧЕСКОЙ СИСТЕМЫ Способность вступать
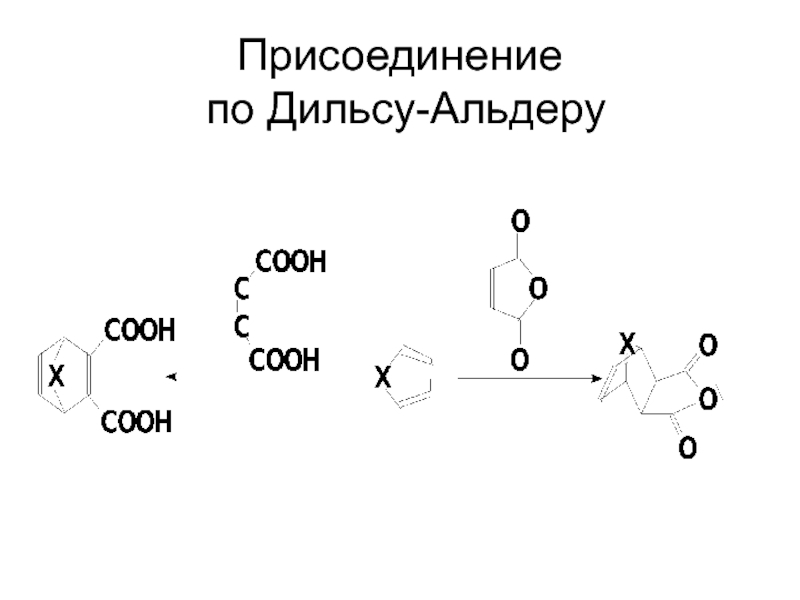
- 38. Присоединение по Дильсу-Альдеру
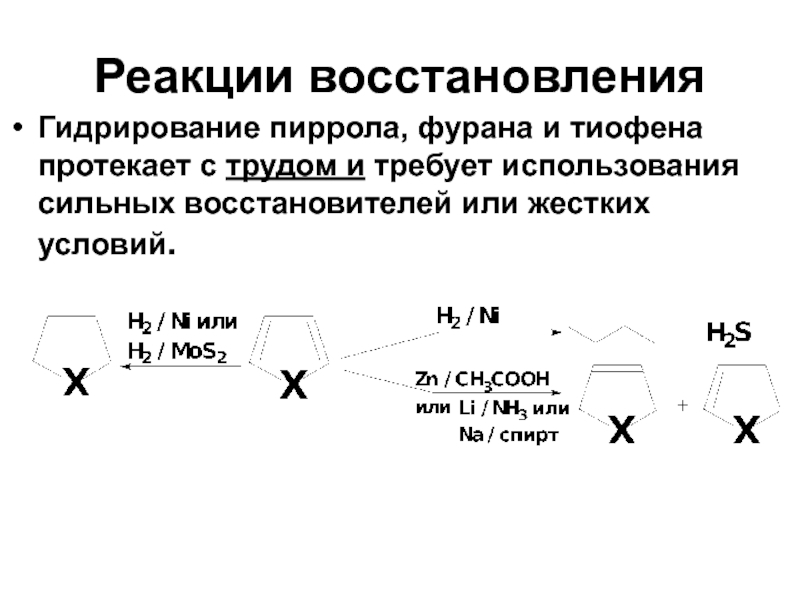
- 39. Реакции восстановления Гидрирование пиррола, фурана и тиофена
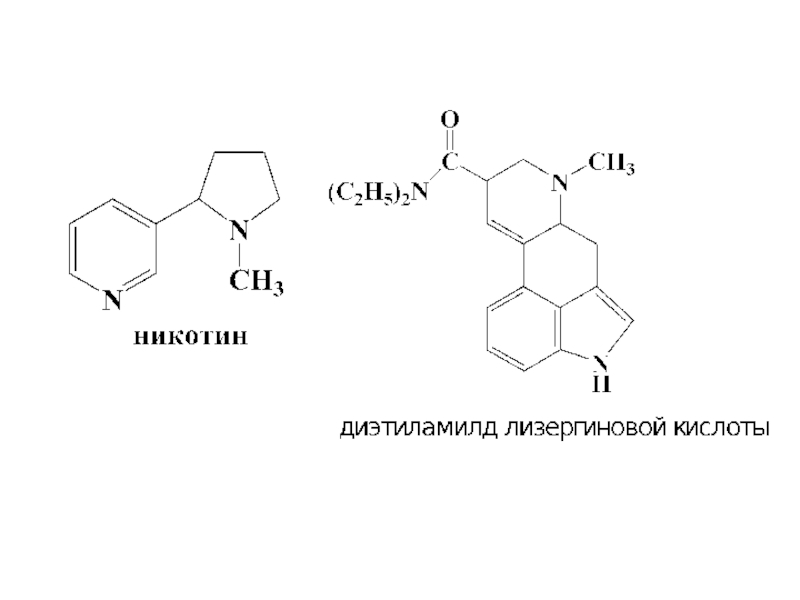
- 40. Биологическое значение пиррола Пиррольные ядра образуют
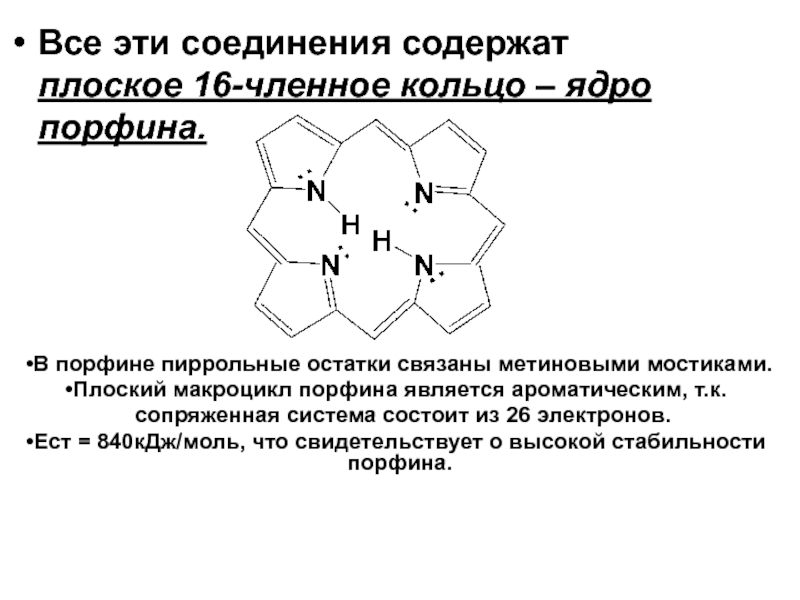
- 41. Все эти соединения содержат плоское 16-членное кольцо
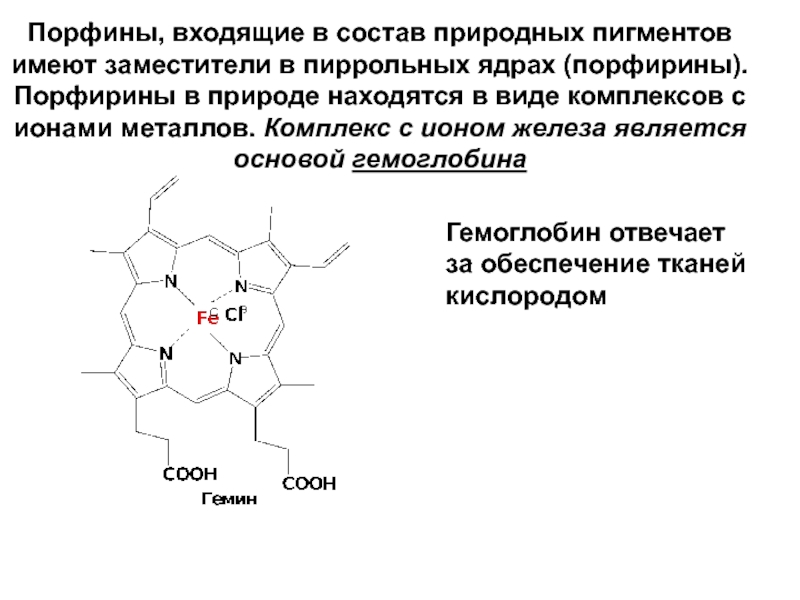
- 42. Порфины, входящие в состав природных пигментов имеют
- 43. Комплекс с ионом магния является
- 44. ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. ПИРИДИН.
- 45. Способы получения В промышленных масштабах пиридин
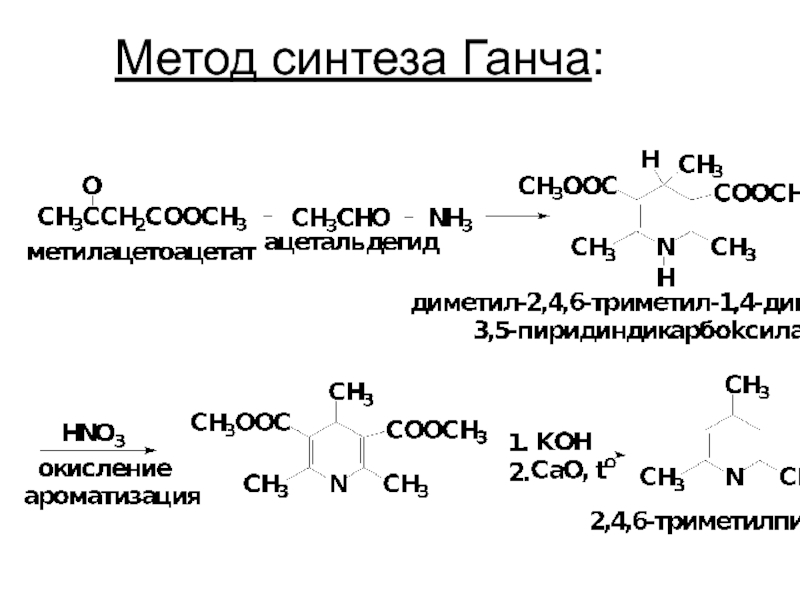
- 46. Метод синтеза Ганча:
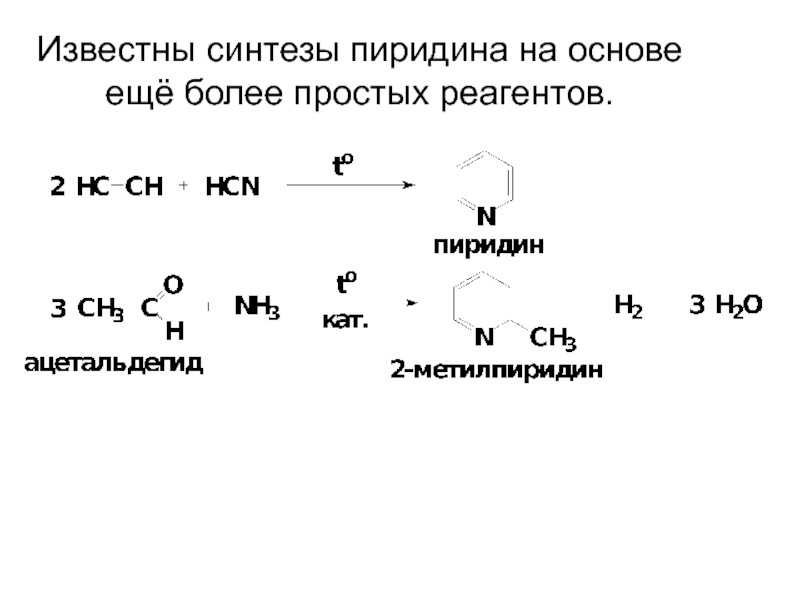
- 47. Известны синтезы пиридина на основе ещё более простых реагентов.
- 48. Физические свойства Пиридин представляет собой бесцветную жидкость
- 49. СТРОЕНИЕ МОЛЕКУЛЫ ПИРИДИНА Пиридин
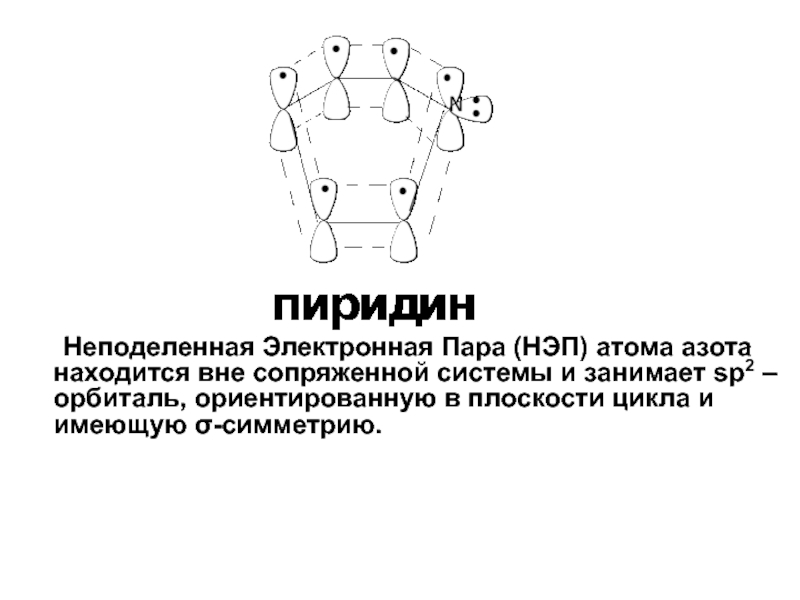
- 50. Неподеленная Электронная Пара (НЭП) атома азота находится
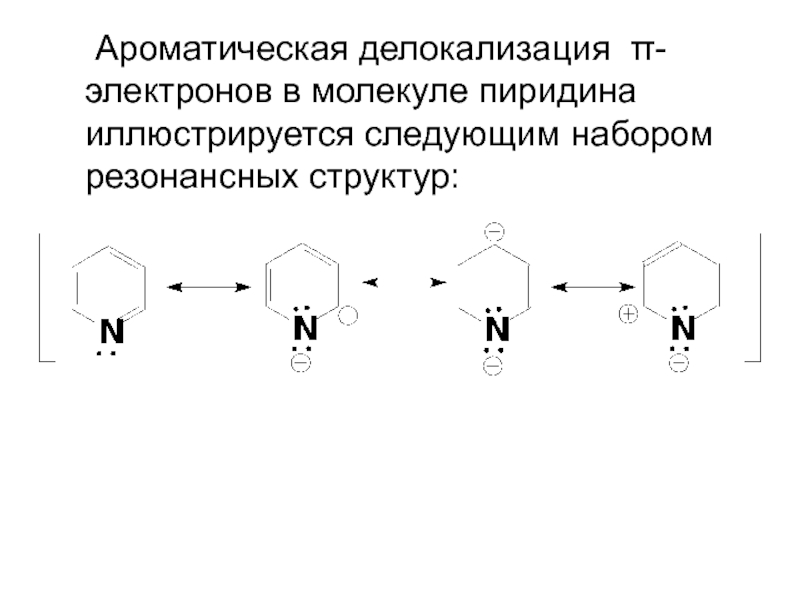
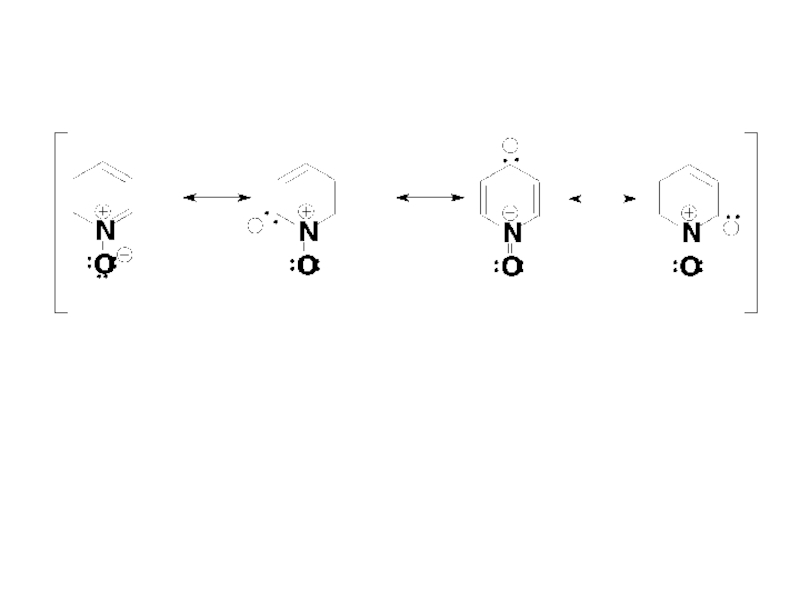
- 51. Ароматическая делокализация π-электронов в молекуле пиридина иллюстрируется следующим набором резонансных структур:
- 52. В большей части этих структур атом азота
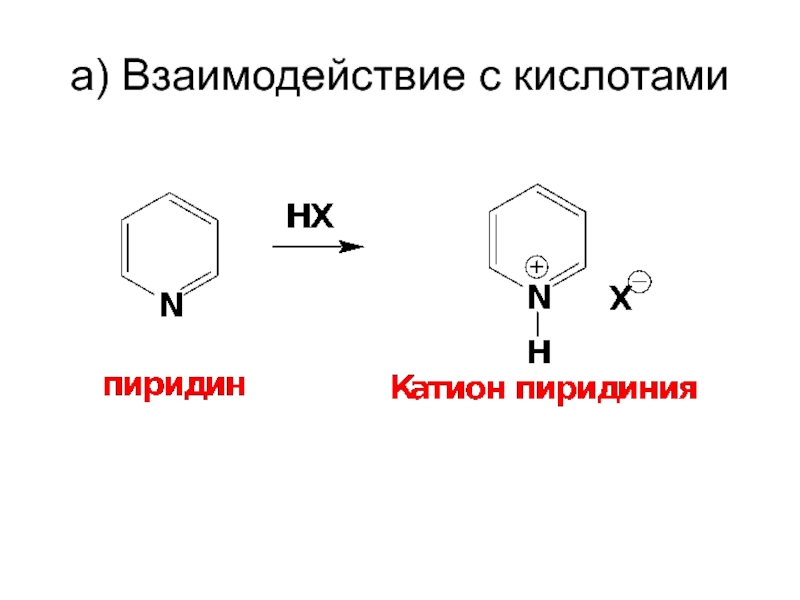
- 53. ХИМИЧЕСКИЕ СВОЙСТВА I. Основные и нуклеофильные
- 54. a) Взаимодействие с кислотами
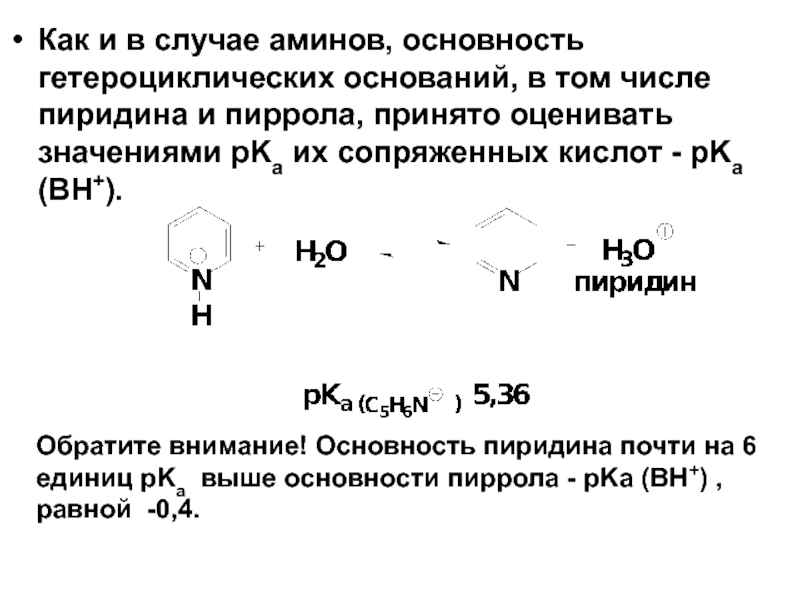
- 55. Как и в случае аминов, основность гетероциклических
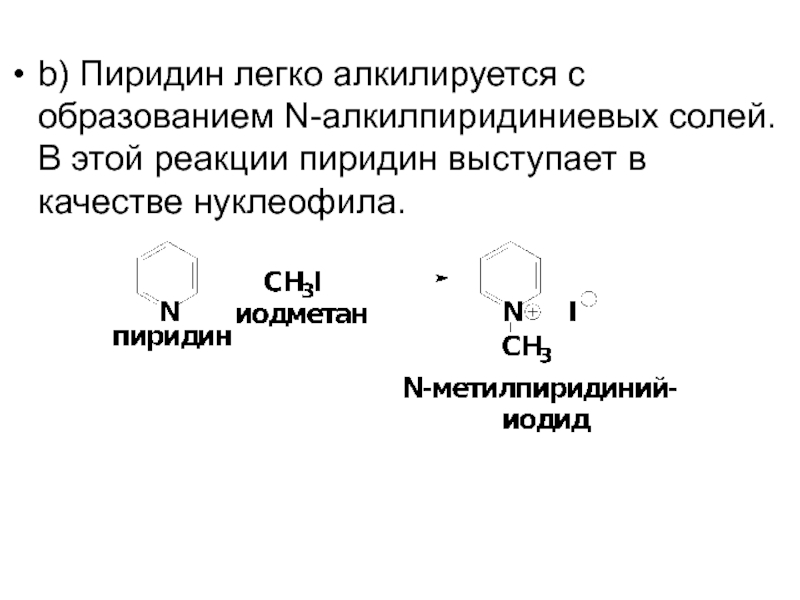
- 56. b) Пиридин легко алкилируется с образованием N-алкилпиридиниевых
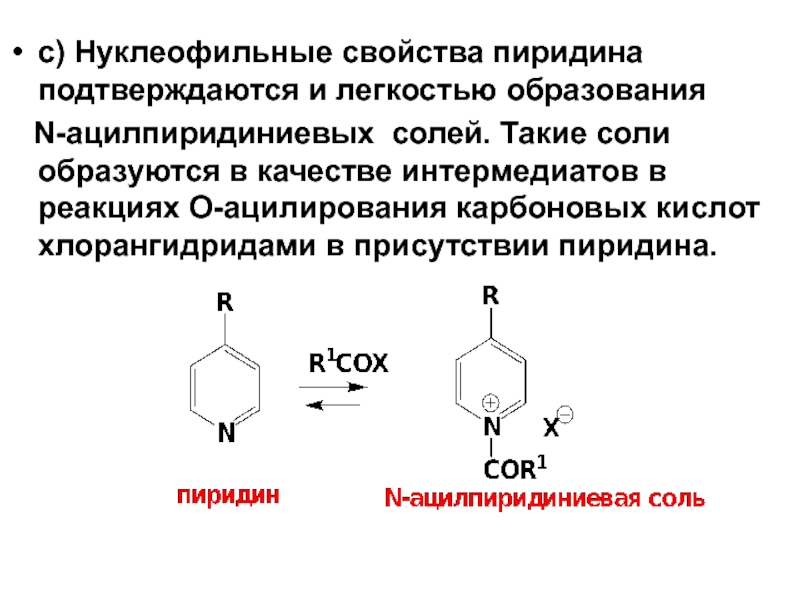
- 57. c) Нуклеофильные свойства пиридина подтверждаются и легкостью
- 58. Вследствие солеобразования пиридиниевое кольцо сильно дезактивируется к
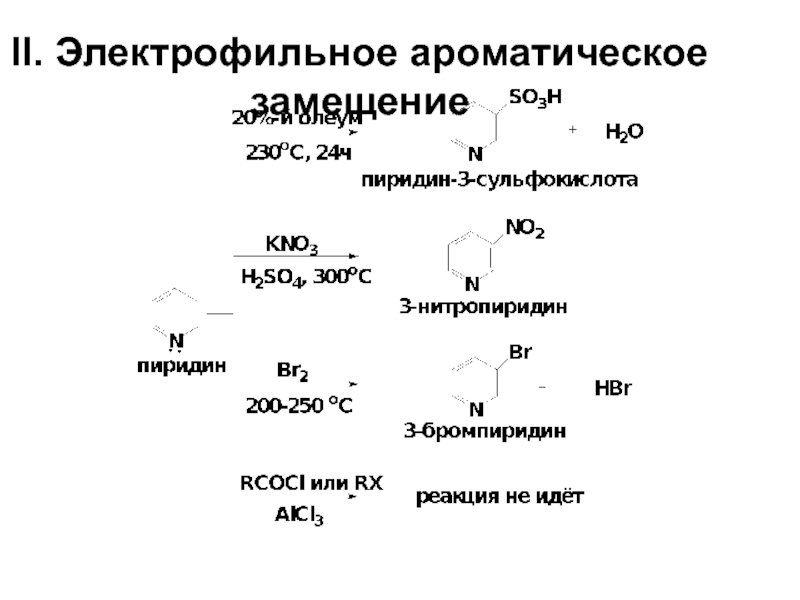
- 59. II. Электрофильное ароматическое замещение
- 60. SE в пиридинах протекает исключительно в β-положения,
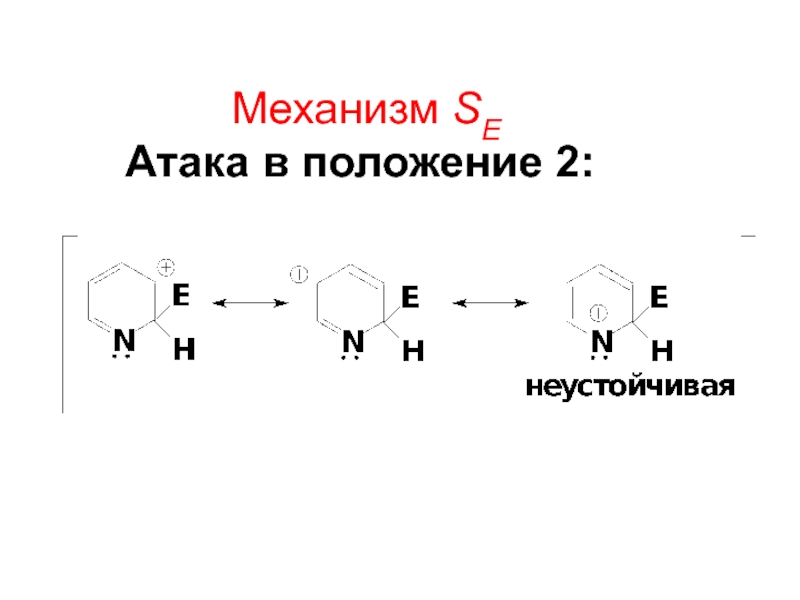
- 61. Mеханизм SE Атака в положение 2:
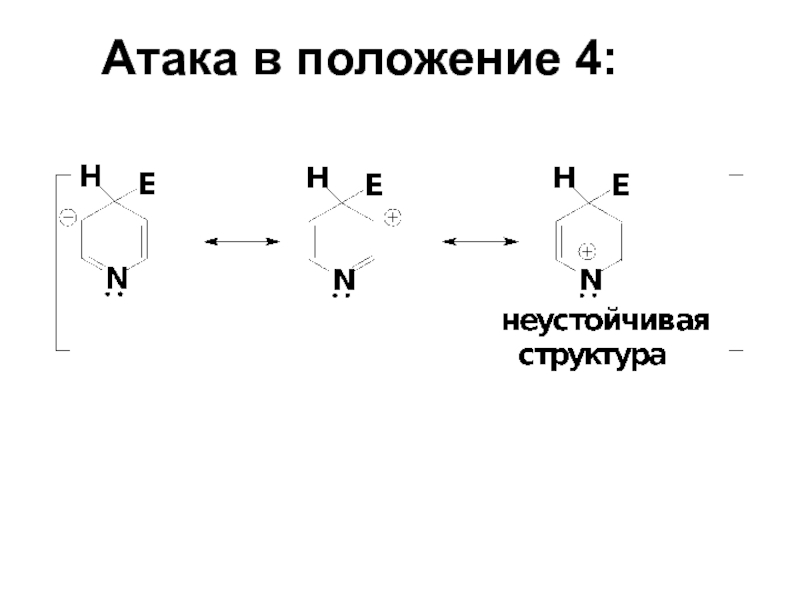
- 62. Атака в положение 4:
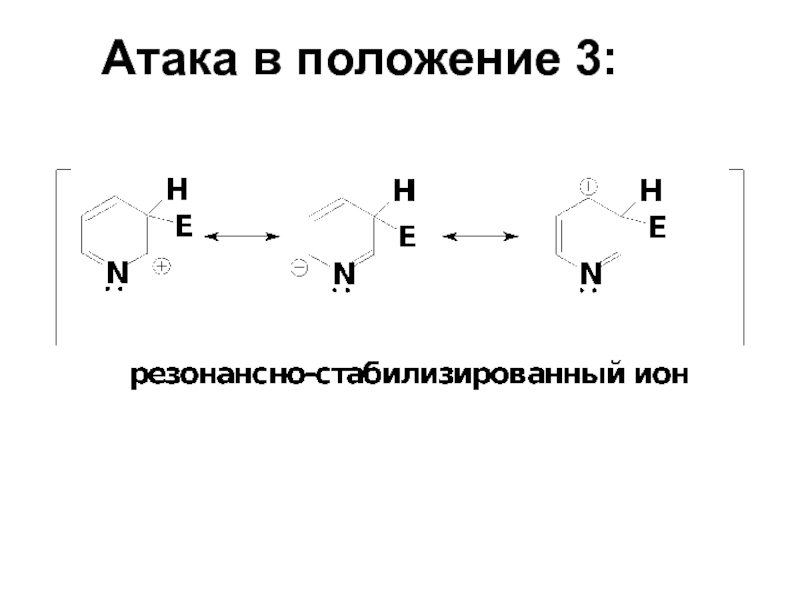
- 63. Атака в положение 3:
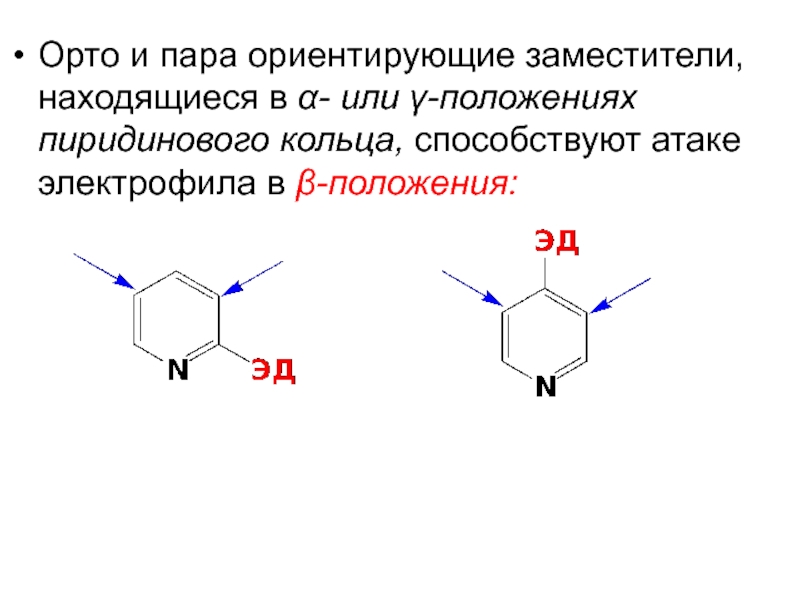
- 64. Орто и пара ориентирующие заместители, находящиеся в
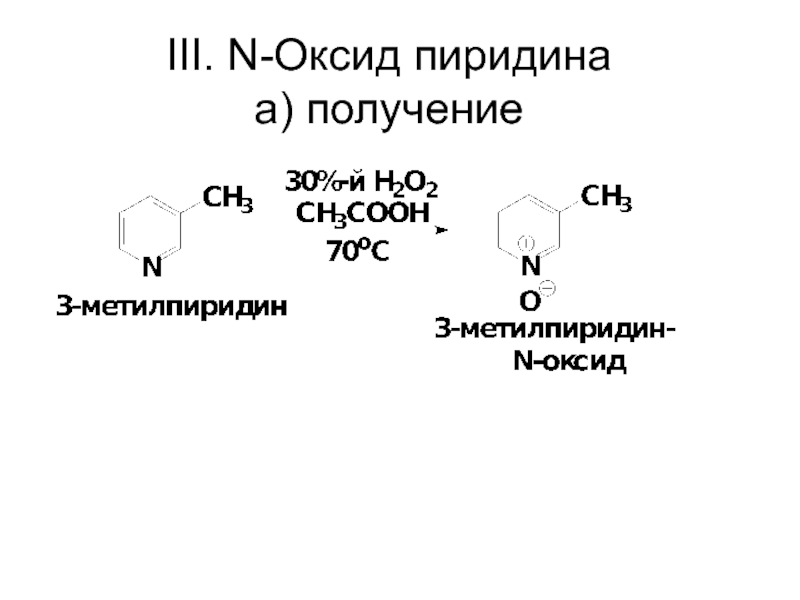
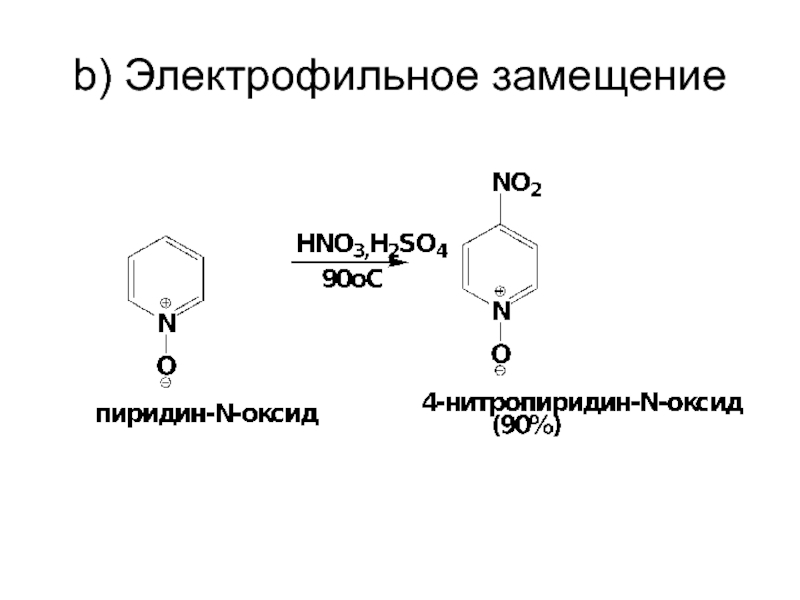
- 65. III. N-Оксид пиридина a) получение
- 67. b) Электрофильное замещение
- 68. Замещению подвергается непротонированный N-оксид, реакционная способность которого
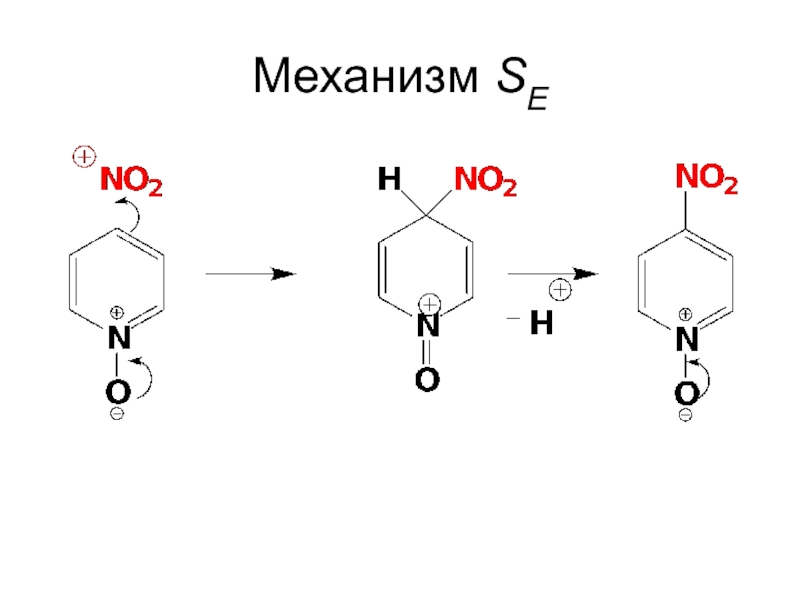
- 69. Mеханизм SE
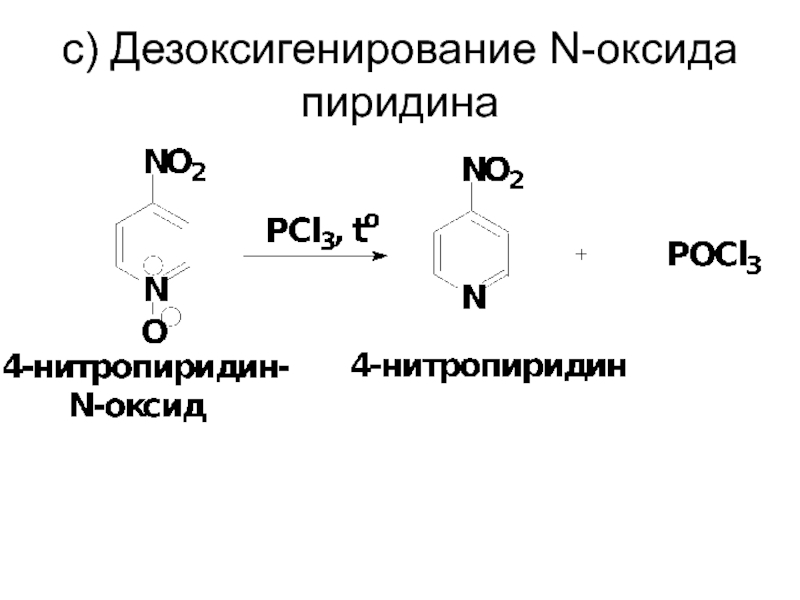
- 70. c) Дезоксигенирование N-оксида пиридина
- 71. IV. Нуклеофильное замещение Высокое сродство к электрону
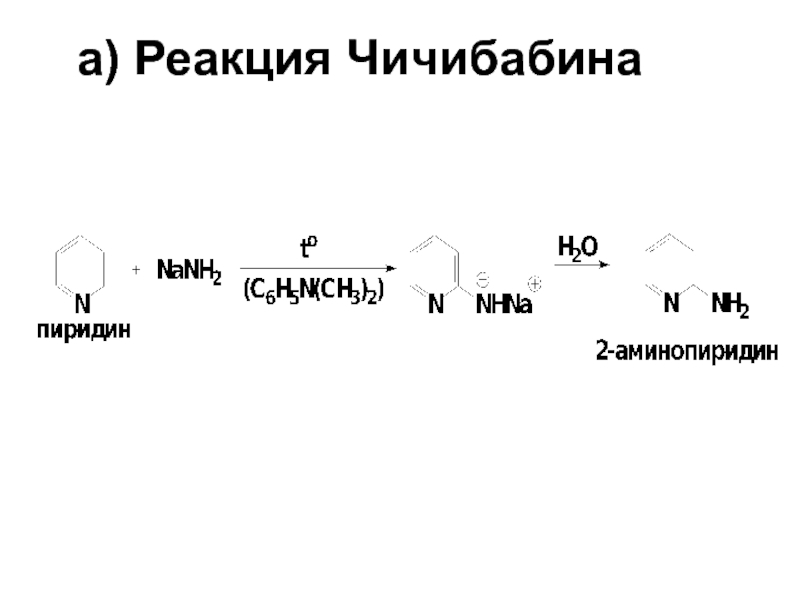
- 72. a) Реакция Чичибабина
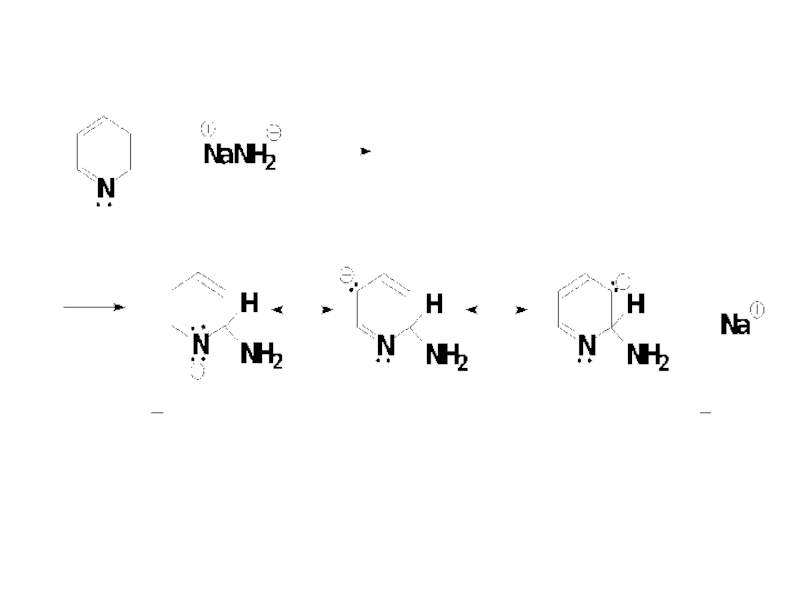
- 73. Механизм реакции Чичибабина Стадия 1
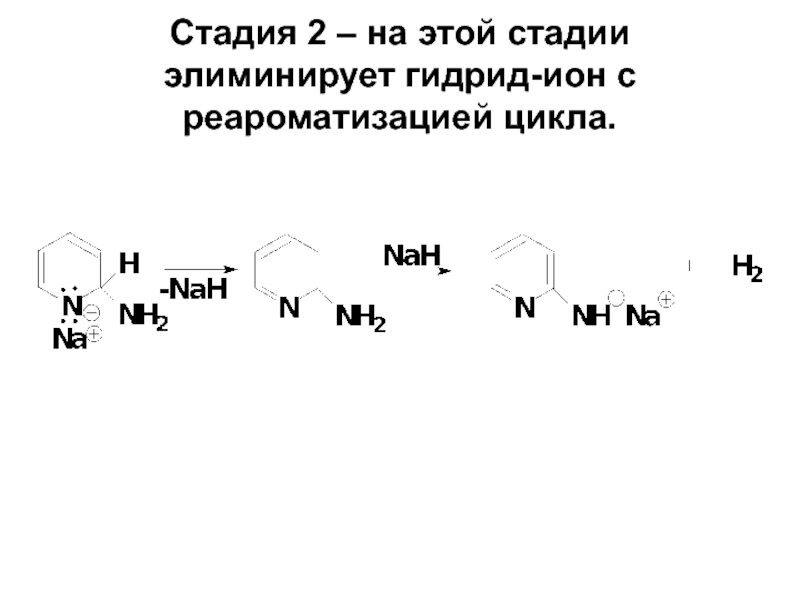
- 75. Стадия 2 – на этой стадии элиминирует гидрид-ион с реароматизацией цикла.
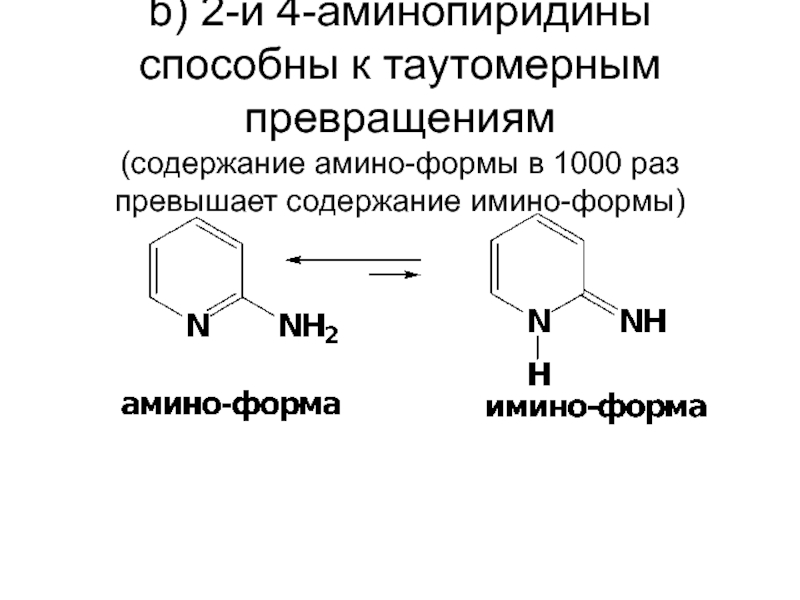
- 76. b) 2-и 4-аминопиридины способны к таутомерным
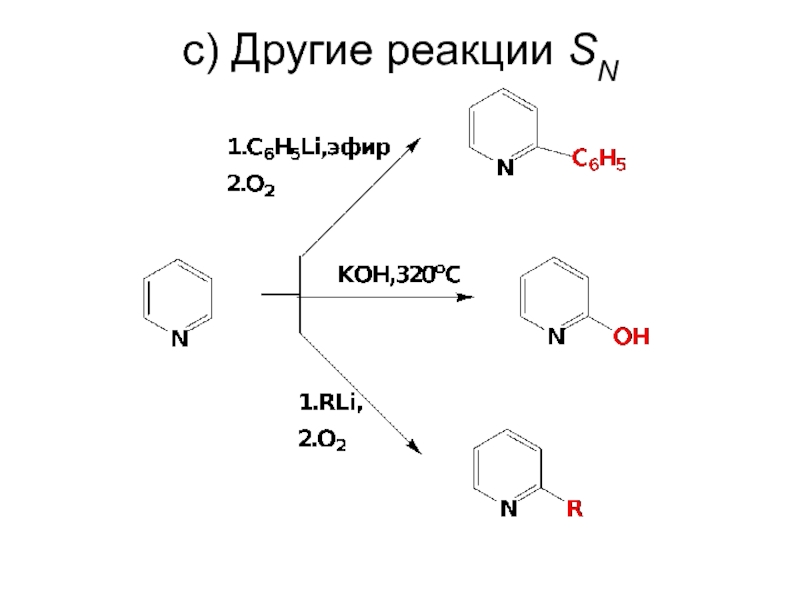
- 77. c) Другие реакции SN
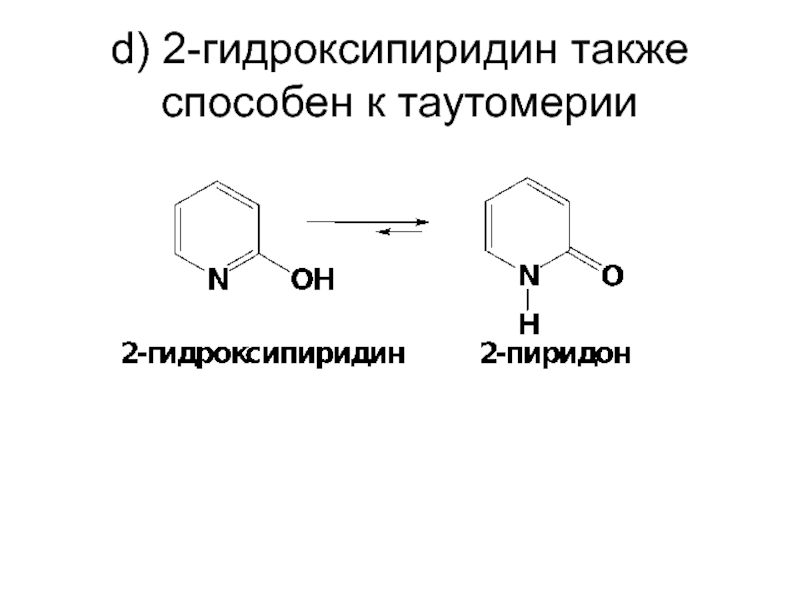
- 78. d) 2-гидроксипиридин также способен к таутомерии
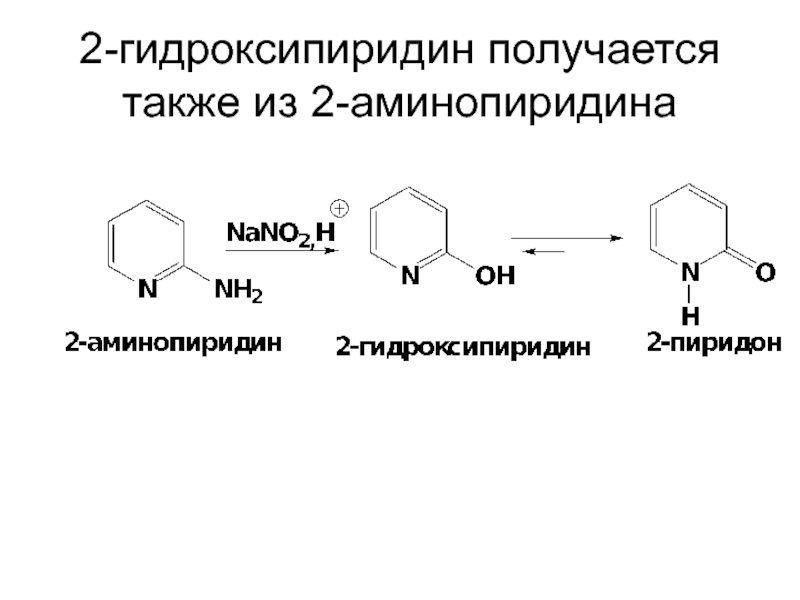
- 79. 2-гидроксипиридин получается также из 2-аминопиридина
- 80. V. Восстановление Электронодефицитный характер пиридина
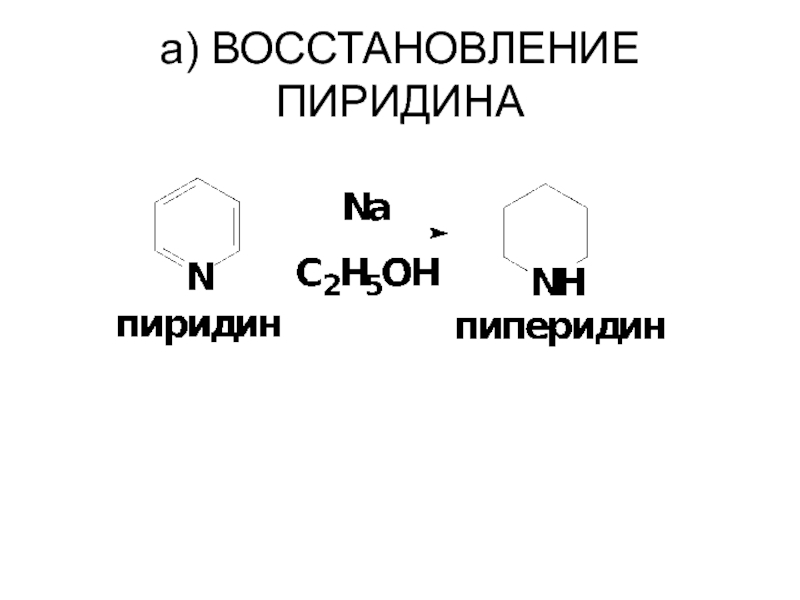
- 81. a) ВОССТАНОВЛЕНИЕ ПИРИДИНА
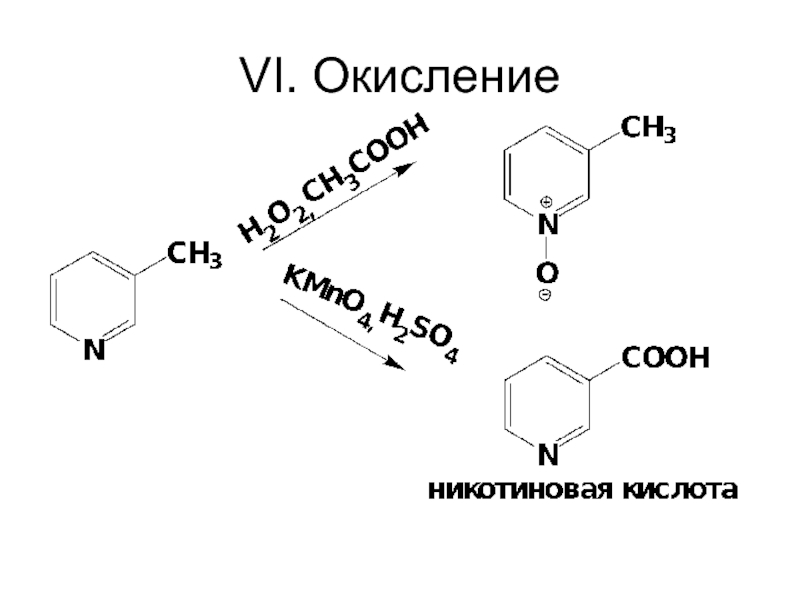
- 82. VI. Окисление
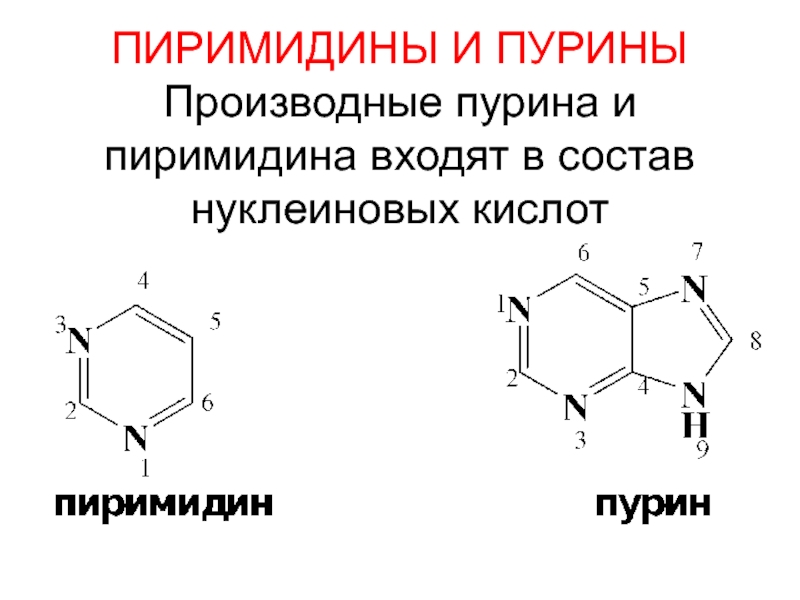
- 83. ПИРИМИДИНЫ И ПУРИНЫ Производные пурина и пиримидина входят в состав нуклеиновых кислот
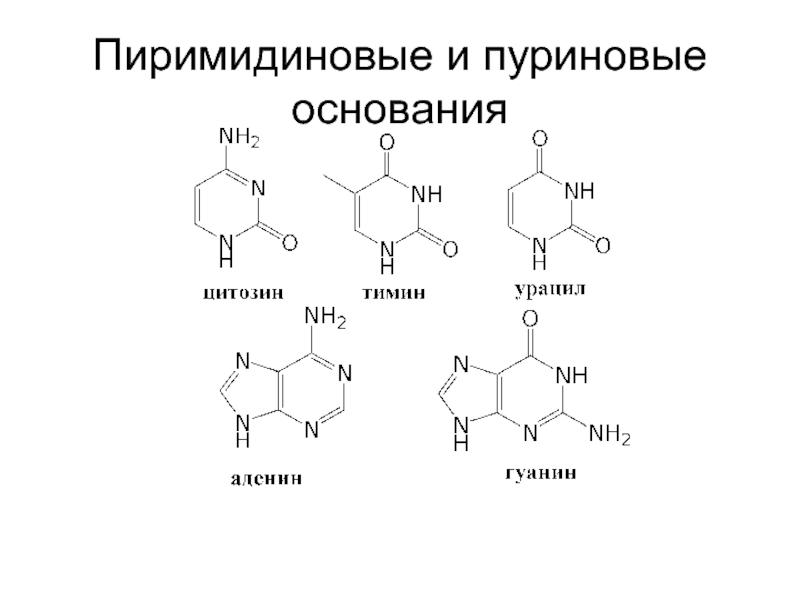
- 84. Пиримидиновые и пуриновые основания
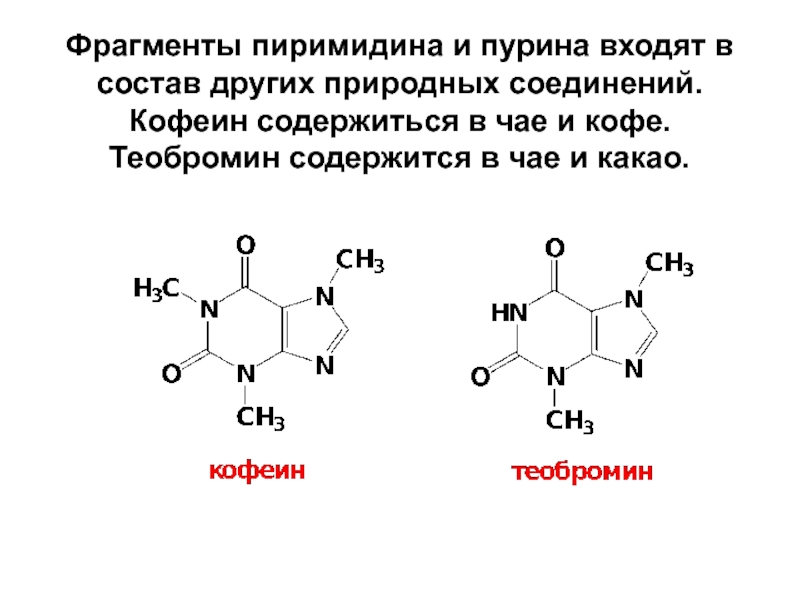
- 85. Фрагменты пиримидина и пурина входят в
Слайд 1Гетероциклические соединения
Гетероциклическими соединениями называют циклические системы, содержащие гетероатом в цикле –
Слайд 2Классификация и номенклатура
Циклы классифицируют:
1. По размеру цикла
Циклы могут быть разного
3-, 4-членные(малые)
5- 8-членные (нормальные),
циклы, содержащие 8-12 атомов, и больше 12 атомов (макроциклы).
Слайд 32. По характеру гетероатома
В качестве гетероатома может выступать любой
Слайд 6Номенклатура
Размер цикла обозначается соответствующим корнем и суффиксом, а природа гетероатома –
O - (окса-), N - (аза-), S - (тиа). -;
если гетероатом не один, применяют перед префиксами умножающие приставки ди-, три-, тетра-и т.д.
Слайд 7Когда в цикле присутствуют разные гетероатомы, они перечисляются в порядке старшинства:
Степень ненасыщенности гетероцикла выражают суффиксами, которые несколько отличаются в зависимости от того, содержит или не содержит цикл азот.
Слайд 8Корни и суффиксы для моноциклов разных размеров, насыщенных и ненасыщенных приведены
Слайд 16Лабораторные способы:
Из 1,4-дикарбонильных соединений
Реакция Пааля-Кнорра – нагревание 1,4-дикарбонильного соединения с NH3
Слайд 17Взаимопревращения фурана, пиррола и тиофена: цикл Юрьева.
Эта
Слайд 18Синтез пиррола по Кнорру:
α- Aминокарбонильное соединение подвергают конденсации с β-кетоэфиром:
Слайд 19ФИЗИЧЕСКИЕ СВОЙСТВА И СТРОЕНИЕ
Молекулы всех этих гетероциклов имеют плоское строение. Ароматический
Слайд 21Теория резонанса подтверждает ароматический характер фурана, пиррола и тиофена.
Все три гетероарена
к числу электроноизбыточных гетероциклов:
6 π-электронов распределены между 5 атомами С.
Слайд 24Относительная активность гетероаренов в SE реакциях:
Пиррол > фуран > тиофен
Но
Пиррол > фуран > тиофен
Слайд 25Пятичленные гетероароматические соединения ацидофобны. В присутствии сильных кислот они протонируются с
Слайд 26Поскольку протонированию подвергается сопряженная π-система пиррола, основность этого соединения оказывается значительно
Из-за чувствительности к кислотам в ряде SE реакций гетероаренов используют специфические реагенты.
Слайд 35Пиррол имеет и особые свойства – он проявляет не только основные,
Слайд 37РЕАКЦИИ РАЗРУШЕНИЕМ АРОМАТИЧЕСКОЙ СИСТЕМЫ
Способность вступать в реакции
1,4-циклоприсоединения наиболее выражена у
Слайд 39Реакции восстановления
Гидрирование пиррола, фурана и тиофена протекает с трудом и требует
Слайд 40Биологическое значение пиррола
Пиррольные ядра образуют основу многих биологически важных пигментов
пигментов крови (гемоглобин),
зеленых частей растений (хлорофилл),
желчи,
витамина В12.
Все эти соединения содержат плоское 16-членное кольцо – ядро порфина.
Слайд 41Все эти соединения содержат плоское 16-членное кольцо – ядро порфина.
В
Плоский макроцикл порфина является ароматическим, т.к.
сопряженная система состоит из 26 электронов.
Ест = 840кДж/моль, что свидетельствует о высокой стабильности порфина.
Слайд 42Порфины, входящие в состав природных пигментов имеют заместители в пиррольных ядрах
Гемоглобин отвечает за обеспечение тканей кислородом
Слайд 43
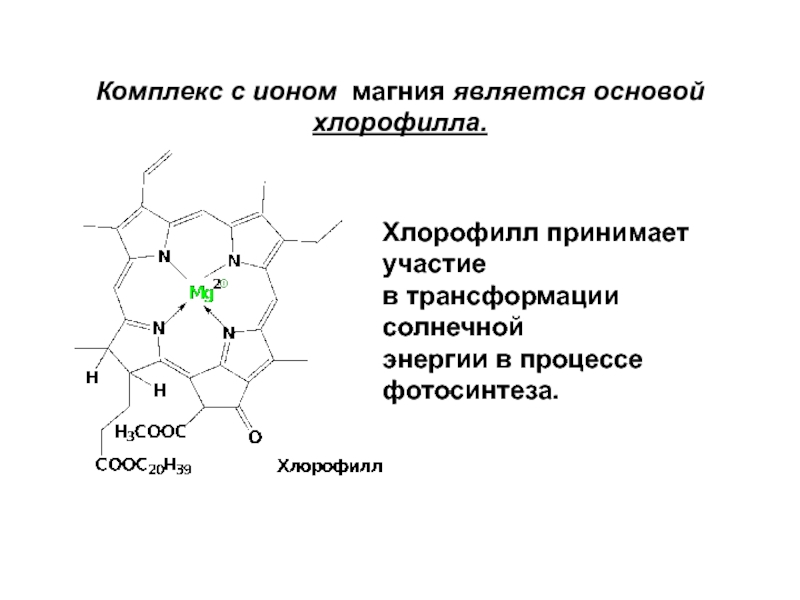
Комплекс с ионом магния является основой хлорофилла.
Хлорофилл принимает участие
в трансформации
энергии в процессе фотосинтеза.
Слайд 45Способы получения
В промышленных масштабах пиридин и его гомологи получают при коксохимической
Слайд 48Физические свойства
Пиридин представляет собой бесцветную жидкость с Ткип. 115,3оС. Он обладает
Слайд 49СТРОЕНИЕ МОЛЕКУЛЫ ПИРИДИНА
Пиридин является шестичленным гетероароматическим аналогом бензола. Его плоская
sp2-гибридизации и вносят по одному электрону в ароматический секстет.
Слайд 50 Неподеленная Электронная Пара (НЭП) атома азота находится вне сопряженной системы и
Слайд 51 Ароматическая делокализация π-электронов в молекуле пиридина иллюстрируется следующим набором резонансных структур:
Слайд 52 В большей части этих структур атом азота имеет отрицательный заряд, что
Слайд 53ХИМИЧЕСКИЕ СВОЙСТВА
I. Основные и нуклеофильные свойства
Поскольку НЭП азота в молекуле пиридина
Слайд 55Как и в случае аминов, основность гетероциклических оснований, в том числе
Обратите внимание! Основность пиридина почти на 6 единиц pKa выше основности пиррола - pKa (ВН+) , равной -0,4.
Слайд 56b) Пиридин легко алкилируется с образованием N-алкилпиридиниевых солей. В этой реакции
Слайд 57c) Нуклеофильные свойства пиридина подтверждаются и легкостью образования
N-ацилпиридиниевых солей.
Слайд 58Вследствие солеобразования пиридиниевое кольцо сильно дезактивируется к электрофильной атаке. Скорость реакции
Пиридин вступает в реакции электрофильного замещения гораздо медленней, чем бензол, напоминая в этом отношении нитробензол. Активность же пиридиний- катиона еще ниже.