- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Галогены. История открытия галогенов презентация
Содержание
- 1. Галогены. История открытия галогенов
- 2. 1. История
- 3. Фтор История открытия галогенов Хлор Бром Йод Астат
- 4. В 1886 году французский химик
- 5. В 1774
- 6. В 1825
- 7. В 1811
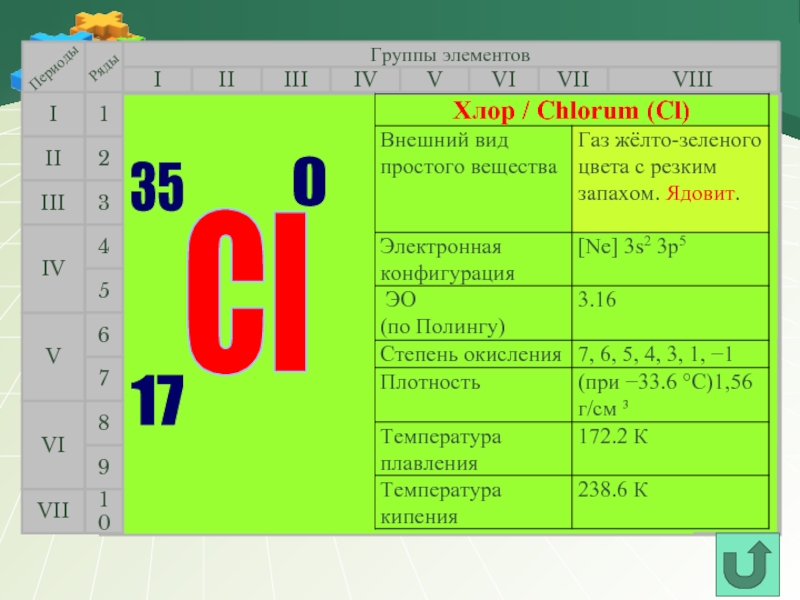
- 8. Группы элементов I III II VIII
- 9. Группы элементов I
- 10. Группы элементов I
- 11. Группы элементов I
- 12. Группы элементов I
- 13. Группы элементов I
- 14. Химические свойства Взаимодействие с металлами:
- 15. Химические свойства Взаимодействие с неметаллами:
- 16. Химические свойства Взаимодействие со сложными
- 17. Химические свойства Взаимодействие со сложными
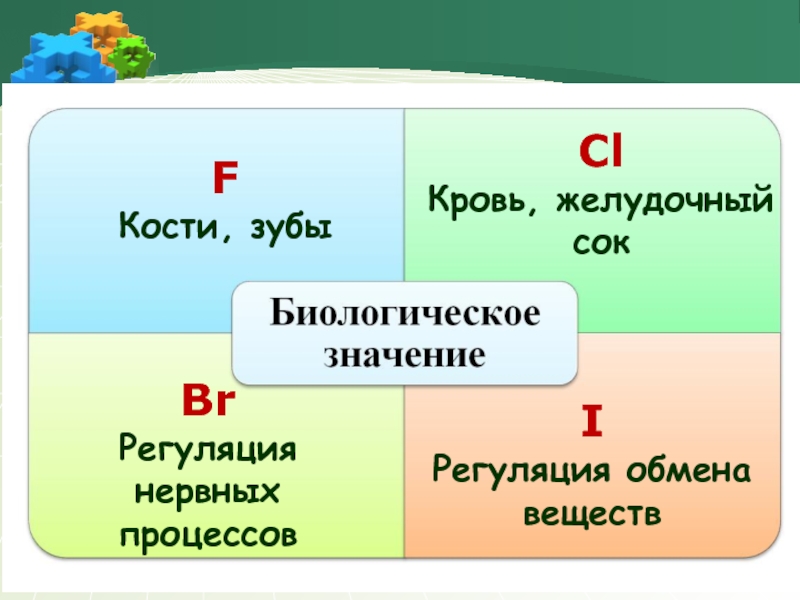
- 18. F Кости, зубы
- 19. Применение фтора Тефлон
- 20. Применение хлора Отбеливатели Производство HCl
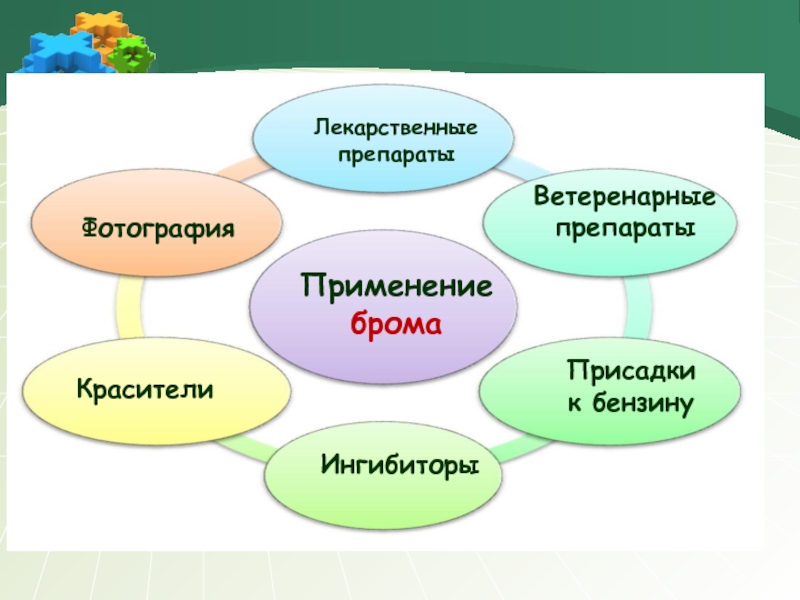
- 21. Применение брома Лекарственные
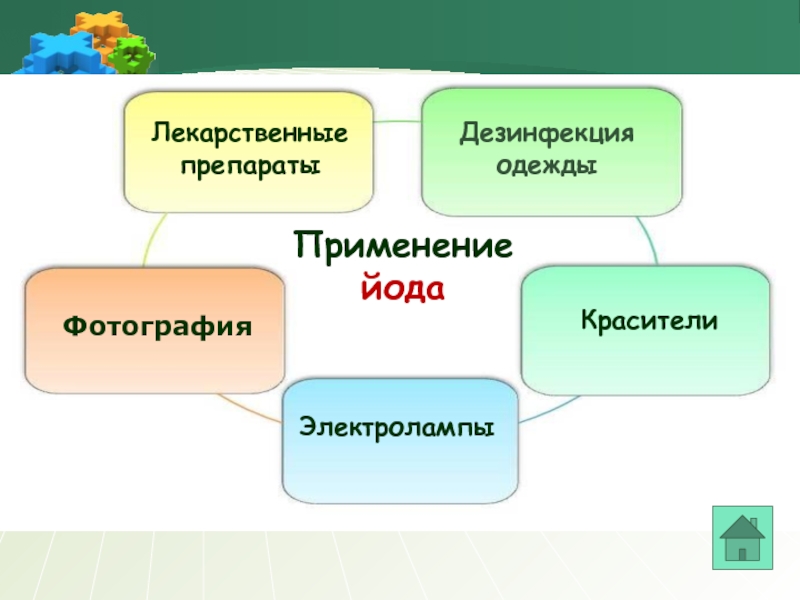
- 22. Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы
- 23. Химические свойства галогенов Вставьте коэффициенты:
- 24. Подумайте… Что образуется в данной
- 25. Домашнее задание § 18, упр. 4,5,6 Составить таблицу
Слайд 2
1. История открытия галогенов
2. Положение в ПСХЭ
3. Химические свойства
4. Применение
5.Проверка знаний
Главная
Галогены
6.Домашнее
Слайд 4 В 1886 году французский химик А. Муассан, используя электролиз
История открытия фтора
Анри Муассан
(1852 – 1907)
Слайд 5 В 1774 году шведский ученый К.
В 1807 году английский химик Гемфри Дэви получил тот же газ. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от "хлорос" - желто-зеленый).
В 1812 году Гей-Люссак дал газу название хлор.
История открытия хлора
Карл Вильгельм Шееле
(1742 – 1786)
Слайд 6 В 1825 году французский химик А.Ж.Балар
История открытия брома
Антуан Жером Балар
(1802 – 1876)
Слайд 7 В 1811 году французский химик Бернар
В 1813 году Гей-Люссак подробно изучил этот элемент и дал ему современное название. Название "иод" происходит от греческого слова "иодэс" - "фиолетовый" (по цвету паров).
История открытия йода
Бернар Куртуа (1777 – 1838 )
Слайд 8
Группы элементов
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
10
F
фтор
9
18.9984
Br
Бром
35
79.904
I
Иод
53
126.904
Cl
Хлор
17
35,453
At
Астат
85
210
9
8
Галогены
Слайд 14Химические свойства
Взаимодействие с металлами:
2К + Cl2→ 2КCl
2Fe + 3Cl2
Cu + Cl2 → Cu Cl2
2Al + 3Br2 → 2AlBr3
2Al + 3I2 → 2AlI3
Слайд 15Химические свойства
Взаимодействие с неметаллами:
А) с водородом
H2 + F2 → 2HF
H2 + Cl2 → 2HCl +Q реакции
H2 + Br2 → 2HBr +Q уменьш.
H2 + I2 → 2HCl - Q
В) с другими неметаллами
2P + 5Cl2 → 2PCl5 ( tº, в изб.Сl2)
Слайд 16Химические свойства
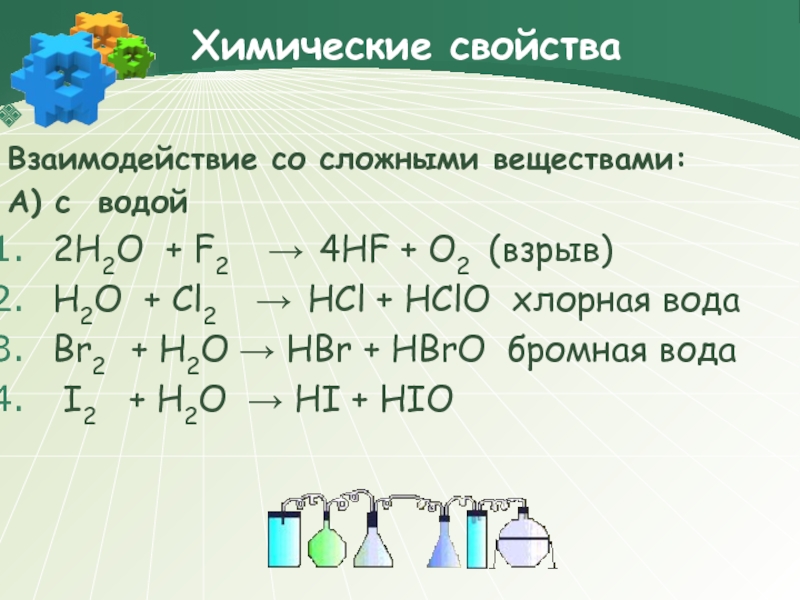
Взаимодействие со сложными веществами:
А) с водой
2H2O + F2
H2O + Cl2 → HCl + HClO хлорная вода
Br2 + H2O → HBr + HBrO бромная вода
I2 + H2O → HI + HIO
Слайд 17Химические свойства
Взаимодействие со сложными веществами:
Б) «ряд активности» галогенов
F2
2KBr + Cl2 → Br2 + 2КCl
2KI + Cl2 → I2 + 2КCl
2KI + Br2 → I2 + 2КCl
В) с органическими веществами:
I2 + крахмал →
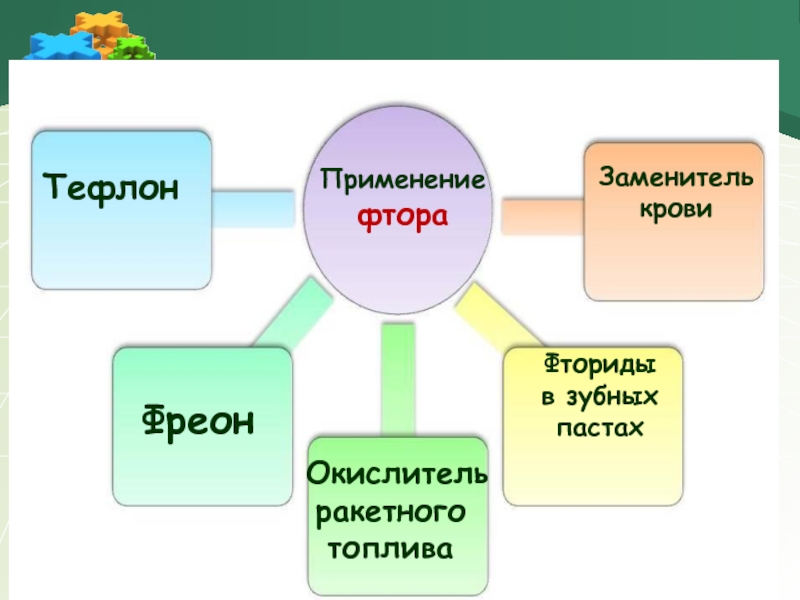
Слайд 19Применение
фтора
Тефлон
Фреон
Окислитель ракетного топлива
Заменитель крови
Фториды
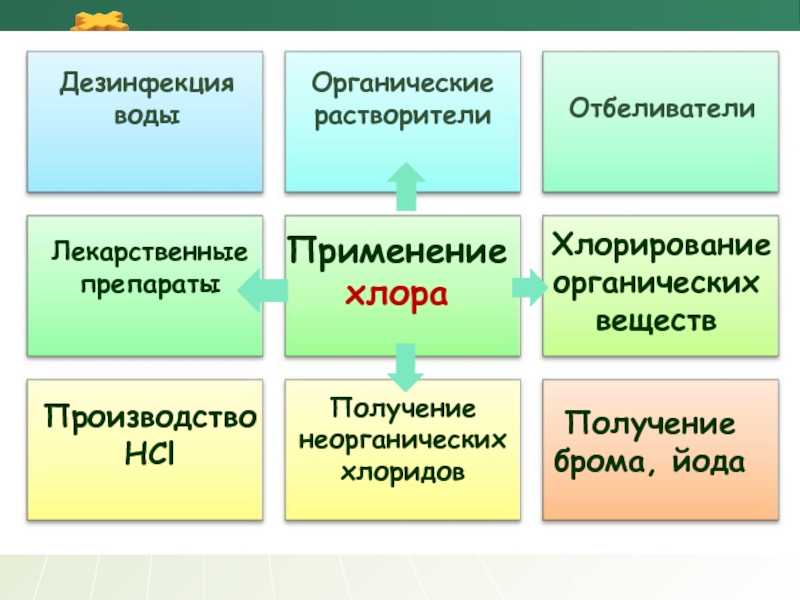
Слайд 20
Применение хлора
Отбеливатели
Производство
HCl
Получение брома, йода
Дезинфекция
Органические растворители
Лекарственные препараты
Хлорирование органических веществ
Получение неорганических хлоридов