- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фтор (Fluorum), F презентация
Содержание
- 1. Фтор (Fluorum), F
- 2. Фтор (Fluorum), F — элементтердің периодтық жүйесінің VII тобындағы химиялық
- 3. Физикалық қасиеті F2 - жасылтым-сары түсті, өткір
- 4. Химиялық қасиеті Фторлы сутек (НҒ), бұл суда
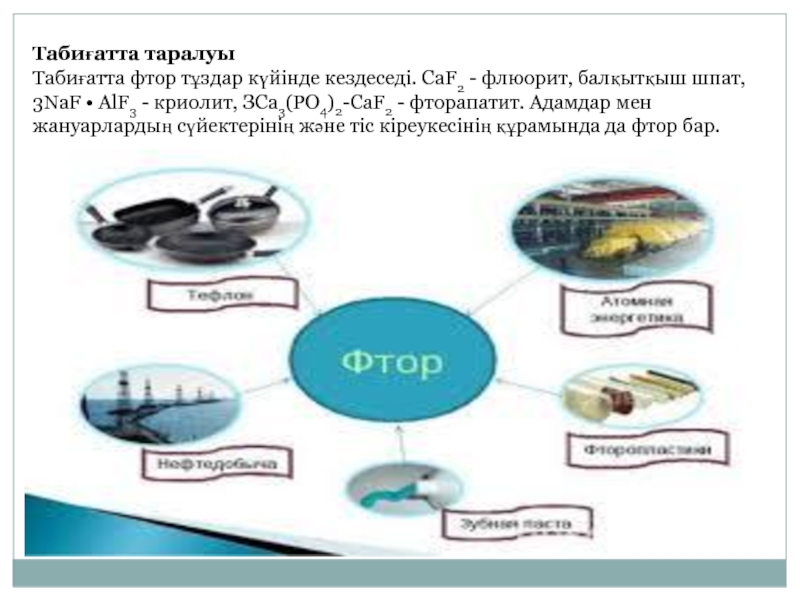
- 6. Табиғатта таралуы Табиғатта фтор тұздар күйінде кездеседі.
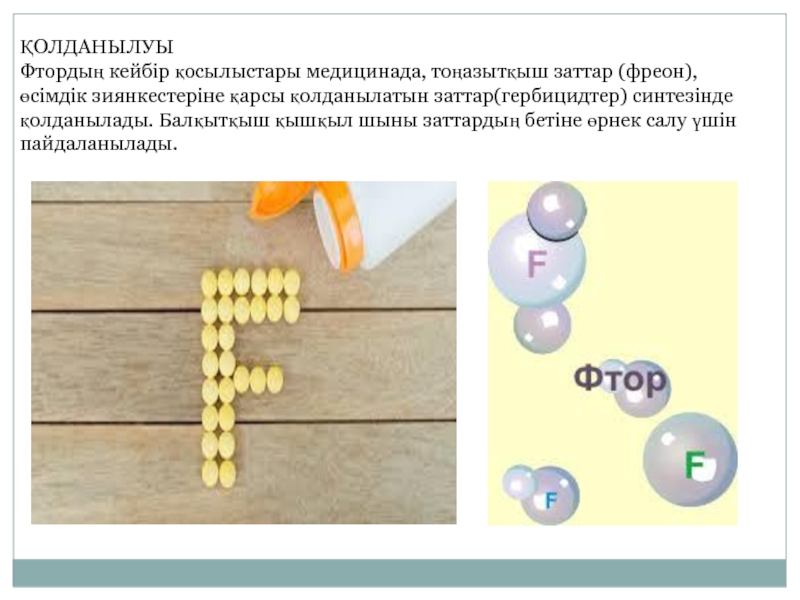
- 7. ҚОЛДАНЫЛУЫ Фтордың кейбір қосылыстары медицинада, тоңазытқыш заттар
- 9. Фтордың алынуы Фторды апатиттен немесе
Слайд 2Фтор (Fluorum), F — элементтердің периодтық жүйесінің VII тобындағы химиялық элемент, ат. н. 9,
Табиғатта тұрақты бір изотопы және жасанды жолмен алынған 5 радиоактивті изотопы бар. Фторды бос күйінде алғаш француз химигі А.Муассан алған (1886). Оның улылығы сондай — Фторды алумен айналысқан көптеген химик-ғалымдар (Г.Дэви, Т.Нокс, Д.Никлес, П.Луйэ) қаза тауып, ал А.Муассон мен Г.Нокс мүгедек болып қалған. Фтордың Жер қыртысындағы салмақ мөлшелері 6,25°10–2%, әр түрлі тау жыныстары мен тұзды құмдар құрамында шашыраңқы түрде кездеседі. Оның маңызды қосылыстарына: флюорит, криолит, топаз жатады. Фтордың ерігіш қосылыстары суда (өзен суында 0,00002%, мұхит суында 0,0001%), Са5(РО4)3F қосылысы организмдердің тісі мен сүйегінде (0,02%) болады. Қалыпты жағдайда Фтор солғын сары түсті, өткір иісті, улы газ, балқу t –219,61°С, қайнау t =188°С. Фтор молекуласы екі атомнан тұрады (F2). Тотығу дәрежесі –1, өте активті, қалыпты температураның өзінде көптеген элементтермен, оның ішінде азот және ауыр инертті газдармен (He, Ne, Ar-нан басқа) әрекеттесіп, фторидтер түзеді. Фтордың маңызды қосылысы фторсутек, судағы ерітіндісі фторсутек қышқылы деп аталады (қ. Фтор қосылыстары). Фтор органикалық заттармен әрекеттесіп, фтор-органикалық қосылыстар түзеді. Фторды балқытылған фторидтерін немесе фторлы сутекті электролиздеу арқылы алады. Ол фтор - органикалық қосылыс синтезінде фторлаушы реагент ретінде, т.б. пайдаланады. Фтор — өсімдіктер мен жануарлар организмінің тұрақты құрамдас бөлігі.
Слайд 3Физикалық қасиеті
F2 - жасылтым-сары түсті, өткір иісті, өте улы газ, -181,1°С-да сұйық,
Химиялық қасиеттері. Фтор бос күйінде өте белсенді бейметалл, инертті газдардың ішінде гелий, неон, аргоннан басқа заттардың барлығымен әрекеттеседі. Электртерістілігі жоғары элементтердің бірі оттек (3,5) фтормен қосылысында оң тотығу дәрежесін көрсетеді. 0+2F2 (оттектің фториді).
Кейбір жай заттармен әрекеттесуінің реакция теңдеулерін келтірейік:
F2 + Н2 = 2НF фторлы сутек
Фтор сутегімен тіпті караңғыда да шабытты әрекеттеседі. Металдармен әрекеттесіп фторидтер түзеді.
Ғ2 + 2Li= 2LiF литий фториді
Ғ2 + Cu = CuF2 мыс (II) фториді
Бұл реакциялар осы заттардың (Li, Cu) оттегімен және хлормен жүретін реакцияларына қарағанда шабыттырақ өтеді.
Слайд 4Химиялық қасиеті
Фторлы сутек (НҒ), бұл суда жақсы еритін зат, судағы ерітіндісі
4НҒ +Si02 = SiF4+ 2Н20
Сондықтан бұл қышкылды шыны ыдыста сақтауға болмайды, ол үшін полиэтиленнен жасалған ыдыстар қолданылады.
Фтордың грекше аты «фторос» - бүлдіру деген мағынаны білдіреді, ол өте агрессивті газ. Фторды бос күйінде алуға тырысқан көптеген ғалымдар оның осы қасиетінен зардап шекті. Фторды 1886 ж. Г. Муассон ашты, алғаш рет оны бос күйінде алды. Фтор бос күйінде белінуі үшін мына үдеріс жүру керек:
Ғ- - е -->Ғ0