- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фосфор и его соединения презентация
Содержание
- 1. Фосфор и его соединения
- 2. Открытие фосфора Гамбургский алхимик Хеннинг Бранд
- 3. период Фосфор как химический элемент группа
- 4. период Фосфор как химический элемент III группа
- 5. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ Р БЕЛЫЙ КРАСНЫЙ ЧЕРНЫЙ Сравните физические свойства АЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
- 6. Молекулы P4 имеют форму
- 7. Существует несколько форм красного
- 8. Черный фосфор имеет слоистую
- 9. С металлами:
- 10. с бертолетовой солью при ударе взрывается,
- 11. Р ОРГАНИЗМЫ МИНЕРАЛЫ ФОСФОЛИПИДЫ, ФЕРМЕНТЫ,
- 12. Оксиды фосфора
- 13. Свойства ортофосфорной кислоты Н3РО4 Металлы до Н
- 14. Фосфорная кислота и её свойства
- 15. Качественная реакция на фосфат ион- ионы серебра
- 16. Физиологическое действие белого фосфора Результат применения
- 17. нагреванием смеси фосфорита, угля и песка
- 18. ПРИМЕНЕНИЕ ФОСФОРА Р Удобрения Ядохимикаты
- 19. Войска США использовали фосфорные Бомбы в Ираке, 2004 г.
- 20. 2. Задача: Какова масса фосфора в вашем
- 21. ДОМАШНЕЕ ЗАДАНИЕ Индивидуальные задания.
Слайд 2Открытие фосфора
Гамбургский алхимик
Хеннинг Бранд
1669 год
«Фосфор» -
от греческого «светоносный»
Слайд 3период
Фосфор как химический элемент
группа
валентных электронов
степени окисления
высший оксид
водородное соединение
Слайд 4период
Фосфор как химический элемент
III
группа
VА
валентных электронов
5
степени окисления
-3, +3, +5
высший оксид
Р2О5
водородное соединение
РН3
Слайд 5
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ
Р
БЕЛЫЙ
КРАСНЫЙ
ЧЕРНЫЙ
Сравните физические свойства
АЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
Слайд 6
Молекулы P4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44,1оС, t(кип)=275оС,
БЕЛЫЙ ФОСФОР
Слайд 7
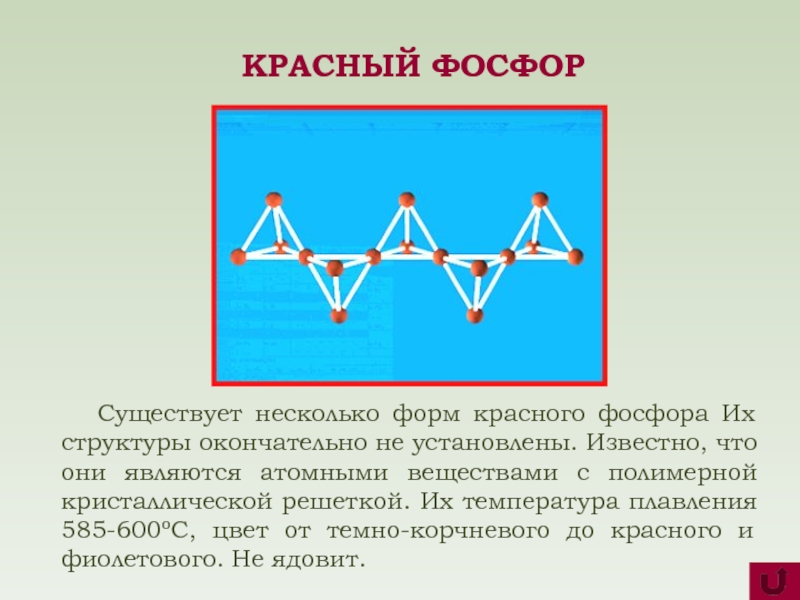
Существует несколько форм красного фосфора Их структуры окончательно не
КРАСНЫЙ ФОСФОР
Слайд 8
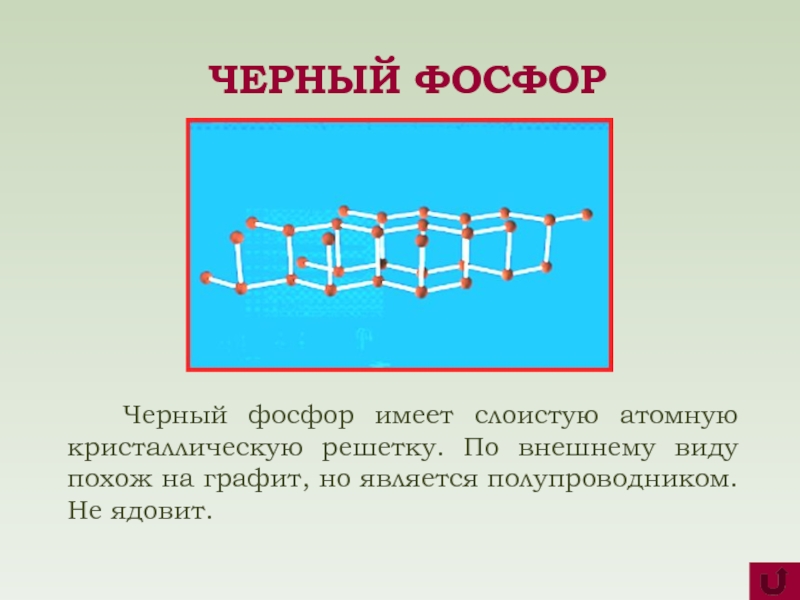
Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему
ЧЕРНЫЙ ФОСФОР
Слайд 11
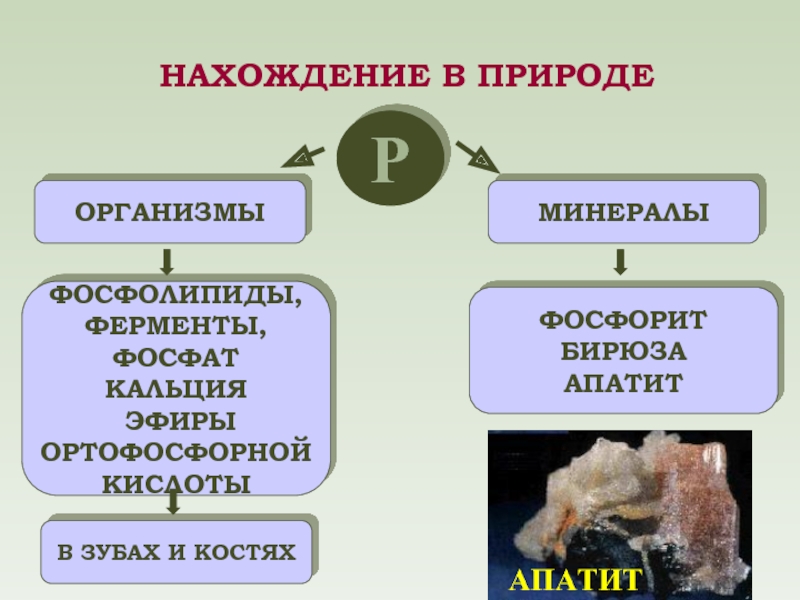
Р
ОРГАНИЗМЫ
МИНЕРАЛЫ
ФОСФОЛИПИДЫ,
ФЕРМЕНТЫ,
ФОСФАТ КАЛЬЦИЯ
ЭФИРЫ
ОРТОФОСФОРНОЙ
КИСЛОТЫ
В ЗУБАХ И КОСТЯХ
ФОСФОРИТ
БИРЮЗА
АПАТИТ
НАХОЖДЕНИЕ В ПРИРОДЕ
АПАТИТ
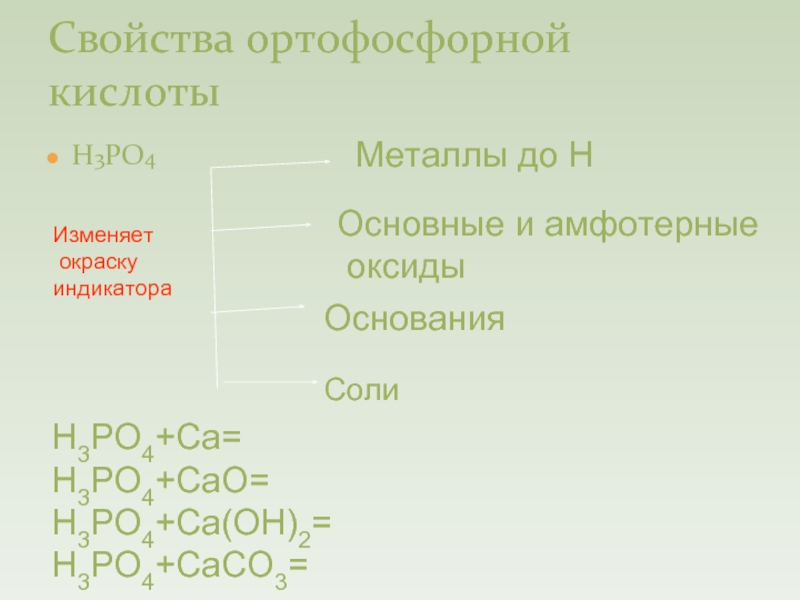
Слайд 13Свойства ортофосфорной кислоты
Н3РО4
Металлы до Н
Основные и амфотерные
оксиды
Основания
Соли
Н3РО4+Са=
Н3РО4+СаО=
Н3РО4+Са(ОН)2=
Н3РО4+СаСО3=
Изменяет
окраску
индикатора
Слайд 15Качественная реакция на фосфат ион- ионы серебра
K3PO4+3AgNO3=Ag3PO4↓+3KNO3
при этом выпадает жёлтый
Слайд 16Физиологическое действие
белого фосфора
Результат применения чрезмерного количества фосфора
Появление лягушек с
Фосфорный некроз – поражение челюстей
Слайд 17нагреванием смеси фосфорита, угля и
песка в электропечи:
Ca3(PO4)2 + C +
Получение фосфора
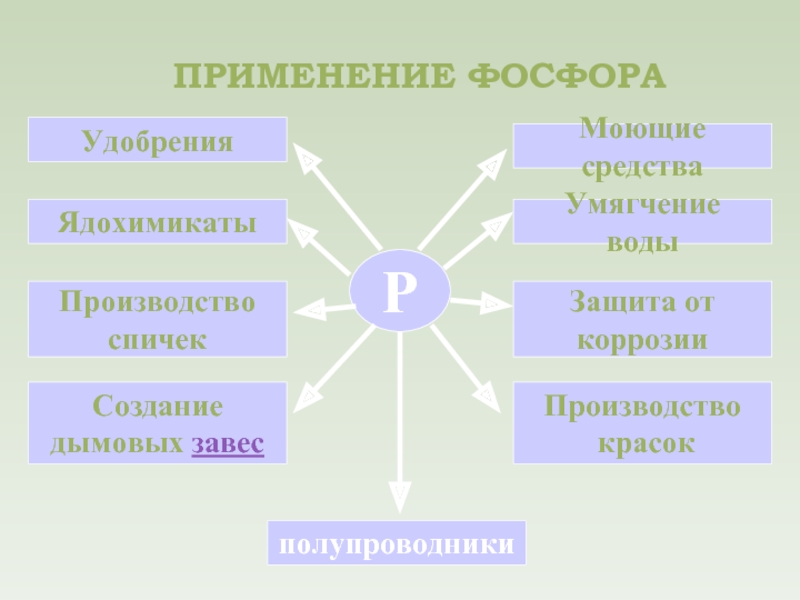
Слайд 18ПРИМЕНЕНИЕ ФОСФОРА
Р
Удобрения
Ядохимикаты
Производство
спичек
Создание
дымовых завес
полупроводники
Производство
красок
Защита от
коррозии
Умягчение воды
Моющие
Слайд 202. Задача:
Какова масса фосфора в вашем теле, если известно, что фосфор
Самостоятельная работа
1.ЗАКОНЧИТЕ УРАВНЕНИЯ:
Р + F2 =
Al + P =
Укажите окислитель и восстановитель
3.Осуществите превращения:
Р РН3 Р2О5 Н3РО4