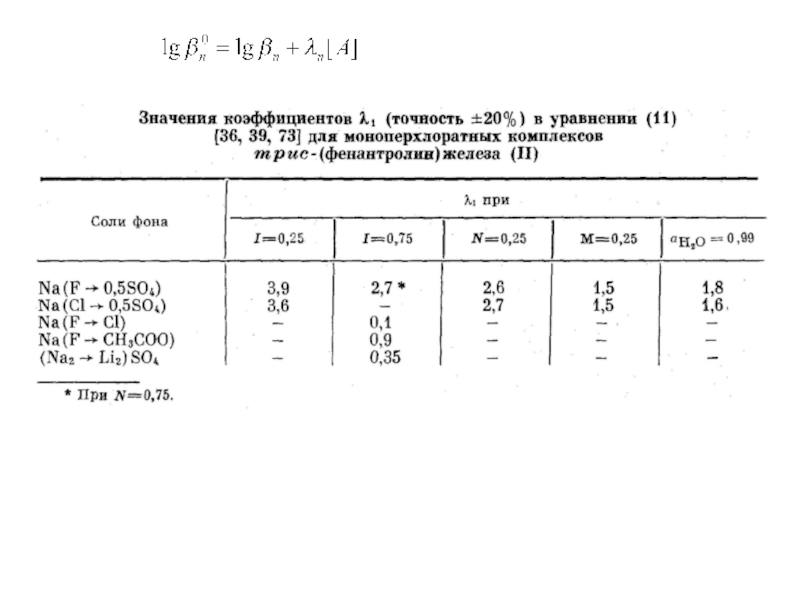
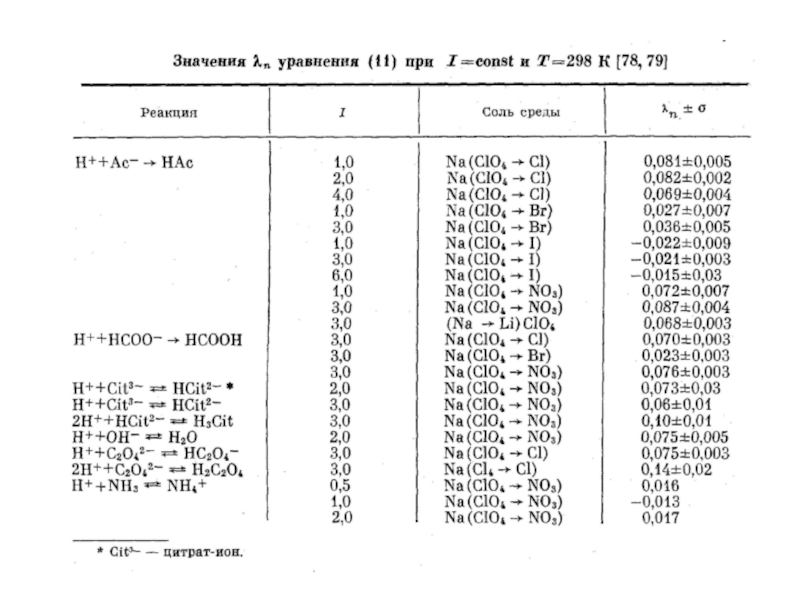
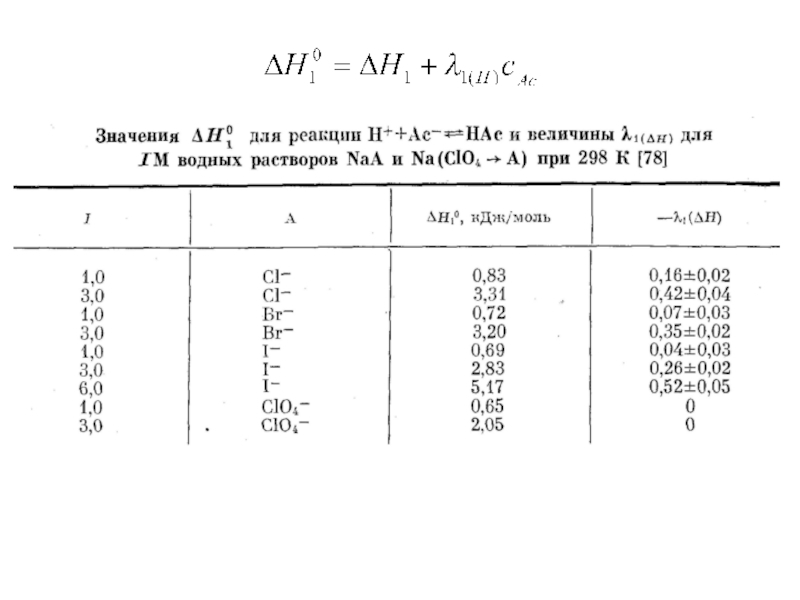
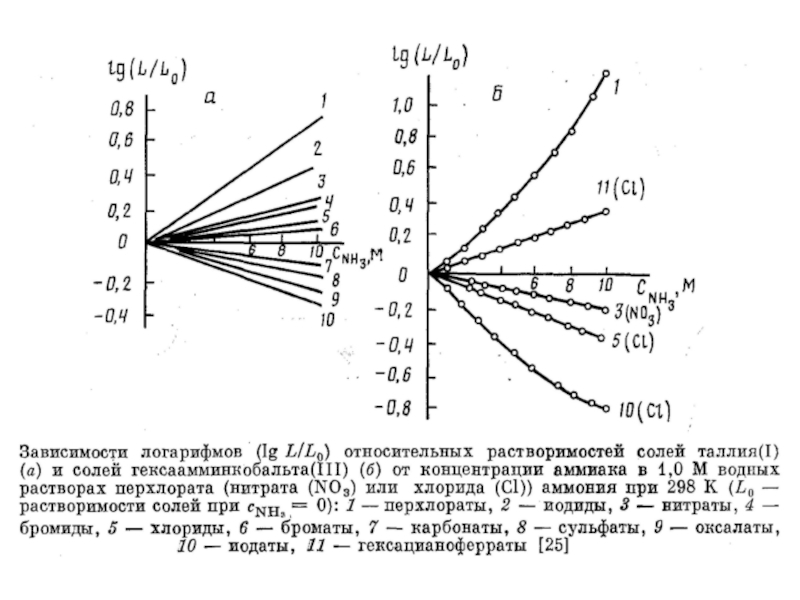
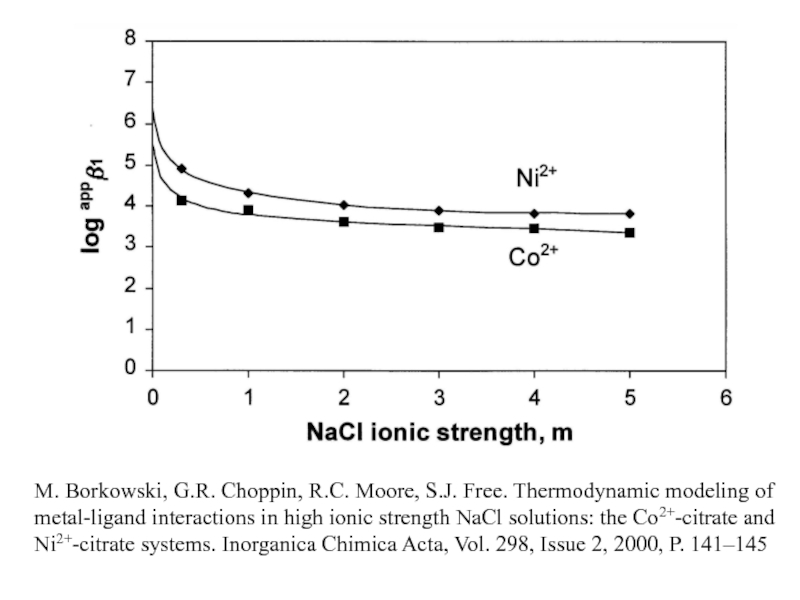
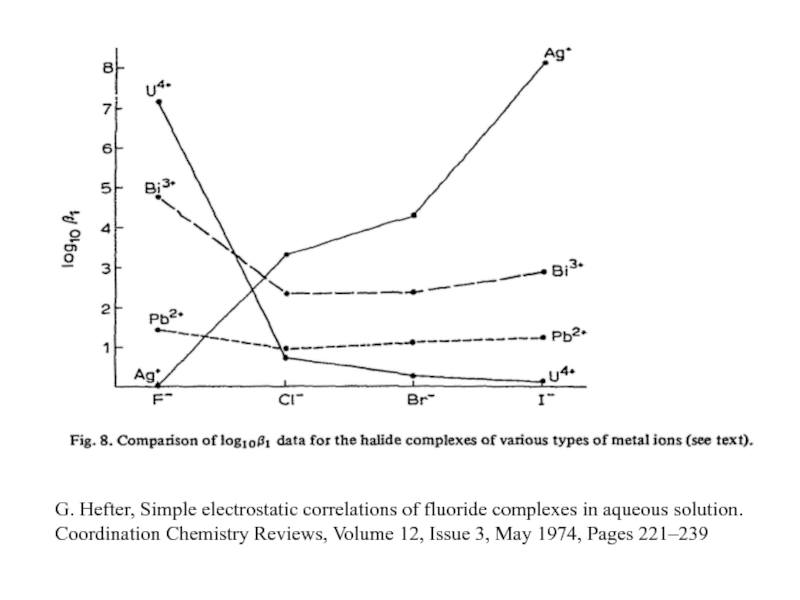
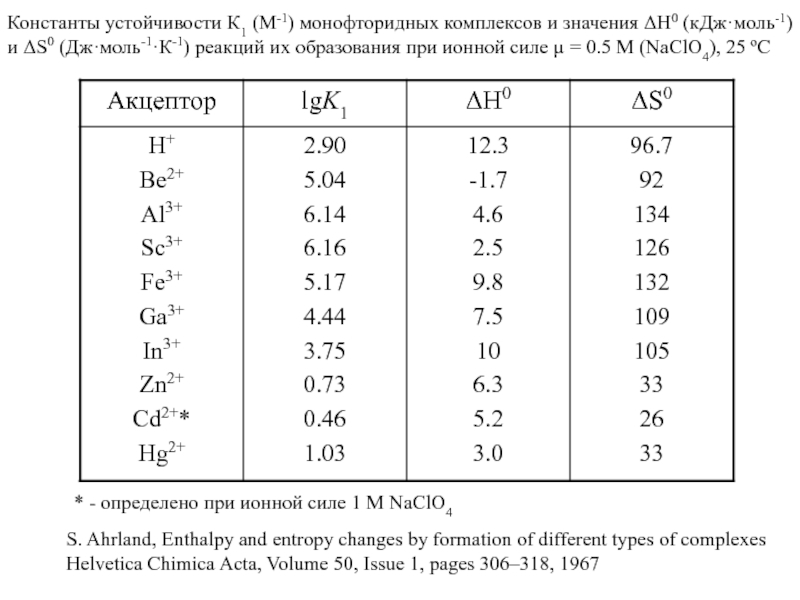
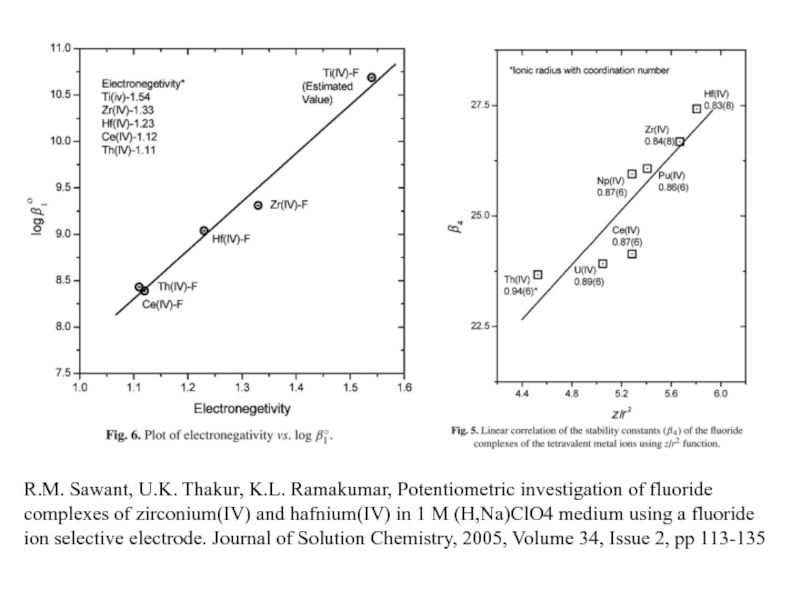
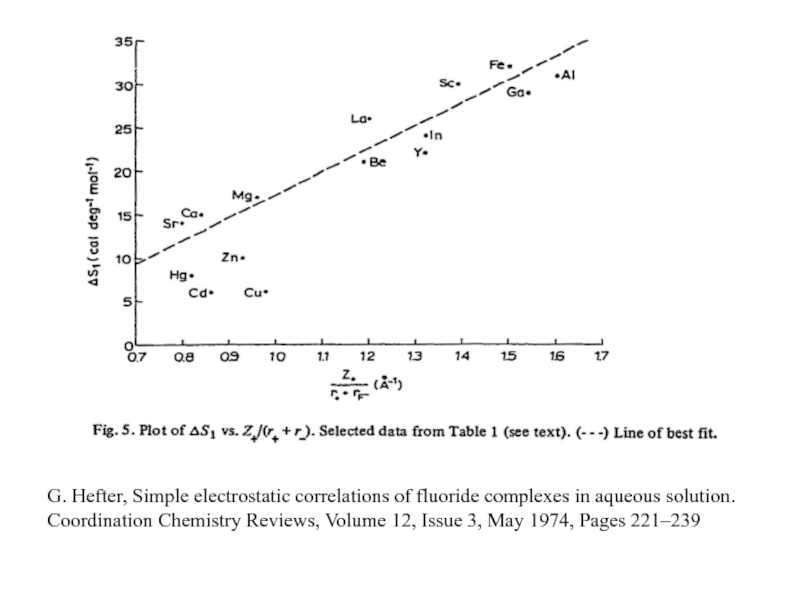
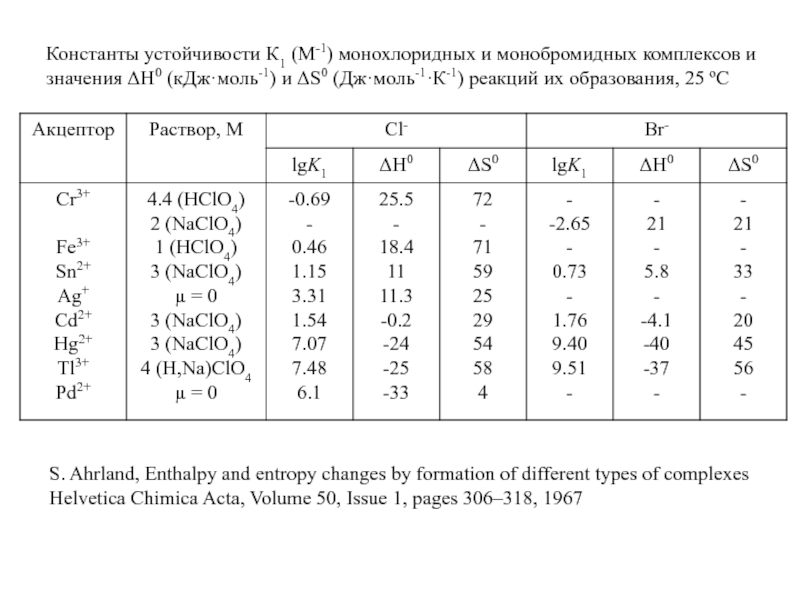
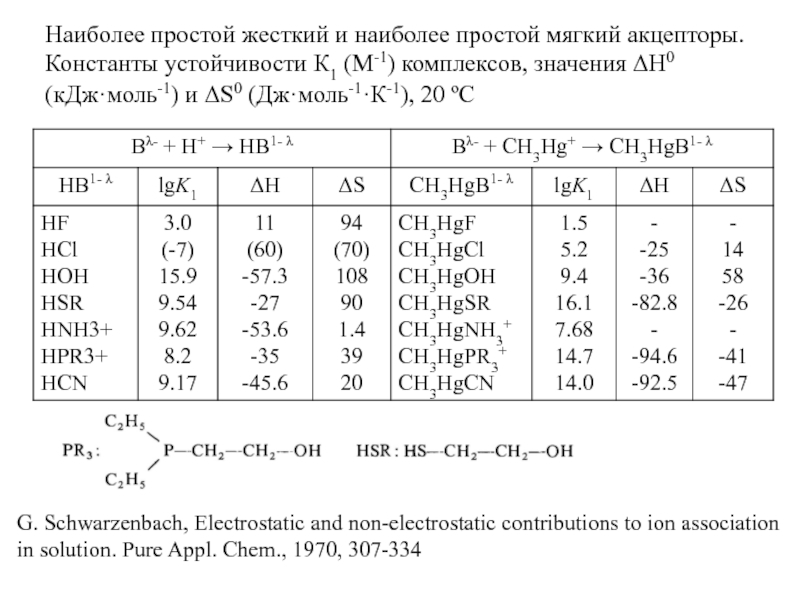
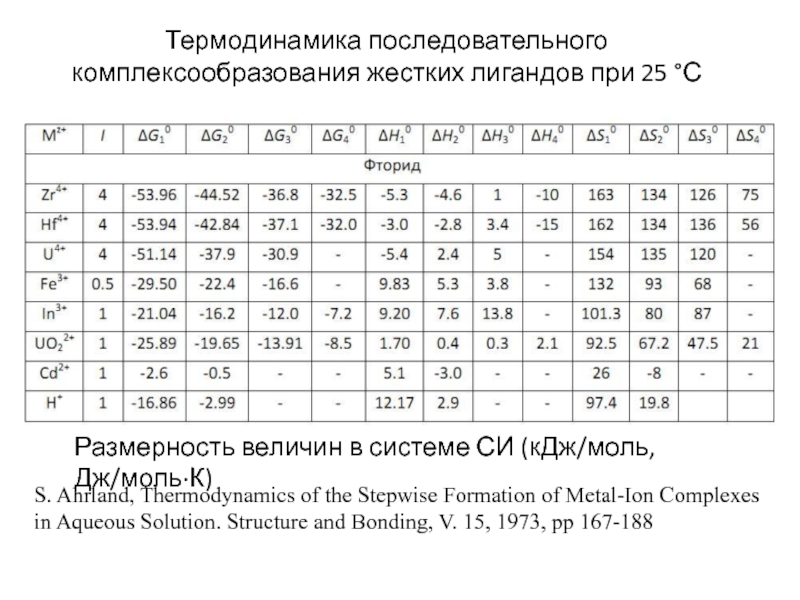
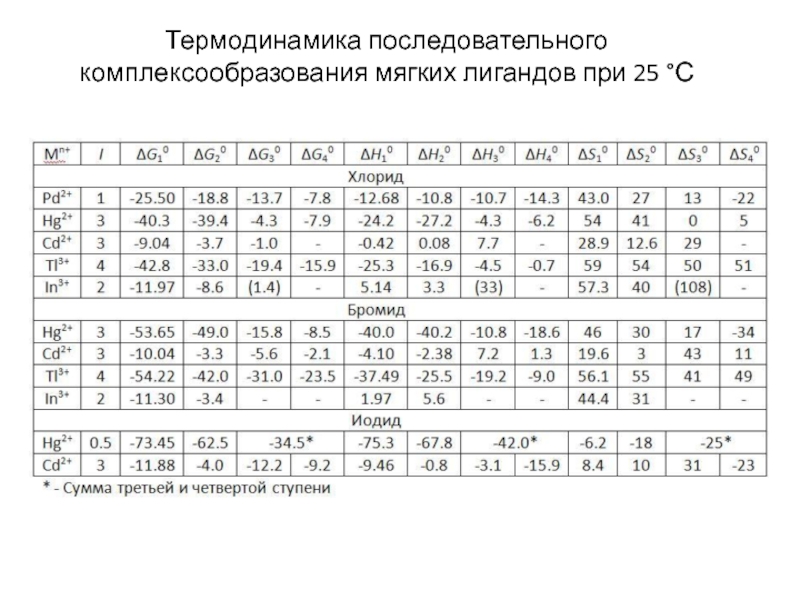
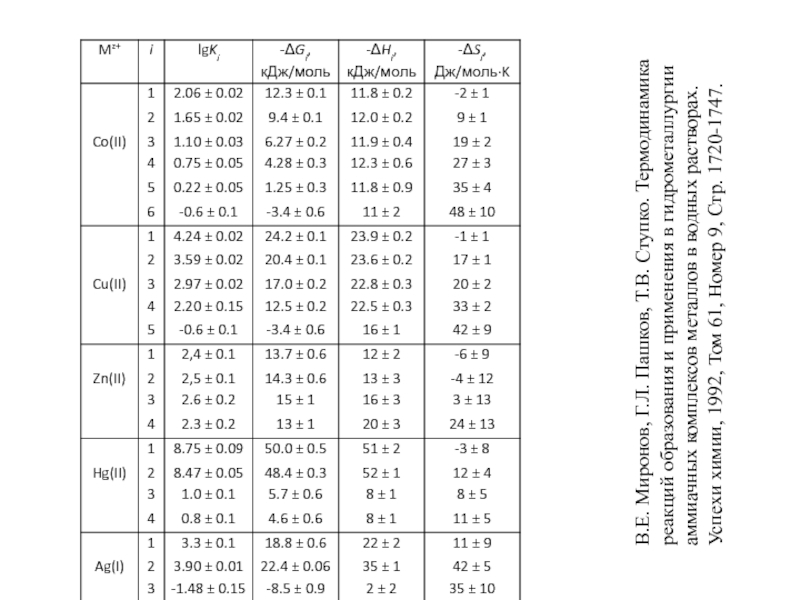
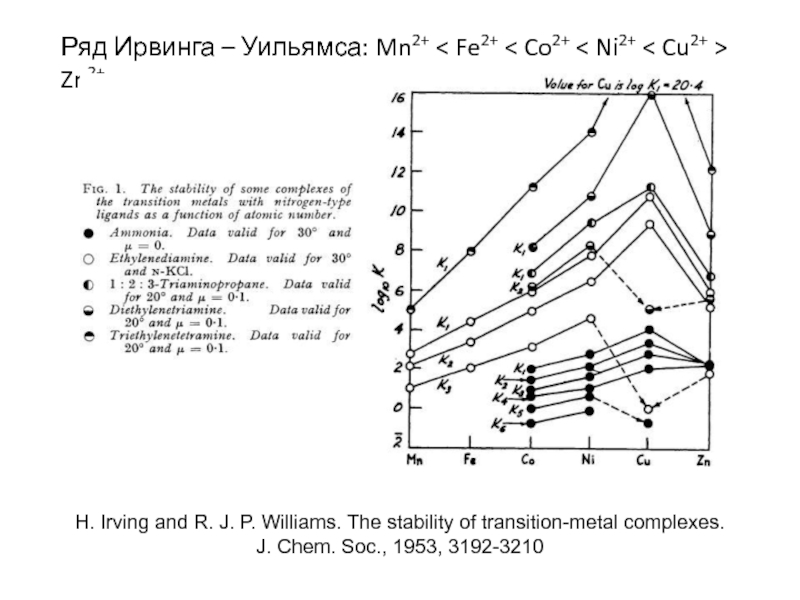
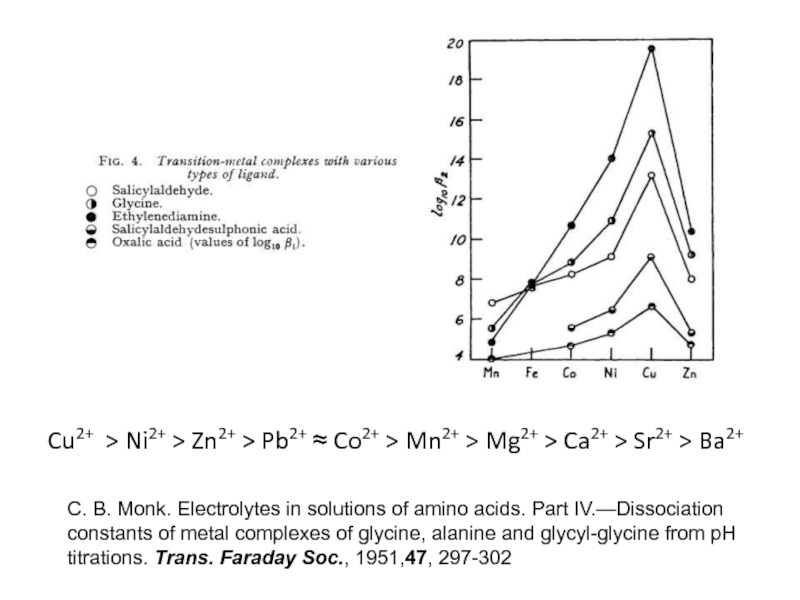
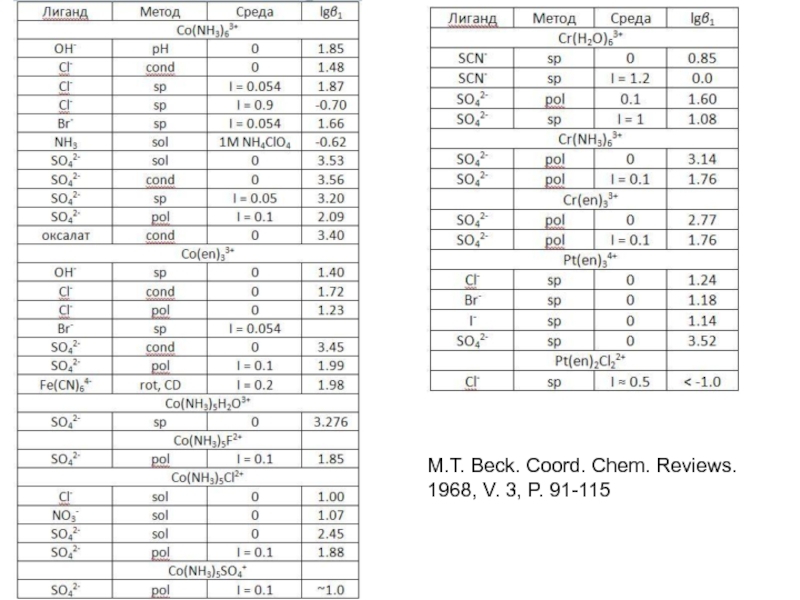
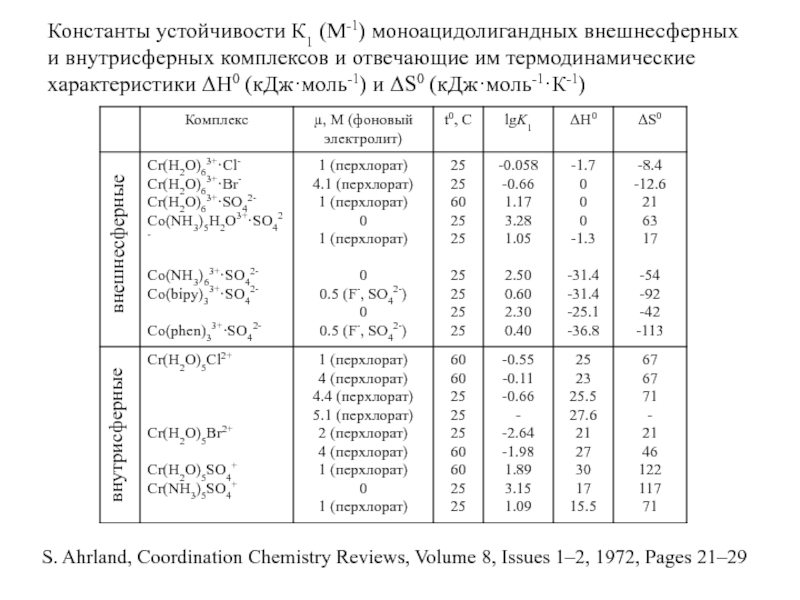
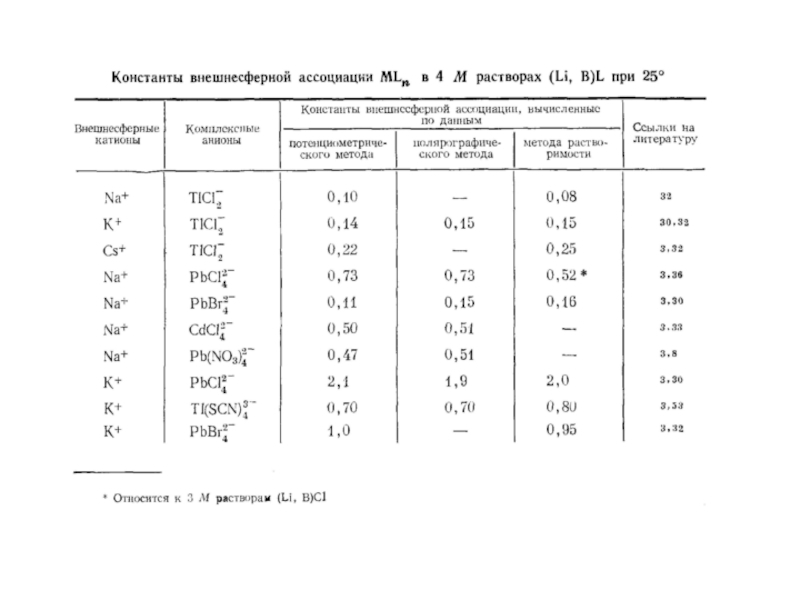
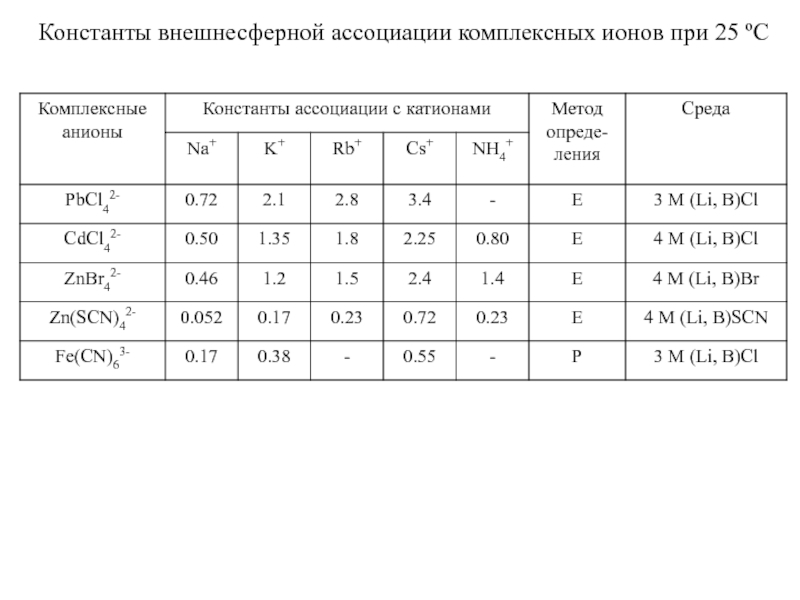
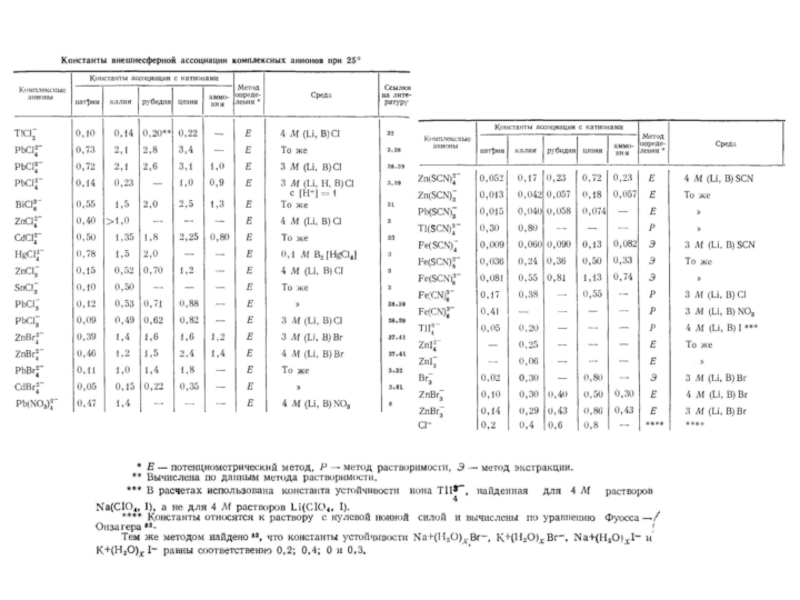
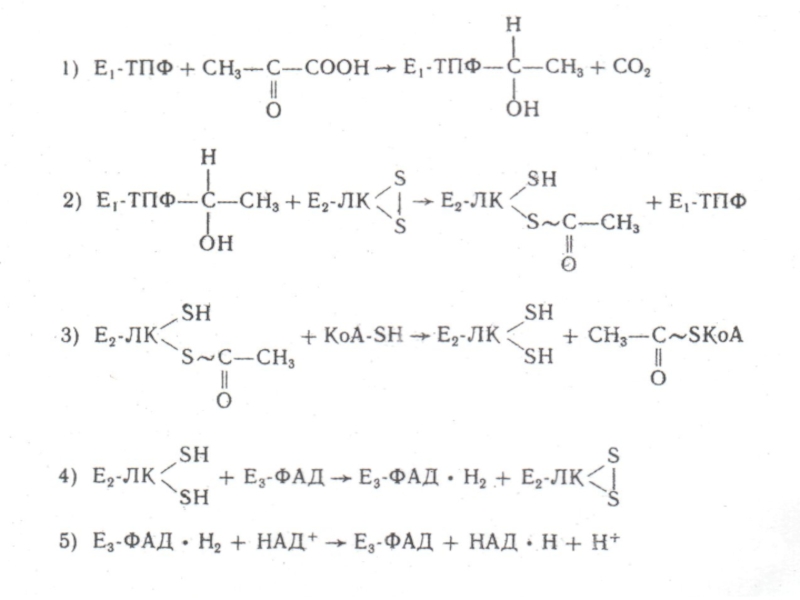
Миронов В.Е., Федоров В.И., Исаев И.Д. Образование слабых комплексов ионами металлов в водных растворах. Успехи химии, 1991, 60, № 6, 1128-1154
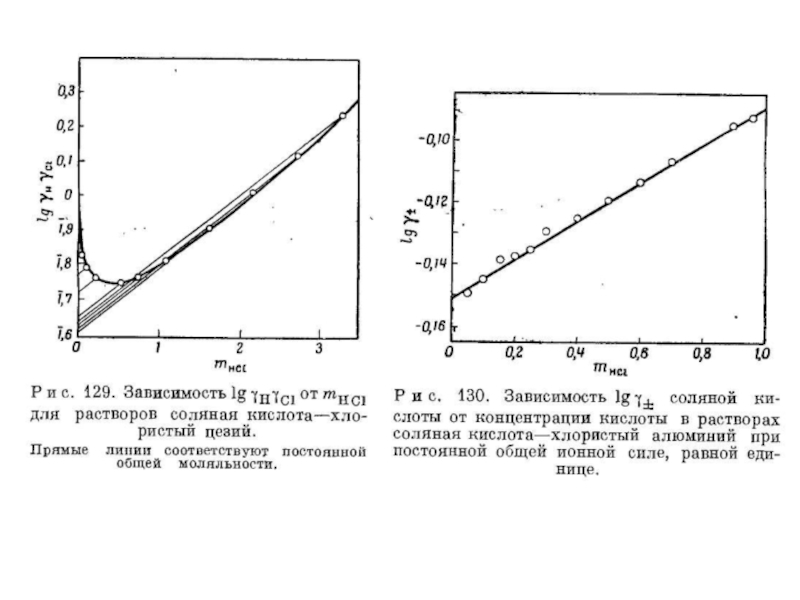
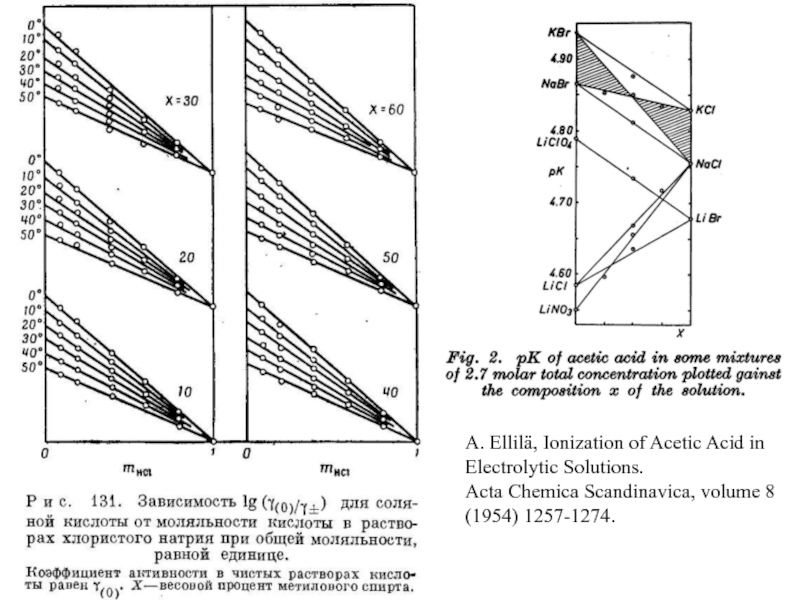
H2 | HCl(m1), MClx(m2) | AgCl | Ag
Г. Харнед, Б. Оуэн. Физическая химия растворов электролитов. М: ИИЛ. 1952.