- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферменты. Часть I презентация
Содержание
- 1. Ферменты. Часть I
- 2. План Определение понятия фермент. Биохимическая природа ферментов.
- 3. Классификация ферментов В 1861 году комиссия по
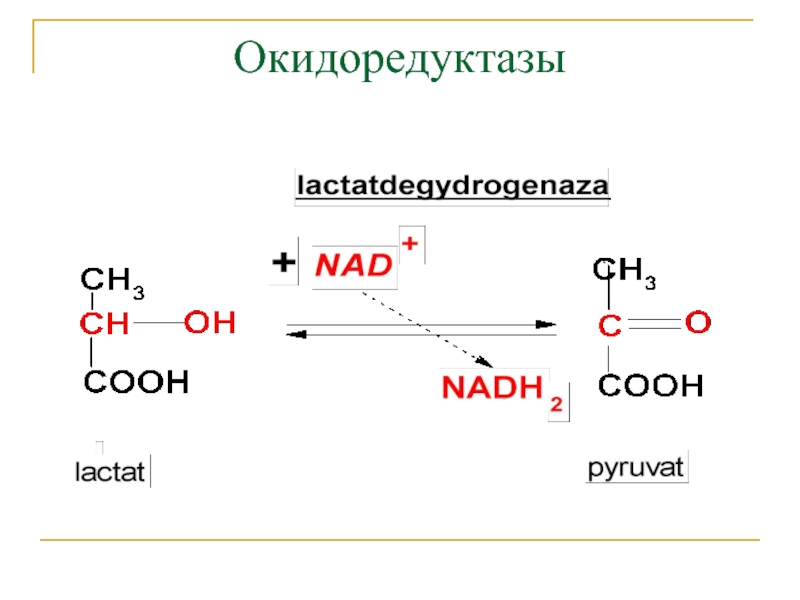
- 4. Окидоредуктазы
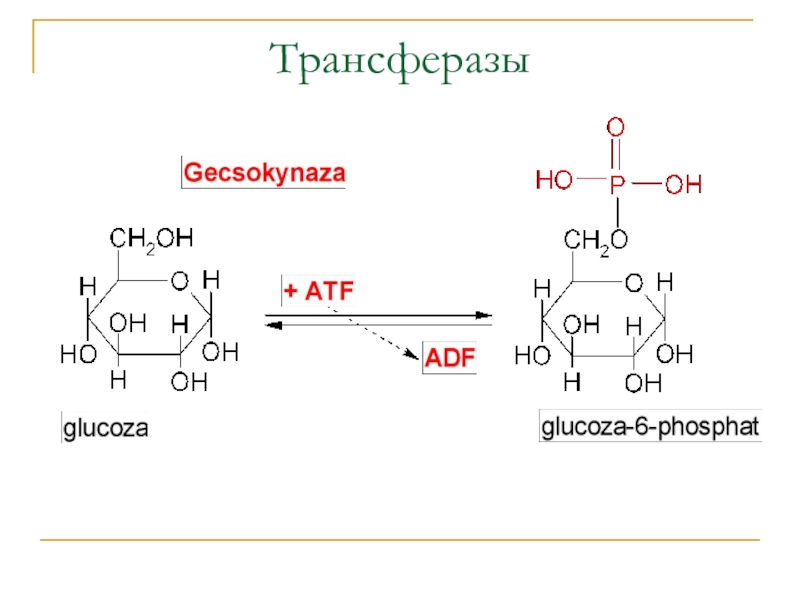
- 5. Трансферазы
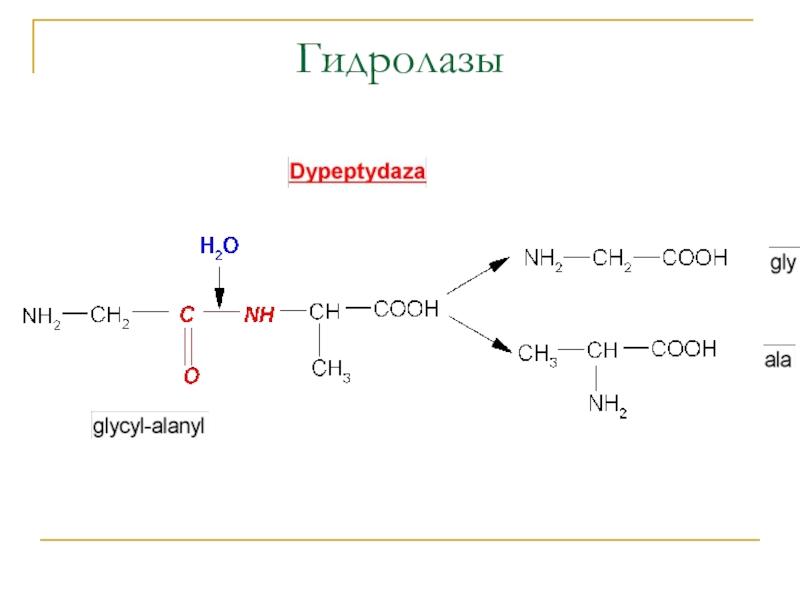
- 6. Гидролазы
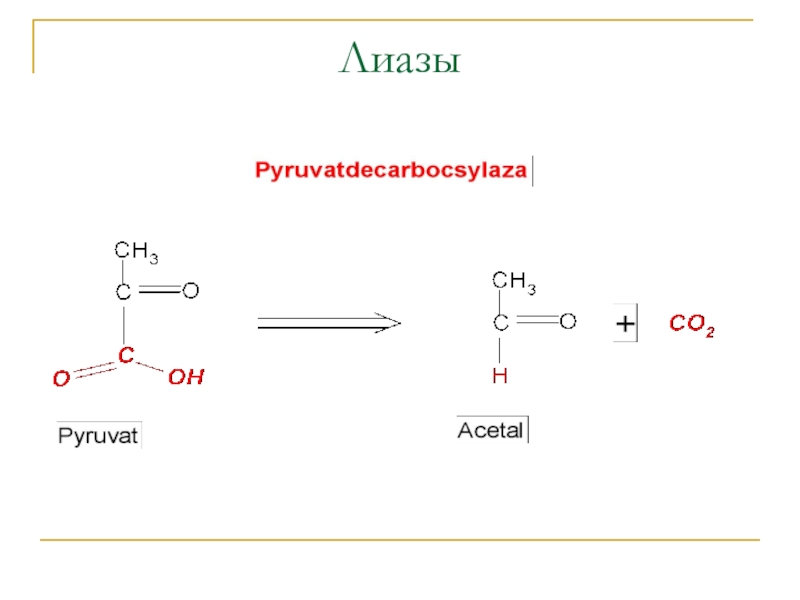
- 7. Лиазы
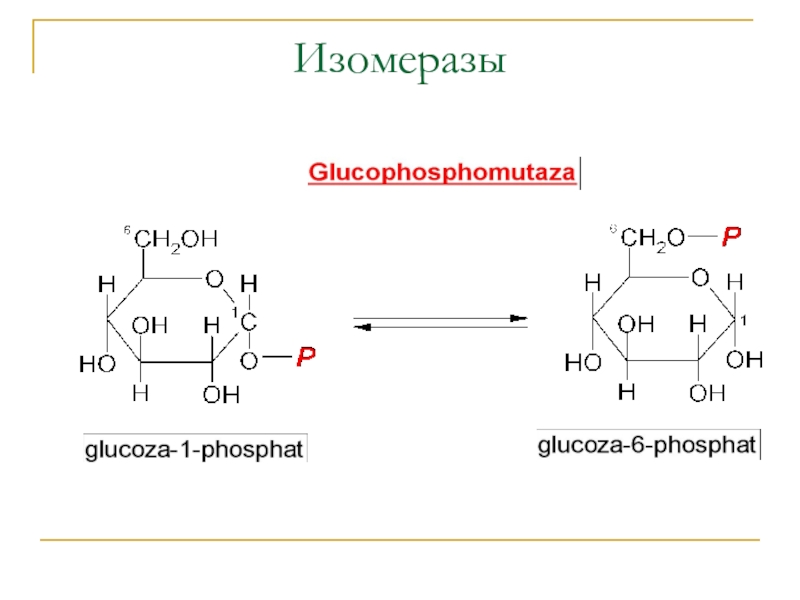
- 8. Изомеразы
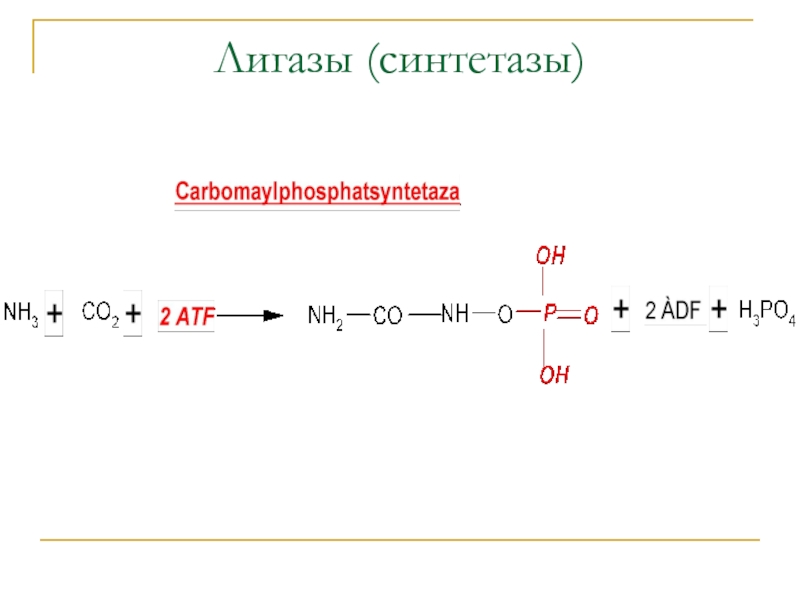
- 9. Лигазы (синтетазы)
- 10. Кинетика ферментативной реакции Уравнение ферментативной реакции и
- 11. Уравнение односубстратной необратимой ферментной реакции
- 12. Уравнение Михаэлиса-Ментен V -
- 13. Концентрация субстрата Скорость max скорость Кm График ферментативной реакции
- 14. Единицы ферментативной активности КАТАЛ - это количество
- 15. Строение ферментов По химическому составу ферменты делят
- 16. Коферменты Коферменты делятся на: Кофакторы - небелковая
- 17. Апофермент На глобуле апофермента можно выделить несколько
- 18. Субстратный центр Субстратный центр (якорный центр) –
- 19. Каталитический центр Место на глобуле апофермента где
- 20. Аллостерический центр АЛЛОСТЕРИЧЕСКИМИ ЦЕНТРАМИ называют такие участки
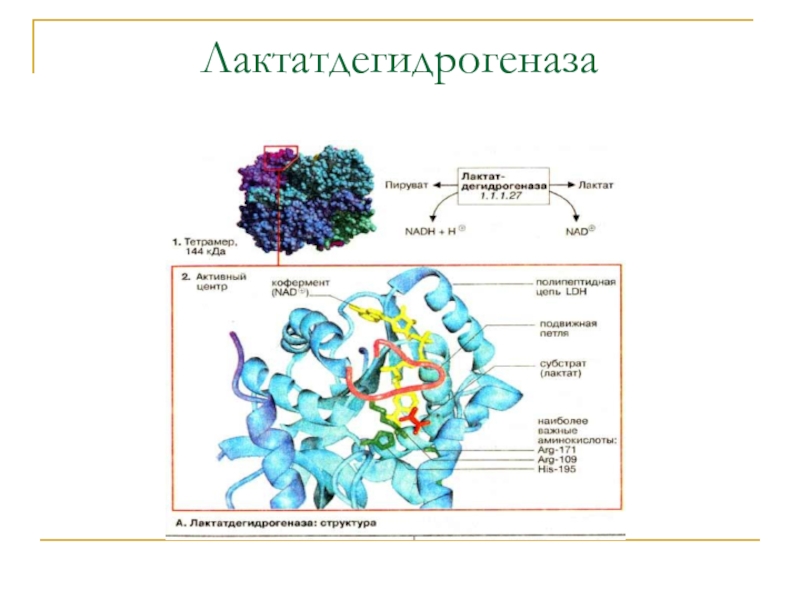
- 21. Лактатдегидрогеназа
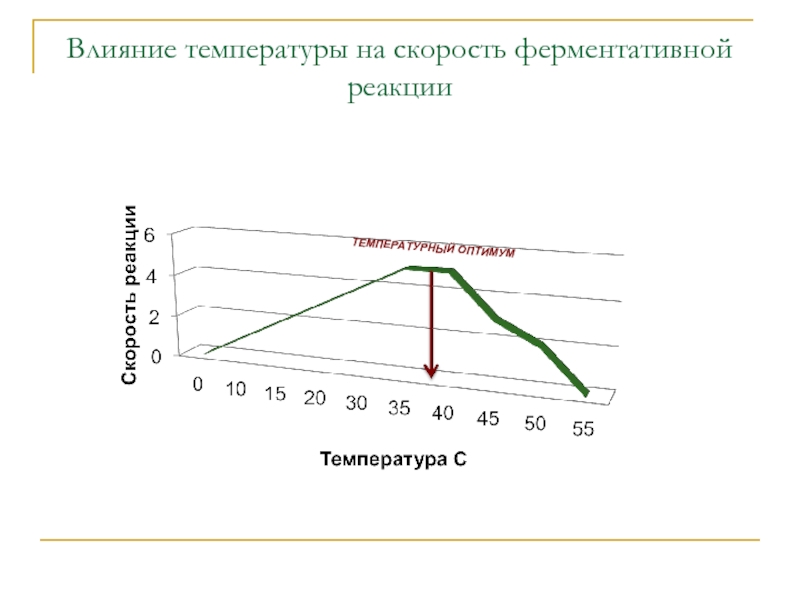
- 22. Влияние температуры на скорость ферментативной реакции ТЕМПЕРАТУРНЫЙ ОПТИМУМ
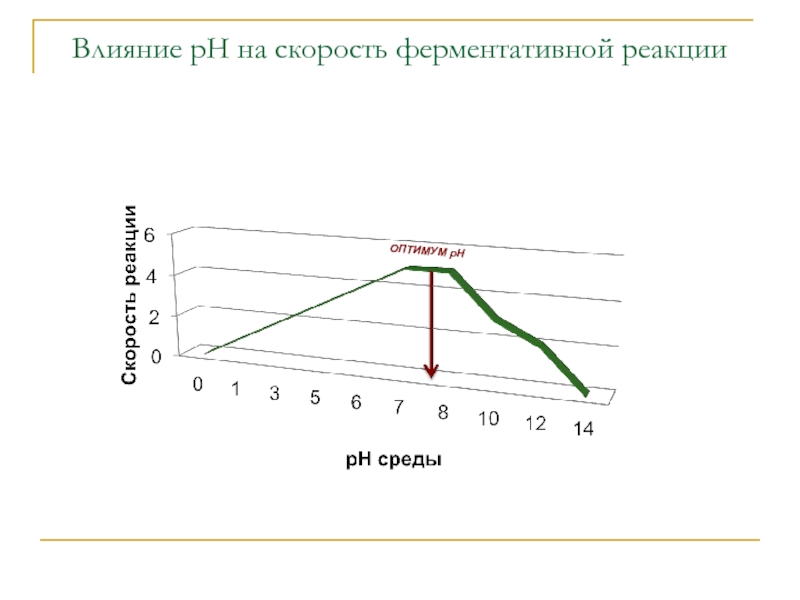
- 23. Влияние рН на скорость ферментативной реакции ОПТИМУМ рН
Слайд 2План
Определение понятия фермент. Биохимическая природа ферментов. Функции ферментов в живом организме.
Специфические черты биологического катализа.
Классификация ферментов.
Уравнение скорости ферментативной реакции. Константы ферментативной реакции Км и Vмах. Единицы ферментативной активности.
Активный центр. Факторы ферментативного катализа.
Влияние условий среды на скорость ферментативной реакции
Классификация ферментов.
Уравнение скорости ферментативной реакции. Константы ферментативной реакции Км и Vмах. Единицы ферментативной активности.
Активный центр. Факторы ферментативного катализа.
Влияние условий среды на скорость ферментативной реакции
Слайд 3Классификация ферментов
В 1861 году комиссия по ферментам Международного биохимического союза приняла
принципы систематизации и номенклатуры ферментов, в основе которой лежат типы химических реакций, которые ими катализируются.
Различают шесть классов ферментов.
Различают шесть классов ферментов.
Слайд 10Кинетика ферментативной реакции
Уравнение ферментативной реакции и вывод скорости ферментативной реакции для
односубстратной необратимой ферментативной реакции с одним продуктом и лимитирующей стадией распада фермент-субстратного комплекса было впервые предложено Леонором Михаэлисом и Мод Ментен в 1913 году.
Слайд 12Уравнение Михаэлиса-Ментен
V - скорость ферментативной реакции
Vmax - максимальная скорость реакции
[S] -концентрация
субстрата
Кm - константа Михаэлиса, такая концентрация субстрата, при которой скорость реакции равна половине максимальной скорости
Кm - константа Михаэлиса, такая концентрация субстрата, при которой скорость реакции равна половине максимальной скорости
Слайд 14Единицы ферментативной активности
КАТАЛ - это количество фермента, которое обеспечивает превращение 1
моля субстрата за 1 секунду.
ЮНИТ - это количество фермента, которое превращает 1 мкмоль субстрата за 1 минуту. 1 Юнит = 16,67 нкатал
ЮНИТ - это количество фермента, которое превращает 1 мкмоль субстрата за 1 минуту. 1 Юнит = 16,67 нкатал
Слайд 15Строение ферментов
По химическому составу ферменты делят на простые, состоящие только из
полипептидных цепей, и сложные, которые кроме полипептидов содержат компоненты другой природы. В сложных ферментах различают полипептидную часть - апофермент и диссоциирующую непептидную – кофермент. Полный комплекс (апофермент + кофермент= холофермент).
Слайд 16Коферменты
Коферменты делятся на:
Кофакторы - небелковая часть нековалентно связанная с ферментом (можно
отделить)
Простетическая группа - небелковая часть ковалентносвязанная с ферментом (нельзя отделить)
Блокирование аминокислотных радикалов или функциональных групп кофермента путем химической модификации лишает фермент каталитической активности.
Простетическая группа - небелковая часть ковалентносвязанная с ферментом (нельзя отделить)
Блокирование аминокислотных радикалов или функциональных групп кофермента путем химической модификации лишает фермент каталитической активности.
Слайд 17Апофермент
На глобуле апофермента можно выделить несколько центров, выполняющих различные функции:
субстратный центр;
каталитический
центр;
аллостерический центр
аллостерический центр
Слайд 18Субстратный центр
Субстратный центр (якорный центр) – узнавание, захват и удерживание молекулы
субстрата.
В его состав могут входить боковые цепи Aсп, Цис, Глу, Гис, Лиз, Meт, Сер, Трео, а также концевые карбоксильные и амино-группы. Среди этих химических функциональных групп находятся несколько аминокислотных радикалов, взаимодействующих с субстратом и образующих ковалентные и нековалентные ферментные интермедиаты.
В его состав могут входить боковые цепи Aсп, Цис, Глу, Гис, Лиз, Meт, Сер, Трео, а также концевые карбоксильные и амино-группы. Среди этих химических функциональных групп находятся несколько аминокислотных радикалов, взаимодействующих с субстратом и образующих ковалентные и нековалентные ферментные интермедиаты.
Слайд 19Каталитический центр
Место на глобуле апофермента где собственно протекает каталитическая реакция (разрыв
старых связей и образование новых)
В состав активного центра входят аминокислотные остатки, находящиеся в различных отделах полипептидной цепи фермента, но сближенных за счет ее изгиба
Каталитический центр и субстратный центр составляют активный центр фермента
В состав активного центра входят аминокислотные остатки, находящиеся в различных отделах полипептидной цепи фермента, но сближенных за счет ее изгиба
Каталитический центр и субстратный центр составляют активный центр фермента
Слайд 20Аллостерический центр
АЛЛОСТЕРИЧЕСКИМИ ЦЕНТРАМИ называют такие участки молекулы фермента вне его активного
центра, которые способны связываться СЛАБЫМИ ТИПАМИ СВЯЗЕЙ (значит - обратимо) с тем или иным веществом (лигандом). Причем такое связывание приводит к такой конформационной перестройке молекулы фермента, которая распространяется и на активный центр, облегчая, либо затрудняя (замедляя) его работу.





![Уравнение Михаэлиса-МентенV - скорость ферментативной реакцииVmax - максимальная скорость реакции[S] -концентрация субстратаКm - константа Михаэлиса,](/img/tmb/3/210909/e9ff790fba7525884ce63ff9e23745ac-800x.jpg)