- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фазовое равновесие презентация
Содержание
- 1. Фазовое равновесие
- 2. Определение Фазу определяют как состояние материи, которое
- 3. Равновесие перехода вещества из одной фазы в
- 4. Фазовое равновесие является динамическим, т.е. скорость
- 5. Правило фаз. Согласно правилу фаз, числа
- 6. Компонент — это однородная по химическим свойствам
- 7. Например, система из аммиака, хлороводорода и хлорида
- 8. Числом степеней свободы С называется число внешних
- 9. Правило справедливо при соблюдении следующих условий: фазы
- 10. С = О (безвариантная система) определяет возможное
- 11. Для изучения фазового равновесия в термодинамических системах
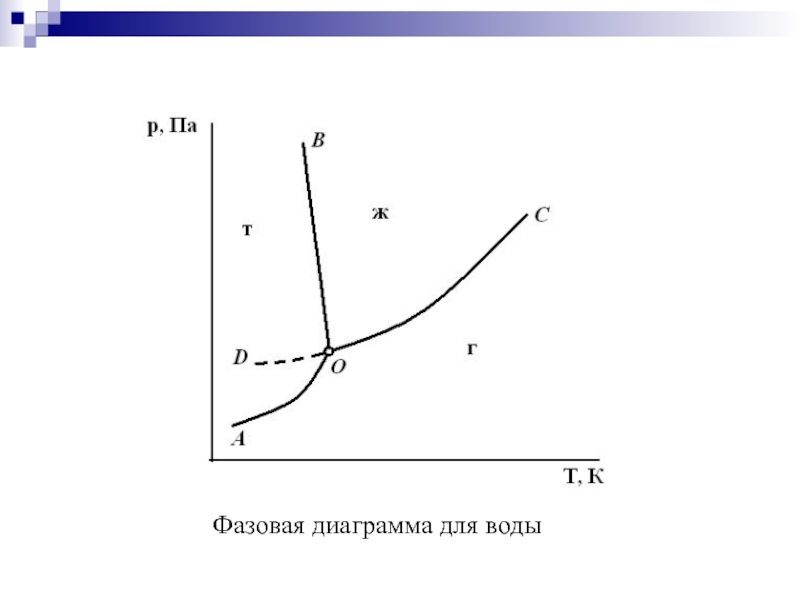
- 12. Фазовая диаграмма для воды
- 13. Линия АО называется линией сублимации (возгонки); Линия
- 14. Для определения фазового состава сплава, знание которого
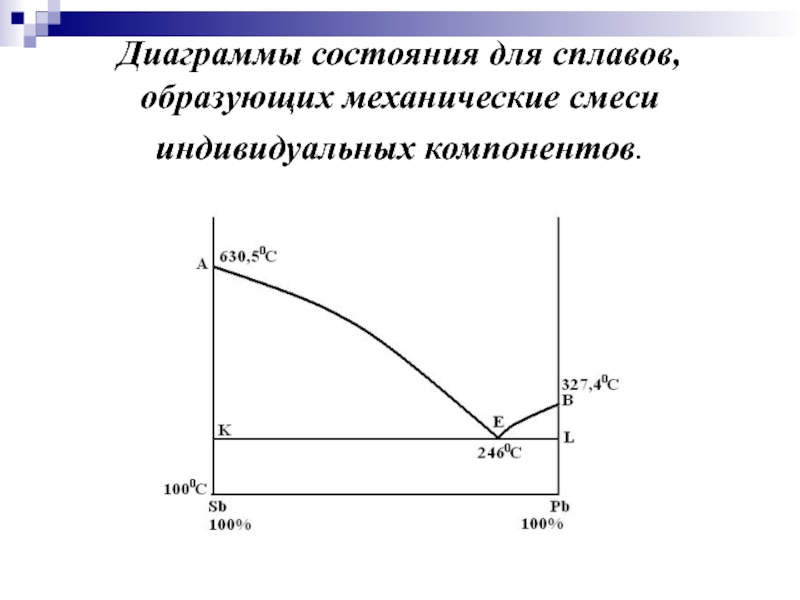
- 15. Диаграммы состояния для сплавов, образующих механические смеси индивидуальных компонентов.
- 16. Линия AEB на диаграмме называется линией ликвидуса
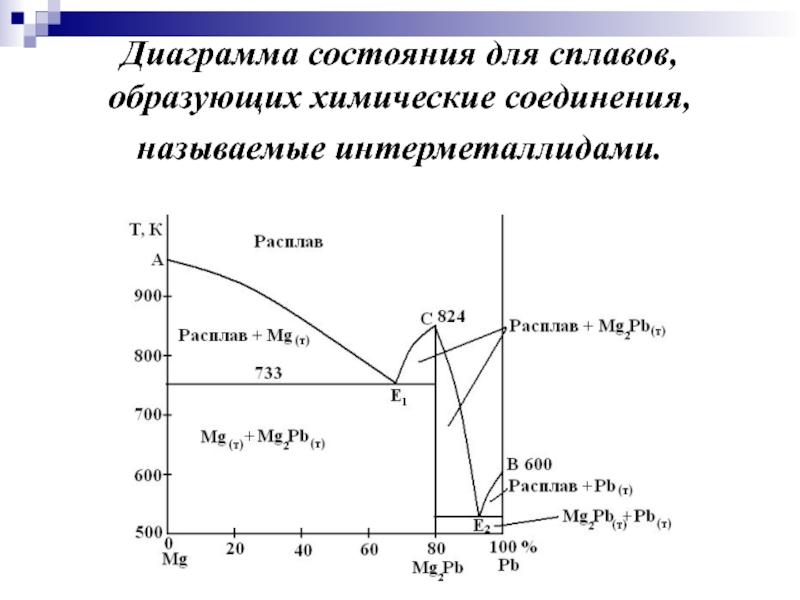
- 17. Диаграмма состояния для сплавов, образующих химические соединения, называемые интерметаллидами.
- 18. ТЕРМОДИНАМИКА ПРОЦЕССА РАСТВОРЕНИЯ
- 19. Основные положения Растворение – это физико-химический процесс.
- 20. Теплотой или энтальпией растворения – называется
- 21. Что происходит при растворении? а) разрушение структуры
- 22. б) гидратация ΔНгидр
- 23. в) ΔHраст = ΔHфп + ΔНгидр Если ΔHфп > ΔНгидр – то процесс эндотермический, Если ΔHфп
- 24. Энтропия растворения Энтропия растворения твердых и
- 25. Энергия Гиббса ΔGраств=ΔНраств+Т·ΔSраств ΔGраств
- 26. Насыщенный раствор – это раствор который находится в равновесии с растворяющимся веществом.
- 27. ИДЕАЛЬНЫЕ РАСТВОРЫ. Закон Рауля
- 28. Идеальные растворы – это такие растворы,
- 29. В идеальных растворах частицы растворенного вещества
- 30. Разбавленные растворы приближаются к идеальным. Из
- 31. Растворы не проводящие электрический ток называются
- 32. Некоторые физические свойства растворов неэлектролитов зависят
- 33. К коллигативным свойствам относятся следующие:
- 34. 1. Понижение давления паров растворителя над раствором
- 35. Р0 – давление насыщенного пара над
- 36. 2а. Повышение температуры кипения Второй закон Рауля:
- 37. Екип – это моляльная константа повышения
- 38. 2б. Понижение температуры затвердевания растворов Второй
- 39. Кзатв – это моляльная константа понижения температуры затвердевания или криоскопическая константа (длярастворителя).
- 40. ПРИМЕР Вычислить температуру затвердевания раствора состоящего из
- 41. 3. Осмотическое давление Раствор представляет собой однородную
- 42. Молекулы растворителя и растворенного вещества будут
- 43. Однако диффузия бывает односторонней, если растворы
- 44. Для количественной характеристики осмотических свойств вводится
- 45. Вант –Гофф предложил, что для осмотического
- 46. СМ – молярная концентрация раствора. Растворы с одинаковым осмотическим давлением называются изотоническими.
- 47. ПРИМЕР: Вычислить осмотическое давление при 270 С
Слайд 2Определение
Фазу определяют как состояние материи, которое «повсюду однородно не только по
Слайд 3Равновесие перехода вещества из одной фазы в другую без изменения химического
плавление
твердое вещество жидкость
кристаллизация
Слайд 4
Фазовое равновесие является динамическим, т.е. скорость прямого процесса равна скорости обратного
Слайд 5Правило фаз.
Согласно правилу фаз, числа степеней свободы С, фаз Ф,
С + Ф = К + n
Слайд 6Компонент — это однородная по химическим свойствам часть термодинамической системы, которая
Слайд 7Например, система из аммиака, хлороводорода и хлорида аммония состоит из трех
NH3 + HCl = NH4+*Cl-
Слайд 8Числом степеней свободы С называется число внешних условий, которые можно изменять
На фазовое равновесие обычно влияют температура и давление, в этом случае n = 2 и правило фаз можно переписать в виде:
С + Ф = К + 2
Слайд 9Правило справедливо при соблюдении следующих условий:
фазы имеют достаточно большие размеры, так
поверхности раздела фаз проницаемы для всех компонентов системы в любых направлениях.
Слайд 10С = О (безвариантная система) определяет возможное число фаз Ф в
При С = 1 (моновариантная система) один из параметров состояния системы можно изменять, тогда другие параметры состояния полностью зависят от первого.
При С = 2 (бивариантная система) изменять независимо можно два параметра состояния, а все остальные параметры состояния полностью зависят от этих двух и т. д.
Слайд 11Для изучения фазового равновесия в термодинамических системах используется так называемая фазовая
Физико-химический анализ
Слайд 13Линия АО называется линией сублимации (возгонки);
Линия ВО соответствует линии плавления;
Кривая
В тройной точке О система нонвариантна (С = 1 + 2 - 3 = 0), что характеризуется фиксированными значениями давления и температуры. Точка О для воды имеет следующие координаты: Т = 273,16 К, p = 610,5 Па.
Слайд 14Для определения фазового состава сплава, знание которого необходимо для понимания его
Слайд 16Линия AEB на диаграмме называется линией ликвидуса
Точка Е с координатами
Линия KEL – линия солидуса
Слайд 17Диаграмма состояния для сплавов, образующих химические соединения, называемые интерметаллидами.
Слайд 19Основные положения
Растворение – это физико-химический процесс.
Физическая сторона – растворяющее вещество теряет
Химическая сторона – растворяемое вещество взаимодействует с растворителем- сольватация- образуются сольваты, если растворение идет в воде, то процесс называется гидратацией - образуются гидраты.
Слайд 20
Теплотой или энтальпией растворения – называется количество теплоты, которое выделяется или
Слайд 21Что происходит при растворении?
а) разрушение структуры растворенного вещества, т.е. фазовый переход
ΔНфп > 0 тепло затрачивается
NaClтв = Na+ + Cl– ΔH>0 ΔS>0
Слайд 24Энтропия растворения
Энтропия растворения твердых и жидких веществ всегда больше нуля
Энтропия растворения газов ΔS<0
Слайд 28
Идеальные растворы – это такие растворы, образование которых происходит без изменения
Идеальные растворы – это растворы, в которых пренебрегают межмолекулярным взаимодействием.
Слайд 29
В идеальных растворах частицы растворенного вещества находятся на большом расстоянии друг
Слайд 30
Разбавленные растворы приближаются к идеальным.
Из реальных растворов разбавленные растворы неэлектролитов могут
Слайд 31
Растворы не проводящие электрический ток называются неэлектролитами.
Слабые электролиты в растворе не
Слайд 32
Некоторые физические свойства растворов неэлектролитов зависят только от концентрации частиц растворенного
Слайд 33
К коллигативным свойствам относятся следующие:
Понижение давления паров растворителя над раствором
Осмотическое давление
Слайд 341. Понижение давления паров растворителя над раствором
Согласно, первому закону Рауля –
Слайд 35
Р0 – давление насыщенного пара над чистым растворителем;
N – молярная доля
Слайд 362а. Повышение температуры кипения
Второй закон Рауля:
а) Повышение температуры кипения ΔТкип раствора
Слайд 37
Екип – это моляльная константа повышения температуры кипения растворителя или его
Екип приведена в справочниках.
Слайд 382б. Понижение температуры затвердевания растворов
Второй закон Рауля:
б) Понижение температуры затвердевания
Слайд 39
Кзатв – это моляльная константа понижения температуры затвердевания или криоскопическая константа
Слайд 40ПРИМЕР
Вычислить температуру затвердевания раствора состоящего из 100 гр этиленгликоля С2Н6О2 (М=62)
Слайд 413. Осмотическое давление
Раствор представляет собой однородную систему.
Частицы растворенного вещества и
Слайд 42
Молекулы растворителя и растворенного вещества будут диффундировать преимущественно в том направлении,
Такая двухсторонняя диффузия приведет к выравниванию концентраций и С1=С2.
Слайд 43
Однако диффузия бывает односторонней, если растворы разделить полупроницаемой перегородкой, пропускающей только
При этом условии, что С2>С1 молекулы растворителя с большей скоростью будут диффундировать в направлении С1⇒С2 и объем раствора с концентрацией С2 несколько возрастет. Такая односторонняя диффузия называется осмосом.
Слайд 44
Для количественной характеристики осмотических свойств вводится понятие осмотического давления.
Осмотическое давление
Слайд 45
Вант –Гофф предложил, что для осмотического давления можно применять уравнение состояния
Слайд 46
СМ – молярная концентрация раствора. Растворы с одинаковым осмотическим давлением называются