“Стоматология” мамандығы бойынша
1-курс студенттеріне арналған
«Химия» пәні
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi презентация
Содержание
- 1. Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi
- 2. Мақсаты: Сұйық ерiтiндiлердiң ерiген заттың санына тәуелдi
- 3. Дәрiс жоспары. Ерiтiндiлер. Ағза тiршiлiгiндегi ерiтiндiлердiң манызы.
- 4. Дәрiс тезистерi Еріген заттан, еріткіштен және олардың
- 5. Ерітінді
- 6. Ерітінділер қатты (құймалар), сұйық (дәрілік заттардың судағы
- 7. Температураны жоғарлатқанда әдетте газдардан басқа заттардың ерігіштік
- 8. Сұйытылған ерітінділердің коллигативтік қасиеттері еріген заттың бөлшектерінің
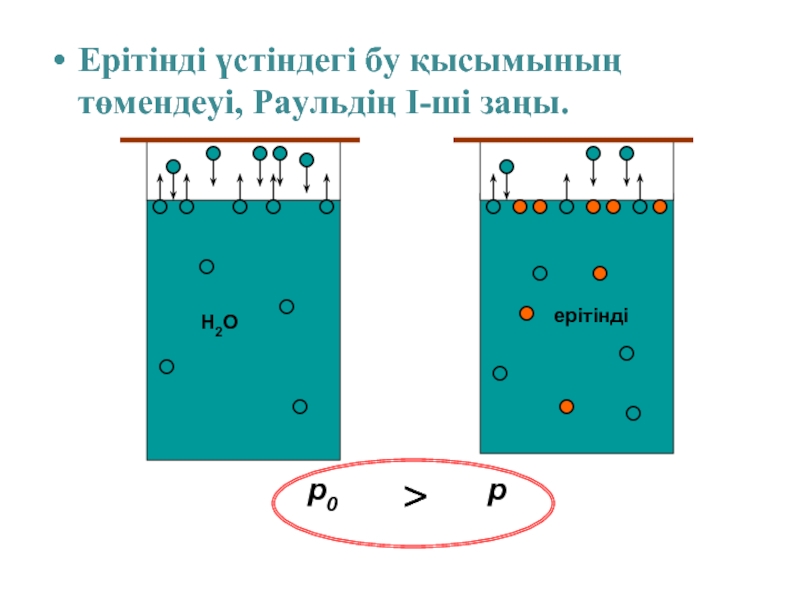
- 9. Ерітінді үстіндегі бу қысымының төмендеуі, Раульдің І-ші
- 10. Ерітінді үстіндегі бу қысымының төмендеуі, Раульдің І-ші заңы. p0 p >
- 11. Франсуа Мари Рауль (фр. François-Marie Raoult; 10
- 12. Раульдің бірінші заңы: электролит емес заттардың сұйытылған
- 13. Рауыльдің екінші заңы: электролит емес ерітінділердің қайнау
- 14. Сm – моляльді концентрация – 1 кг
- 15. Криометрия –қату температурасы бойынша заттың молярлық массасын
- 17. Осмос. Осмос қысымы. Шала өткізгіш арқылы бір
- 18. һ
- 19. Қант ерітіндісінің концентрациясы кемиді, сыртқы ыдыстан енген
- 20. Якоб Хендрик Вант-Гофф (нидерл. Jacobus Henricus (Henry)
- 21. Осмос қысымы ерітілген зат бөлшектерінің тегіне емес,
- 23. Осмостың мәні Жасушаның, тіннің, ағза түрлерінің серпімділігі
- 24. Қанның осмос қысымы Қан плазмасының құрамы:
- 25. Бірдей температурада концентрациясы бірдей екі ерітіндінің осмос
- 26. Эритроциттердің гемолизі
- 27. Электролит ерітінділердің коллигативті қасиеттері Электролит
- 28. Күшті электролиттер үшін (α≈1): i =
- 29. Кері байланыс: Медициналық аспаптарды залалсыздандыру үшін тұздық
- 30. Тыңдағандарыңызға рахмет!!!
Слайд 1Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi.
“Жалпы медицина”,
Слайд 2Мақсаты: Сұйық ерiтiндiлердiң ерiген заттың санына тәуелдi – коллигативтi қасиеттерiн қарау
ағзадағы процесстерді түсінуге мүмкіндік береді.
Слайд 3Дәрiс жоспары.
Ерiтiндiлер. Ағза тiршiлiгiндегi ерiтiндiлердiң манызы.
Бейэлектролит ерітінділерінің коллигативті қасиеттері.
Рауль заңы және
оның салдары (Рауль заңдары)
Осмос. Осмостық және онкотикалық қысым. Вант-Гофф заңы.
Электролит ерiтiндiлерiнiң коллигативтiк қасиеттерi.
Осмос. Осмостық және онкотикалық қысым. Вант-Гофф заңы.
Электролит ерiтiндiлерiнiң коллигативтiк қасиеттерi.
Слайд 4Дәрiс тезистерi
Еріген заттан, еріткіштен және олардың өзара әрекеттесуінен түзілген өнімдерден тұратын
біртекті жүйе қалай аталады?
Слайд 6Ерітінділер қатты (құймалар), сұйық (дәрілік заттардың судағы немесе спирттегі ерітінділері), газ
тәріздес (ауа) болады.
Медицина үшін ең маңыздысы – сұйық ерітінділер. Тірі ағзаның массасы 50-90% судан тұрады.
Берілген температурада 100 г еріткіште заттың еріген грамм санын заттың еріткіштігі дейді.
Медицина үшін ең маңыздысы – сұйық ерітінділер. Тірі ағзаның массасы 50-90% судан тұрады.
Берілген температурада 100 г еріткіште заттың еріген грамм санын заттың еріткіштігі дейді.
Слайд 7Температураны жоғарлатқанда әдетте газдардан басқа заттардың ерігіштік қасиеті өседі.
Газдардың ерігіштігіне қысым
да әсер етеді. Генри заңы бойынша “еріткіштің кесімді көлемінде газдың еруі, сол газдың қысымына тура пропорционал”.
Слайд 8Сұйытылған ерітінділердің коллигативтік қасиеттері еріген заттың бөлшектерінің санына тәуелді, олардың табиғатына
тәуелсіз: ерітінді үстіндегі бу қысымының төмендеуі, ерітіндінің қайнау температурасының жоғарлауы(Δ T к), ерітіндінің қату температурасына төмендеуі (ΔTз)(Рауль заңдары), осмос қысымы (π)
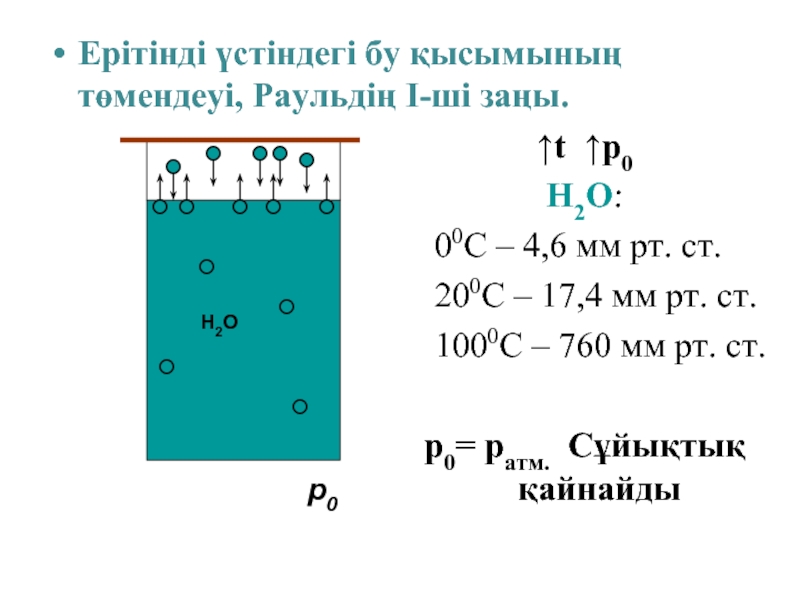
Слайд 9Ерітінді үстіндегі бу қысымының төмендеуі, Раульдің І-ші заңы.
p0
↑t ↑p0
H2O:
00C –
4,6 мм рт. ст.
200C – 17,4 мм рт. ст.
1000C – 760 мм рт. ст.
p0= pатм. Сұйықтық қайнайды
200C – 17,4 мм рт. ст.
1000C – 760 мм рт. ст.
p0= pатм. Сұйықтық қайнайды
Слайд 11
Франсуа Мари Рауль (фр. François-Marie Raoult; 10 мамыр1830, Фурн-ан-Веп, Нор, — 1
сәуір1901, Гренобль) — француз химигі және физигі, Париж ғылыми академиясының корреспондент мүшесі (1890).
1867 жылдан бастап Гренобльскм университетінде, (профессор с 1870). Петербург АН (1899) корреспондент мүшесі . 1882—88 жж еріген күйдегі заттың молекулалық массасын анықтау үшін қолданылатын Рауль заңын ашты
Слайд 12Раульдің бірінші заңы: электролит емес заттардың сұйытылған ерітінділерінің үстіндегі бу қысымының
салыстырмалы төмендеуі еріген заттың молярлық үлесіне тура пропорционал болады.
Слайд 13Рауыльдің екінші заңы: электролит емес ерітінділердің қайнау температурасының жоғарылауы және қату
температурасының төмендеуі еріген заттың молярлық концентрациясына тура пропорционал.
ΔТ(қайнау) = Кэ·Сm;
ΔТ(қату) = Кз·Сm;
ΔT(қату) = T(ер-ш қату)– T(ер-ді қату)
ΔТ(қайнау) = Т(ер-ді қайнау)– Т(ер-ш қайнау)
ΔТ(қайнау) = Кэ·Сm;
ΔТ(қату) = Кз·Сm;
ΔT(қату) = T(ер-ш қату)– T(ер-ді қату)
ΔТ(қайнау) = Т(ер-ді қайнау)– Т(ер-ш қайнау)
Слайд 14Сm – моляльді концентрация – 1 кг еріткіштегі еріген заттың мольманы(моль/кг):
m ер. зат
Cm = ————————
M · m ер-ш (кг)
Кэ – эбулиометриялық const, (латынша. Ebullire - «қайнау» және грекше. σκοπέω - «байқау») ;
Кз (КК) – криометриялық const, ;
Бұл константалар еріткіштің табиғатына тәуелді.
Еріген заттың концентрациясы жоғары болған сайын ерітіндінің Т(қайнау) жоғары, ал Т(қату) төмен болады.
Слайд 15Криометрия –қату температурасы бойынша заттың молярлық массасын (М) анықтау әдісі:
Кз · m ер.зат
М ер.зат = —————— (г/моль)
ΔТз·m ер-ш (кг)
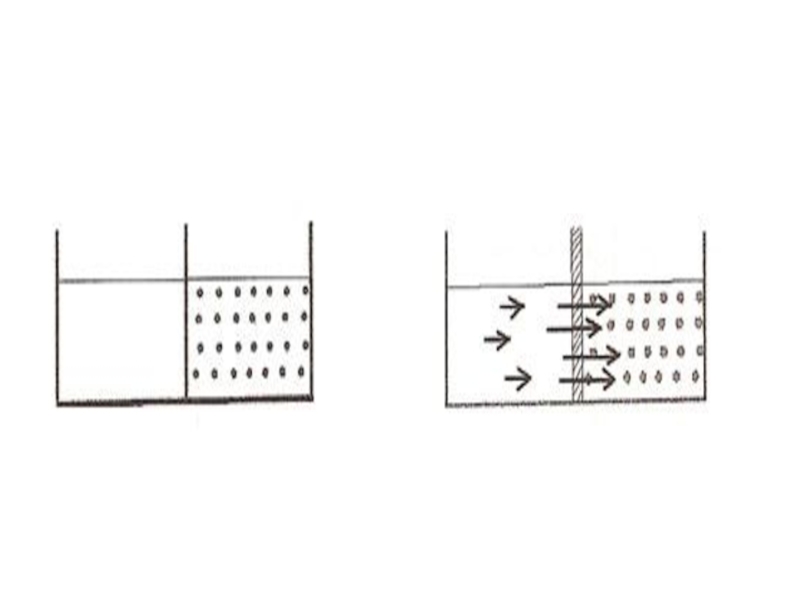
Слайд 17Осмос. Осмос қысымы.
Шала өткізгіш арқылы бір бағытта жүретін диффузияны осмос дейді
(осмос-итеру, басу). Осмос ерітінділердің концентрациялары әр түрлі болса ғана жүреді. Шала өткізгіштен жасалған ыдысқа (осмос ұяшығына) қант ерітіндісін құйып, оны судың ішіне түсірсе, судың молекулалары осмос ұяшығына тез өтеді, кері өтуі баяу болады.
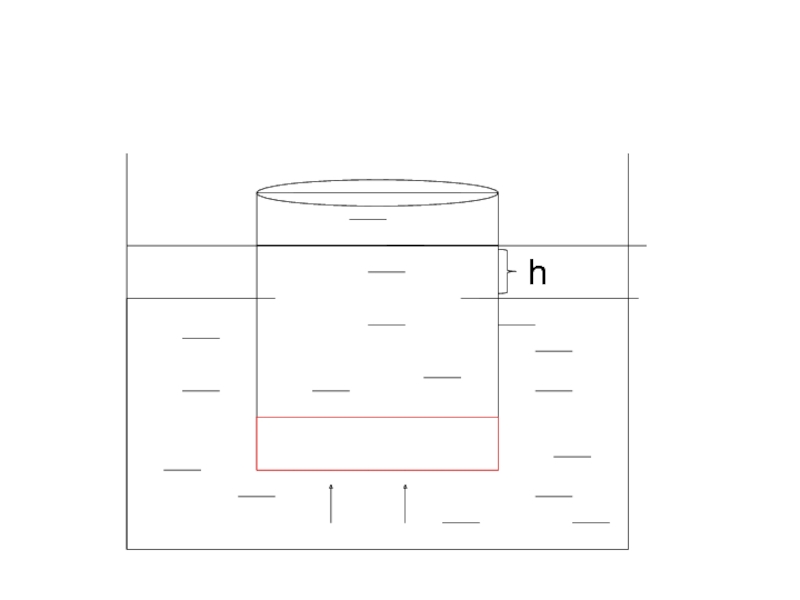
Слайд 19Қант ерітіндісінің концентрациясы кемиді, сыртқы ыдыстан енген су ерітіндінің көлемін үлкейтеді,
ерітінді түтікпен жоғары көтеріледі. Түтікте туған гидростатикалық қысым (басу) сыртқы қысымға теңескенде осмос тоқтайды.
Ұяшықтың ішінде осмостың әсерінен туған қысымды осмос қысымы дейді.
Ұяшықтың ішінде осмостың әсерінен туған қысымды осмос қысымы дейді.
Слайд 20
Якоб Хендрик Вант-Гофф (нидерл. Jacobus Henricus (Henry) van 't Hoff; 30 тамыз1852,
Роттердам — 1 наурыз1911, Берлин) — голланд химигі, химиядан Нобель сыйлығының бірінші иегері (1901 ж). Ерітінділердегі осмос қысымының заңын ашқан.
Слайд 21Осмос қысымы ерітілген зат бөлшектерінің тегіне емес, олардың санына тәуелді болады.
Вант- Гофф ашқан заң бойынша: электролит емес заттың сұйытылған ерітіндісінің осмос қысымы, сол еріген зат газ күйінде болып, сол температурада ерітіндінің көлеміндей көлем алып тұрғандағы туғызатын қысымына тең
Слайд 23Осмостың мәні
Жасушаның, тіннің, ағза түрлерінің серпімділігі
➢ тағамның қорытылуы, лимфаның, несептің түзілуі
➢дәрінің
әсері
➢осмостың есебінен су ағзада қан, тін, жасуша араларына таралады.
➢осмостың есебінен су ағзада қан, тін, жасуша араларына таралады.
Слайд 24Қанның осмос қысымы
Қан плазмасының құрамы:
90 % Н2О, 7 % ақуыздар,
0,9 % эл-т (> NaCl),
≈ 2 % (лип., а/к, глюкоза, органикалық қышқылдар).
π = π НМС + π ВМС
(эл. + неэл.) (ақуыздар)
ΔТз·R·T
ΔТз (қан) =0,56 Сº; π (плазма) = ———— = Кз
0,56·0,083·(273+37º)
= ————————— = 7,65 атм
1,86
π пл жмқ (ақуыздар) = 0,04 – 0,03 атм
π (плазма) = π тмқ + π жмқ = 7,65 + 0,03(0,04) ≈ 7,7 – 8,1 атм
≈ 2 % (лип., а/к, глюкоза, органикалық қышқылдар).
π = π НМС + π ВМС
(эл. + неэл.) (ақуыздар)
ΔТз·R·T
ΔТз (қан) =0,56 Сº; π (плазма) = ———— = Кз
0,56·0,083·(273+37º)
= ————————— = 7,65 атм
1,86
π пл жмқ (ақуыздар) = 0,04 – 0,03 атм
π (плазма) = π тмқ + π жмқ = 7,65 + 0,03(0,04) ≈ 7,7 – 8,1 атм
Слайд 25Бірдей температурада концентрациясы бірдей екі ерітіндінің осмос қысымы да тең болса,
олар изотоникалық ерітінділер деп аталады. Екі ерітіндінің концентрациясы әртүрлі болса, концентрациясы аз-ерітіндінің осмос қысымы төмен болып, гипотоникалық ерітінді, концентрациясы көп ерітінді – гипертоникалық ерітінді деп аталады.
Гемолиз – гипотоникалық ерітіндіде эритроцит жасушаларының ісініп, жарылуы. Плазмолиз – гипертоникалық ерітіндіде жасушаның солуы.
Гемолиз – гипотоникалық ерітіндіде эритроцит жасушаларының ісініп, жарылуы. Плазмолиз – гипертоникалық ерітіндіде жасушаның солуы.
Слайд 27
Электролит ерітінділердің коллигативті қасиеттері
Электролит ерітінділерінде диссоциация есебінен бөлшектер саны көп болады.
Вант-Гофф электролиттердің диссоциациясын есепке алатын түзету изотоникалық коэффициентін i ұсынды.
i = 1+ α (n – 1)
/ \
диссоциациялану 1 молекуладағы
дәрежесі бөлшектердің саны
Практикада i ΔТз, ΔТк, π бойынша анықталады.
ΔТз пр ΔТк пр π пр
i = ———— = ————— = —————
ΔТз теор ΔТк теор π теор
i есебінен коллигативті қасиеттерді анықтайтын формулалар:
РО – Р
——— = i · N(x2); ΔТз = i · Кз· Сm; ΔТк = i · Кэ · Cm; π = i · R · C(x)
РО
Слайд 28Күшті электролиттер үшін (α≈1):
i = 1+ α (n – 1)
NaCl ↔
Na+ + Cl-
2 ион => n=2, α=1 болғанда i=2
CaCl2 ↔ Ca2+ + 2Cl-
3 ион => n=3, α=1 болғанда i=3
2 ион => n=2, α=1 болғанда i=2
CaCl2 ↔ Ca2+ + 2Cl-
3 ион => n=3, α=1 болғанда i=3
Слайд 29Кері байланыс:
Медициналық аспаптарды залалсыздандыру үшін тұздық ерітінділерді қолдануға болады. Осы әсердің
механизмін түсіндіріңіз. Қандай ерітіндінің әсері жоғары : натрий хлориді әлде кальций хлориді?