- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Элементы IV группы, побочной подгруппы периодической системы Менделеева презентация
Содержание
- 1. Элементы IV группы, побочной подгруппы периодической системы Менделеева
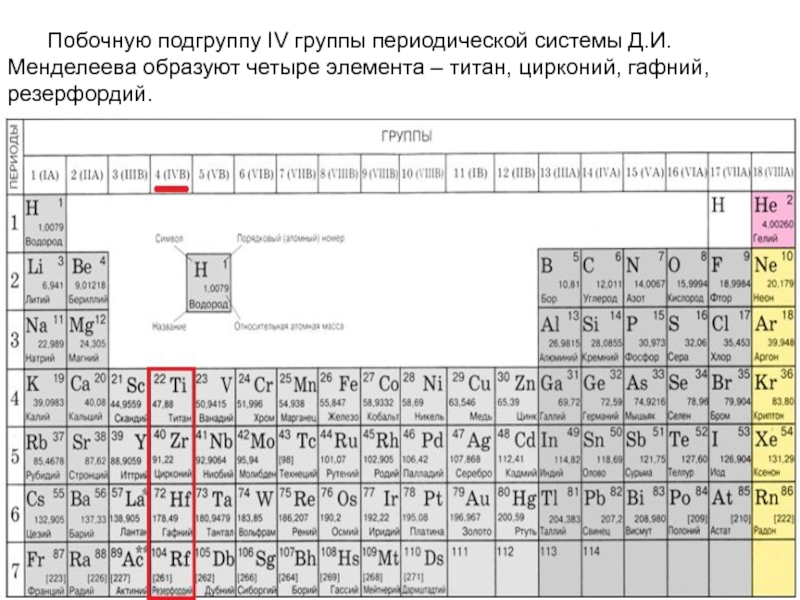
- 2. Побочную подгруппу IV группы периодической системы Д.И. Менделеева образуют четыре элемента – титан, цирконий, гафний, резерфордий.
- 3. Строение атома Титан (Ti) - элемент побочной
- 4. Нахождение в природе Титан находится на
- 5. Нахождение в природе Важнейшими минералами, содержащими титан,
- 6. Физические свойства Титан серебристо - белый металл.
- 7. Химические свойства Благодаря образованию на поверхности
- 8. Химические свойства При нагревании на воздухе до
- 9. Получение Как правило, исходным материалом для производства
- 10. Получение Концентрат титановых руд подвергают сернокислотной или
- 11. Получение TiO2 + 2C + 2Cl2 =
- 12. Получение Полученную титановую «губку» переплавляют и очищают.
- 13. Применение Титан и его сплавы в связи
- 14. Применение Титан, как и тантал, не действует
- 15. Спасибо за внимание!
Слайд 1Элементы IV группы, побочной подгруппы периодической системы Менделеева
Выполнил: Неупокоев Алексей Алексеевич
Слайд 2 Побочную подгруппу IV группы периодической системы Д.И. Менделеева образуют четыре элемента – титан,
цирконий, гафний, резерфордий.
Слайд 3Строение атома
Титан (Ti) - элемент побочной подгруппы четвёртой группы, четвёртого периода
периодической системы химических элементов Д. И. Менделеева, с порядковым номером 22.
Как и у многих других d-элементов, в атоме титана Тi подвижными являются не только электроны наружного энергетического уровня, но и два электрона d-подуровня. Поэтому титан в соединениях проявляет степени окисления + 2 и +4 (реже +3).Титан обладает переменной валентностью и обычно встречается в 2-х, 3-х и 4-х валентном состояниях.
Как и у многих других d-элементов, в атоме титана Тi подвижными являются не только электроны наружного энергетического уровня, но и два электрона d-подуровня. Поэтому титан в соединениях проявляет степени окисления + 2 и +4 (реже +3).Титан обладает переменной валентностью и обычно встречается в 2-х, 3-х и 4-х валентном состояниях.
Слайд 4Нахождение в природе
Титан находится на 10-м месте по распространённости в природе.
Содержание
в земной коре 0,57 % по массе, в морской воде 0,001 мг/л.
В ультраосновных породах 300 г/т, в основных — 9 кг/т, в кислых 2,3 кг/т, в глинах и сланцах 4,5 кг/т.
В земной коре титан почти всегда четырёхвалентен и присутствует только в кислородных соединениях.
В свободном виде не встречается.
В ультраосновных породах 300 г/т, в основных — 9 кг/т, в кислых 2,3 кг/т, в глинах и сланцах 4,5 кг/т.
В земной коре титан почти всегда четырёхвалентен и присутствует только в кислородных соединениях.
В свободном виде не встречается.
Слайд 5Нахождение в природе
Важнейшими минералами, содержащими титан, являются: титаномагнетиты FeTiO3 *nFe3O4, ильменит
FeTiO3, рутил TiO2. Титановые руды распространены относительно широко, но содержание в них титана небольшое.
Слайд 6Физические свойства
Титан серебристо - белый металл. Сравнительно легкий, немного тяжелее алюминия,
но примерно в три раза прочнее его. Тугоплавкий (1665°С). В обычных условиях отличается высокой прочностью и вязкостью. Поддается различным видам обработки.
Слайд 7Химические свойства
Благодаря образованию на поверхности металла плотной защитной оксидной пленки он
обладает исключительно высокой стойкостью против коррозии превышающей стойкость нержавеющей стали, но при измельчении в порошок, а также в тонкой стружке или проволоке титан пирофорен. При обычных условиях на титан не действуют ни кислород воздуха, ни морская вода. При повышенной температуре его химическая активность повышается. Так, например, титан реагирует с хлором: Ti + 2Cl2 = TiCl4
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF-фтороводородной , H3PO4-орто-фосфорной и концентрированной H2SO4-серной кислоты).
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF-фтороводородной , H3PO4-орто-фосфорной и концентрированной H2SO4-серной кислоты).
Слайд 8Химические свойства
При нагревании на воздухе до 1200 °C Ti загорается ярким
белым пламенем с образованием оксидных фаз переменного состава TiOx.
Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2.
Гидроксид TiO(OH)2·xH2O и диоксид TiO2 амфотерны.
Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2.
Гидроксид TiO(OH)2·xH2O и диоксид TiO2 амфотерны.
Слайд 9Получение
Как правило, исходным материалом для производства титана и его соединений служит
диоксид титана со сравнительно небольшим количеством примесей. В частности, это может быть рутиловый концентрат, получаемый при обогащении титановых руд.
Слайд 10Получение
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке.
Продукт сернокислотной обработки —
порошок диоксида титана TiO2.
Пирометаллургическим методом руду спекают с коксоми обрабатывают хлором, получая пары тетрахлорида титана TiCl4.
Пирометаллургическим методом руду спекают с коксоми обрабатывают хлором, получая пары тетрахлорида титана TiCl4.
Слайд 11Получение
TiO2 + 2C + 2Cl2 = TiCl4 + 2CO
Образующиеся пары TiCl4
при 850 °C восстанавливают магнием:
TiCl4 + 2Mg = 2MgCl2 + Ti
TiCl4 + 2Mg = 2MgCl2 + Ti
Слайд 12Получение
Полученную титановую «губку» переплавляют и очищают.
Рафинируют титан йодидным способом или электролизом,
выделяя Ti из TiCl4.
Для получения титановых слитков применяют дуговую, электроннолучевую или плазменную переработку.
Для получения титановых слитков применяют дуговую, электроннолучевую или плазменную переработку.
Слайд 13Применение
Титан и его сплавы в связи с их легкостью, прочностью, термической
и коррозионной стойкостью применяются для изготовления деталей самолетов, космических кораблей, ракет, подводных лодок, трубопроводов, котлов высокого давления, различных аппаратов для химической промышленности. Титан широко используется в виде листов для обшивки корпусов судов, обеспечивающих высокую прочность и стойкость в морской воде.
Слайд 14Применение
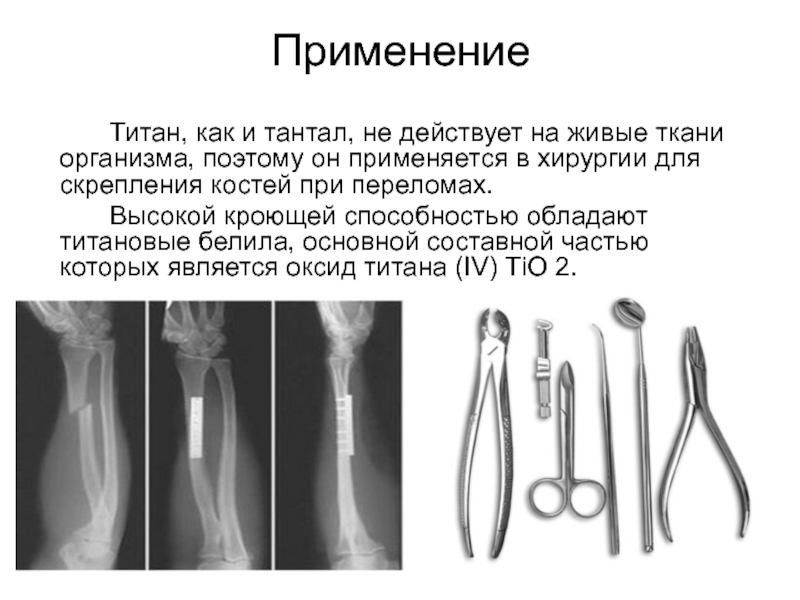
Титан, как и тантал, не действует на живые ткани организма, поэтому
он применяется в хирургии для скрепления костей при переломах.
Высокой кроющей способностью обладают титановые белила, основной составной частью которых является оксид титана (IV) ТiO 2.
Высокой кроющей способностью обладают титановые белила, основной составной частью которых является оксид титана (IV) ТiO 2.