Менделеева
Химическая связь
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электронные конфигурации атомов. Периодический Закон. Периодическая система Д.И. Менделеева. Химическая связь презентация
Содержание
- 1. Электронные конфигурации атомов. Периодический Закон. Периодическая система Д.И. Менделеева. Химическая связь
- 2. Распределение электронов по энергетическим уровням и подуровням
- 3. В графических электронных формулах каждая орбиталь обозначается
- 4. 1. Принцип Паули
- 5. 2. Правило Хунда в пределах одного
- 6. 3. Принцип наименьшей энергии электроны заполняют
- 7. 3. Принцип наименьшей энергии ПРАВИЛА ЗАПОЛНЕНИЯ УРОВНЕЙ И ПОДУРОВНЕЙ
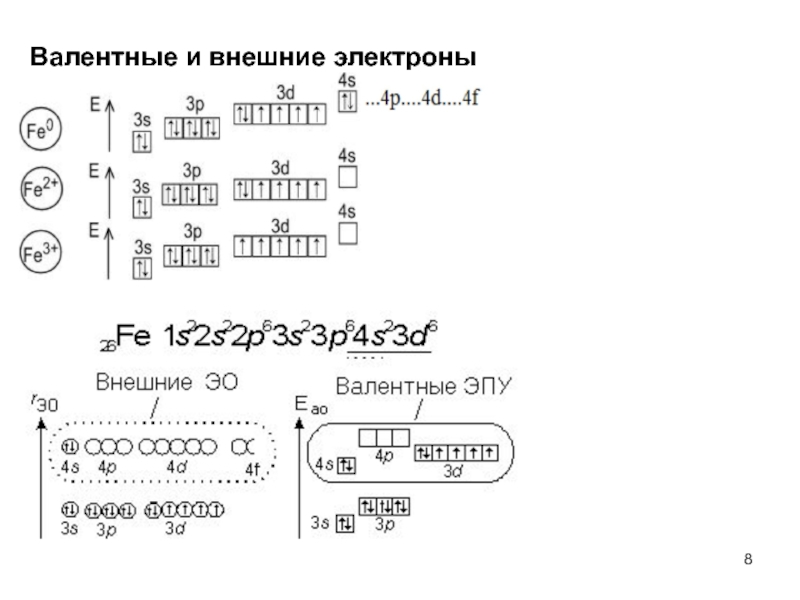
- 8. Валентные и внешние электроны
- 9. Периодичность в изменении основных атомных характеристик «свойства
- 25. Размеры атомов и ионов эффективный
- 26. Энергия ионизации Как потеря, так
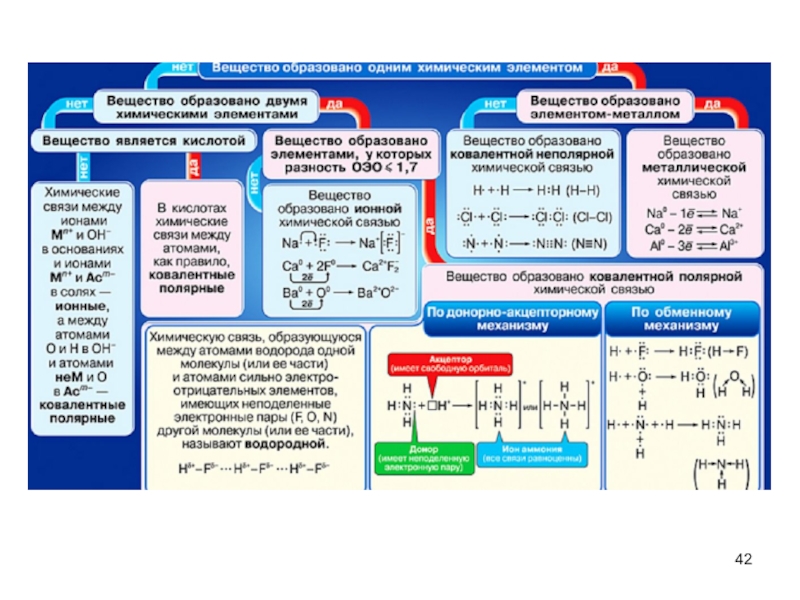
- 27. Химическая связь Сильные химические взаимодействия, т. е.
- 28. В настоящее время различают ковалентную, ионную и
- 29. Ковалентная связь характеризуется следующими основными параметрами: энергия
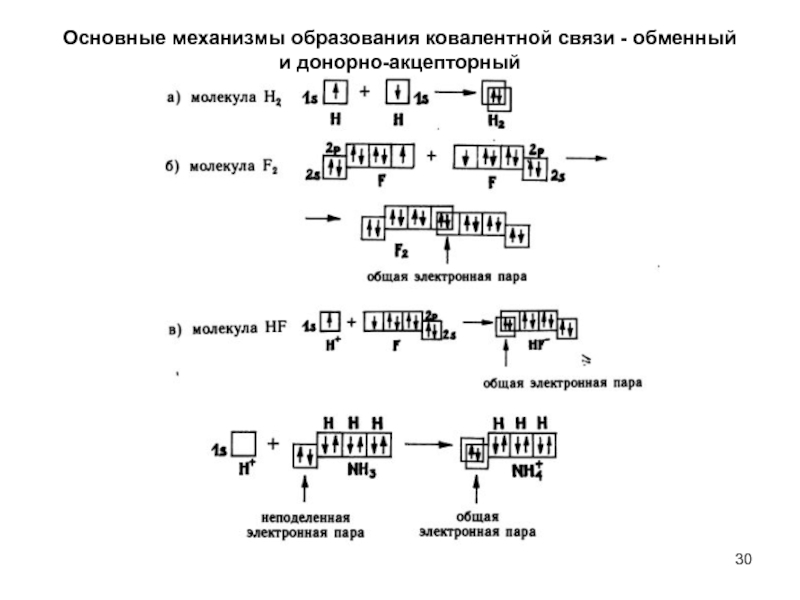
- 30. Основные механизмы образования ковалентной связи - обменный и донорно-акцепторный
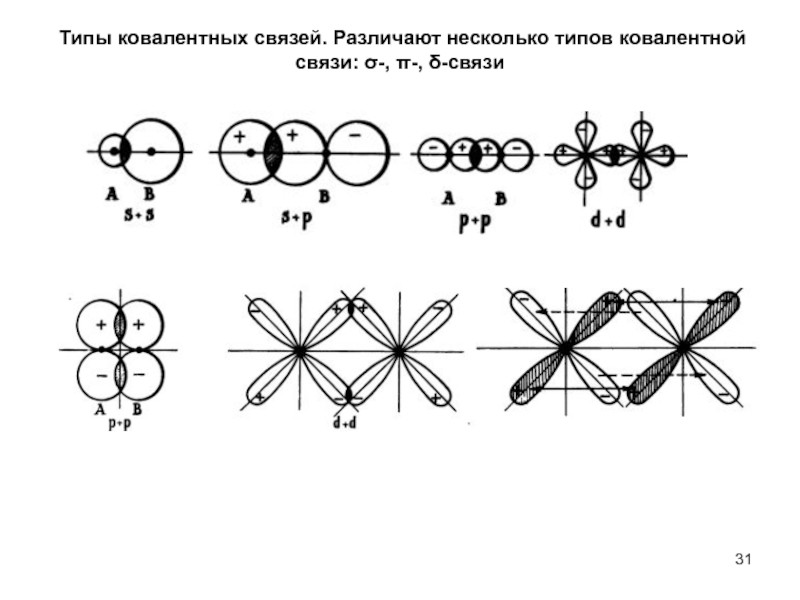
- 31. Типы ковалентных связей. Различают несколько типов ковалентной связи: σ-, π-, δ-связи
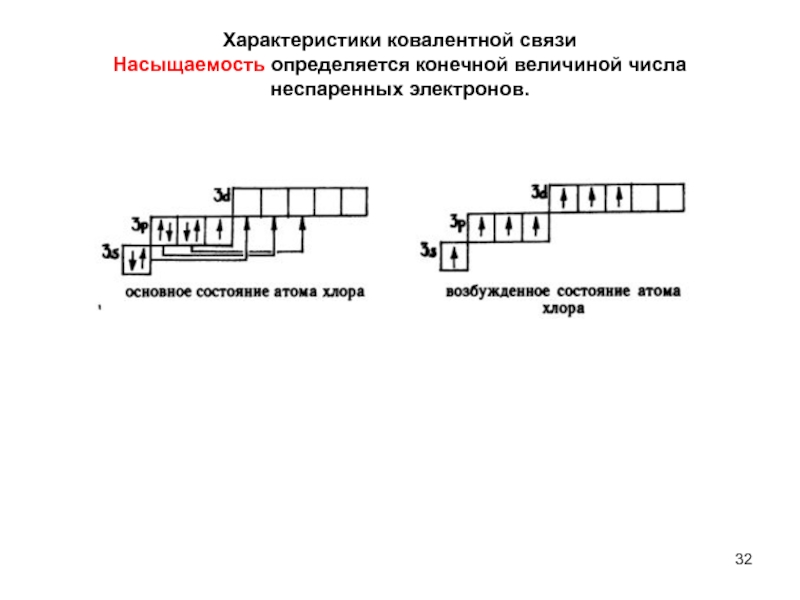
- 32. Характеристики ковалентной связи Насыщаемость определяется конечной величиной числа неспаренных электронов.
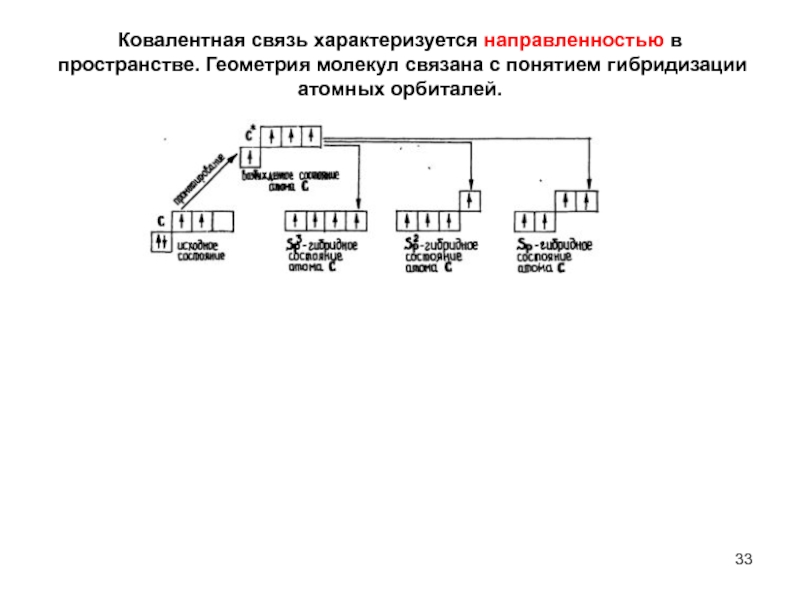
- 33. Ковалентная связь характеризуется направленностью в пространстве. Геометрия
- 39. Если молекула образована различными атомами, то связь
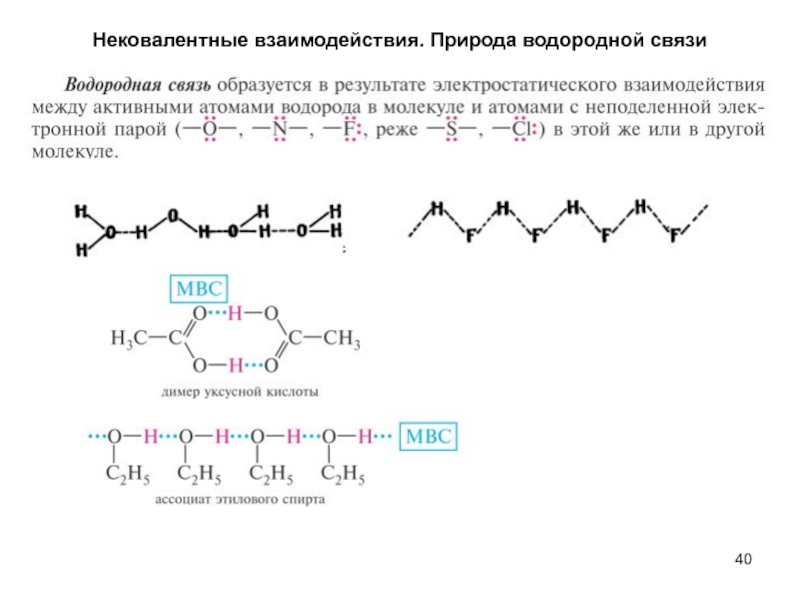
- 40. Нековалентные взаимодействия. Природа водородной связи
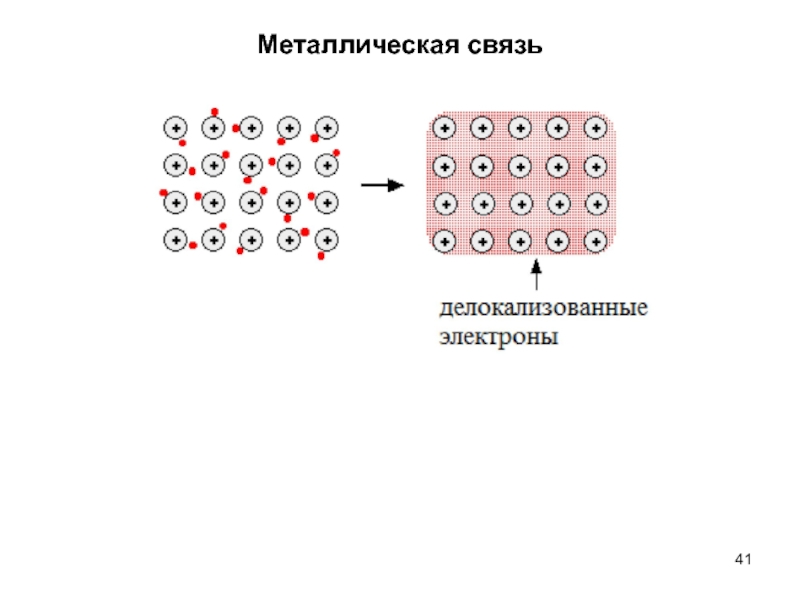
- 41. Металлическая связь
Слайд 2Распределение электронов по энергетическим уровням и подуровням изображают в виде
электронных
формул
и энергетических ячеек так называемых
графических электронных формул.
и энергетических ячеек так называемых
графических электронных формул.
Слайд 3В графических электронных формулах
каждая орбиталь обозначается клеткой, стрелка − электрон, направление
стрелки − направление спина, свободная клетка − свободная орбиталь. Например, электронные формулы атомов элементов № 15 и № 23 имеют вид:
№ 15 (Р) 1s2, 2s2, 2p6, 3s2, 3p3
№ 23 (V) 1s2, 2s2, 2p6, 3s2, 3p6, 3d3, 4s2
Для атома фосфора электронно-графическая схема:
№ 15 (Р) 1s2, 2s2, 2p6, 3s2, 3p3
№ 23 (V) 1s2, 2s2, 2p6, 3s2, 3p6, 3d3, 4s2
Для атома фосфора электронно-графическая схема:
Слайд 41. Принцип Паули
В атоме не существует двух
электронов с одинаковым набором квантовых чисел. Максимальное число электронов на энергетическом уровне определяется как N = 2n2, а на подуровне – как 2(2L+1)
ПРАВИЛА ЗАПОЛНЕНИЯ УРОВНЕЙ И ПОДУРОВНЕЙ
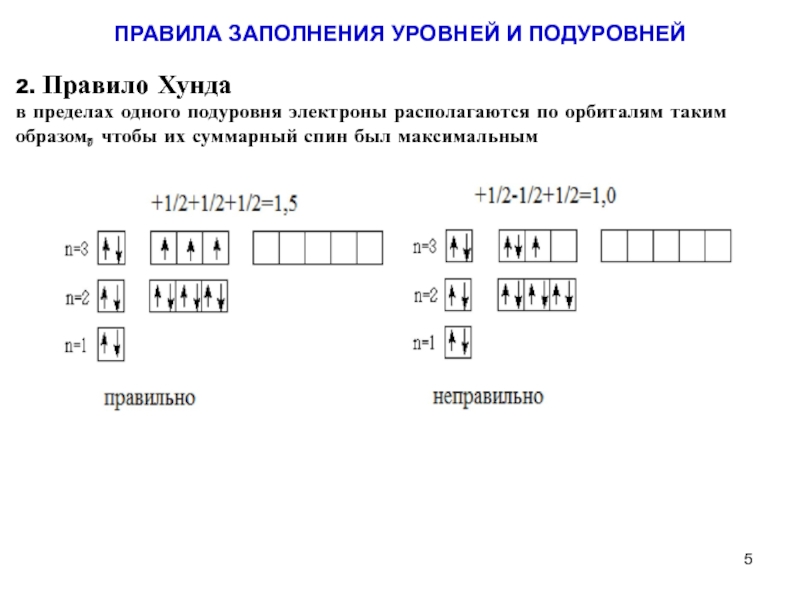
Слайд 52. Правило Хунда
в пределах одного подуровня электроны располагаются по орбиталям
таким образом, чтобы их суммарный спин был максимальным
ПРАВИЛА ЗАПОЛНЕНИЯ УРОВНЕЙ И ПОДУРОВНЕЙ
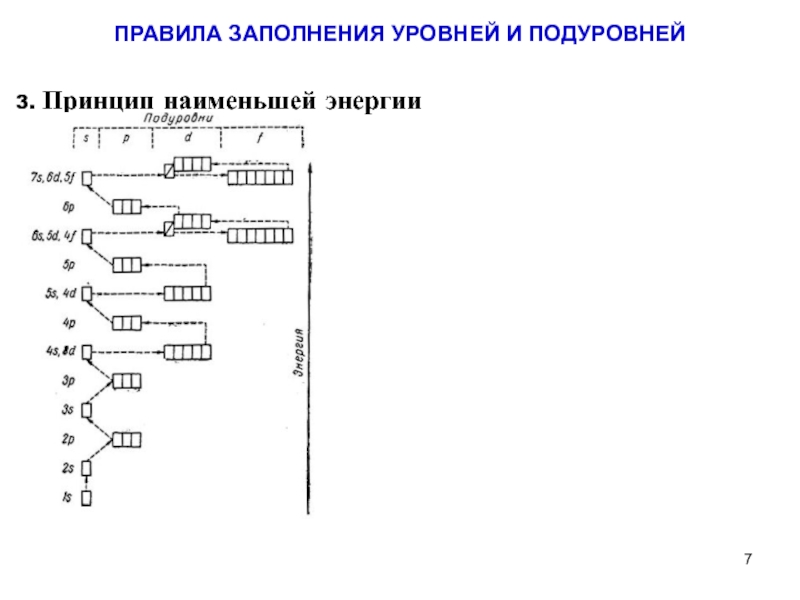
Слайд 63. Принцип наименьшей энергии
электроны заполняют орбитали в порядке возрастания энергии
орбиталей. Принцип реализован в правиле Клечковского. Клечковский показал, что из двух данных состояний меньшей энергии электрона отвечает состояние, которое характеризуется меньшей суммой n+L. Например, из двух состояний 3d и 4s – состояние 4s отвечает меньшей энергии электрона в атоме, т. к. для 4s (4+0) = 4 меньше чем для 3d (3+2=5). В случае если для двух состояний одинакова, меньшей энергии отвечает состояние, характеризующееся меньшим значением n. В соответствии с этим заполнение электронами орбиталей происходит согласно ряду Клечковского:
ПРАВИЛА ЗАПОЛНЕНИЯ УРОВНЕЙ И ПОДУРОВНЕЙ
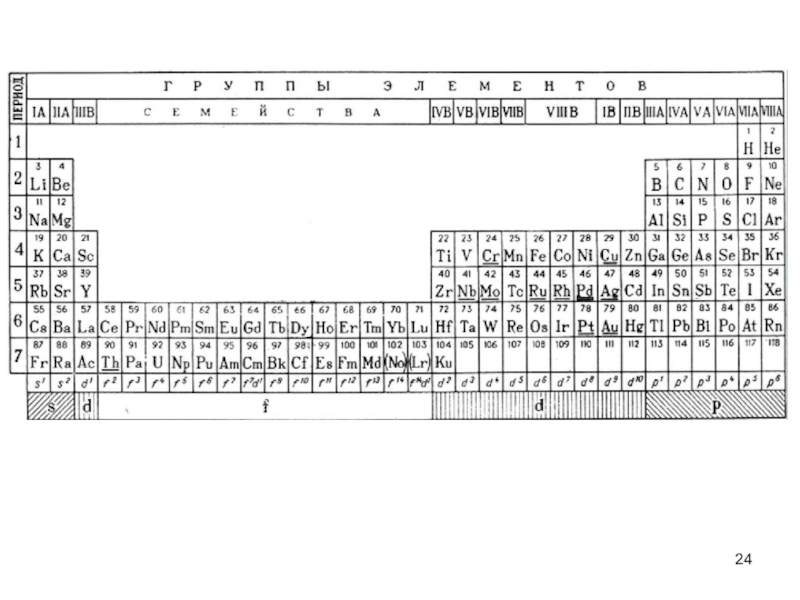
Слайд 9Периодичность в изменении основных атомных характеристик
«свойства химических элементов (т.е. свойства и
форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов»
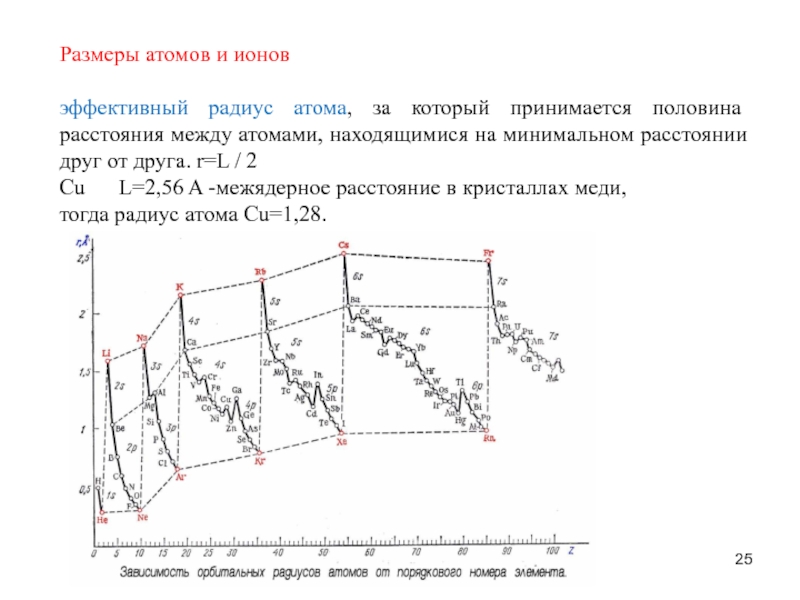
Слайд 25Размеры атомов и ионов
эффективный радиус атома, за который принимается половина
расстояния между атомами, находящимися на минимальном расстоянии друг от друга. r=L / 2
Cu L=2,56 A -межядерное расстояние в кристаллах меди,
тогда радиус атома Cu=1,28.
Cu L=2,56 A -межядерное расстояние в кристаллах меди,
тогда радиус атома Cu=1,28.
Слайд 26Энергия ионизации
Как потеря, так и присоединение атомами электронов сопровождается энергетическим
эффектом. Количество энергии, которое необходимо затратить для отрыва электрона от атома и удаления его из сферы влияния ядра, называется энергией ионизации
Энергия сродства к электрону
Атомы не только могут отдавать электроны, но и присоединять их. Энергия, выделяющаяся при присоединении электрона к свободному атому, называется сродством атома к электрону (Е).
Электроотрицательность
Для сравнительной оценки этой способности присоединения электрона введена характеристика, названная электроотрицательностью (ЭО)
Энергия сродства к электрону
Атомы не только могут отдавать электроны, но и присоединять их. Энергия, выделяющаяся при присоединении электрона к свободному атому, называется сродством атома к электрону (Е).
Электроотрицательность
Для сравнительной оценки этой способности присоединения электрона введена характеристика, названная электроотрицательностью (ЭО)
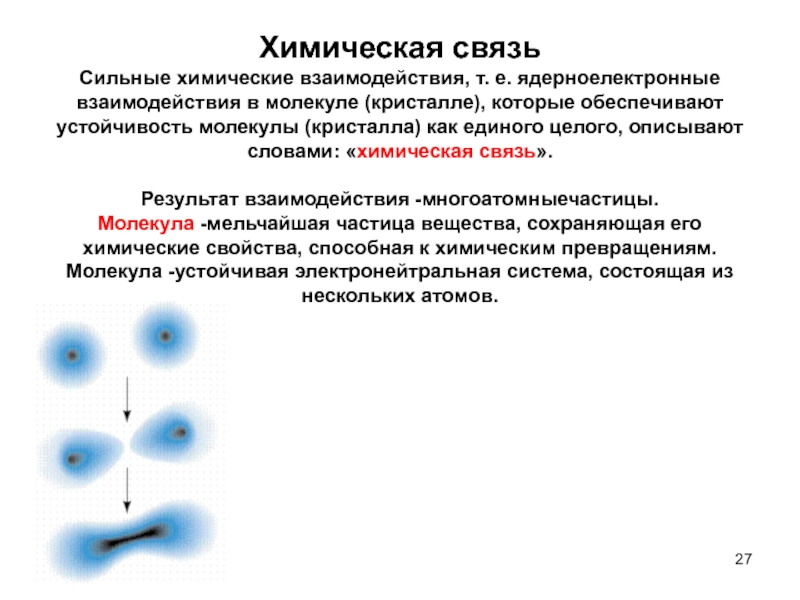
Слайд 27Химическая связь
Сильные химические взаимодействия, т. е. ядерноелектронные взаимодействия в молекуле (кристалле),
которые обеспечивают устойчивость молекулы (кристалла) как единого целого, описывают словами: «химическая связь».
Результат взаимодействия -многоатомныечастицы.
Молекула -мельчайшая частица вещества, сохраняющая его химические свойства, способная к химическим превращениям. Молекула -устойчивая электронейтральная система, состоящая из нескольких атомов.
Результат взаимодействия -многоатомныечастицы.
Молекула -мельчайшая частица вещества, сохраняющая его химические свойства, способная к химическим превращениям. Молекула -устойчивая электронейтральная система, состоящая из нескольких атомов.
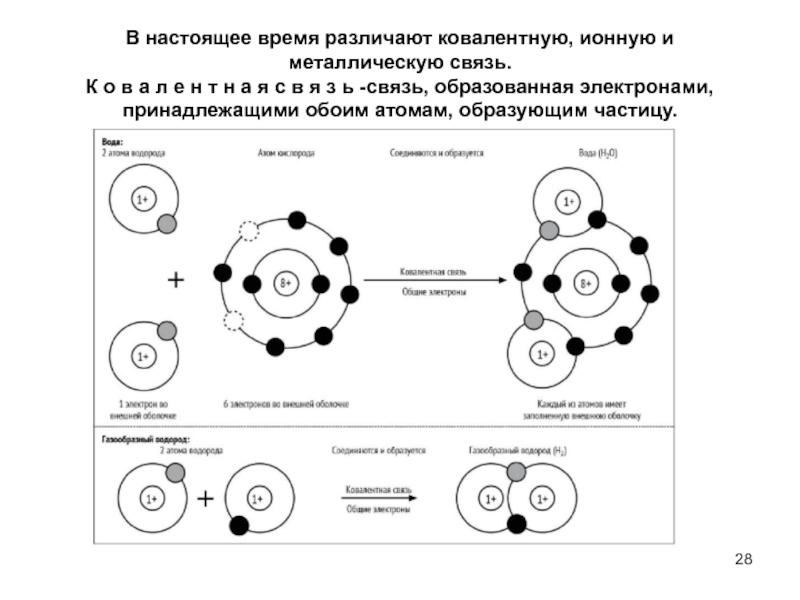
Слайд 28В настоящее время различают ковалентную, ионную и металлическую связь.
К о в
а л е н т н а я с в я з ь -связь, образованная электронами, принадлежащими обоим атомам, образующим частицу.
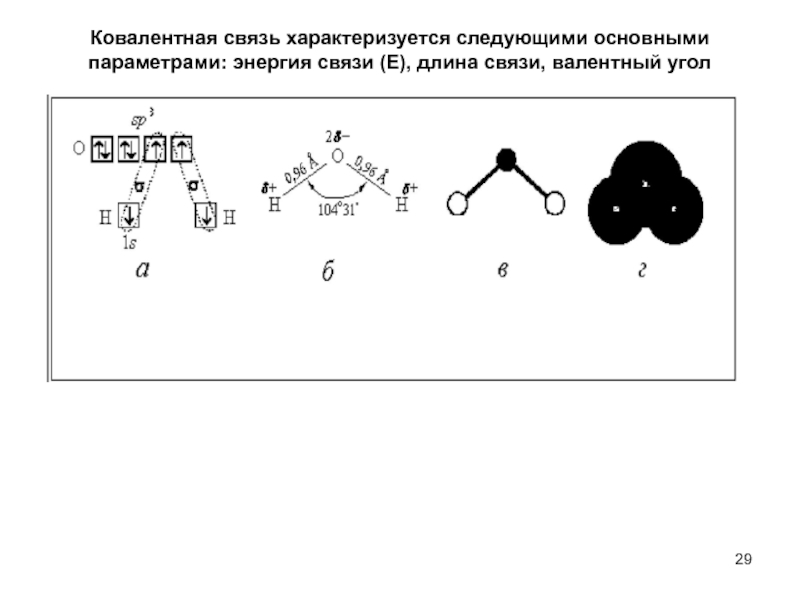
Слайд 29Ковалентная связь характеризуется следующими основными параметрами: энергия связи (Е), длина связи,
валентный угол
Слайд 32Характеристики ковалентной связи
Насыщаемость определяется конечной величиной числа неспаренных электронов.
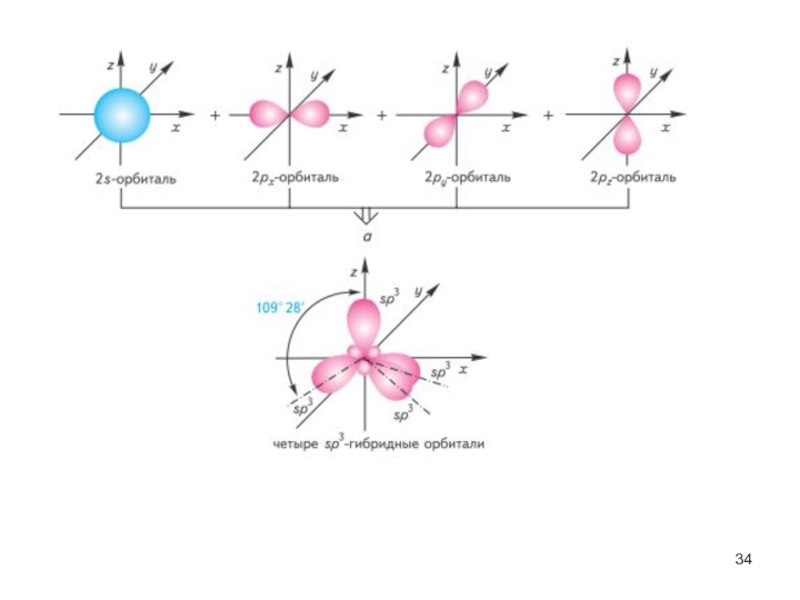
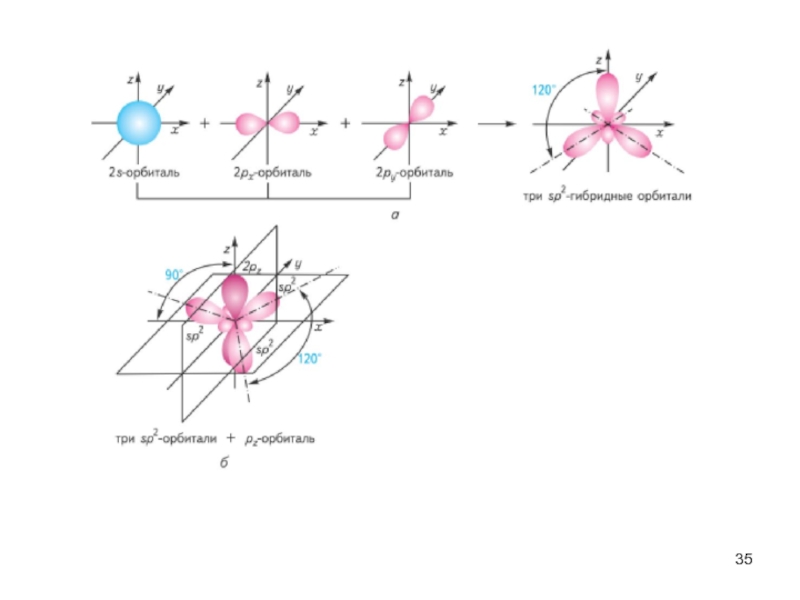
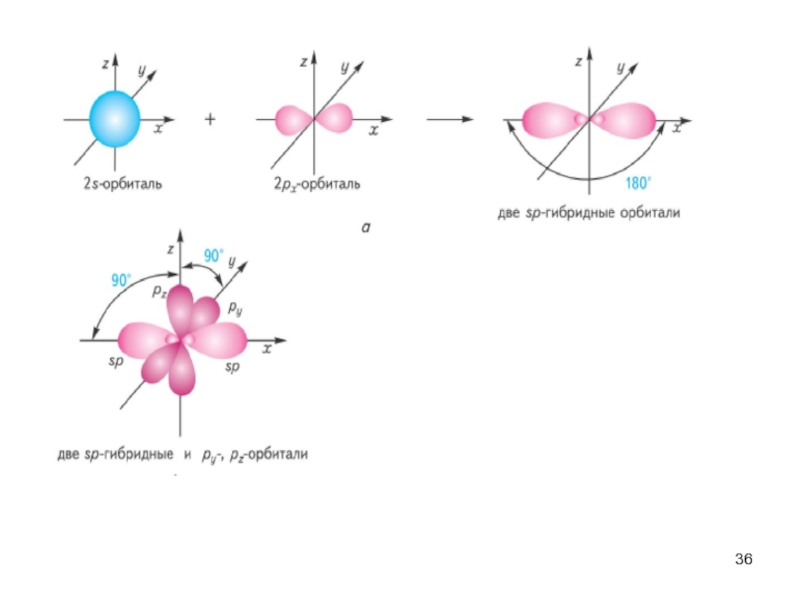
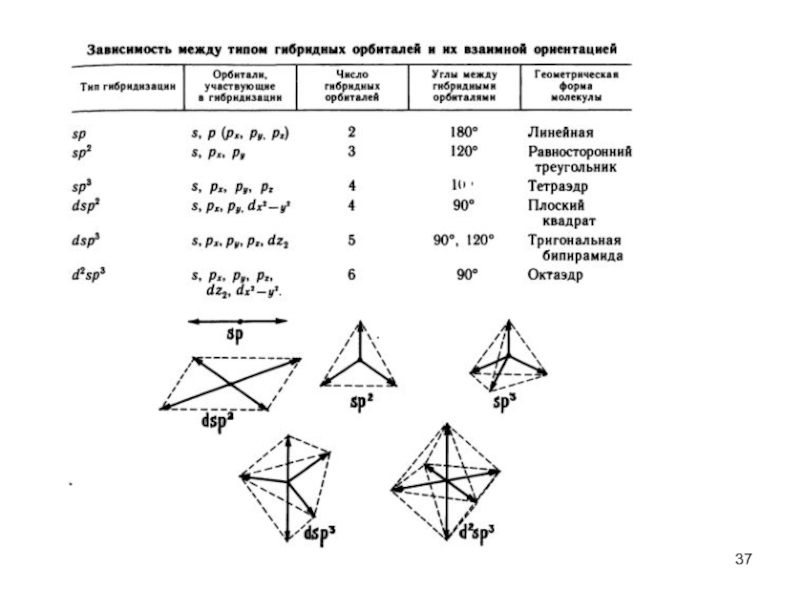
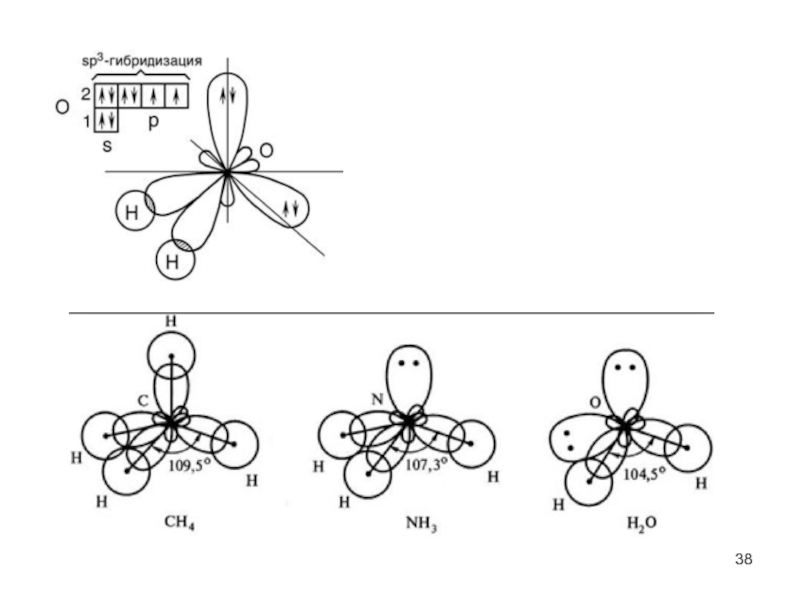
Слайд 33Ковалентная связь характеризуется направленностью в пространстве. Геометрия молекул связана с понятием
гибридизации атомных орбиталей.
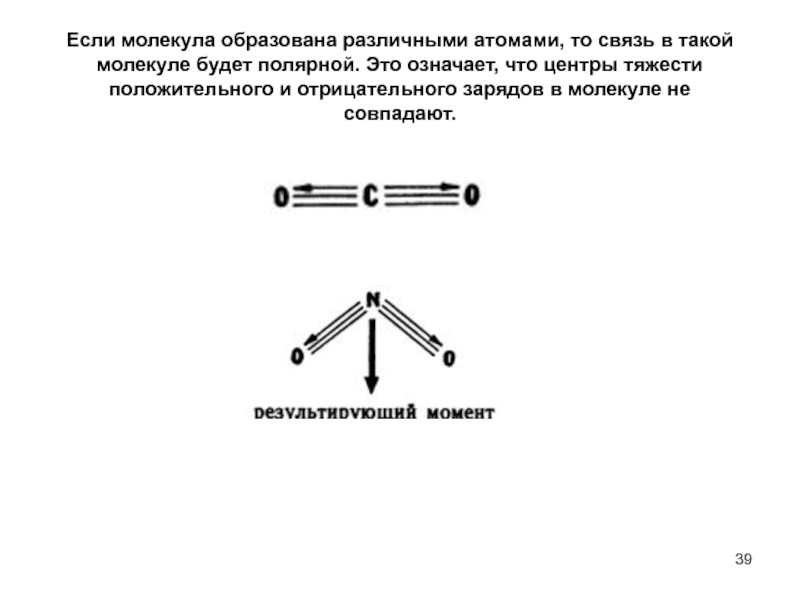
Слайд 39Если молекула образована различными атомами, то связь в такой молекуле будет
полярной. Это означает, что центры тяжести положительного и отрицательного зарядов в молекуле не совпадают.