- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электронное строение элементов-органогенов. Типы химической связи презентация
Содержание
- 1. Электронное строение элементов-органогенов. Типы химической связи
- 2. Биоорганическая химия изучает строение и свойства
- 3. В основе теории органической химии, сформулированной А.М.
- 4. Рассмотрим электронное строение атомов тех элементов, которые
- 6. Водород – элемент первого периода, следовательно, его
- 8. Углерод, азот и кислород – элементы второго
- 12. Электронная конфигурация углерода в основном состоянии
- 13. В органической химии широко используются представления о
- 14. Атомы углерода и азота могут находиться в
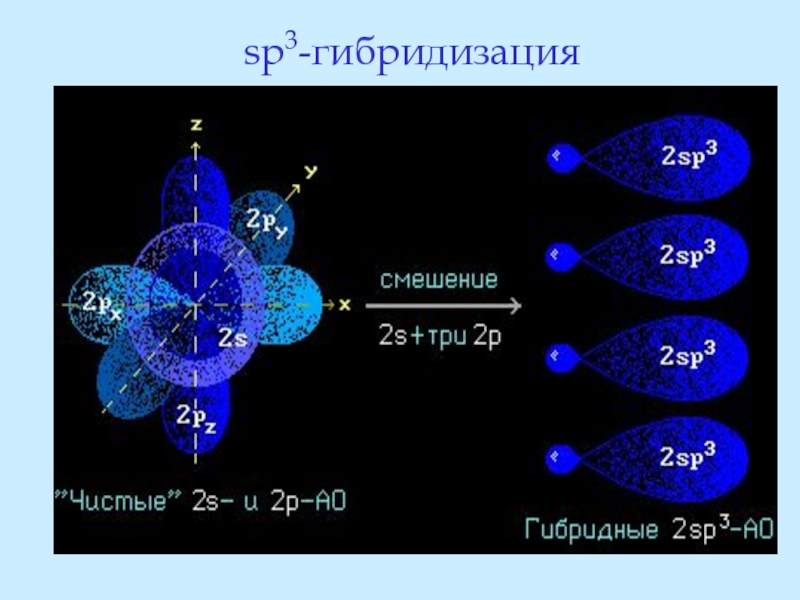
- 15. sp3-гибридизация
- 16. Гибридные орбитали равноценны, имеют форму неправильных объёмных
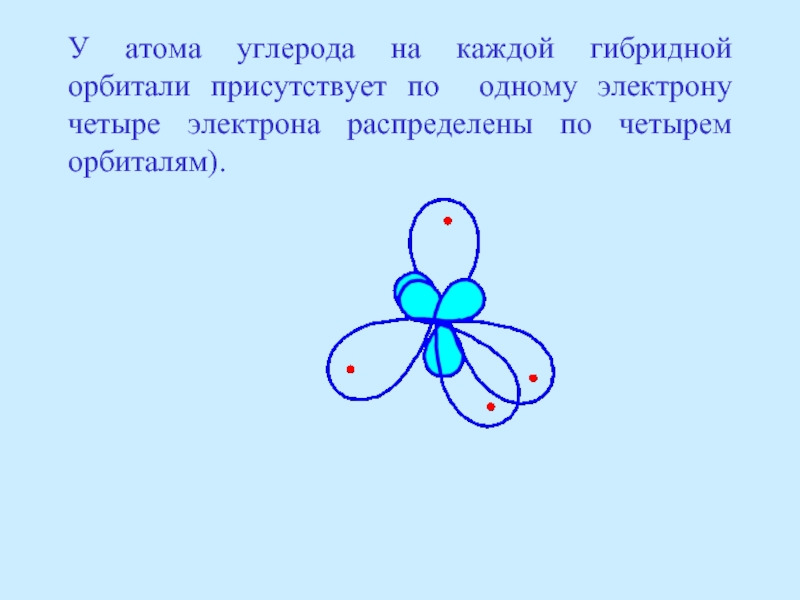
- 17. У атома углерода на каждой гибридной орбитали
- 18. Электронная конфигурация sp3-гибридизованного атома азота отличается тем,
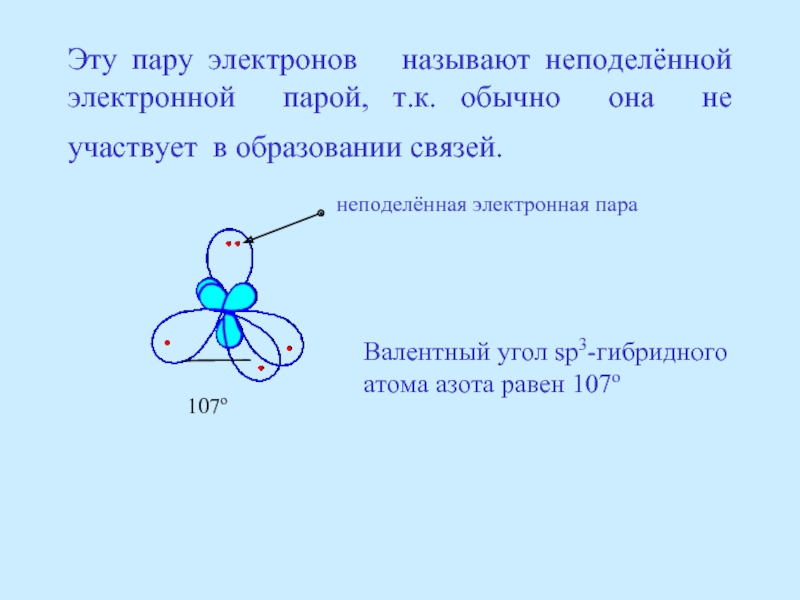
- 19. Эту пару электронов называют неподелённой электронной
- 20. У sp3-гибридизованного атома кислорода на двух гибридных
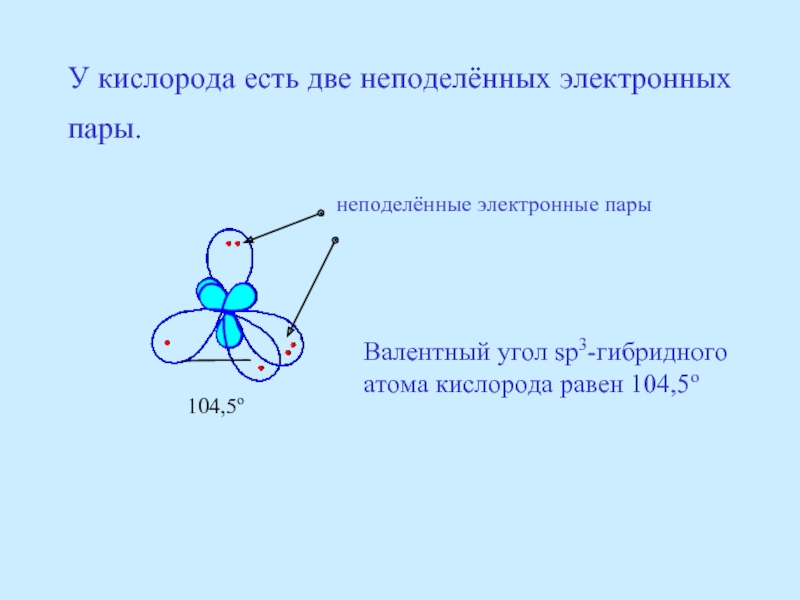
- 21. У кислорода есть две неподелённых электронных пары.
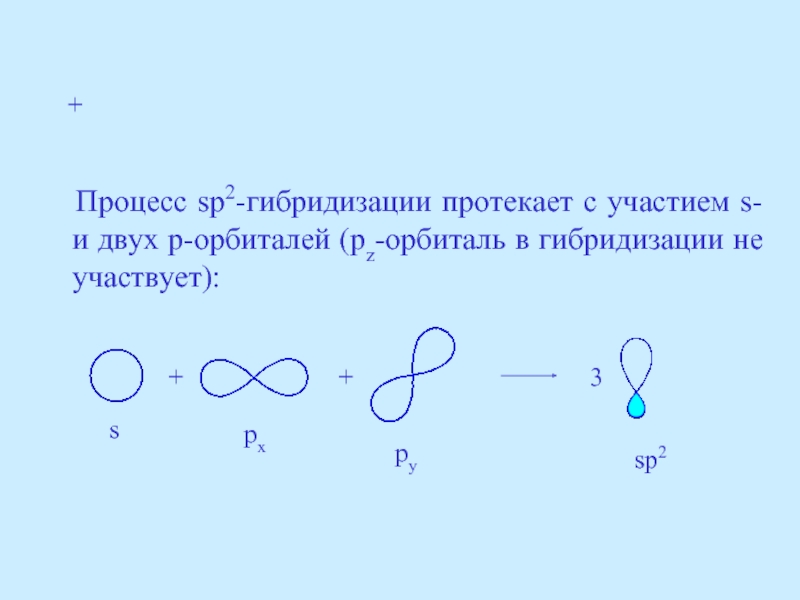
- 22. Процесс sp2-гибридизации протекает с участием
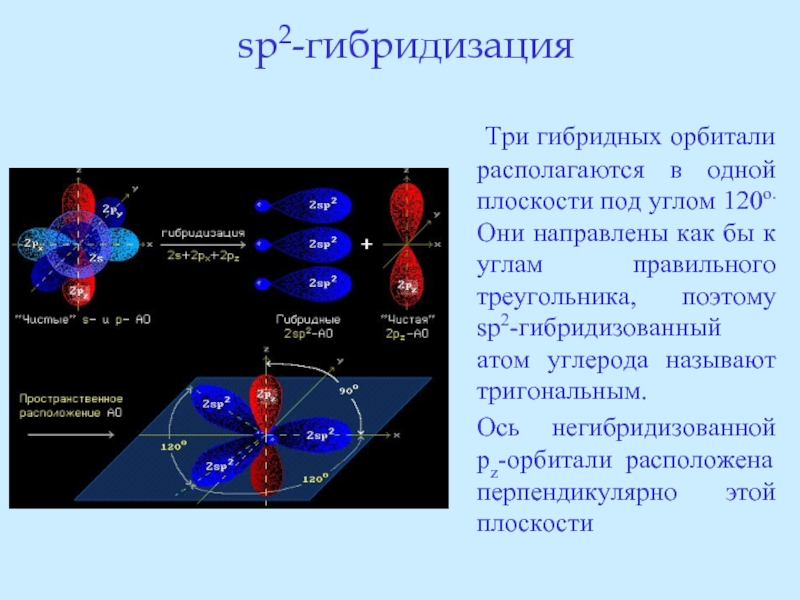
- 23. sp2-гибридизация Три гибридных орбитали располагаются
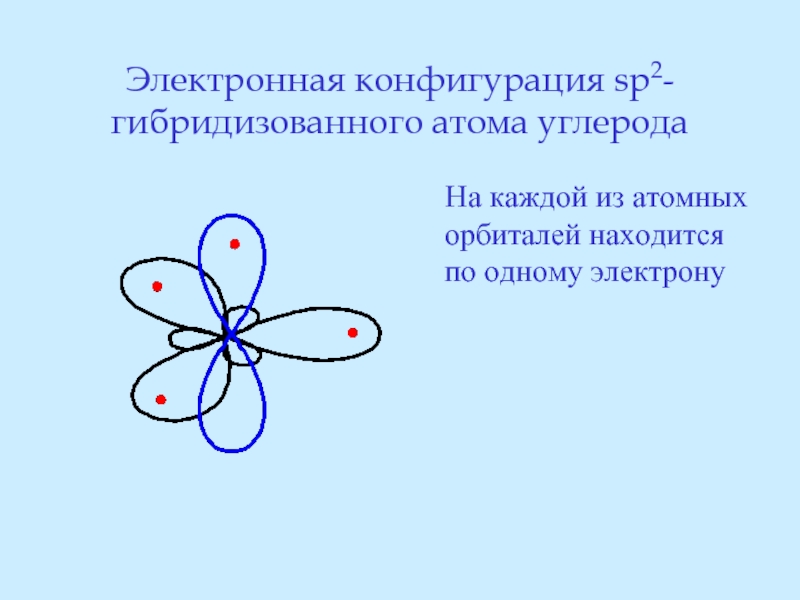
- 24. Электронная конфигурация sp2-гибридизованного атома углерода
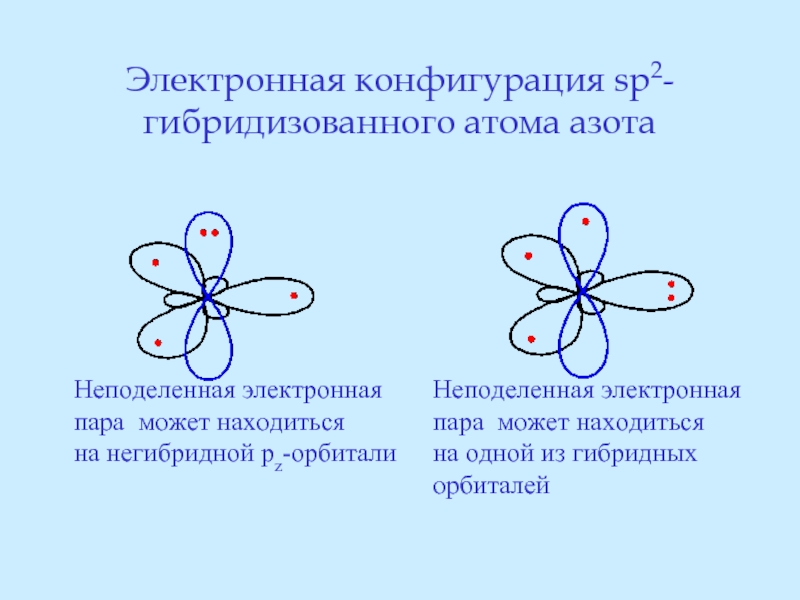
- 25. Электронная конфигурация sp2-гибридизованного атома азота Неподеленная электронная
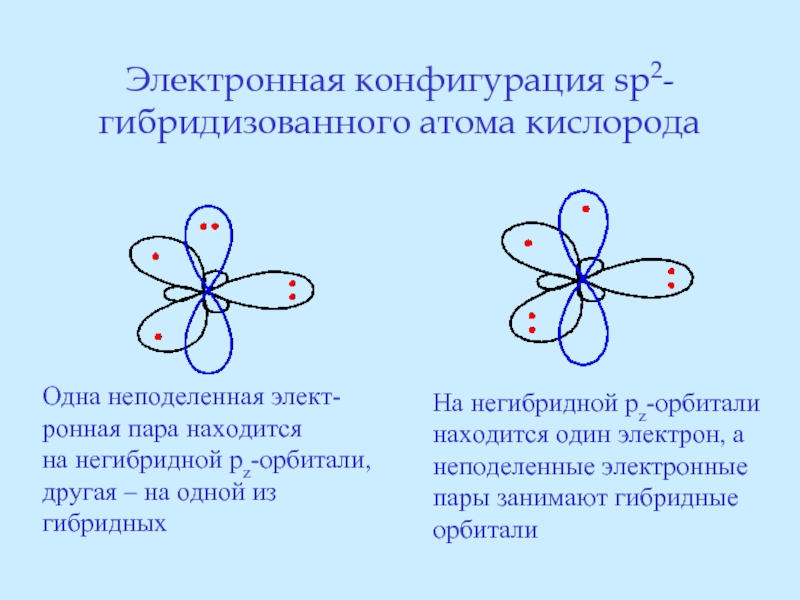
- 26. Электронная конфигурация sp2-гибридизованного атома кислорода Одна неподеленная
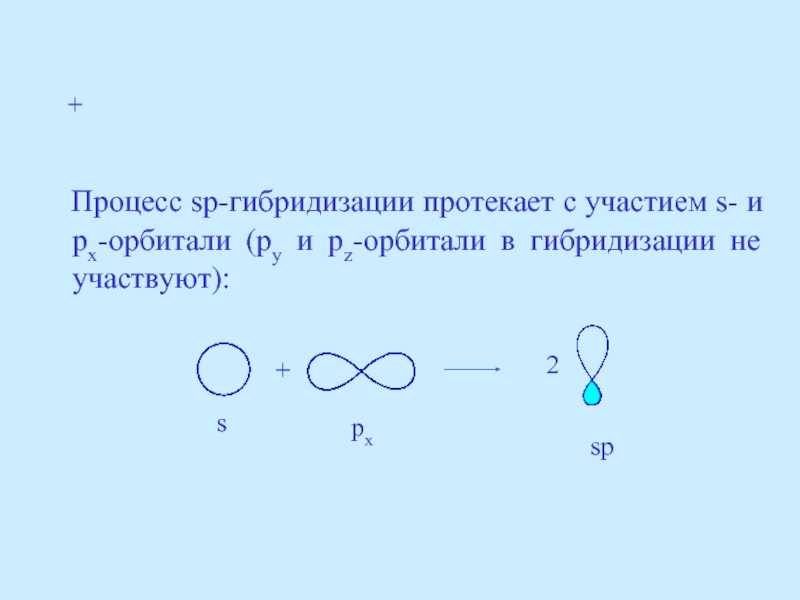
- 27. Процесс sp-гибридизации протекает с участием
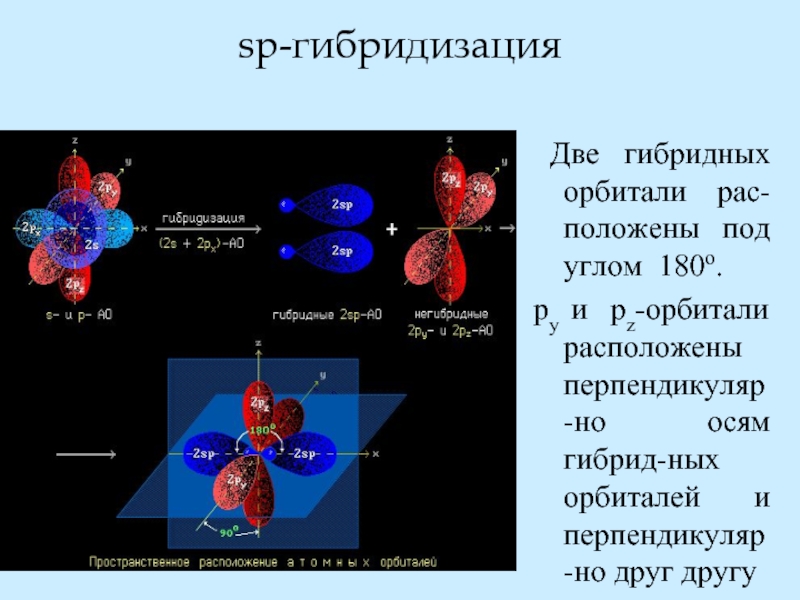
- 28. sp-гибридизация Две гибридных орбитали рас-положены
- 29. Электронная конфигурация sp-гибридизованного атома углерода На каждой орбитали находится по одному электрону
- 30. Электронная конфигурация sp-гибридизованного атома азота Неподеленная
- 31. Почему важно научиться определять тип гибридизации атомов
- 32. Как определить тип гибридизации атомов в молекуле
- 33. Как определить тип гибридизации атомов в молекуле
- 34. Как определить тип гибридизации атомов в молекуле
- 35. Как определить тип гибридизации атомов в молекуле
- 36. Если мы установили, что атом
- 37. Как определить электронную конфигурацию sp2-гибридизованного атома азота
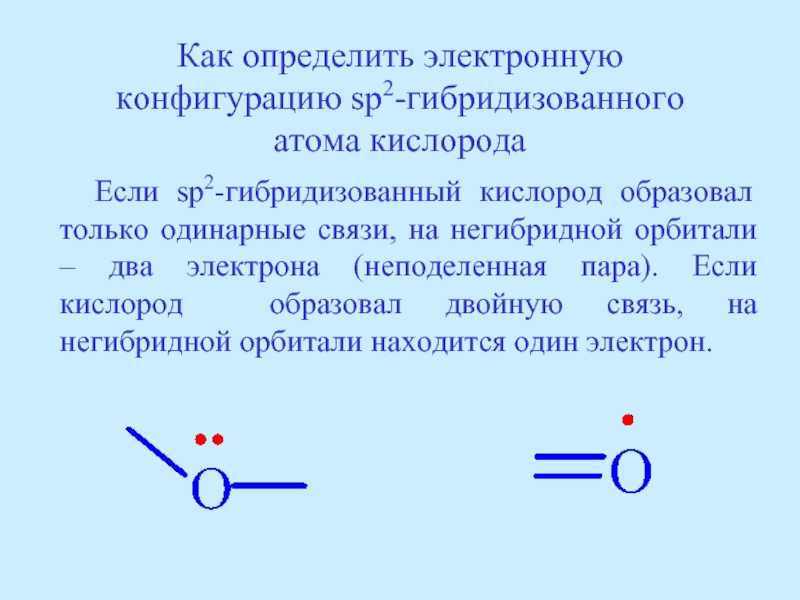
- 38. Как определить электронную конфигурацию sp2-гибридизованного атома кислорода
- 39. Электронная конфигурация sp2-гибридизованного азота CH2=CH-NH2
- 40. Электронная конфигурация sp2-гибридизованного кислорода CH2=CH-O-CH3 CH3-C-CH3
- 41. Химические связи в органических молекулах
- 42. При образовании связей атомы завершают внешний энергетический
- 44. Схемы образования ионной и ковалентной связей + + ионная связь ковалентная связь
- 45. Образование ионной связи + - ионы Между противоположно заряженными ионами возникают силы притяжения.
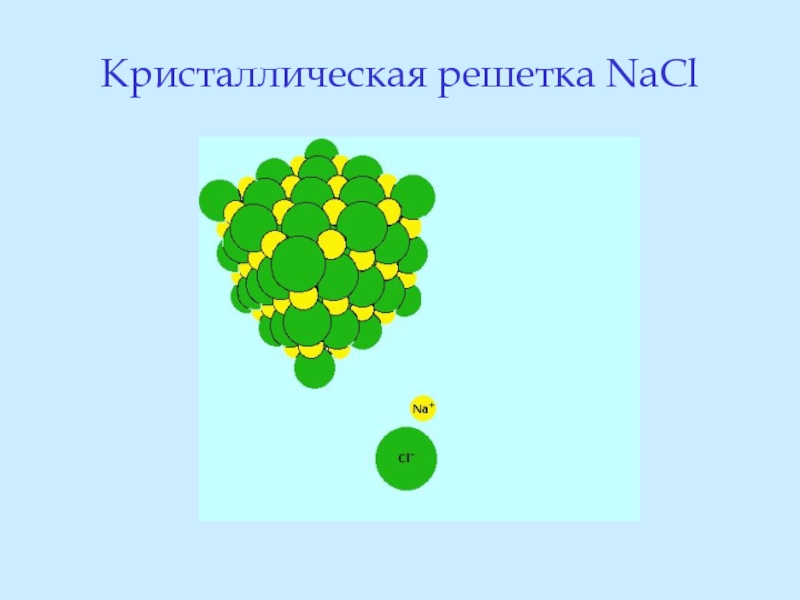
- 46. Кристаллическая решетка NaCl
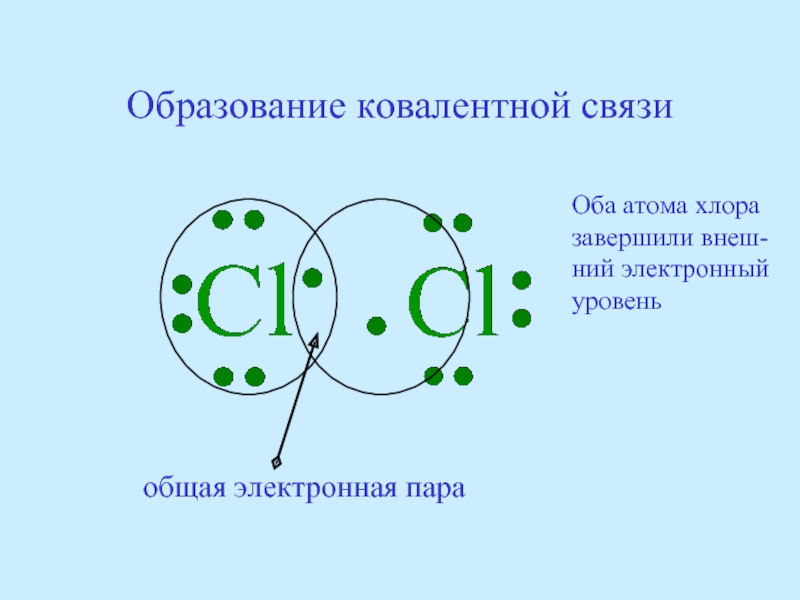
- 47. Образование ковалентной связи общая электронная
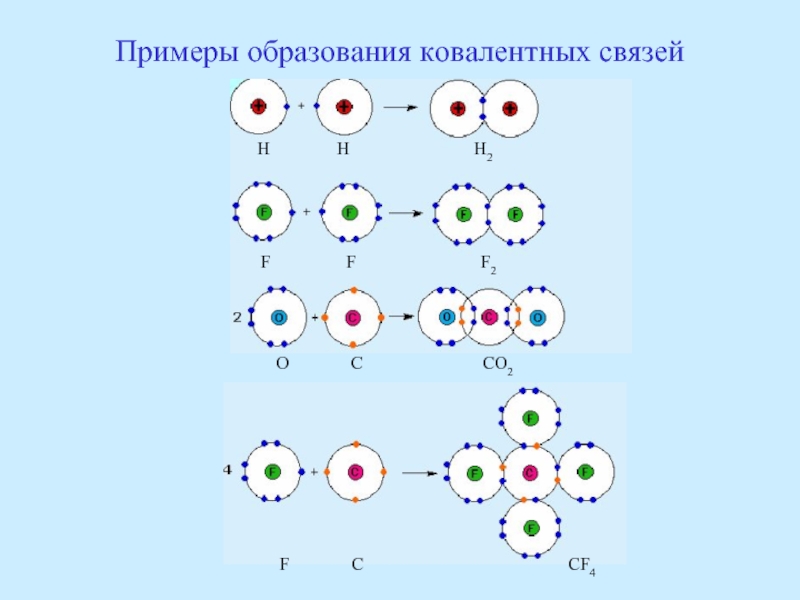
- 48. Примеры образования ковалентных связей H
- 50. Ковалентная связь может образоваться и по донорно-акцепторному
- 51. Существует два типа ковалентных связей – σ-
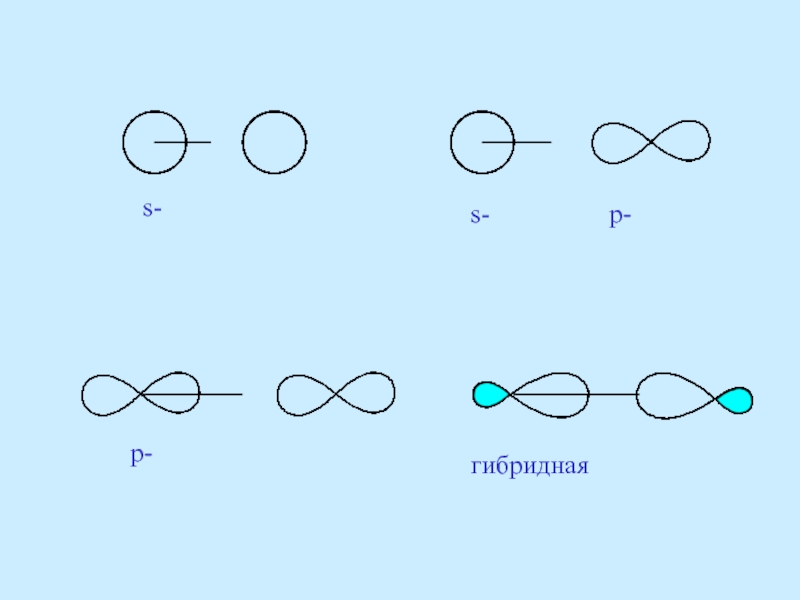
- 52. s- s- p- p- гибридная
- 53. π-Связь образуется при боковом перекрывании негибридных p-орбиталей
- 55. Встречающиеся в органических соединениях кратные связи
- 56. Свойства ковалентной связи выражаются следующими характеристиками: длина энергия полярность поляризуемость
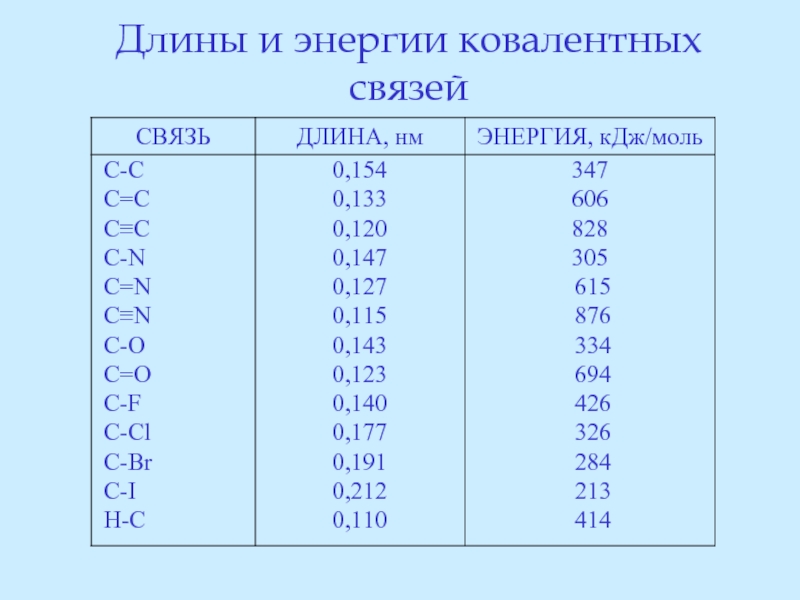
- 57. Длина связи – это
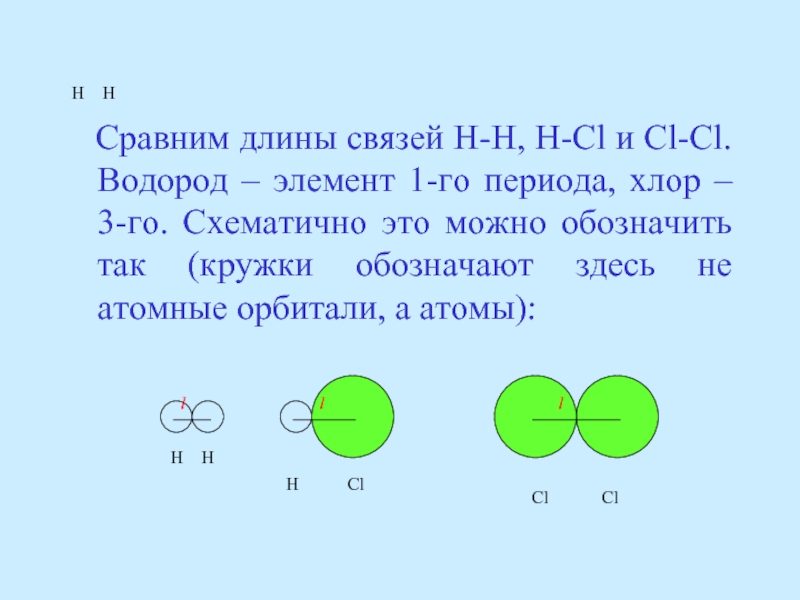
- 58. Чтобы сравнить длины различных
- 59. H H
- 60. Двойная связь короче одинарной,
- 61. Энергия связи – это
- 62. Чем короче связь, тем она
- 63. Длины и энергии ковалентных связей
- 64. Полярность связи – это неравномерное
- 65. Чем больше разница в электроотрицательности атомов, тем
- 66. Поляризуемость – лёгкость, с
- 67. + + -
- 68. Чем дальше электроны связи
Слайд 1Электронное строение
элементов-органогенов.
Типы химической связи
учебное пособие для студентов 1 курса
Слайд 2Биоорганическая химия изучает строение и свойства соединений, участвующих в процессах
Слайд 3В основе теории органической химии, сформулированной А.М. Бутлеровым, лежит положение о
Химические свойства органических соединений обусловлены типом химических связей, природой связываемых атомов и их взаимным влиянием. А это, в свою очередь, определяется электронным строением атомов и взаимодействием их атомных орбиталей
Слайд 4Рассмотрим электронное строение атомов тех элементов, которые чаще всего встречаются в
Слайд 6Водород – элемент первого периода, следовательно, его внешний электронный уровень представлен
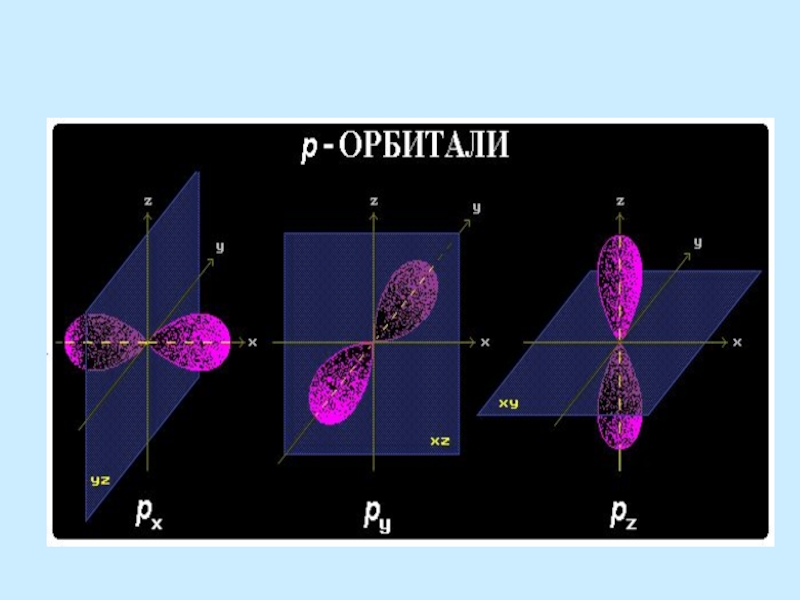
Атомная орбиталь – это область
пространства вокруг атомного ядра,
в которой возможность нахождения
электрона максимальна.
Слайд 8Углерод, азот и кислород – элементы второго периода, их внешний электронный
Слайд 12
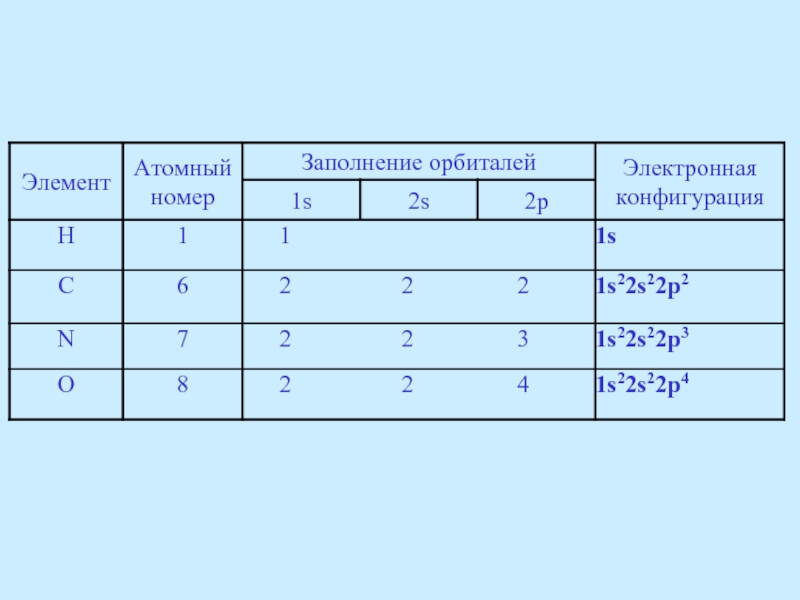
Электронная конфигурация углерода в основном состоянии 1s22s22p2, т.е. углерод должен быть
Слайд 13В органической химии широко используются представления о гибридных орбиталях.
Сущность
Слайд 14Атомы углерода и азота могут находиться в одном из трёх состояний
Процесс sp3-гибридизации протекает с участием всех четырёх внешних атомных орбиталей углерода:
+
+
+
4
s
px
py
pz
sp3
Слайд 16Гибридные орбитали равноценны, имеют форму неправильных объёмных восьмёрок и расположены в
Слайд 17У атома углерода на каждой гибридной орбитали присутствует по одному электрону
Слайд 18Электронная конфигурация sp3-гибридизованного атома азота отличается тем, что на одной из
Слайд 19Эту пару электронов называют неподелённой электронной парой, т.к. обычно она
неподелённая электронная пара
107о
Валентный угол sp3-гибридного
атома азота равен 107о
Слайд 20У sp3-гибридизованного атома кислорода на двух гибридных орбиталях находится по два
Слайд 21У кислорода есть две неподелённых электронных пары.
неподелённые электронные пары
104,5о
Валентный угол
атома кислорода равен 104,5о
Слайд 22 Процесс sp2-гибридизации протекает с участием s- и двух p-орбиталей
+
+
3
s
px
py
sp2
+
Слайд 23sp2-гибридизация
Три гибридных орбитали располагаются в одной плоскости под углом 120о.
Ось негибридизованной pz-орбитали расположена перпендикулярно этой плоскости
Слайд 24Электронная конфигурация sp2-гибридизованного атома углерода
На каждой из атомных орбиталей
Слайд 25Электронная конфигурация sp2-гибридизованного атома азота
Неподеленная электронная
пара может находиться
на негибридной pz-орбитали
Неподеленная
пара может находиться
на одной из гибридных
орбиталей
Слайд 26Электронная конфигурация sp2-гибридизованного атома кислорода
Одна неподеленная элект-
ронная пара находится
на негибридной
другая – на одной из
гибридных
На негибридной pz-орбитали
находится один электрон, а
неподеленные электронные
пары занимают гибридные
орбитали
Слайд 27 Процесс sp-гибридизации протекает с участием s- и px-орбитали (py
+
2
s
px
sp
+
Слайд 28sp-гибридизация
Две гибридных орбитали рас-положены под углом 180о.
py и pz-орбитали расположены
Слайд 29Электронная конфигурация
sp-гибридизованного атома углерода
На каждой орбитали находится по одному электрону
Слайд 30Электронная конфигурация
sp-гибридизованного атома азота
Неподеленная электронная пара всегда находится на одной
Слайд 31Почему важно научиться определять тип гибридизации атомов в молекуле
Это
Это необходимо, чтобы определить преимущественное направление реакции, сравнить активность различных соединений в той или иной химической реакции.
Слайд 32Как определить тип гибридизации атомов в молекуле
Для углерода тип
Слайд 33Как определить тип гибридизации атомов в молекуле
CH2 CH
1 2 3
пропен
Первый атом углерода образовал три σ-связи: две с атомами водорода и одну – с соседним углеродом (двойная связь – это одна σ- и одна π-связь), значит, он sp2-гибридизован. Второй углерод также sp2-гибридизован. Третий углерод образовал четыре σ-связи: три с атомами водорода и одну – с соседним углеродом, значит, он sp3-гибридизован.
Слайд 34Как определить тип гибридизации атомов в молекуле
CH C
1 2 3
пропин
Первый атом углерода образовал две σ-связи: одну с атомом водорода и одну – с соседним углеродом (тройная связь – это одна σ- и две π-связи), значит, он sp-гибридизован. Второй углерод также sp-гибридизован. Третий углерод образовал четыре σ-связи: три с атомами водорода и одну – с соседним углеродом, значит, он sp3-гибридизован.
Слайд 35Как определить тип гибридизации атомов в молекуле
Тип гибридизации атомов
CH3-CH2-OH
этанол
sp3
sp3
CH2=CH-NH2
виниламин
sp2
sp2
Слайд 36 Если мы установили, что атом азота или кислорода находятся
Слайд 37Как определить электронную конфигурацию sp2-гибридизованного атома азота
Если sp2-гибридизованный азот
Слайд 38Как определить электронную конфигурацию sp2-гибридизованного атома кислорода
Если sp2-гибридизованный кислород
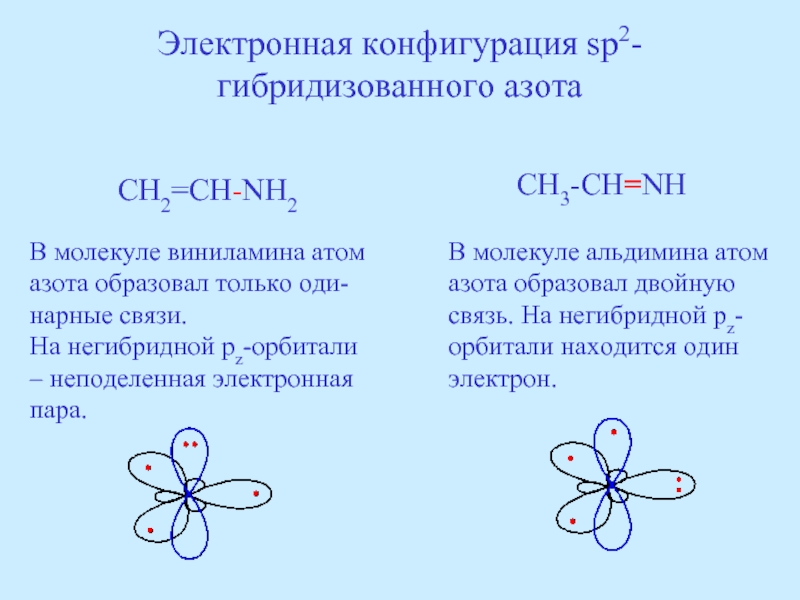
Слайд 39Электронная конфигурация sp2-гибридизованного азота
CH2=CH-NH2
CH3-CH=NH
В молекуле виниламина атом азота образовал только оди-нарные
На негибридной pz-орбитали – неподеленная электронная пара.
В молекуле альдимина атом азота образовал двойную связь. На негибридной pz-орбитали находится один электрон.
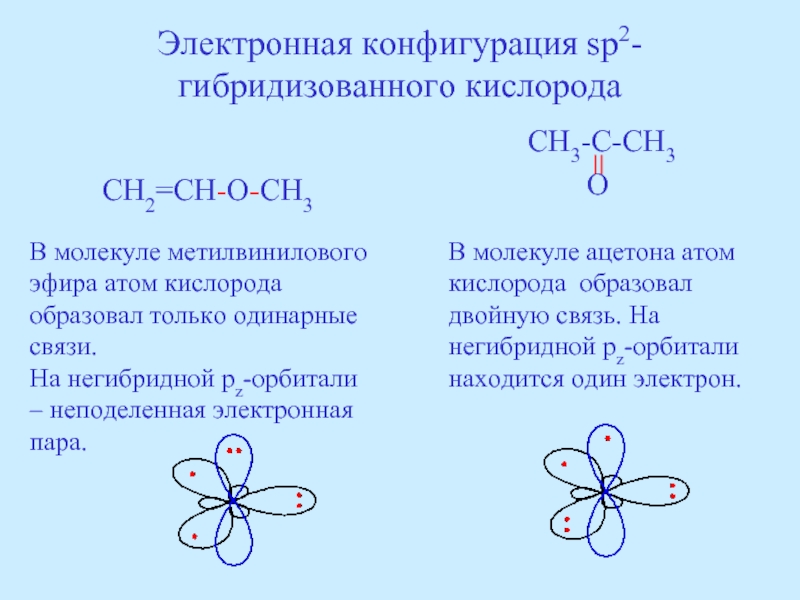
Слайд 40Электронная конфигурация sp2-гибридизованного кислорода
CH2=CH-O-CH3
CH3-C-CH3
В молекуле метилвинилового эфира атом кислорода образовал только одинарные связи.
На негибридной pz-орбитали – неподеленная электронная пара.
В молекуле ацетона атом кислорода образовал двойную связь. На негибридной pz-орбитали находится один электрон.
Слайд 41Химические связи в органических молекулах
Химические связи – это силы,
При образовании связей выделяется энергия, т.е. их образование является энергетически выгодным процессом.
Слайд 42При образовании связей атомы завершают внешний энергетический уровень.
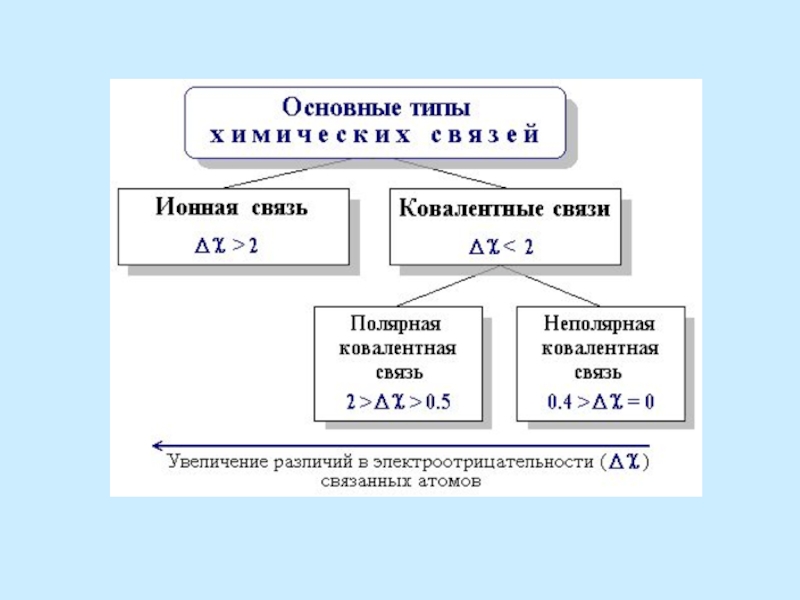
Основными типами
Ионная связь возникает между атомами с очень разной электро-отрицательностью, ковалентная связь – между атомами с одинаковой или близкой электроотрицательностью.
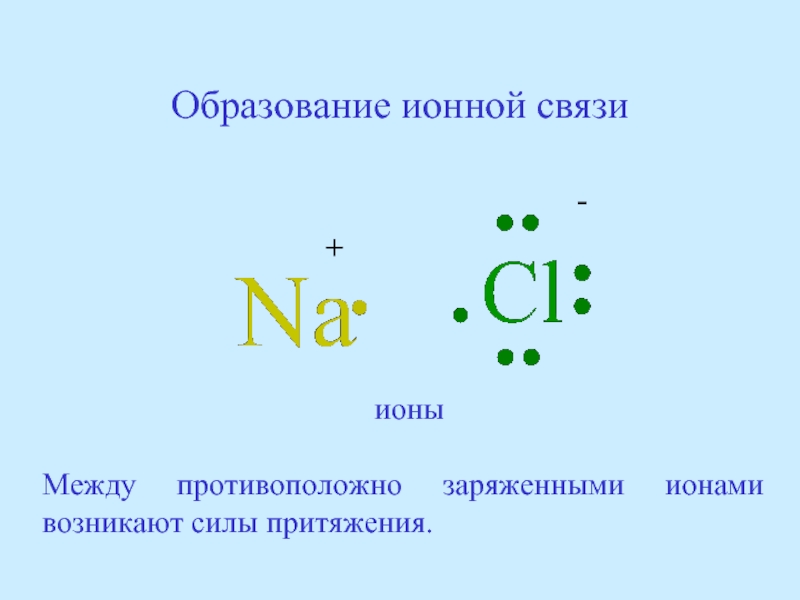
Слайд 45Образование ионной связи
+
-
ионы
Между противоположно заряженными ионами возникают силы притяжения.
Слайд 47Образование ковалентной связи
общая электронная пара
Оба атома хлора
завершили внеш-
ний электронный
уровень
Слайд 50Ковалентная связь может образоваться и по донорно-акцепторному механизму: один из атомов
Слайд 51Существует два типа ковалентных связей – σ- и π-.
Слайд 53π-Связь образуется при боковом перекрывании негибридных p-орбиталей с максимумом перекрывания
p-
Слайд 55Встречающиеся в органических соединениях кратные связи являются сочетанием σ- и
Слайд 56Свойства ковалентной связи выражаются следующими характеристиками:
длина
энергия
полярность
поляризуемость
Слайд 57 Длина связи – это расстояние между центрами связанных атомов. Длина связи
Слайд 58
Чтобы сравнить длины различных связей, нужно сравнить атомные радиусы
В группах атомные радиусы возрастают сверху вниз, т.к. увеличивается число электронных уровней.
Слайд 59 H H
Сравним длины связей H-H, H-Cl и
H H
H Cl
Cl Cl
l
l
l
Слайд 60
Двойная связь короче одинарной, тройная – короче двойной. Это
Слайд 61
Энергия связи – это энергия (в расчёте на 1
или
Энергия связи – это энергия (в расчёте на 1 моль), которая необходима для разрыва связи.
Слайд 62 Чем короче связь, тем она прочнее (например, H-H связь
σ-Связь прочнее π-связи, т.к. при осевом перекрывании атомных орбиталей площадь перекрывания больше, чем при боковом.
Слайд 64 Полярность связи – это неравномерное распределение электронной плотности связи
Cl : Cl
H :Cl
связь неполярная
связь полярная
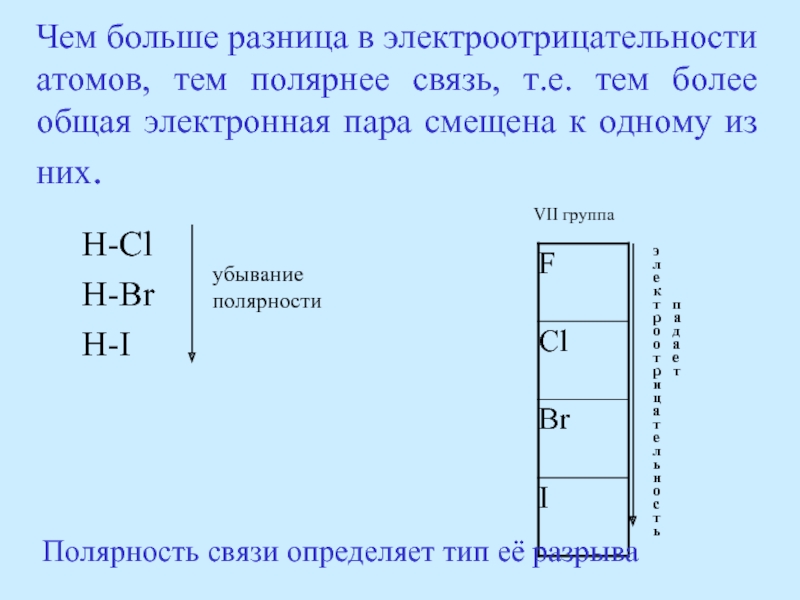
Слайд 65Чем больше разница в электроотрицательности атомов, тем полярнее связь, т.е. тем
H-Cl
H-Br
H-I
убывание
полярности
VII группа
э
л
е
к
т п
р а
о д
о а
т е
р т
и
ц
а
т
е
л
ь
н
о
с
т
ь
Полярность связи определяет тип её разрыва