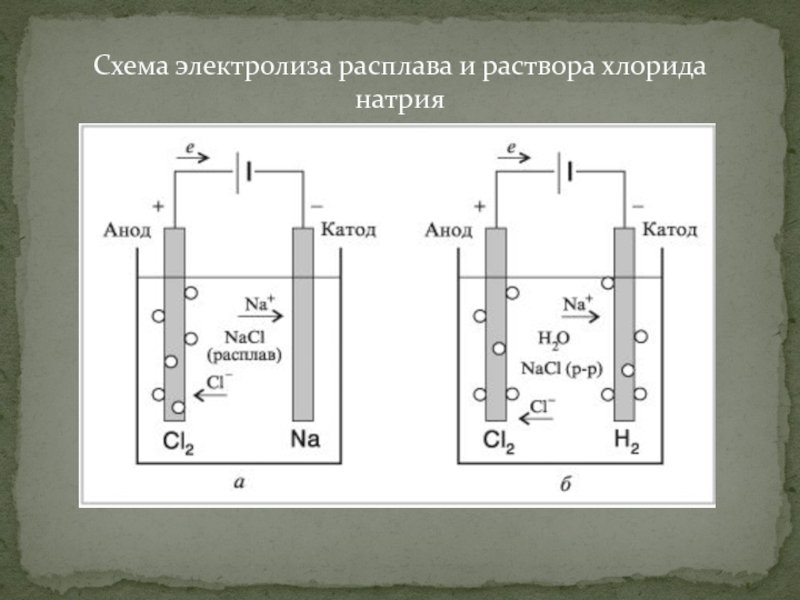
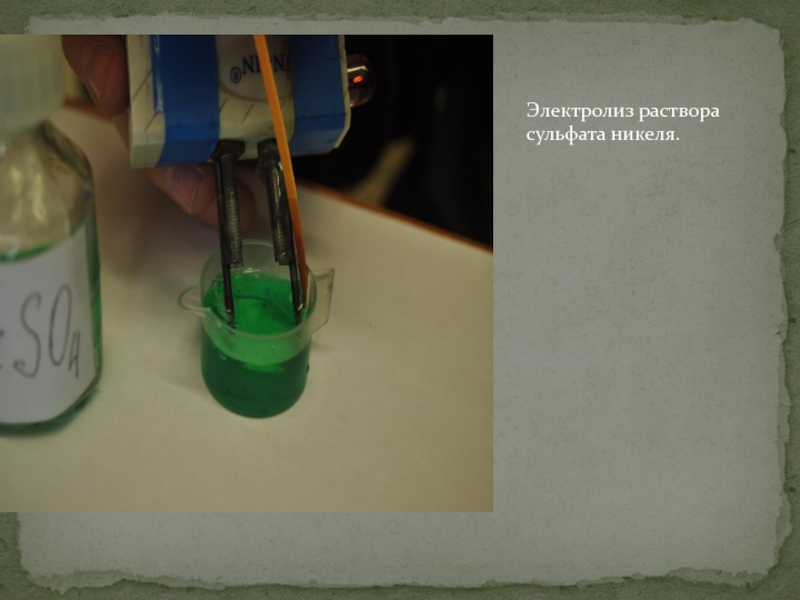
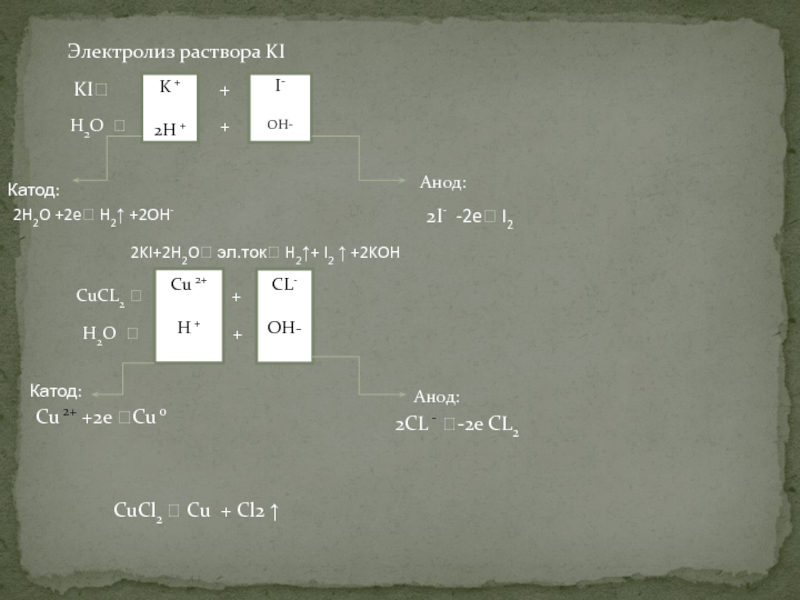
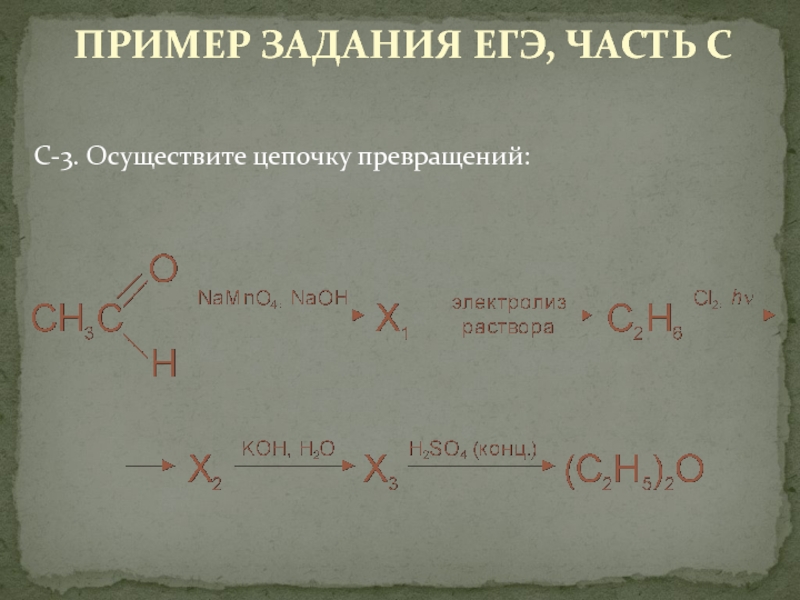
Направление: Электронные приложения и демонстрационные материалы
«Электролиз: опыты к заданиям ЕГЭ»
Работу выполнил
Гафиятуллин Рияз, 11 А класс
Руководитель
Рахимова Розалия Хамидовна
Казань – 2014
Министерство образования и науки Республики Татарстан
МБОУ « Средняя общеобразовательная школа № 171 с углубленным изучением отдельных предметов»