- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролитическая диссоциация. Степень и константа диссоциации презентация
Содержание
- 1. Электролитическая диссоциация. Степень и константа диссоциации
- 2. Тема: Электролитическая диссоциация. Степень и константа диссоциации.
- 3. Растворы (расплавы) Электролиты – проводят электрический
- 4. 2) В растворе или расплаве электролитов оны
- 5. Теория электролитической диссоциации Аррениуса (1887г.) Молекулы электролитов
- 7. 3) Диссоциация процесс обратимый.
- 8. Механизм электролитической диссоциации. Гидратация ионов. 1) Механизм диссоциации электролитов с ионной связью
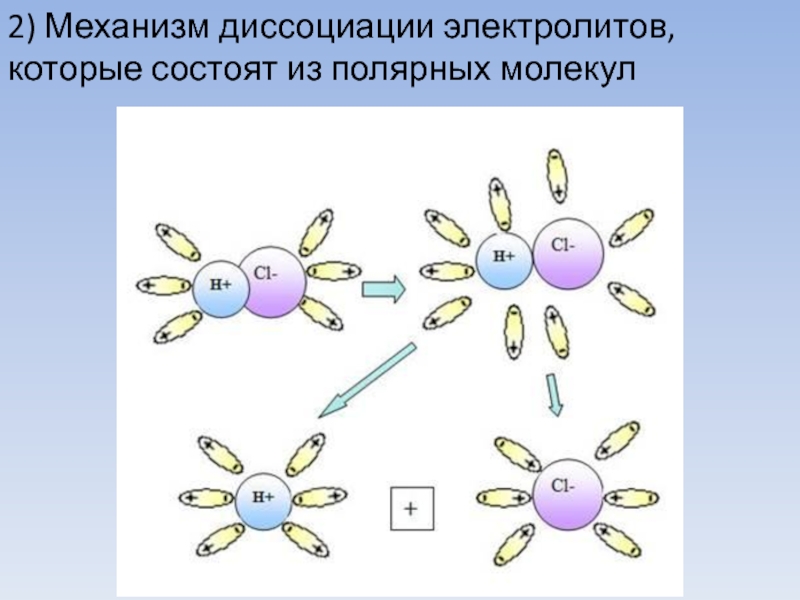
- 9. 2) Механизм диссоциации электролитов, которые состоят из полярных молекул
- 10. Степень диссоциации
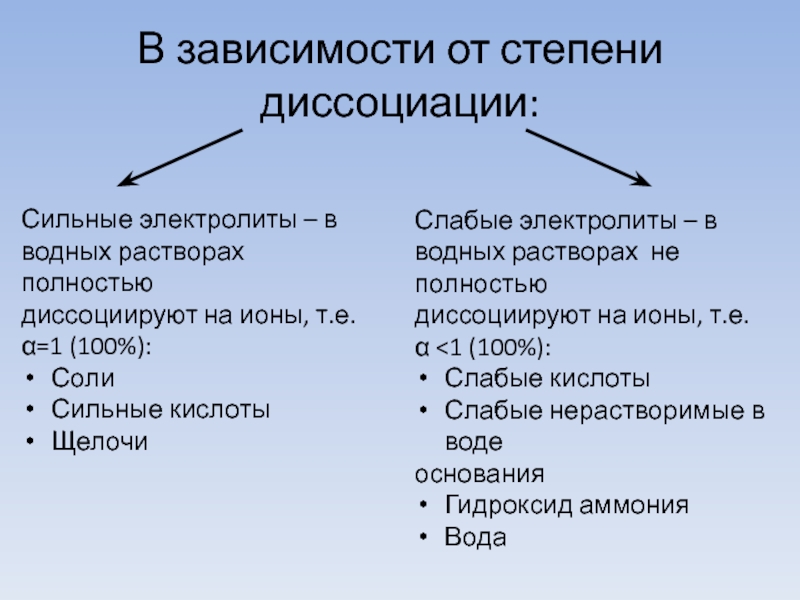
- 11. В зависимости от степени диссоциации: Сильные электролиты
- 13. Константа диссоциации Для характеристики слабых электролитов применяют
- 15. Диссоциация солей, оснований, амфотерных гидроксидов и солей
- 17. Сильные однокислотные Сильные двухкислотные Слабые многокислотные основания диссоциируют ступенчато
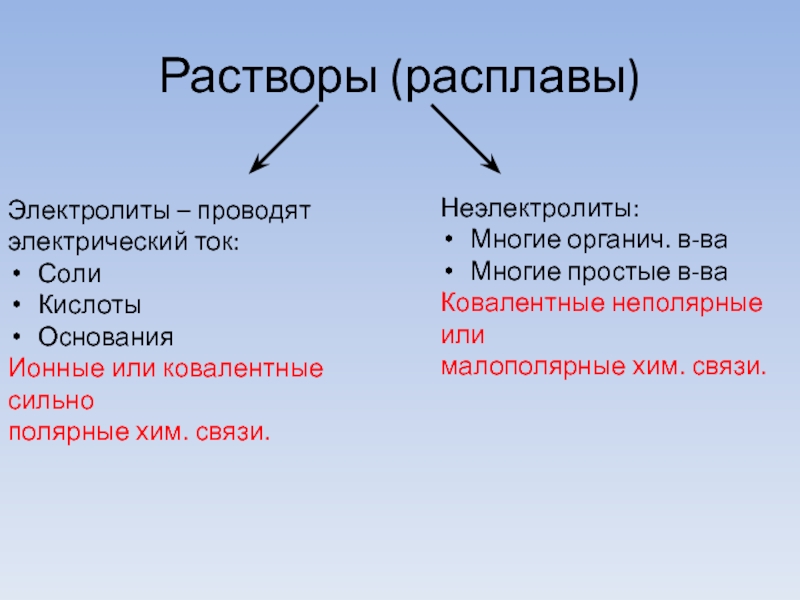
Слайд 3Растворы (расплавы)
Электролиты – проводят
электрический ток:
Соли
Кислоты
Основания
Ионные или ковалентные сильно
полярные хим. связи.
Неэлектролиты:
Многие
органич. в-ва
Многие простые в-ва
Ковалентные неполярные или
малополярные хим. связи.
Многие простые в-ва
Ковалентные неполярные или
малополярные хим. связи.
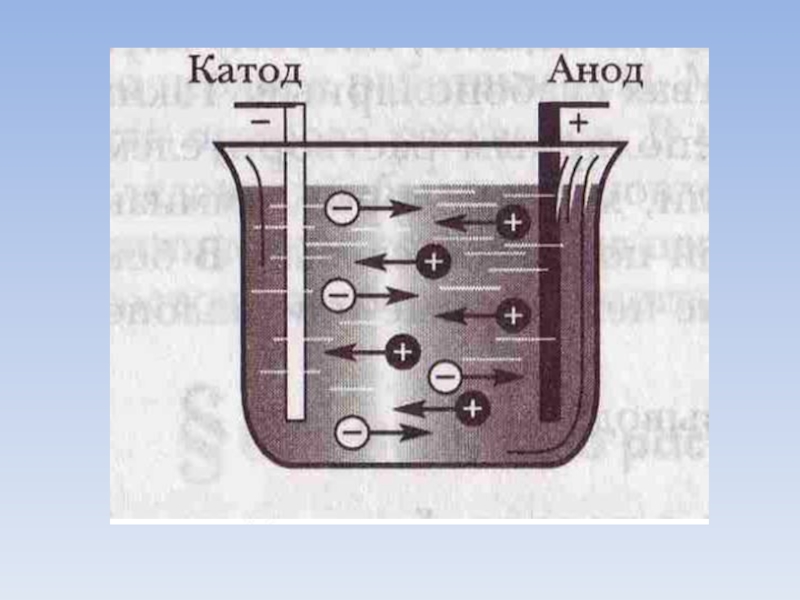
Слайд 42) В растворе или расплаве электролитов оны движутся хаотически. При пропускании
через раствор или расплав электрического тока положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы к положительно заряженному электроду (аноду). Поэтому положительно заряженные ионы называются КАТИОНАМИ, а отрицательно заряженные ионы – АНИОНАМИ.
КАТИОНЫ:
АНИОНЫ:
КАТИОНЫ:
АНИОНЫ:
Слайд 5Теория электролитической диссоциации Аррениуса (1887г.)
Молекулы электролитов при растворении или расплавлении распадаются
на ионы
Ионы – атомы или группы атомов, имеющие положительный или отрицательй заряд.
Ионы – атомы или группы атомов, имеющие положительный или отрицательй заряд.
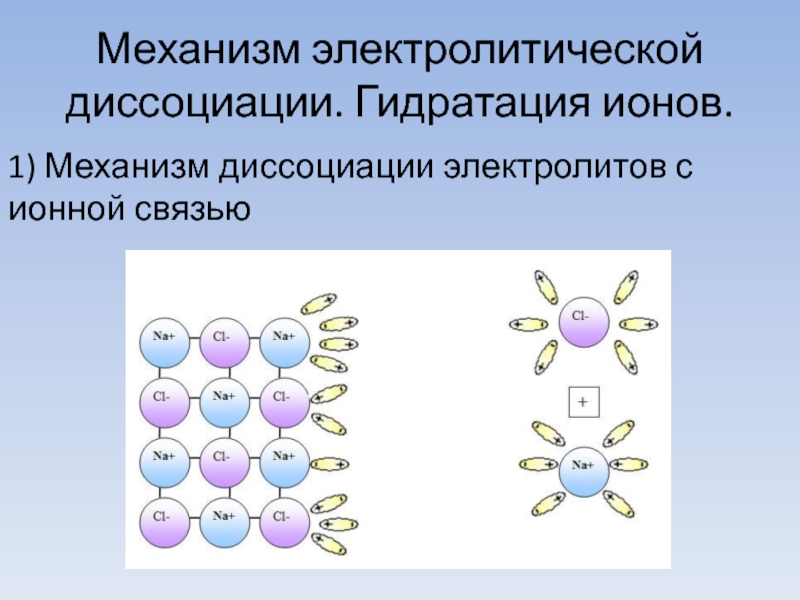
Слайд 8Механизм электролитической диссоциации. Гидратация ионов.
1) Механизм диссоциации электролитов с ионной связью
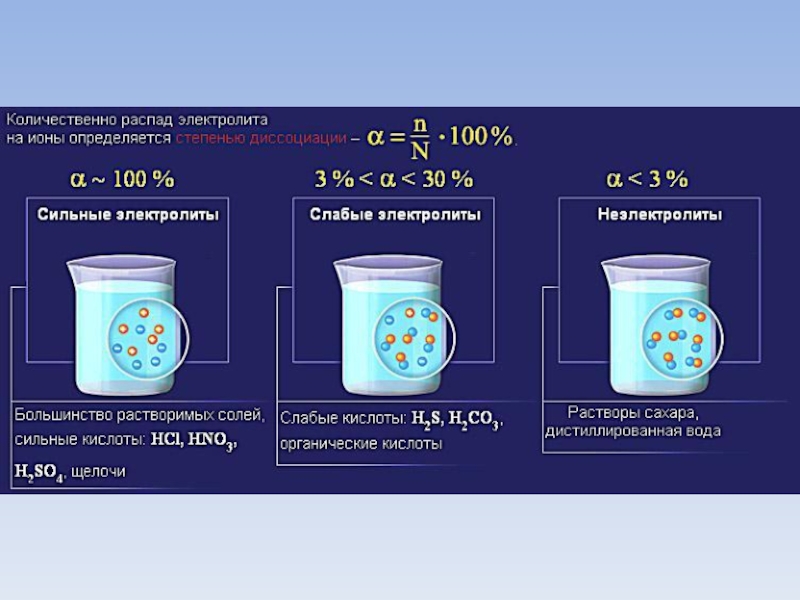
Слайд 10Степень диссоциации
Степень диссоциации зависит:
1)Природы растворяемого вещества
2) Концентрации раствора
3) Температуры
Слайд 11В зависимости от степени диссоциации:
Сильные электролиты – в
водных растворах полностью
диссоциируют
на ионы, т.е.
α=1 (100%):
Соли
Сильные кислоты
Щелочи
α=1 (100%):
Соли
Сильные кислоты
Щелочи
Слабые электролиты – в
водных растворах не полностью
диссоциируют на ионы, т.е.
α <1 (100%):
Слабые кислоты
Слабые нерастворимые в воде
основания
Гидроксид аммония
Вода
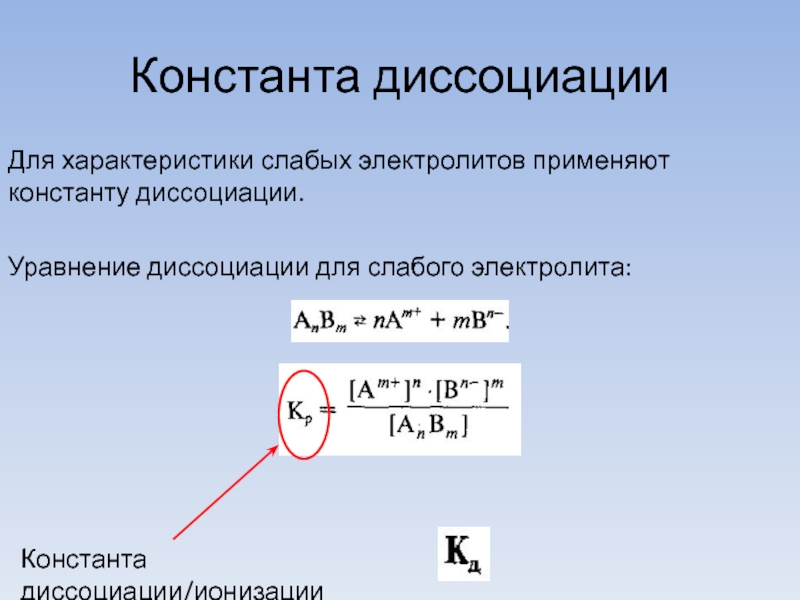
Слайд 13Константа диссоциации
Для характеристики слабых электролитов применяют константу диссоциации.
Уравнение диссоциации для слабого
электролита:
Константа диссоциации/ионизации
Слайд 14
характеризует способность электролита диссоциировать на ионы.
Чем больше , тем легче электролит распадается на ионы, тем больше его ионов в растворе, тем сильнее электролит.
ЗАВИСИТ: природы электролита и растворителя, температуры
НЕ ЗАВИСИТ: концентрации раствора
Чем больше , тем легче электролит распадается на ионы, тем больше его ионов в растворе, тем сильнее электролит.
ЗАВИСИТ: природы электролита и растворителя, температуры
НЕ ЗАВИСИТ: концентрации раствора
Слайд 15Диссоциация солей, оснований, амфотерных гидроксидов и солей в водных растворах
Сильные кислоты
Слабые
многоосновные кислоты диссоциируют ступенчато (число ступеней диссоциации зависит от основности кислоты)