- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролитическая диссоциация презентация
Содержание
- 1. Электролитическая диссоциация
- 2. Ознакомиться с электролитической диссоциацией , её особенностями , рассмотреть примеры. Цель:
- 3. -Определение -Особенности -Тип кристаллической решетки -Схемы образования -Примеры -Тест -Вывод -Литература Содержание:
- 4. Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. Определение:
- 6. Диссоциация на ионы в растворах происходит вследствие
- 7. Под действием высоких температур ионы кристаллической решётки
- 8. -Процессу диссоциации подвержены все вещества, имеющие ионный
- 9. Сильные электролиты Слабые электролиты Сильные электролиты
- 10. Электроли́ты — вещества, которые проводят электрический ток
- 12. Электролиты: -Кислоты (HCl;HNO3;H2SO4) -Щелочи( NaOH; KOH;
- 13. Практическая часть
- 14. Ознакомилась с электролитической диссоциацией и её особенностями , рассмотрела примеры. Вывод:
- 15. https://ru.wikipedia.org/wiki/Электролитическая_диссо.. http://ppt4web.ru/khimija/ehlektroliticheskaja-dissoc.. http://www.alhimikov.net/dissoziation/Page-1.html Учебник Химия. 11 класс. Базовый уровень Габриелян О.С. Литература:
Слайд 3 -Определение
-Особенности
-Тип кристаллической решетки
-Схемы образования
-Примеры
-Тест
-Вывод
-Литература
Содержание:
Слайд 4Электролитическая диссоциация — процесс распада электролита на ионы при его растворении
Определение:
Слайд 6Диссоциация на ионы в растворах происходит вследствие взаимодействия растворённого вещества с
Диссоциация в растворах
Слайд 7Под действием высоких температур ионы кристаллической решётки начинают совершать колебания, кинетическая
Диссоциация при плавлении
Слайд 8-Процессу диссоциации подвержены все вещества, имеющие ионный и ковалентный полярный тип
Особенности:
Слайд 9Сильные электролиты
Слабые электролиты
Сильные электролиты — химические соединения, молекулы которых в разбавленных
Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
Слайд 10Электроли́ты — вещества, которые проводят электрический ток вследствие диссоциации на ионы,
Неэлектролиты -вещества, водные растворы и расплавы которых не проводят электрический ток.
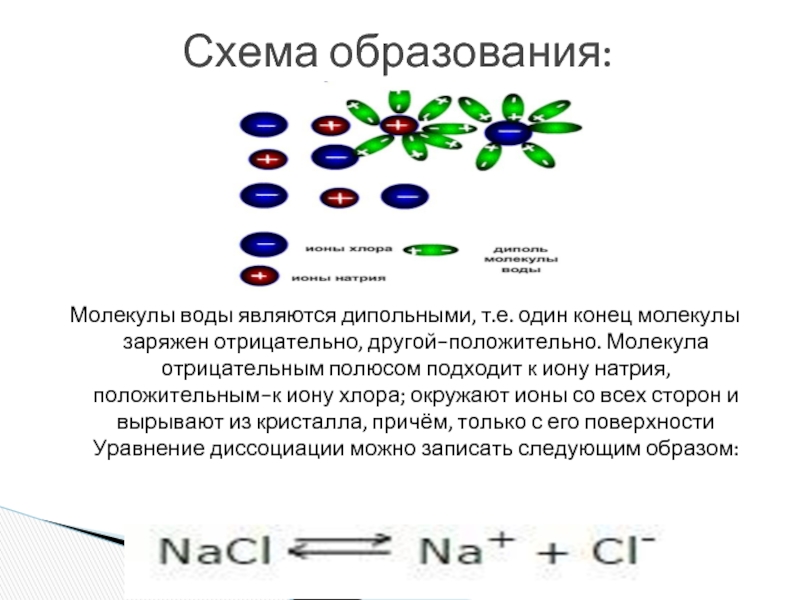
Слайд 11
Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой-положительно.
Схема образования:
Слайд 12Электролиты:
-Кислоты (HCl;HNO3;H2SO4)
-Щелочи( NaOH; KOH; Ba(OH)2)
-Соли(NaCl; CuSO4; Al(NO3)3)
Неэлектролиты:
-Органические вещества(сахар, ацетон,бензин, керосин, глицерин,
Примеры: