Лекция 3. Электрохимические методы анализа
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электрохимические методы анализа. Лекция 3 презентация
Содержание
- 1. Электрохимические методы анализа. Лекция 3
- 2. Неравновесные электрохимические системы Поляризация – изменение
- 3. Кинетическая поляризация (перенапряжение) - поляризация, вызванная
- 4. Вольтамперометрия Вольтамперометрия включает электрохимические методы анализа
- 5. лекция3 Аналитическая химия 2. ФХМА Рабочие (индикаторные)
- 6. лекция3 Аналитическая химия 2. ФХМА Твердые электроды
- 7. лекция3 Аналитическая химия 2. ФХМА Ультрамикроэлектроды –
- 8. лекция3 Аналитическая химия 2. ФХМА Полярография
- 9. лекция3 Аналитическая химия 2. ФХМА Полярограмма раствора,
- 10. Разновидности полярографии Полярография с линейной
- 11. лекция3 Аналитическая химия 2. ФХМА Импульсная полярография
- 12. лекция3 Аналитическая химия 2. ФХМА Инверсионная вольтамперометрия
- 13. лекция3 Аналитическая химия 2. ФХМА Амперометрическое титрование
- 14. лекция3 Аналитическая химия 2. ФХМА Преимущества вольтамперометрии
- 15. лекция3 Аналитическая химия 2. ФХМА Кулонометрия Законы
- 16. лекция3 Аналитическая химия 2. ФХМА Гальваностатическая кулонометрия
- 17. лекция3 Аналитическая химия 2. ФХМА Кулонометрическое титрование
- 18. лекция3 Аналитическая химия 2. ФХМА Кондуктометрия
- 19. лекция3 Аналитическая химия 2. ФХМА Кондуктометрическое титрование
Слайд 1Аналитическая химия II. Физические и физико-химические методы анализа
лекция3
Аналитическая химия 2.
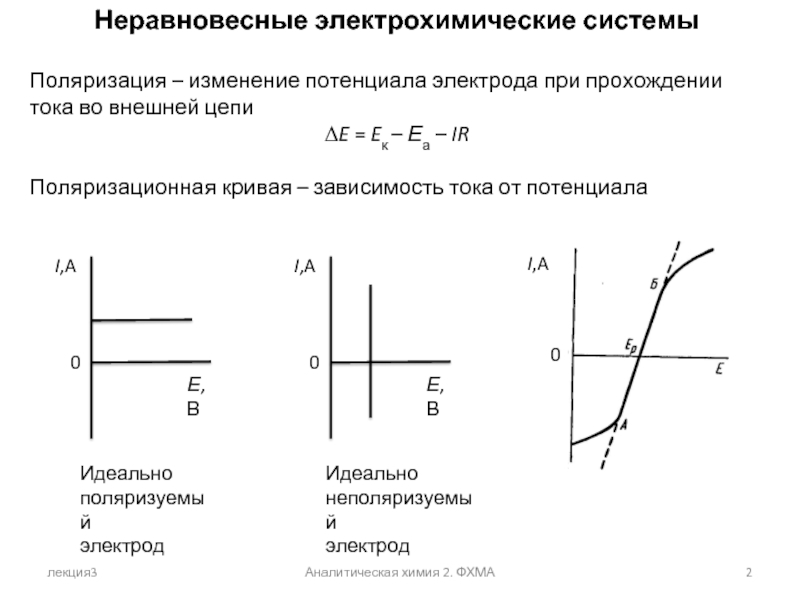
Слайд 2Неравновесные электрохимические системы
Поляризация – изменение потенциала электрода при прохождении тока во
ΔE = Eк – Еа – IR
Поляризационная кривая – зависимость тока от потенциала
Идеально
поляризуемый
электрод
Идеально
неполяризуемый
электрод
лекция3
Аналитическая химия 2. ФХМА
Слайд 3
Кинетическая поляризация (перенапряжение) - поляризация, вызванная замедленной стадией процесса разряда –
ηt =E-EI=0
Концентрационная поляризация - поляризация, вызванная обеднением приэлектродного слоя электроактивным веществом, расходующимся в электрохимической реакции, из-за медленной его диффузии из глубины раствора.
лекция3
Аналитическая химия 2. ФХМА
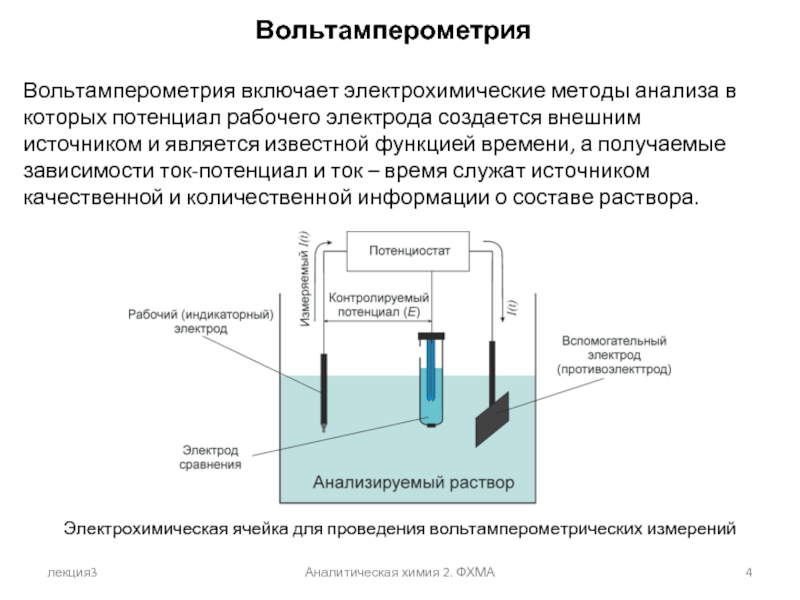
Слайд 4Вольтамперометрия
Вольтамперометрия включает электрохимические методы анализа в которых потенциал рабочего электрода создается
лекция3
Аналитическая химия 2. ФХМА
Электрохимическая ячейка для проведения вольтамперометрических измерений
Слайд 5лекция3
Аналитическая химия 2. ФХМА
Рабочие (индикаторные) электроды
Рабочий электрод в вольтамерометрических методах должен
Ртутный капающий электрод
постоянное обновление поверхности электрода предотвращает загрязнение поверхности электрода;
ртутный электрод является почти идеально поляризуемым в широком интервале потенциалов:
от +0,4 ̶ 0,06 (окисление ртути в кислой или щелочной среде) до -2 ̶ -2.7 (восстановление катиона фонового электролита)
S = 0,85m2/3t2/3
Статический ртутный капельный электрод
-электрод с заданной площадью
Слайд 6лекция3
Аналитическая химия 2. ФХМА
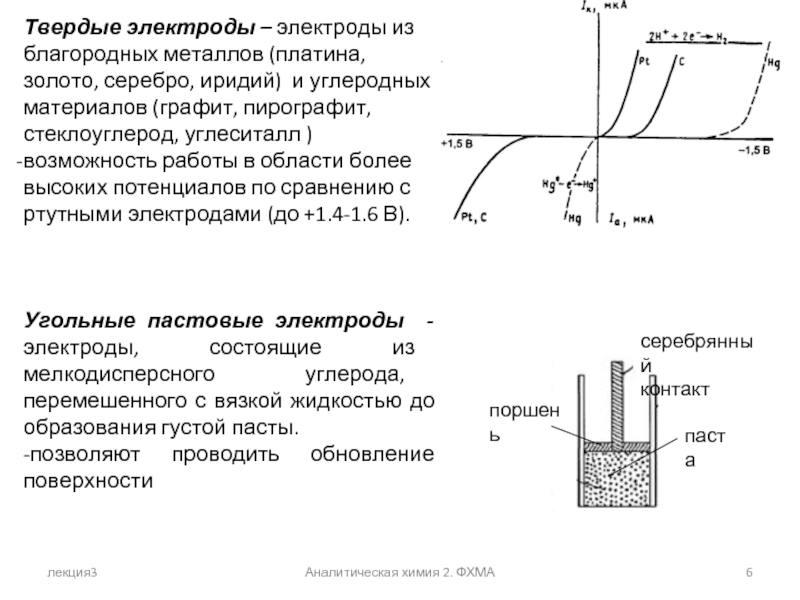
Твердые электроды – электроды из благородных металлов (платина,
возможность работы в области более высоких потенциалов по сравнению с ртутными электродами (до +1.4-1.6 В).
Угольные пастовые электроды - электроды, состоящие из мелкодисперсного углерода, перемешенного с вязкой жидкостью до образования густой пасты.
-позволяют проводить обновление поверхности
Слайд 7лекция3
Аналитическая химия 2. ФХМА
Ультрамикроэлектроды – электроды, сечение которых хотя бы в
Одноразовые электроды – электроды, напечатанные на полимерной пленке чернилами, содержащими мелкодисперсный углерод.
Вращающийся дисковый электрод - особая форма твердого электрода. Рабочей частью дискового электрода служит диск из проводящего материала, запрессованный (или впаянный) в изолирующую оболочку. электрод приводится во вращение вокруг своей оси при помощи электромотора.
Пленочные электроды – амальгамные электроды (проволока или диск из серебра, золота или платины в металлической ртути), золотые пленочные электроды и т.д.
Ртутно-графитовые электроды – элетролитически осажденная ртуть на поверхности графита или стеклоуглерода
Слайд 8лекция3
Аналитическая химия 2. ФХМА
Полярография
Полярография – вольтамперометрия с линейной разверткой
Остаточный ток (участок A-Б) = Iф+Ic
фарадеевский ток, возникающий за счет окисление или восстановление примесей из раствора;
ток заряжения(емкостный тока), возникающего за счет заряжения или разряда двойного электрического слоя: Ic=kCim2/3t-1/3(E-EM)
Ток, контролируемый переносом заряда (участок Б-В) – ток, возникающий за счет протекания электрохимической реакции на электроде.
Предельный диффузионный ток
(участок В-Г) – максимальный ток, возникающий при установлении динамического равновесия при котором все ионы деполяризатора, достигшие поверхности электрода, немедленно восстанавливаются. Определяется только диффузией поляризатора из объема раствора в приэлектродный слой.
Vдиф = k’(c0-cs); Iдиф = k(c0-cs)
Iдиф = 607nD1/2m2/3t1/6c (у-е Ильковича),
n – число электронов, m- скорость вытекания ртути , D – коэффициент диффузии , t – период капания
Полярограмма обратимого процесса восстановления
Слайд 9лекция3
Аналитическая химия 2. ФХМА
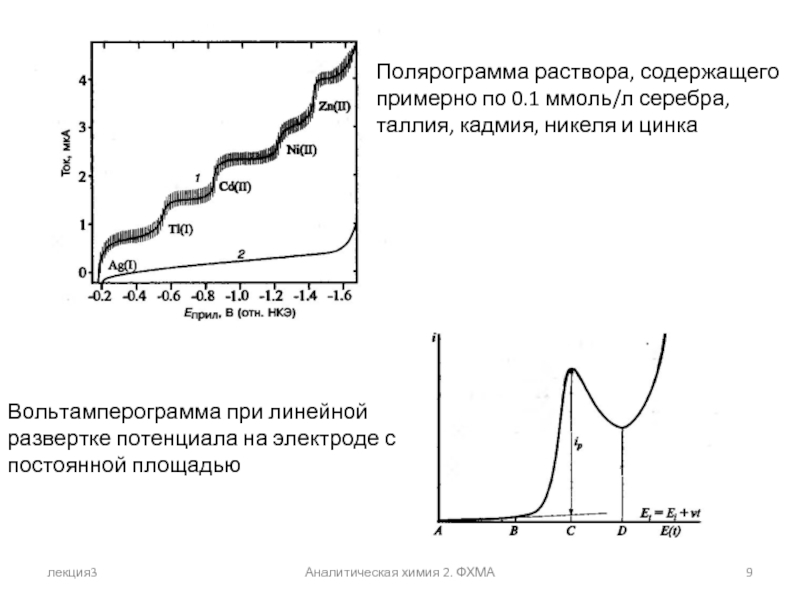
Полярограмма раствора, содержащего примерно по 0.1 ммоль/л серебра,
Вольтамперограмма при линейной развертке потенциала на электроде с постоянной площадью
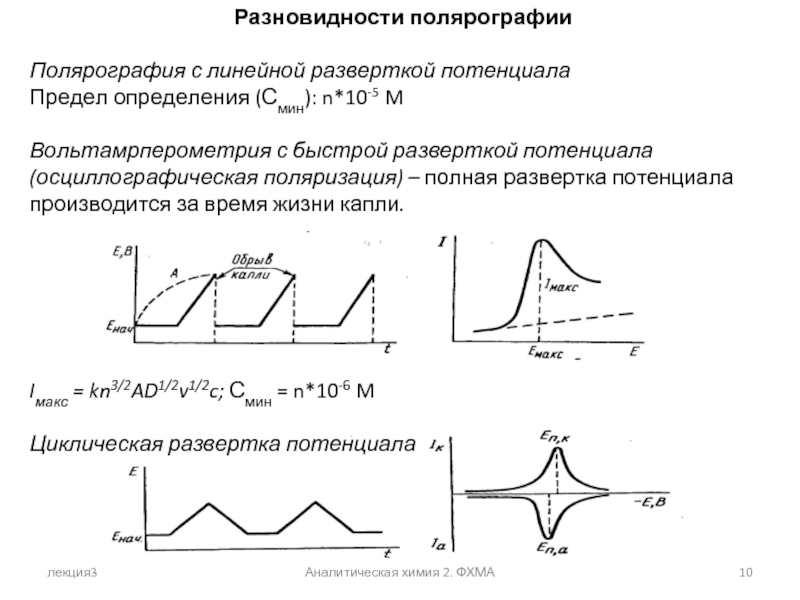
Слайд 10Разновидности полярографии
Полярография с линейной разверткой потенциала
Предел определения (Смин): n*10-5 M
Вольтамрперометрия
Iмакс = kn3/2AD1/2v1/2c; Смин = n*10-6 M
Циклическая развертка потенциала
лекция3
Аналитическая химия 2. ФХМА
Слайд 11лекция3
Аналитическая химия 2. ФХМА
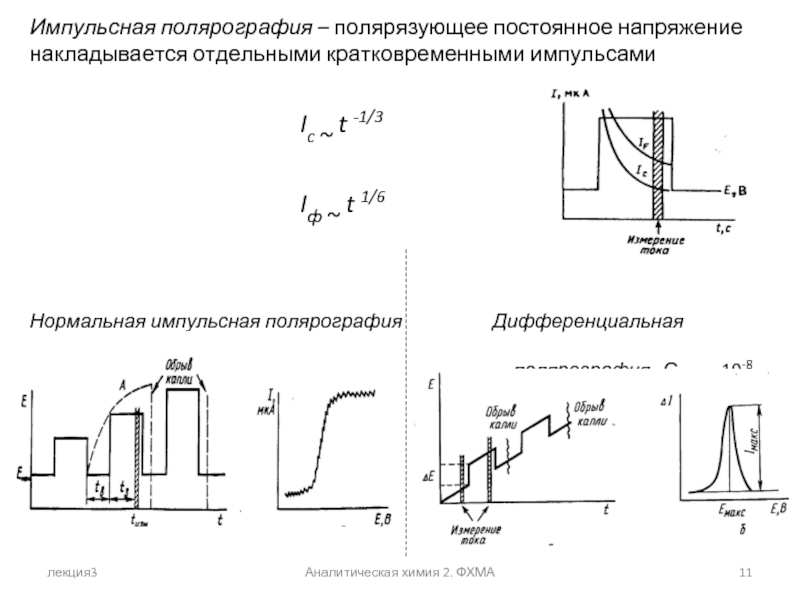
Импульсная полярография – полярязующее постоянное напряжение накладывается отдельными
Ic ~ t -1/3
Iф ~ t 1/6
Нормальная импульсная полярография Дифференциальная импульсная
Смин = 5*10-7 полярография Смин = 10-8
Слайд 12лекция3
Аналитическая химия 2. ФХМА
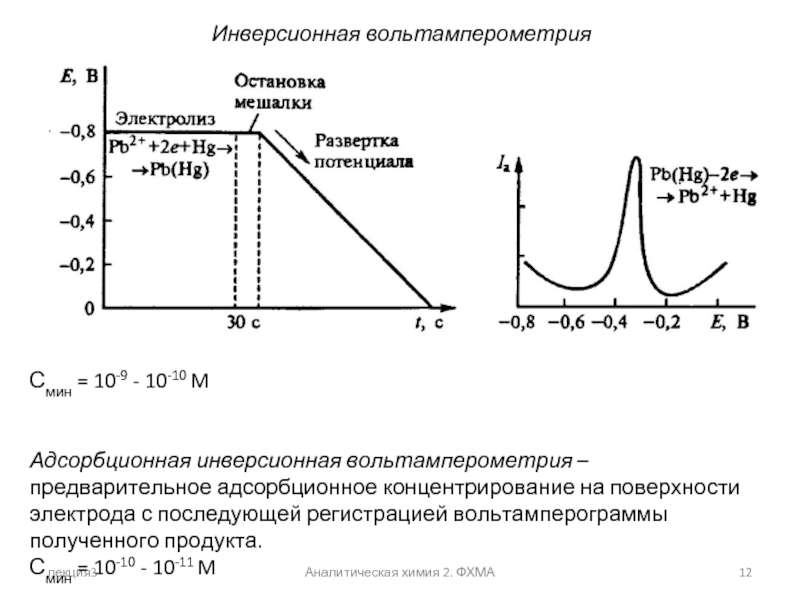
Инверсионная вольтамперометрия
Смин = 10-9 - 10-10 M
Адсорбционная
Смин = 10-10 - 10-11 M
Слайд 13лекция3
Аналитическая химия 2. ФХМА
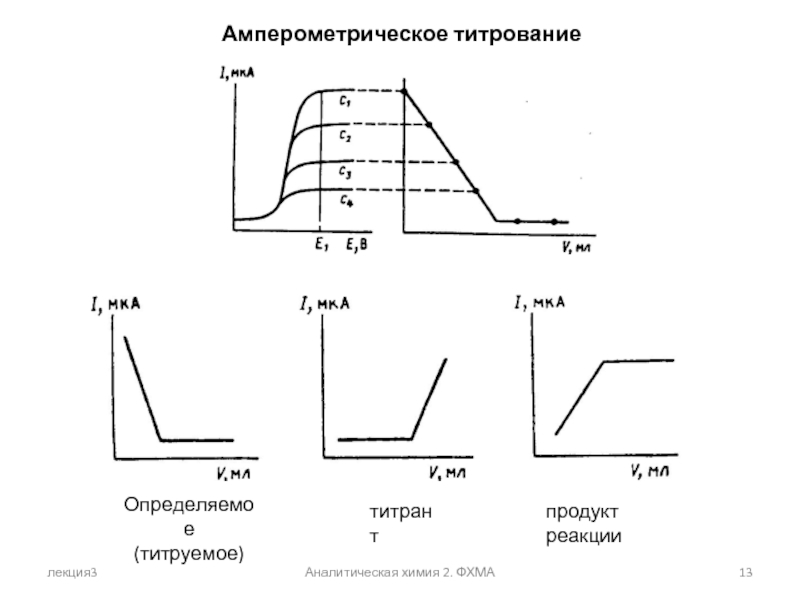
Амперометрическое титрование
Определяемое
(титруемое)
титрант
продукт реакции
Слайд 14лекция3
Аналитическая химия 2. ФХМА
Преимущества вольтамперометрии
-Возможность качественного и количественного определения неорганических и
-Одновременный многоэлементный(многокомпонентный) анализ
-Низкие пределы определения (до 10-11 M в варианте инверсионной вольтамперолметрии)
-Большой динамический концентрационный диапазон определения (10-11 – 10-2M)
-Возможность миниатюризации сенсоров
-Широкий круг анализируемых объектов – химические, биологические, геологические и т.д.
Ограничения вольтамперометрии
-Определяемое вещество должно быть электроактивно
-При использовании статических электродов возможно загрязнение их поверхности, что приведет к невоспроизводимым результатам анализа; при использовании капающего электрода необходимо использовать токсичную ртуть.
Слайд 15лекция3
Аналитическая химия 2. ФХМА
Кулонометрия
Законы Фарадея
Количество электропревращенного (восстановленного или окисленного) в процессе
Массы различных веществ, выделенных или растворенных при прохождении одного и того же количества электричества, пропорциональны их электрохимическим эквивалентам.
Электрохимический эквивалент – это масса вещества, выделившегося на электроде (или растворившегося с электрода ) в процессе электролиза при протекании единицы количества электричества.
,
Q – количество электричества, Кл; m – масса выделившегося на электроде вещества, г.; M – молярная масса определяемого вещества, г/моль; n – число электронов, участвующих в электродной реакции.
F = 96484 Кл/моль
Слайд 16лекция3
Аналитическая химия 2. ФХМА
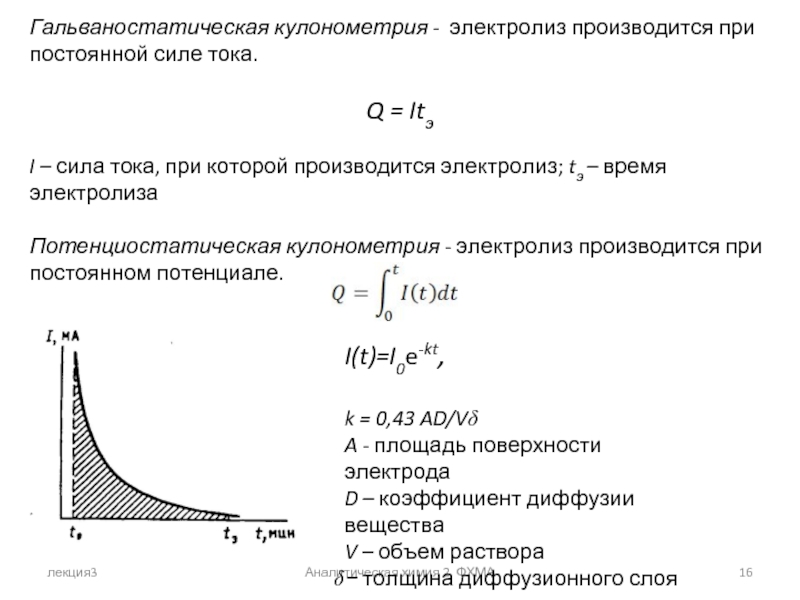
Гальваностатическая кулонометрия - электролиз производится при постоянной силе
Q = Itэ
I – сила тока, при которой производится электролиз; tэ – время электролиза
Потенциостатическая кулонометрия - электролиз производится при постоянном потенциале.
I(t)=I0e-kt,
k = 0,43 AD/Vδ
A - площадь поверхности электрода
D – коэффициент диффузии вещества
V – объем раствора
− толщина диффузионного слоя
Слайд 17лекция3
Аналитическая химия 2. ФХМА
Кулонометрическое титрование
В процессе титрования определяемое вещество реагирует с
Слайд 18лекция3
Аналитическая химия 2. ФХМА
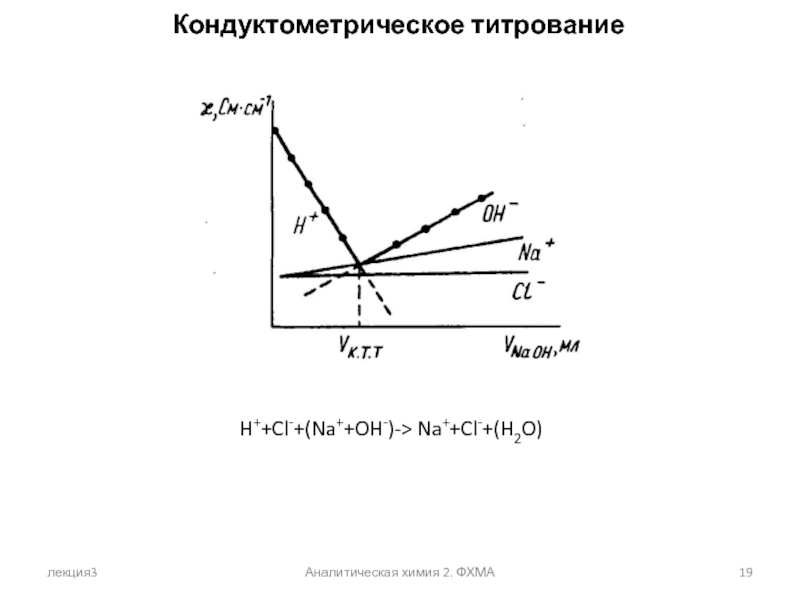
Кондуктометрия
Кондуктометрия основана на измерении удельной электропроводности анализируемого раствора.
Сопротивление
d – расстояние между электродами (см), A – площадь электрода (см2 )
Удельная электропроводность χ = 1/ρ
= 10-3A/dΣλici , λi - эквивалентная электропроводность i-го иона (Ом-1·см2/г·экв)