- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электрохимическая коррозия металлов презентация
Содержание
- 1. Электрохимическая коррозия металлов
- 2. Электрохимической коррозией называется самопроизвольный процесс разрушения металлов
- 3. ЭРаспространеннррррр Электролит – любая электропроводящая жидкость. В
- 4. Электрохимическая коррозия встречается повсеместно (атмосферная, подводная,
- 5. Fe - 2e→Fe2+
- 6. - + Fe Fe+2
- 7. Екор – потенциал коррозии, образующийся за счёт
- 8. Коррозионный потенциал возникает всегда когда выполняется термодинамическое
- 9. Насколько часто выполняется термодинамическое условие электрохимической
- 10. Al Zn Fe
- 11. Растворенный в электролите кислород самый распространенный окислитель
- 12. Ион водорода или вода также могут вызывать
- 13. Me - ne Катионы Меne+ Комплексные соединения
- 14. Наиболее опасен для практики случай, когда
- 15. Если в результате анодной реакции коррозионного процесса
- 16. Если продукты коррозии получаются рыхлые не
- 17. Состояние повышенной коррозионной стойкости металла, вызванное
- 18. Электрохимическая коррозия чаще
- 19. При локальной коррозии в металле и
- 20. Возникает всегда, когда на поверхности металла появляется
- 21. В строительной практике электрохимическая коррозия чаще
- 22. Особенности коррозии с водородной деполяризацией Сопровождается выделением
- 23. Особенности коррозии с кислородной деполяризацией Растворимость кислорода
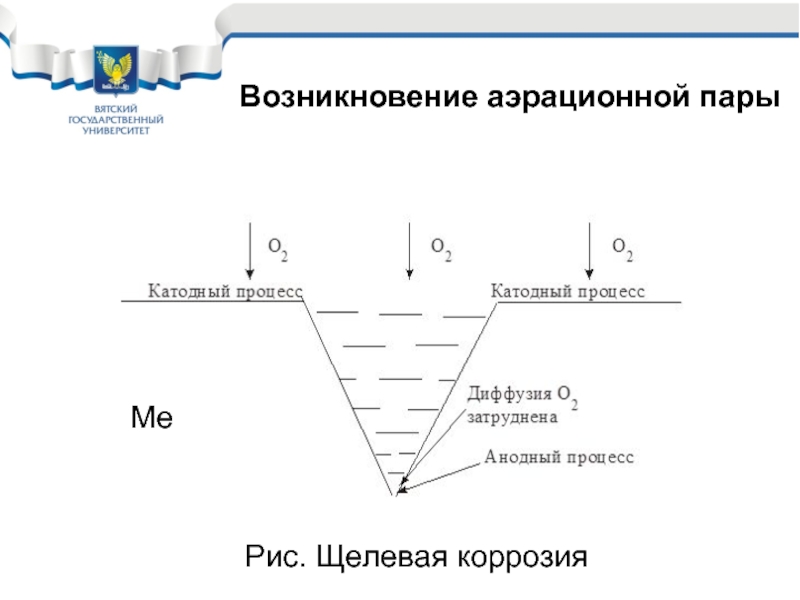
- 24. Возникновение аэрационной пары Рис. Щелевая коррозия Ме
- 25. Чтобы проанализировать коррозионную ситуацию и оценить
- 26. Исходя из состава коррозионной среды прежде всего
- 27. Далее необходимо сравнить стационарный потенциал коррозии (Екор)
- 28. Равновесные потенциалы окислителей
- 29. Пример: Если потенциал коррозии Екор равен
- 30. Для определения пути реакции коррозионного процесса
- 31. Если в коррозионной среде нет комплексообразователей,
- 32. 7 2 3 4 1
- 33. 1 3 5 7
- 34. Пример: В растворах Na2SO4 железо согласно
- 35. Анализ коррозионного процесса для углеродистых и
- 36. В диапазоне рН 11,5-13 железо корродирует
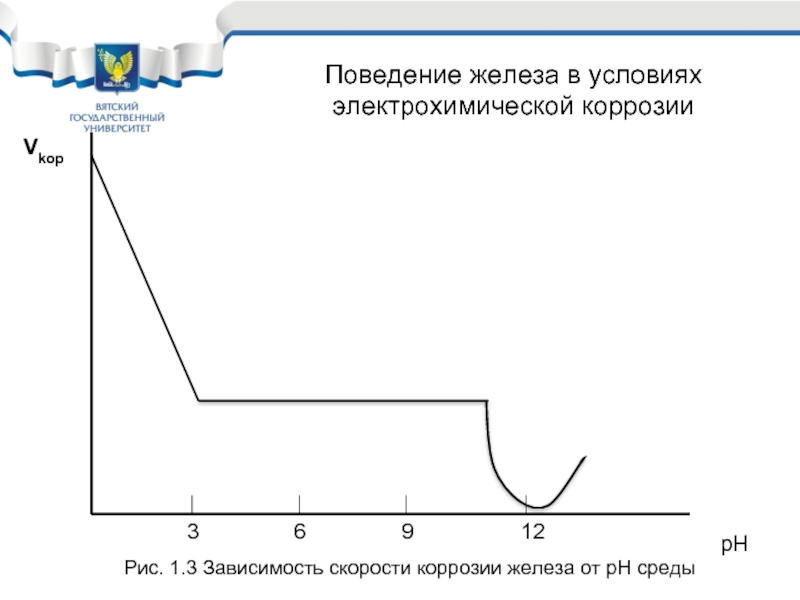
- 37. Vkop рH 3 6 9
- 38. Вывод: Железо, углеродистые и
- 39. Коррозия металлов в контакте (Контактная коррозия)
- 40. Т.е. при контактной коррозии потенциал более
- 41. Ответы на эти вопросы дает ГОСТ
Слайд 2Электрохимической коррозией называется самопроизвольный процесс разрушения металлов под действием электролитов ,
Определение
Слайд 3ЭРаспространеннррррр
Электролит – любая электропроводящая жидкость.
В строительной практике это вода и любые
Чтобы узнать есть ли электрохимическая коррозия - нужно ответить на вопрос: есть ли электролит на поверхности металла в рассматриваемых условиях.
Распространенность электрохимической коррозии
Слайд 4
Электрохимическая коррозия встречается повсеместно (атмосферная, подводная, грунтовая коррозии).
Возникает вопрос: как возникают
Распространенность электрохимической коррозии
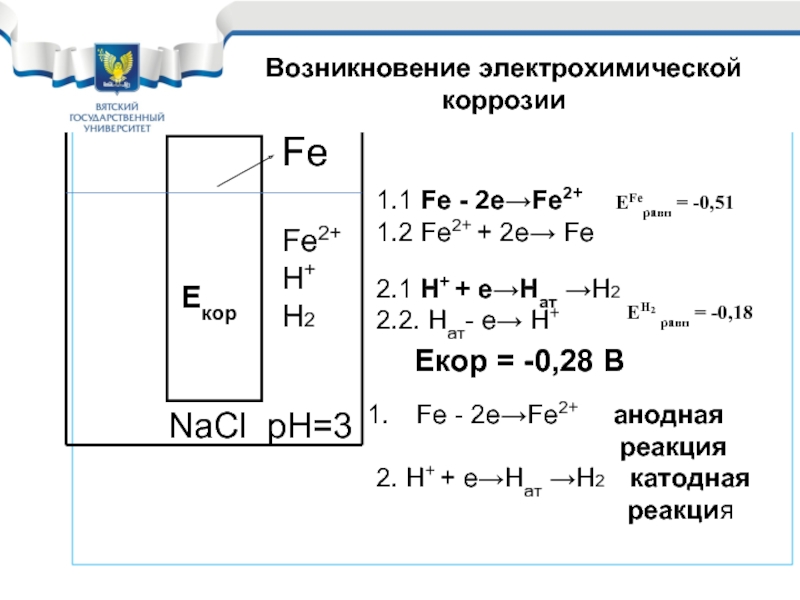
Слайд 5
Fe - 2e→Fe2+ анодная
2. H+ + e→Haт →Н2 катодная
реакция
NaCl рН=3
Fe
Fe2+
Н+
Н2
Возникновение электрохимической коррозии
1.1 Fe - 2e→Fe2+
1.2 Fe2+ + 2e→ Fe
ЕFeравн = -0,51
2.1 H+ + e→Haт →Н2
2.2. Haт- e→ H+
ЕН2 равн = -0,18
Екор = -0,28 В
Екор
Слайд 6
-
+
Fe
Fe+2
Взаимодействие поверхностных ионов железа с водой
Вода- это диполь НОН (Н+ОН-)
-
+
Н2О
В NaCl
Слайд 7Екор – потенциал коррозии, образующийся за счёт одновременного протекания на нём
Потенциал коррозии
Слайд 8Коррозионный потенциал возникает всегда когда выполняется термодинамическое условие электрохимической коррозии
Термодинамическое условие:
ЕMeравн < ЕOх равн
Коррозионный потенциал довольно постоянен , что происходит за счет того что выполняется условие стационарности электрохимической коррозии.
Условие стационарности коррозии: скорости анодной и катодной реакции коррозионного процесса равны:
Ja = Jк
Условия возникновения и протекания электрохимической коррозии
Слайд 9
Насколько часто выполняется термодинамическое условие электрохимической коррозии?
ЕMeравн < ЕOх равн
В
окислителями могут быть: Н2О (НОН), H+,
ЕН2 равн = -0,06 рН;
и растворенный в электролите О2,
ЕО2 равн = 1.23-0,06 рН
Термодинамика электрохимической коррозии
Слайд 10Al Zn Fe Ni
-1,5 -0,79 -0,44 -0,23 0 +0,34 1,23
Ряд напряжений
Если посмотреть ряд напряжений, то можно сделать вывод, что все металлы за исключением золота должны окислятся растворенным в электролите кислородом. А железо и его сплавы могут корродировать, как под действием ионов водорода или воды, так и под действием растворенного кислорода.
Слайд 11Растворенный в электролите кислород самый распространенный окислитель О2 + 4Н+ + 4е
Окислители, вызывающие электрохимическую коррозию
Слайд 12Ион водорода или вода также могут вызывать электрохимическую коррозию 2Н+ + 2е
Окислители, вызывающие электрохимическую коррозию
Слайд 13Me - ne
Катионы Меne+
Комплексные соединения [Ме(Кn)]m+,
Оксиды и гидроксиды МеО, Ме(ОН)2
Сложные анионы металла МеО-2, МеО22-
Труднорастворимые соли МеА
Анодные реакции электрохимической коррозии
Слайд 14
Наиболее опасен для практики случай, когда получаются растворимые продукты коррозии
Гидратированные катионы
Сложные анионы металла
Комплексные соединения
Растворяясь в электролите, они не влияют на скорость коррозии и она всегда остается опасной.
Опасность электрохимической коррозии
Слайд 15Если в результате анодной реакции коррозионного процесса получаются нерастворимые продукты коррозии:
гидроксиды,
трудностворимые соли,
то такие продукты обычно снижают скорость коррозии во времени, и тем в большей степени, чем выше степень упорядоченности(плотности) получаемых продуктов коррозии.
Опасность электрохимической коррозии
Слайд 16
Если продукты коррозии получаются рыхлые не упорядоченные (например, ржавчина на железе),
Если продукты коррозии получаются упорядоченные, плотные (например, на сплавах алюминия при атмосферной коррозии), то металл перестает корродировать, металл запассивировался, коррозия не опасна.
В практике часто получаются растворимые или неупорядоченные продукты коррозии, поэтому электрохимическая коррозия опасна при любой τ оС
Зависимость скорости коррозии от вида и упорядоченности продуктов коррозии
Слайд 17
Состояние повышенной коррозионной стойкости металла, вызванное торможением анодного процесса за счет
Примеры пассивных металлов: титан в кислотах; медь, алюминий, цинк – атмосферная коррозия.
Пассивность металлов
Слайд 18
Электрохимическая коррозия чаще всего протекает локально, т.е. анодная
Причин локальности много: неоднородность металла;
неоднородность коррозионной среды; неоднородность физических условий на металле и т.д.
Отсюда много видов локальной коррозии: язвенная, питтинговая (точечная), коррозия пятнами, межкристаллитная, коррозионное растрескивание и т.д.).
Локальные формы коррозии более опасны, т.к. металл быстрее выходит из строя.
При локальном характере коррозии ее скорость зависит от электропроводности коррозионной среды.
Локальный характер протекания электрохимической коррозии
Слайд 19
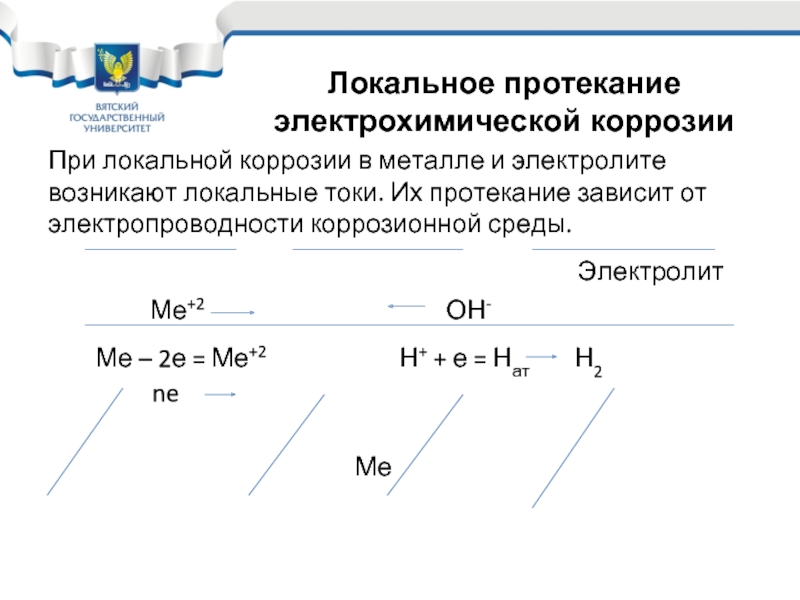
При локальной коррозии в металле и электролите возникают локальные токи. Их
Электролит
Ме+2 ОН-
Ме – 2е = Ме+2 Н+ + е = Нат Н2
ne
Ме
Локальное протекание электрохимической коррозии
Слайд 20Возникает всегда, когда на поверхности металла появляется электролит;
Протекает в виде двух
На поверхности корродирующего металла появляется потенциал коррозии;
Электрохимическая коррозия часто идет локально, локальные формы коррозии опаснее общей;
Электрохимическая коррозия зависит от электропроводности коррозионной среды;
Опасна при любой температуре.
Основные особенности электрохимической коррозии
Слайд 21
В строительной практике электрохимическая коррозия чаще всего протекает по действием двух
2Н+ + 2е = 2Нат Н2 (кислая среда) 2Н2О + 2е = 2Нат + 2ОН - Н2 + 2ОН –
И растворенного в электролите кислорода
О2 + 4Н+ + 4е 2Н2О (кислая среда) О2 + 2Н2О + 4е 4ОН - (нейтральная или щелочная среда)
Окислители, вызывающие коррозию в строительной практике
Слайд 22Особенности коррозии с водородной деполяризацией
Сопровождается выделением атомарного водорода Нат , который
Коррозия с водородной деполяризацией сопровождается выделением молекулярного водорода (Н2), который отрывает защитные покрытия (лакокрасочные, битумные, полимерные), что усугубляет коррозию.
Если есть коррозия с водородной деполяризацией, то одновременно есть и коррозия с кислородной деполяризацией.
Вывод: коррозия с водородной деполяризацией очень опасна для строительной практики и ее нужно исключать, т.е строительные конструкции не должны контактировать с растворами с рН<3-4.
Слайд 23Особенности коррозии с кислородной деполяризацией
Растворимость кислорода в электролитах не велика, поэтому
При коррозии с кислородной деполяризацией диффузия к различным точкам корродирующего металла идет не одинаково. Возникают аэрационные пары
В результате и возникновения аэрационных пар коррозия протекает локально.
В большей степени корродируют участки с плохой диффузией кислорода.
Слайд 25 Чтобы проанализировать коррозионную ситуацию и оценить опасность коррозии необходимо выяснить:
Какие
По какому пути идёт анодная реакция коррозионного процесса, т.е. какие продукты коррозии получаются: растворимые, нерастворимые, упорядоченные, неупорядоченные;
Анализ коррозионной ситуации
Слайд 26Исходя из состава коррозионной среды прежде всего определяется, какие окислители в
Далее с помощью электрода сравнения и вольтметра замеряют потенциал коррозии (Екор) металла в исследуемой коррозионной среде.
Анализ коррионной ситуации
Слайд 27Далее необходимо сравнить стационарный потенциал коррозии (Екор) с равновесными потенциалами этих
Екор<Еохравн,
То данный окислитель участвует в процессе коррозии.
Определение вида окислителя, вызывающего электрохимическую коррозию
Слайд 28
Равновесные потенциалы окислителей (Н+ и О2) при известном рН коррозионной среды
ЕН2равн= - 0,06рН;
ЕО2равн=1,23 - 0,06рН
Равновесные потенциалы двух главных окислителей, вызывающих электрохимическую коррозию
Слайд 29Пример: Если потенциал коррозии Екор равен - 0,2 В, а
pH=2 , EH2равн = -0,12В, EO2равн= 1,11В
pH=7 EH2равн = -0,42 В, EO2равн= 0,81В
pH=12 EH2равн = -0,72 В, EO2равн= 0,51В
Проверяем неравенство Eкор < Eoxравн, и видим, что при pH=2 коррозия протекает под действием обоих окислителей, а при pH=7, и pH=12 в коррозионном процессе участвует только один окислитель O2
Определение вида окислителя, вызывающего электрохимическую коррозию
Слайд 30
Для определения пути реакции коррозионного процесса нужно знать состав коррозионной среды.
Если
Если в коррозионной среде нет комплексообразователей, но есть анионы, способные давать с корродирующим металлом труднорастворимую соль, то именно она и получается при протекании анодного процесса. А для того, что бы сделать вывод об опасности коррозии необходимо знать насколько упорядоченна эта соль. (литературные данные).
Определение пути анодной реакции коррозионного процесса
Слайд 31
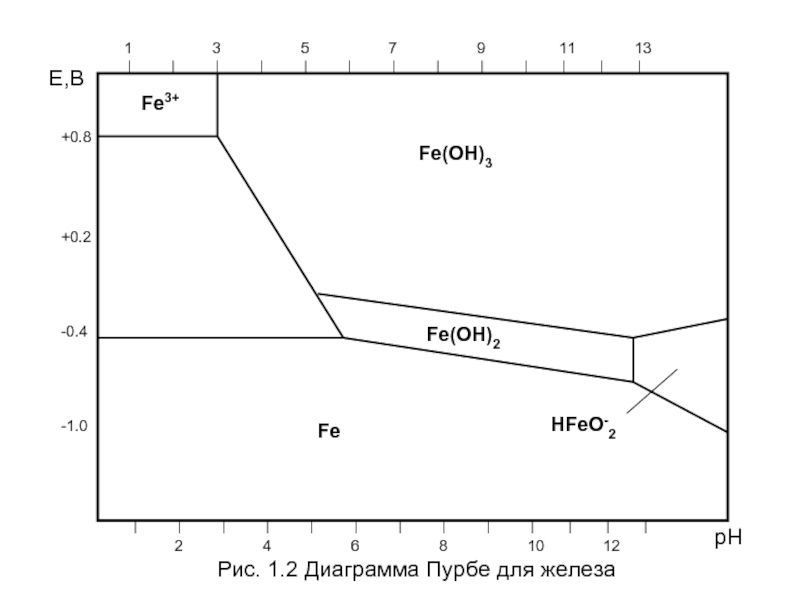
Если в коррозионной среде нет комплексообразователей, и анионов, способных образовывать с
На следующих слайдах представлены упрощенные диаграммы Пурбе для алюминия и железа.
Для того, чтобы определить какое вещество получается в результате анодного реакции коррозии по диаграмме Пурбе нужно знать потенциал коррозии и рН коррозионной среды.
Определение характера анодной реакции и вида продуктов коррозии
Слайд 33
1
3
5
7
9
11
13
2
12
10
8
4
6
+0.2
+0.8
-1.0
-0.4
Fe3+
Fe(OH)3
Fe(OH)2
Fe
HFeO-2
Рис. 1.2 Диаграмма Пурбе для железа
E,B
pH
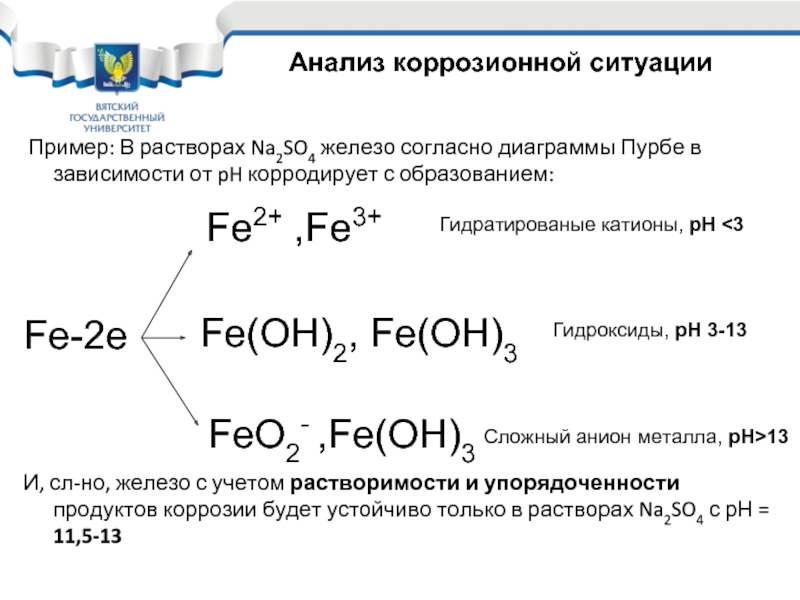
Слайд 34 Пример: В растворах Na2SO4 железо согласно диаграммы Пурбе в зависимости
И, сл-но, железо с учетом растворимости и упорядоченности продуктов коррозии будет устойчиво только в растворах Na2SO4 с рН = 11,5-13
Fe-2e
Fe2+ ,Fe3+
FeO2- ,Fe(OH)3
Fe(OH)2, Fe(OH)3
Гидратированые катионы, рН <3
Гидроксиды, рН 3-13
Сложный анион металла, рН>13
Анализ коррозионной ситуации
Слайд 35
Анализ коррозионного процесса для углеродистых и низколегированных сталей в средах с
При рН < 3 железо корродирует под действием двух окислителей Н+ и О2, продуктами коррозии являются растворимые катионы Fe2+, Fe3+, и коррозия очень опасна и тем опасней, чем выше кислотность коррозионной среды.
В диапазоне рН 3-11,5 железо корродирует под действием только О2, продуктами коррозии являются смесь гидроксидов Fe(OH)2, Fe(OH)3 , причем они получаются в виде ржавчины, т.е. неупорядоченные, неплотные. Защитное действие ржавчины плохое и коррозия остается высокой по скорости и опасной.
Поведение железа в условиях электрохимической коррозии
Слайд 36
В диапазоне рН 11,5-13 железо корродирует под действием только О2, продуктами
При рН > 13 железо корродирует с образованием упорядоченных гидроксидов Fe(OH)2, Fe(OH)3 и одновременно растворимых анионов HFeO-2, в результате чего скорость коррозии в концентрированных щелочах повышается.
Графически изменение скорости коррозии железа от рН коррозионной среды представлено на следующем слайде
Поведение железа в условиях электрохимической коррозии
Слайд 37
Vkop
рH
3
6
9
12
Рис. 1.3 Зависимость скорости коррозии железа от рН среды
Поведение железа
Слайд 38
Вывод:
Железо, углеродистые и низколегированные стали в условиях электрохимической коррозии
Поведение железа и его сплавов в условиях электрохимической коррозии
Слайд 39Коррозия металлов в контакте (Контактная коррозия)
В реальной практике конструкции
В этом случае на поверхности корродирующей конструкции устанавливается единый потенциал коррозии, лежащий между коррозионными потенциалами отдельных металлов.
Коррозия металлов в контакте
Слайд 40
Т.е. при контактной коррозии потенциал более отрицательного металла сдвигается в положительном
А потенциал коррозии более положительного металла сдвигается в отрицательном направлении, скорость коррозии его уменьшается или он совсем перестает корродировать.
Контактная коррозия
Слайд 41
Ответы на эти вопросы дает ГОСТ 9.005–72 ЕСЗКС «Допустимые и недопустимые
При необходимости использовать в конструкциях недопустимый контакт нужно предусмотреть методы защиты от контактной коррозии, также регламентируемые ГОСТ 9.005–72.
Коррозия металлов в контакте











![Me - neКатионы Меne+Комплексные соединения [Ме(Кn)]m+,](/img/tmb/1/15033/f9be76393187b89629acf6ab34013f65-800x.jpg)