- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Дисперсные системы. Поверхностная энергия презентация
Содержание
- 1. Дисперсные системы. Поверхностная энергия
- 2. Состояние вещества на границе раздела фаз воздух
- 3. ΔGпов = ΔHпов - TΔSпов = σF
- 4. Шарообразные капли
- 5. Все самопроизвольные процессы происходят в направлении уменьшения
- 6. Как уменьшить ΔG? ↓F ↓σ туманы и
- 7. Моющее действие ПАВ заключается в том, что
- 8. Если молекулы растворенного вещества вытесняются из поверхностного
- 9. Мыльный пузырь — тонкая пленка мыльной воды, которая формирует шар с переливчатой поверхностью.
- 10. Пленка пузыря состоит из тонкого слоя воды,
- 11. Пузырь существует потому, что поверхность любой жидкости
- 12. Еще примеры действия поверхностного натяжения Скрепка на воде водомерка
- 13. Дисперсные системы – гетерогенные системы, которые образуются
- 14. вода сахар Истинный раствор– гомогенная система
- 15. Количественная характеристика дисперсности (раздробленности) вещества - степень
- 16. Классификация дисперсных систем по агрегатному состоянию
- 18. Система газ – твердое: дым пыль В
- 19. Дымы естественные и искуственные: Дымовые шашки CCl4
- 20. Система газ – жидкость: туман облака аэрозоль
- 21. Облака – взвешенные в атмосфере капли воды
- 22. АЭРОЗОЛИ: Малый размер частиц, развитая межфазная поверхность
- 23. Для аэрозолей характерны особенности, связанные с
- 24. Система жидкое – газообразное: Пены - Самые
- 25. Система жидкое – жидкое: эмульсии молоко -
- 26. Система жидкое – твердое: Суспензии паста эмали Коллоидные растворы
- 27. Магнитная жидкость - коллоидная система однодоменных магнитных
- 28. к магнитной жидкости подносится магнит и при
- 29. Система твердое – газообразное: Твердые пены «воздушный» шоколад поролон кирпич пемза
- 30. Система твердое – жидкое: гели крема Жемчуг – Н2О в СаСО3
- 31. Система твердое – твердое: Минералы, цветные стекла, сплавы агаты
- 32. В высокодисперсных системах удельная поверхность и поверхностная
- 33. Степень дисперсность влияет на все основные свойства дисперсных систем: молекулярно-кинетические, реологические, оптические, каталитические, электрокинетические:
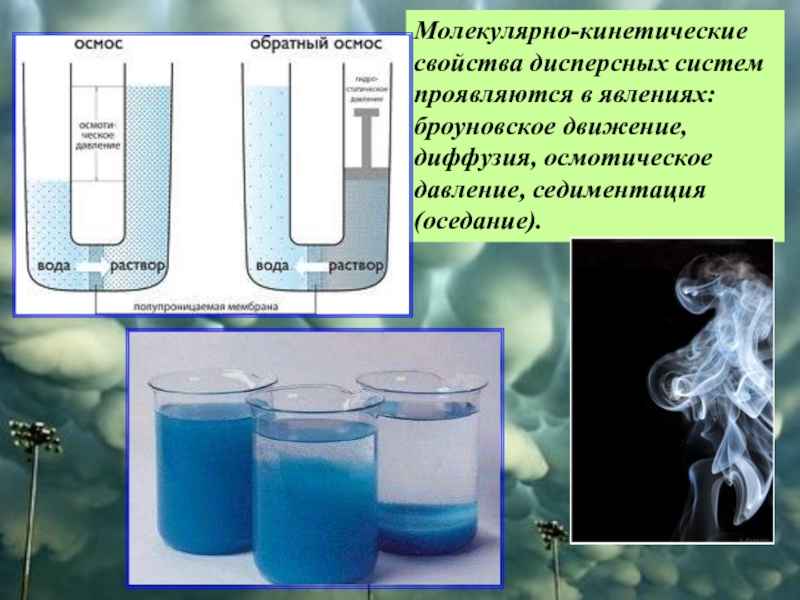
- 34. Молекулярно-кинетические свойства дисперсных систем проявляются в явлениях: броуновское движение, диффузия, осмотическое давление, седиментация (оседание).
- 36. Самое интересное свойство – опалесценция и эффект
- 37. Сумеречные лучи Эффект Тиндаля в природе Окраска облаков на закате
- 38. Электрокинетические свойства коллоидных растворов обусловлены особым строением
- 39. Золь AgCl AgNO3(избыток) + HCl =
- 40. Гранула электрически заряжена Может направленно перемещаться в
- 41. Устойчивость коллоидных систем - постоянство во времени
- 42. Отсутствие факторов устойчивости Коллоидные р-ры разрушаются: коагулируют
- 43. Факторы, вызывающие коагуляцию: 1) Изменение температуры;
- 44. Методы получения дисперсных систем диспергирование
- 45. 1. Испарение и конденсация. При сварке стали
- 46. 2. Смена растворителя. Истинный раствор +
- 47. 3H2O + FeCl3 → Fe(OH)3↓ + 3HCl
- 48. Реакция восстановления золота: NaAuO2 + HCOH +
- 49. Нанотехнологии: в сферу этой деятельности попадают объекты
- 50. размер наночастицы влияет на: Тпл, Т полиморфного
- 51. обычно Ag не реагирует с разбавленными кислотами
- 52. Иллюстрация Science обычный нанокластер Au субнанокластер (пикокластер)
- 53. Вместе с уменьшением размеров уменьшается и характерное
- 54. Получение наночастиц. Диспергирование Методы конденсации подход «сверху»:
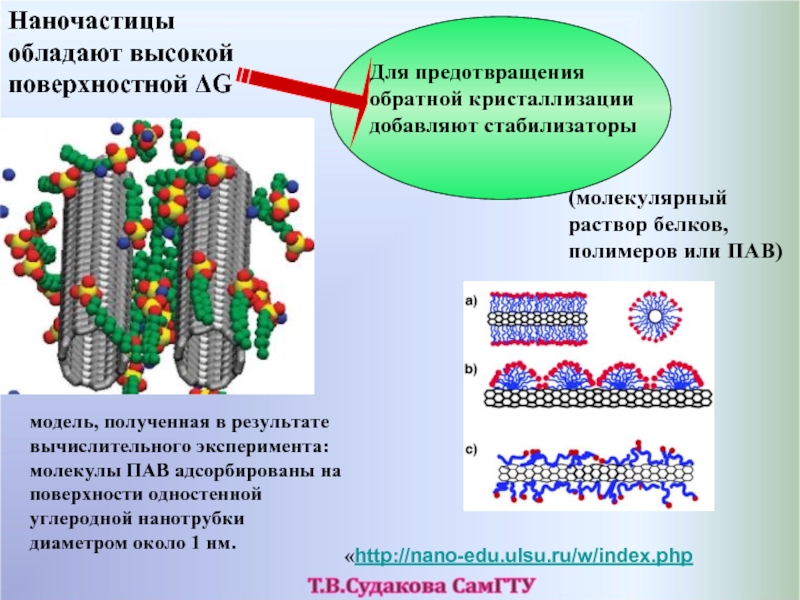
- 55. Наночастицы обладают высокой поверхностной ΔG Для
- 56. Некоторые наночастицы могут быть стабильны сами по
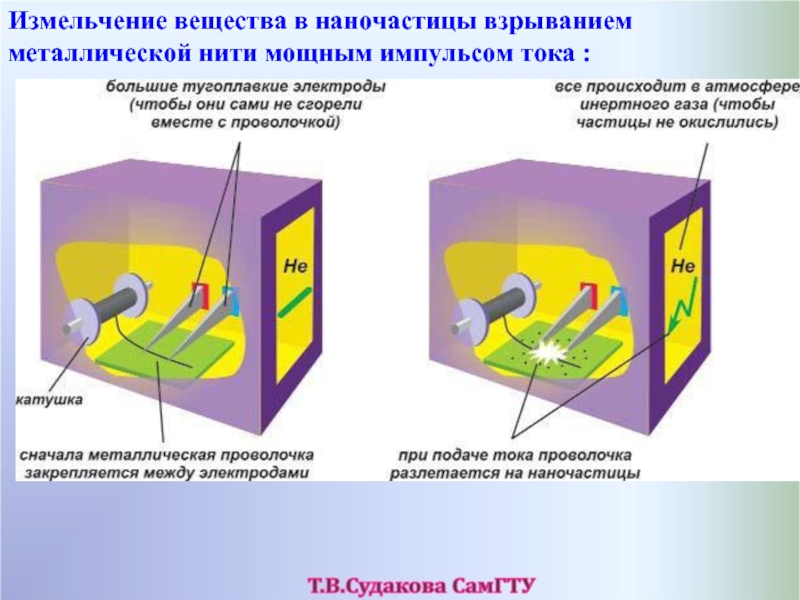
- 57. Измельчение вещества в наночастицы взрыванием металлической нити мощным импульсом тока :
- 58. Конденсационные методы:
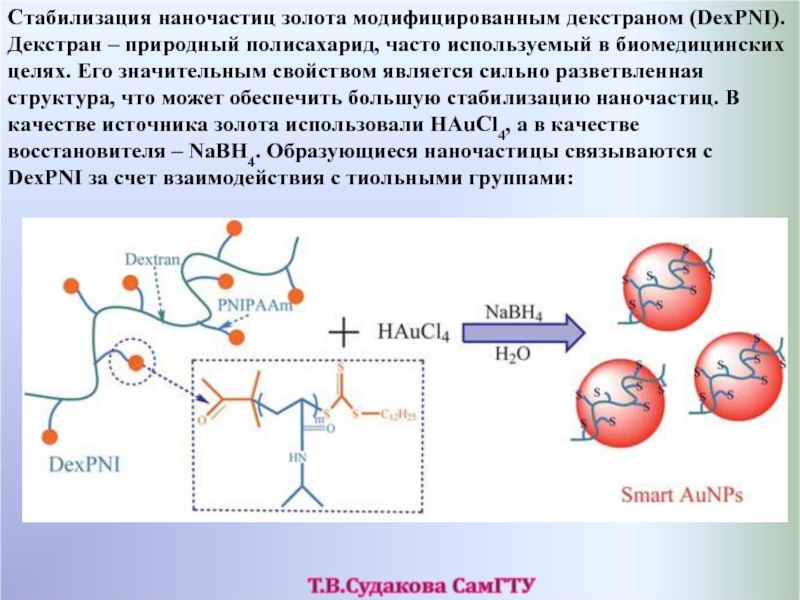
- 59. Стабилизация наночастиц золота модифицированным декстраном (DexPNI). Декстран –
- 60. За счет того, что наночастицы окружены макромолекулами DexPNI,
- 61. Фото- и радиационно-химические восстановление: на химическую систему
- 62. В кавитирующую жидкость опускают электроды и вызывают
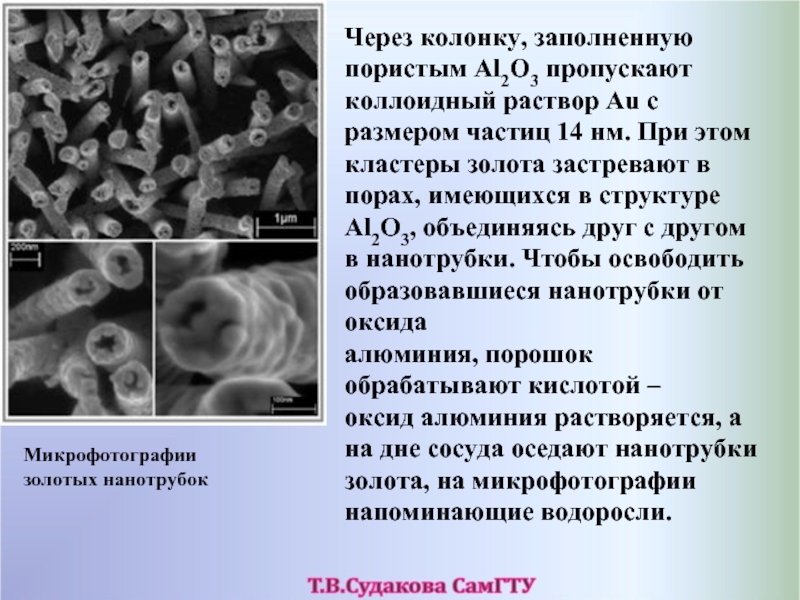
- 63. Через колонку, заполненную пористым Al2O3 пропускают коллоидный
- 64. Трёхмерные наночастицы оксидов металлов, полученных под воздействием
- 65. Нанокомпозит - многокомпонентный твердый материал, в котором
- 66. И н т е р н е
Слайд 1ДИСПЕРСНЫЕ СИСТЕМЫ.
ПОВЕРХНОСТНАЯ ЭНЕРГИЯ
План.
1. Поверхностная энергия, поверхностное натяжение; поверхностно-активные вещества (ПАВ).
2.
3. Свойства коллоидных систем.
4. Методы получения дисперсных систем. Строение мицеллы.
5. Устойчивость коллоидных систем.
6. Наночастицы: способы получения и стабилизации.
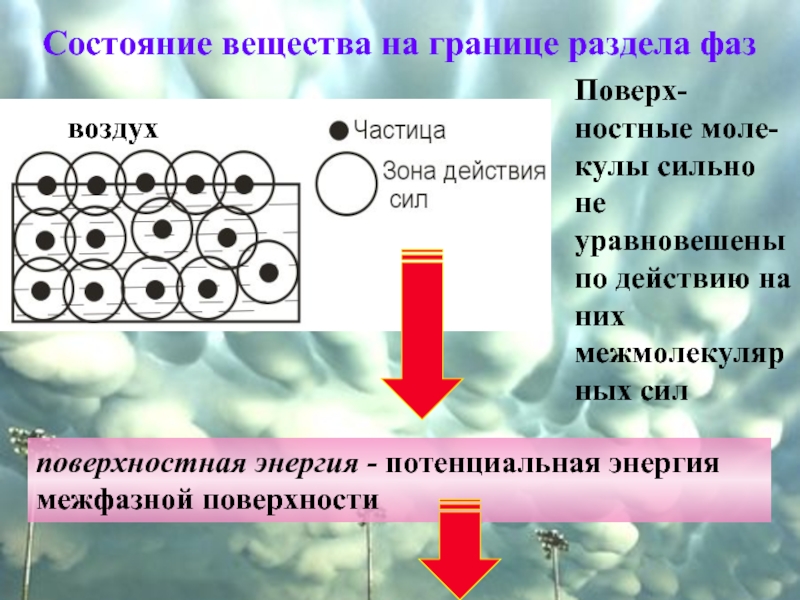
Слайд 2Состояние вещества на границе раздела фаз
воздух
Поверх- ностные моле-кулы сильно
поверхностная энергия - потенциальная энергия межфазной поверхности
Слайд 3ΔGпов = ΔHпов - TΔSпов = σF
ΔGпов – изменение энергии Гиббса
σ – поверхностное натяжение, Дж/м2, F – площадь поверхности, м2.
Поверхностное натяжением - работа, затрачиваемая на изотермическое и обратимое образование единицы поверхности раздела фаз:
σ = ΔGпов/ F
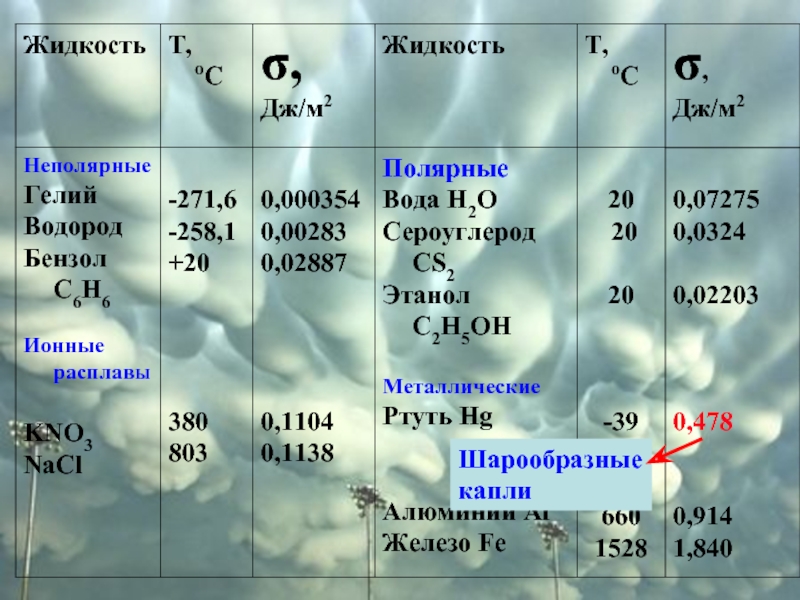
σ зависит от природы соприкасающихся фаз, температуры и добавок растворенных веществ.
Чем больше σ, тем труднее создать данную поверхность!
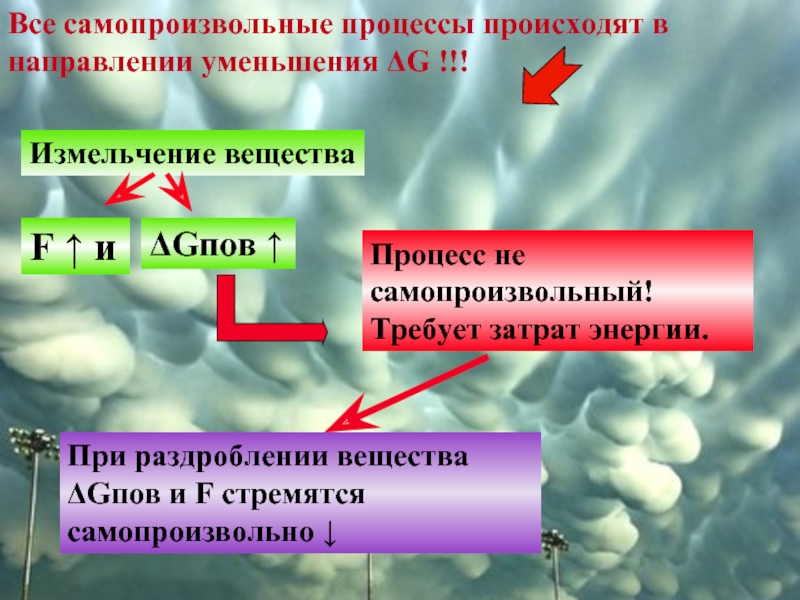
Слайд 5Все самопроизвольные процессы происходят в направлении уменьшения ΔG !!!
Измельчение вещества
F
ΔGпов ↑
Процесс не самопроизвольный! Требует затрат энергии.
При раздроблении вещества ΔGпов и F стремятся самопроизвольно ↓
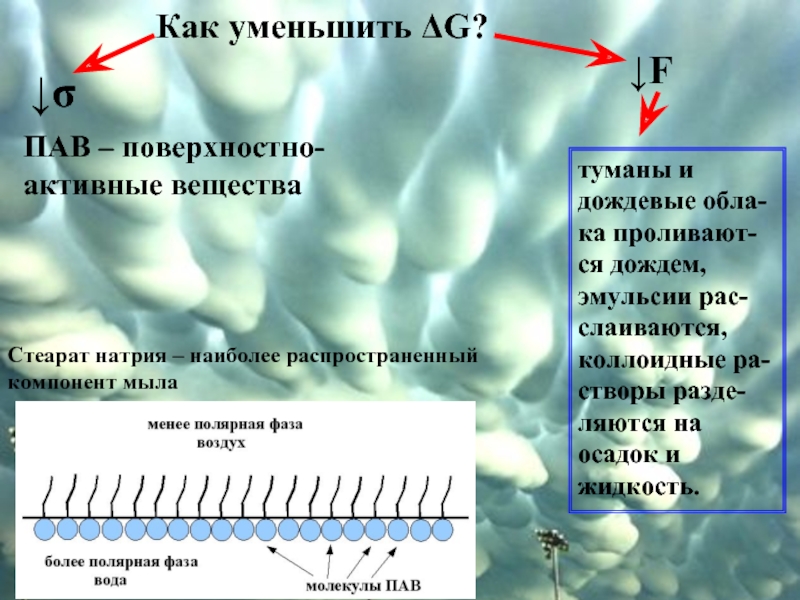
Слайд 6Как уменьшить ΔG?
↓F
↓σ
туманы и дождевые обла-ка проливают-ся дождем, эмульсии рас-слаиваются, коллоидные
ПАВ – поверхностно-активные вещества
Стеарат натрия – наиболее распространенный компонент мыла
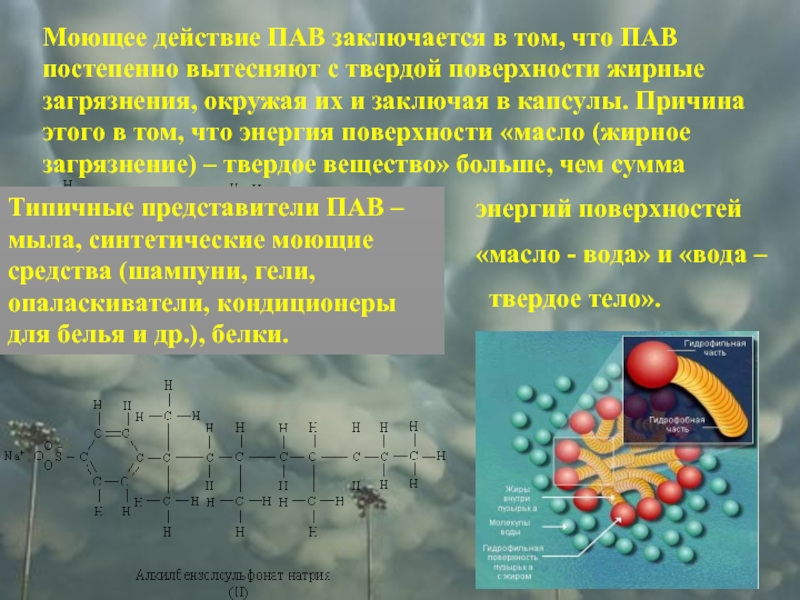
Слайд 7Моющее действие ПАВ заключается в том, что ПАВ постепенно вытесняют с
энергий поверхностей
«масло - вода» и «вода –
твердое тело».
Типичные представители ПАВ – мыла, синтетические моющие средства (шампуни, гели, опаласкиватели, кондиционеры для белья и др.), белки.
Слайд 8Если молекулы растворенного вещества вытесняются из поверхностного слоя внутрь раствора, то
Слайд 9Мыльный пузырь — тонкая пленка мыльной воды, которая формирует шар с
Слайд 10Пленка пузыря состоит из тонкого слоя воды, заключенного между двумя слоями
Слайд 11Пузырь существует потому, что поверхность любой жидкости (в данном случае воды)
Мыло уменьшает σ примерно до трети от σ чистой воды. Когда мыльная пленка растягивается, концентрация мыльных молекул на поверхности уменьшается, увеличивая при этом поверхностное натяжение.
Сферическая форма пузыря также получается за счет поверхностного натяжения. Силы натяжения формируют сферу потому, что сфера имеет наименьшую площадь поверхности при данном объеме.
Слайд 13Дисперсные системы – гетерогенные системы, которые образуются в результате распределения одного
Гетерогенные
Состоят из нескольких фаз с границей раздела между ними
Дисперсионная среда
Дисперсная фаза
Слайд 14вода
сахар
Истинный раствор– гомогенная система
вода
мел
взвесь
Гетерогенная система
Необходимое условие:
Взаимная нерастворимость дисперсной фазы и
Слайд 15Количественная характеристика дисперсности (раздробленности) вещества - степень дисперсности:
l – размер дисперсной частицы.
Слайд 18Система газ – твердое:
дым
пыль
В земных условиях чаще всего - воздух
Высокодисперсные аэрозоли
А также пепел
Слайд 19Дымы естественные и искуственные:
Дымовые шашки
CCl4 + 2Zn→ 2ZnCl2 + C →
Слайд 21Облака – взвешенные в атмосфере капли воды и кристаллы льда
Образуются при
Наличие в атмосфере твердых частиц (напр. частиц порохового дыма) ускоряет конденсацию паров и провоцирует выпадение осадков
Слайд 22АЭРОЗОЛИ:
Малый размер частиц, развитая межфазная поверхность
Высокая химическая активность
Аэрозоли взрывоопасны!!!
Угольная пыль, пыль
Внешняя поверхность пачки спрессованного чая массой 100г равна 150см2. Суммарная поверхность чайных пылинок размером 2мкм из этой массы равна 300 м2!
Для взрыва достаточно небольшой электростатической искры
Большой выброс тепловой энергии за короткое время и образование газообразных продуктов окисления.
Слайд 23
Для аэрозолей характерны особенности, связанные с газообразной дисперсионной средой: перемещение аэрозоля
Аэрозоли образуются при взрывах, дроблении и распылении веществ, с помощью химических реакций.
Слайд 24Система жидкое – газообразное:
Пены -
Самые устойчивые пены содержат ПАВ!
высококонцентрированные гетерогенные системы
Слайд 25Система жидкое – жидкое:
эмульсии
молоко
- Эмульсия жира в воде
Водоэмульсионные краски
Эмульгаторы стабилизируют эмульсии
Слайд 27Магнитная жидкость - коллоидная система однодоменных магнитных частиц (дисперсная фаза), диспергированных
для создания магнитных жидкостей необходимо взвесить твердые частицы с плотностью более 5 г/см3 в жидкости с плотностью 1 г/см3 или менее.
частицы дисперсной фазы покрывают слоем молекул стабилизатора
поэтому
Слайд 28к магнитной жидкости подносится магнит и при достаточном воздействии его поля
Внешнее магнитное поле ориентирует магнитные моменты частиц и форма ее свободной поверхности изменяется.
Классический опыт:
Слайд 32В высокодисперсных системах удельная поверхность и поверхностная энергия Гиббса чрезвычайно велики.
FeC2O4 = Fe + 2CO2
Также увеличивается и химическая активность веществ:
Слайд 33Степень дисперсность влияет на все основные свойства дисперсных систем: молекулярно-кинетические, реологические,
Слайд 34Молекулярно-кинетические свойства дисперсных систем проявляются в явлениях: броуновское движение, диффузия, осмотическое
Слайд 36Самое интересное свойство – опалесценция и эффект Тиндаля: рассеяние видимого диапазона
дисперсной фазы
вначале
потом
Na2S2O3 + H2SO4 = Na2SO4 + H2SO3 + S↓
Коллоидная сера
опалесценция
Причина: λ видимого диапазона света (400-800 нм) соизмерима с размерами дисперсных частиц
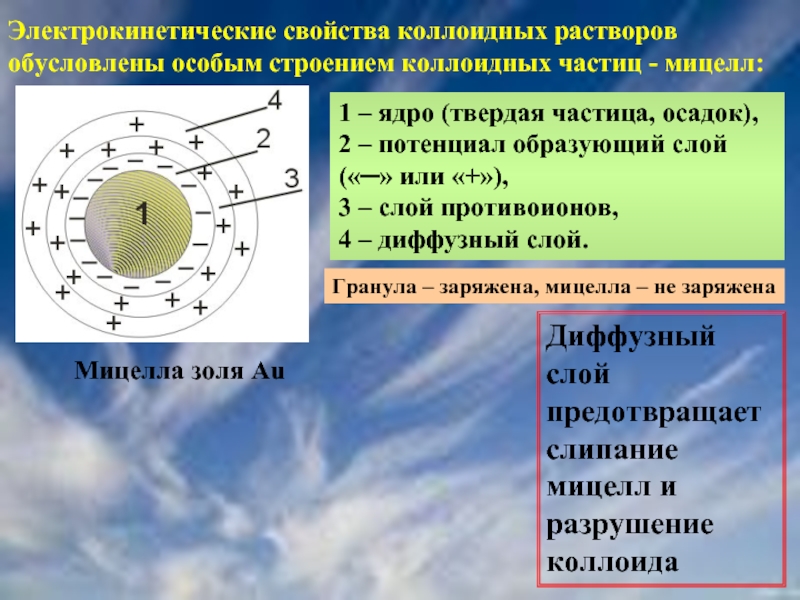
Слайд 38Электрокинетические свойства коллоидных растворов обусловлены особым строением коллоидных частиц - мицелл:
1
Мицелла золя Au
Гранула – заряжена, мицелла – не заряжена
Диффузный слой предотвращает слипание мицелл и разрушение коллоида
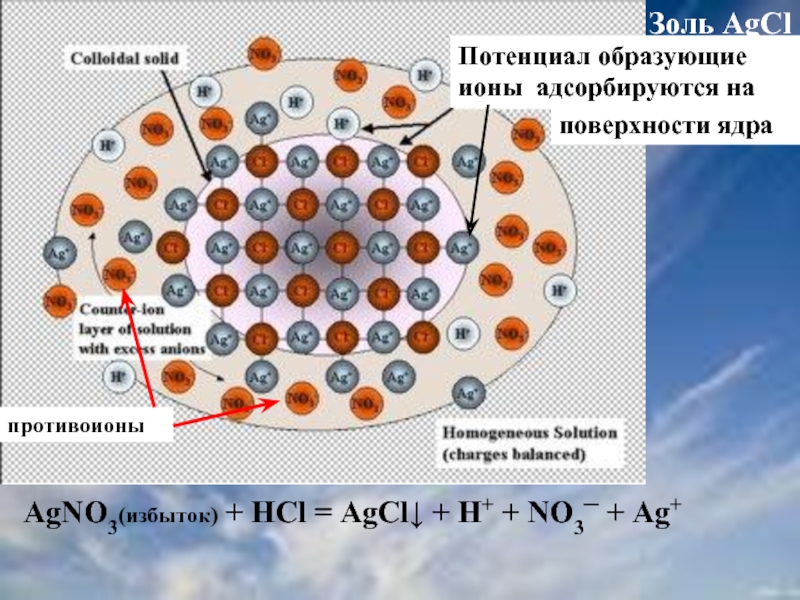
Слайд 39Золь AgCl
AgNO3(избыток) + HCl = AgCl↓ + H+ + NO3─ +
Потенциал образующие ионы адсорбируются на
противоионы
поверхности ядра
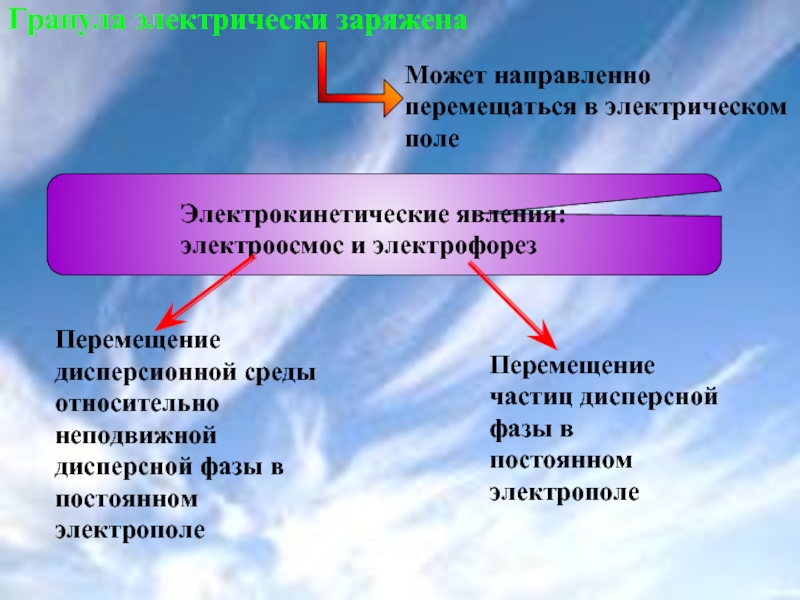
Слайд 40Гранула электрически заряжена
Может направленно перемещаться в электрическом поле
Электрокинетические явления:
Перемещение частиц дисперсной фазы в постоянном электрополе
Перемещение дисперсионной среды относительно неподвижной дисперсной фазы в постоянном электрополе
Слайд 41Устойчивость коллоидных систем -
постоянство во времени их состояния и основных свойств.
Основные
1) Электростатические силы отталкивания благодаря ионной оболочке; 2) уменьшение σ и энергии Гиббса благодаря адсорбции ионов и молекул воды; 3) броуновское движение дисперсных частиц; 4) защитные слои на поверхности дисперсных частиц; 5) гидродинамический – вязкость и плотность дисперсионной среды.
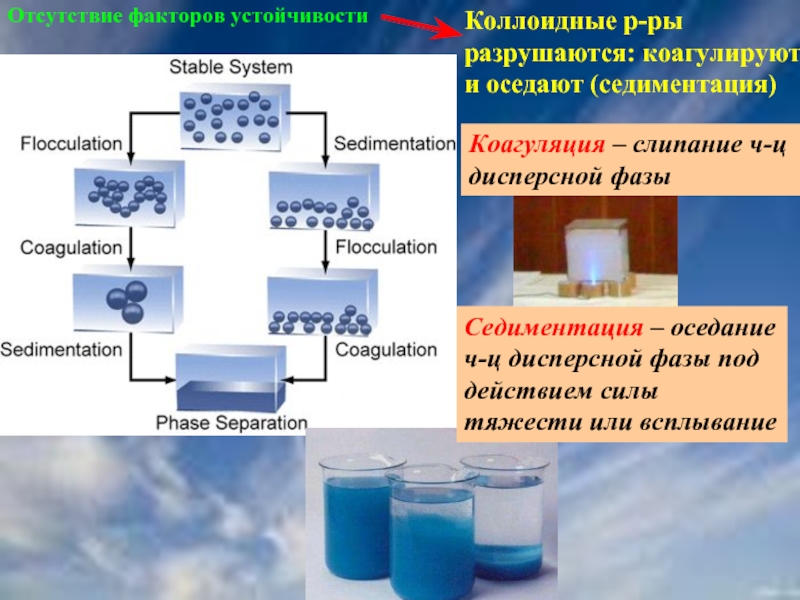
Слайд 42Отсутствие факторов устойчивости
Коллоидные р-ры разрушаются: коагулируют и оседают (седиментация)
Седиментация – оседание
Коагуляция – слипание ч-ц дисперсной фазы
Слайд 43Факторы, вызывающие коагуляцию:
1) Изменение температуры;
Al2(SO4)3 – очистка питьевой воды от коллоидных частиц
Слайд 44Методы получения дисперсных систем
диспергирование
конденсация
Работа (энергия) на измельчение материала, равна сумме
W = kV + σΔS,
k – коэффициент деформирования единицы объема твердого тела; V - объем тела; ΔS – новая поверхность, образующаяся при разрушении вещества.
Чем больше дисперсность, тем больше расход энергии на диспергирование!!!
Слайд 451. Испарение и конденсация.
При сварке стали под водой в зоне сварки
Fe + 3H2O = Fe(OH)3 + 3H2↑
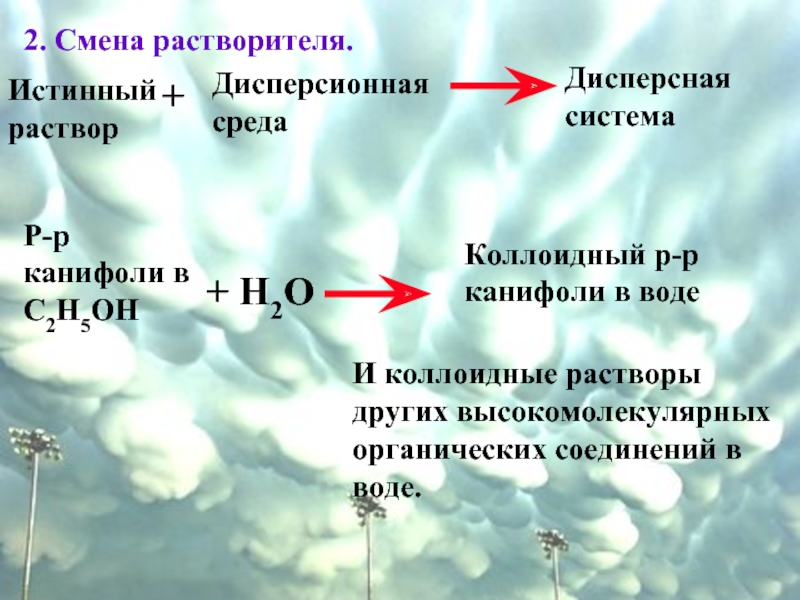
Слайд 462. Смена растворителя.
Истинный раствор
+
Дисперсионная среда
Дисперсная система
Р-р канифоли в С2Н5ОН
+ Н2О
Коллоидный
И коллоидные растворы других высокомолекулярных органических соединений в воде.
Слайд 473H2O + FeCl3 → Fe(OH)3↓ + 3HCl
3. Химические реакции с
NH3 (газ) + HCl (газ) → NH4Cl ↓ (белый дым)
Кипящая вода
Водный р-р
Прозрачный коллоидный р-р ярко коричневого цвета
Слайд 48Реакция восстановления золота:
NaAuO2 + HCOH + Na2CO3 → Au↓ + HCOONa
Золь красного цвета
Получение геля кремневой кислоты обменной реакцией:
K2SiO3 + 2HCl избыток → H2SiO3↓ + 2KCl
Слайд 49Нанотехнологии: в сферу этой деятельности попадают объекты с характерными размерами (хотя
Наноструктура – совокупность связанных друг с другом наночастиц определенного размера.
Наночастица – частица, имеющая размер хотя бы в одном направлении не более 10 нм.
Слайд 50размер наночастицы влияет на: Тпл, Т полиморфного превращения, растворимость, сдвиг химического
Характерное свойство наночастиц - избыточная поверхностная энергия и высокая химическая активность!!!
значительная доля атомов на поверхности частицы
Например, высокая активность наночастиц металлов приводит к тому, что их существование без взаимодействия с окружающей средой возможно только в вакууме.
Размерный эффект -
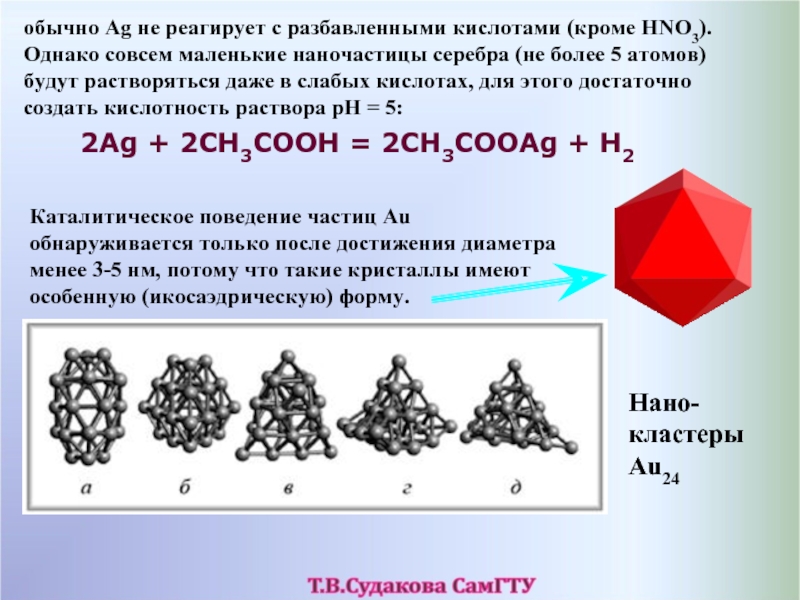
Слайд 51обычно Ag не реагирует с разбавленными кислотами (кроме HNO3). Однако совсем
2Ag + 2CH3COOH = 2CH3COOAg + H2
Каталитическое поведение частиц Au обнаруживается только после достижения диаметра менее 3-5 нм, потому что такие кристаллы имеют особенную (икосаэдрическую) форму.
Нано-кластеры Au24
Слайд 52Иллюстрация Science
обычный нанокластер Au
субнанокластер (пикокластер)
При размере наночастиц 3-5 нм реакция протекает
В случае пикокластеров частота циклов на пять порядков величины больше и реакция протекает при комнатной температуре!!!
Слайд 53Вместе с уменьшением размеров уменьшается и характерное время протекания разнообразных процессов
Широко применяются тонкопленочные наноструктуры состава Ge2Sb2Te5 (т.н. GST состав)
в перезаписываемых оптических дисках формата DVD повышенной плотности записи.
Слайд 54Получение наночастиц.
Диспергирование
Методы конденсации
подход «сверху»: механохими-ческое дробление, плазмохимические методы.
подход «снизу»: в
(сохраняется структура исходного компактного материала)
(надмолекулярная структура может меняться)
Слайд 55Наночастицы обладают высокой поверхностной ΔG
Для предотвращения обратной кристаллизации добавляют стабилизаторы
(молекулярный раствор
модель, полученная в результате вычислительного эксперимента: молекулы ПАВ адсорбированы на поверхности одностенной углеродной нанотрубки диаметром около 1 нм.
«http://nano-edu.ulsu.ru/w/index.php
Слайд 56Некоторые наночастицы могут быть стабильны сами по себе. Например, для щелочных
Наночастицы с «магическими числами»: а) наночастицы Pt (http://tesla2.ruНаночастицы с «магическими числами»: а) наночастицы Pt (http://tesla2.ru); б) однослойная нанотрубка (http://www.computer-museum.ruНаночастицы с «магическими числами»: а) наночастицы Pt (http://tesla2.ru); б) однослойная нанотрубка (http://www.computer-museum.ru); в) фуллерен C140 (http://www.chem.msu.su).
а
б
в
Слайд 58Конденсационные методы:
Для стабилизации наночастиц используют четвертичную соль дисульфида аммония:
AgNO3 + Na[BH4] + H2O = NaNO3 + B(OH)3 + H2 + Ag
(от 3 до 5 нм)
2
Слайд 59Стабилизация наночастиц золота модифицированным декстраном (DexPNI). Декстран – природный полисахарид, часто используемый
Слайд 60За счет того, что наночастицы окружены макромолекулами DexPNI, они демонстрируют длительную стабильность
Электронная микрофотография
Слайд 61Фото- и радиационно-химические восстановление:
на химическую систему воздействуют либо световым излучением либо
энергии – 103-104 эВ.
Энергии до 60 эВ
Под воздействием света из молекулы воды образуются активные частицы:
H2O + hν → ē(aq) + H + OH•
Гидратированный ē взаимодействует с катионом металла, например,
Ag+ + ē(aq) → Ag0
Н и радикал ОН• реагируют с молекулами воды или органического растворителя.
Слайд 62В кавитирующую жидкость опускают электроды и вызывают между ними пробой, что
Слайд 63Через колонку, заполненную пористым Al2O3 пропускают коллоидный раствор Au с размером
Микрофотографии золотых нанотрубок
Слайд 64Трёхмерные наночастицы оксидов металлов, полученных под воздействием микроволнового излучения. Polshettiwar, Baruwati
Электромагнитное излучение микроволнового диапазона (0,3–300 ГГц) можно активно использовать для синтеза: полярные молекулы вещества под действием микроволнового излучения стараются сориентироваться по переменному электромагнитному полю. В итоге происходит нагрев и селективная передача энергии микроволнового излучения определённым молекулам вещества. В 2009 году исследователям удалось получить наночастицы оксидов металлов, имеющих разветвлённую форму (рис. 2). Для синтеза использовались лишь соли, содержащие исходные металлы, вода и микроволновое излучение.
2FeCl3 + 3H2O → Fe2O3 + 6HCl
Слайд 65Нанокомпозит - многокомпонентный твердый материал, в котором один из компонентов в
Нанокомпозиты на основе керамической матрицы улучшают оптические и электрические свойства первоначального материала (керамического).
В нанокомпозитах на основе металлической матрицы так называемым усиливающим материалом (нанокомпонентом) часто служат углеродные нанотрубки, повышающие прочность и электрическую проводимость.
Полимерные нанокомпозиты содержат полимерную матрицу с распределенными по ней наночастицами или нанонаполнителями.
Слайд 66И н т е р н е т - р е
www.nanometer.ru – информационный сайт, посвященный нанотехнологиям;
www.nauka.name – научно-популярный портал;
www.nanojournal.ru – российский электронный «Наножурнал».