- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Buffer solutions презентация
Содержание
- 1. Buffer solutions
- 2. Buffer solutions solution which can
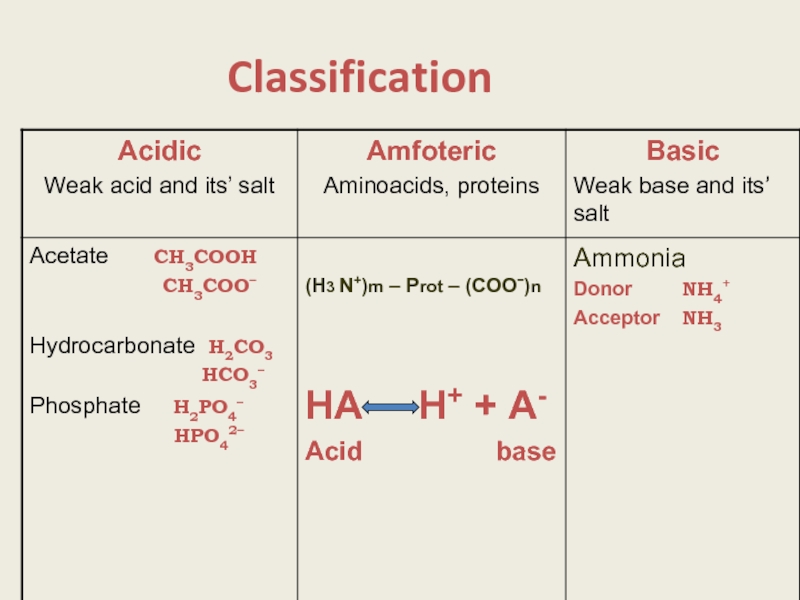
- 3. Classification
- 4. Mechanism of buffer action Acetate buffer СН3СООNa
- 5. рН formulas are derived from Kdis.
- 6. HOW TO PREPARE BUFFER 1.
- 7. 2. Partial neutralization For acidic buffer
- 8. Buffer capacity Ba = nacid
- 9. Buffer capacity depends on : pH
- 10. Mechanism of buffer action Acetate buffer СН3СООNa
- 11. Buffer capacity nsalt > nacid
- 12. Choose the buffer with maximum capacity and
- 13. Buffer systems of a body 1.Mineral
- 14. Hydrocarbonate buffer (K) NaHCO3/H2CO3
- 15. [НСО3–]:[СО2] = 20:1
- 16. 1. A buffer consists of 0,5 moles
- 17. 4. What volume of 0,01M NaOH should
Слайд 2Buffer solutions
solution which can resist the addition of a
+ 1 drop of base [H+] in 1000 000 times
+ 1 drop of acid [H+] in 5000 times
(from 10-7 tо 5 х10-4)
In buffer solution from 1.00х10-7
to 1.01х10-7
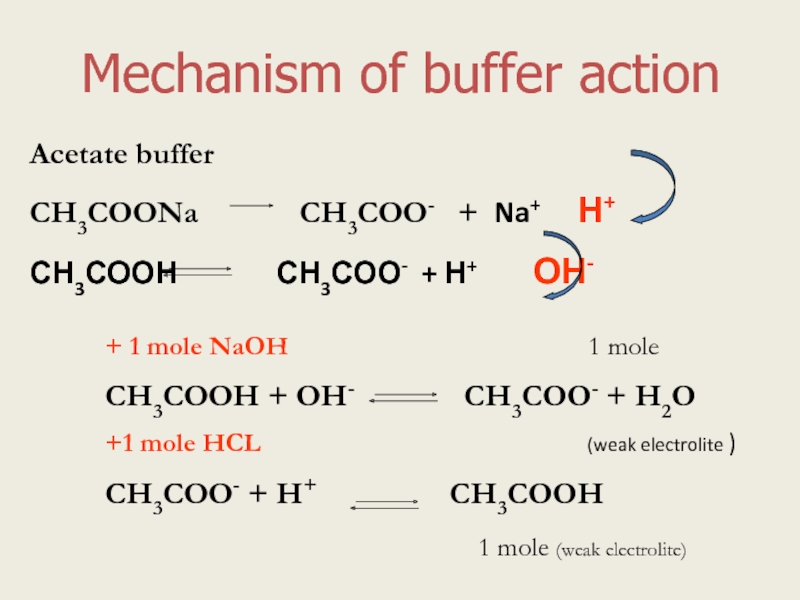
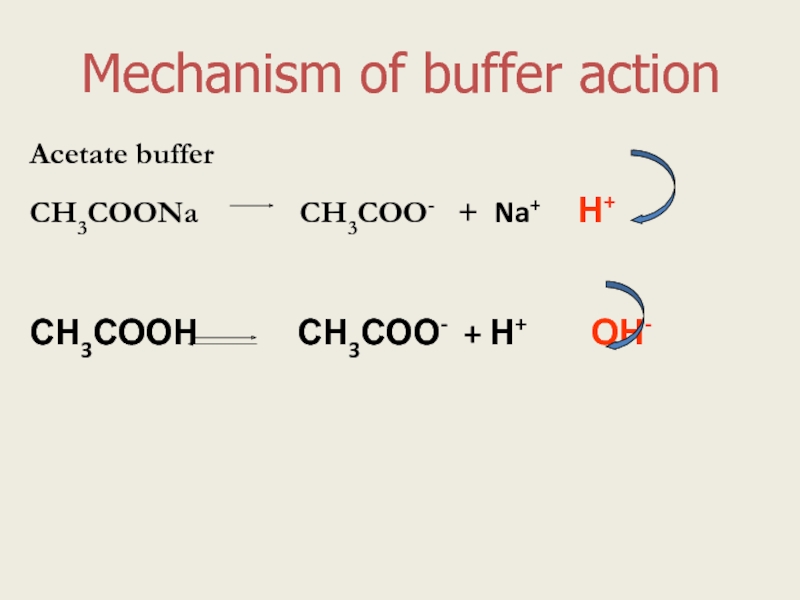
Слайд 4Mechanism of buffer action
Acetate buffer
СН3СООNa
СН3СООН СН3СОО- + Н+ ОН-
+ 1 mole NaOH 1 mole
СН3СООН + ОН- СН3СОО- + Н2О
+1 mole HCL (weak electrolite )
СН3СОО- + Н+ СН3СООН
1 mole (weak electrolite)
Слайд 6HOW TO PREPARE BUFFER
1. Mixing the components:
-for acidic buffer
pH = pKa
-for basic buffer
pH = 14 – pKв – lg Ns·Vs/Nb·Vb
Слайд 72. Partial neutralization
For acidic buffer
nacid = nbase
СН3СООН + NaOH = CH3COONa + H2O
(exsess)
pH = pKa + lg Nb·Vb / (Na·Va –Nb·Vb)
For basic buffer
NH4OH + HCL = NH4Cl + H2O
(exsess)
pH = 14 – pKв – lg Na·Va / (Nb·Vb - Na· Va)
Слайд 8Buffer capacity
Ba = nacid / |∆р Н|. Vbuf.sol
Вb = nbase/ |∆р
n – mole equivalents of a strong acid or a strong base
Vbuf.sol - volume of a buffer solution
∆рН – pH change as a result of acid or base addition
Слайд 9Buffer capacity depends on :
pH = pKa + lg nsalt/nacid
pH =
1.Components amount
2.nsalt/nacid or nsalt/nbase
Вmax
for acidic buffer
at nsalt = nacid
рН = рКа
- for basic buffer
at nsalt = nbase
рН = 14-рКb
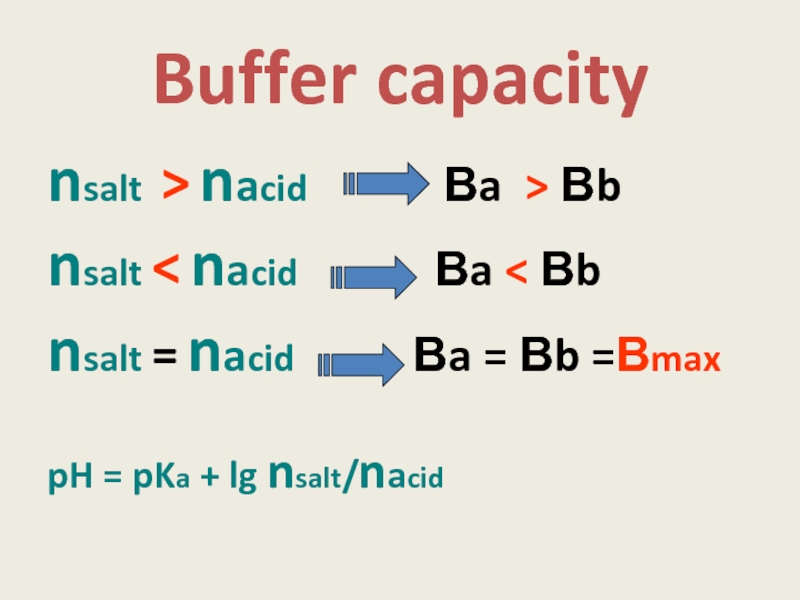
Слайд 11Buffer capacity
nsalt > nacid
nsalt < nacid Вa < Вb
nsalt = nacid Вa = Вb =Вmax
pH = pKa + lg nsalt/nacid
Слайд 12Choose the buffer with maximum capacity and рН = 7.36 :
1)
2) phosphate рК = 7.21;
3) hydrocarbonate рК = 6.37.
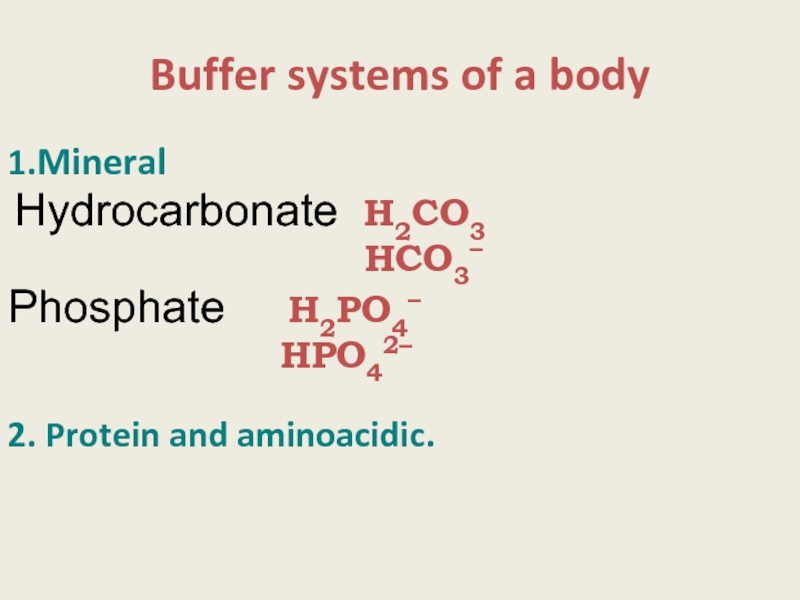
Слайд 13Buffer systems of a body
1.Mineral
Hydrocarbonate Н2СО3
Phosphate Н2РО4–
НРO42–
2. Protein and aminoacidic.
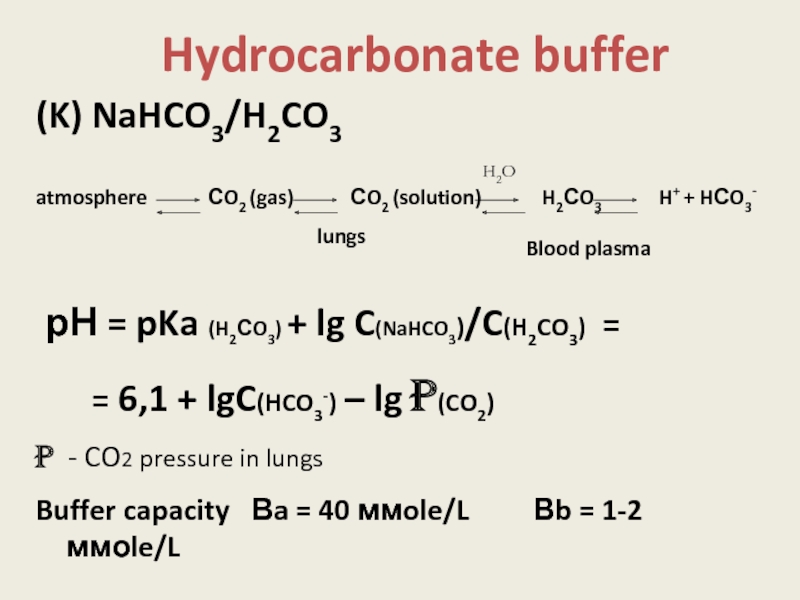
Слайд 14Hydrocarbonate buffer
(K) NaHCO3/H2CO3
atmosphere
рН = pKa (H2СO3) + lg C(NaHCO3)/C(H2CO3) =
= 6,1 + lgC(HCO3-) – lg p(CO2)
p - CO2 pressure in lungs
Buffer capacity Вa = 40 ммole/L Вb = 1-2 ммоle/L
lungs
Blood plasma
H2O
Слайд 15 [НСО3–]:[СО2] = 20:1
Н2СО3 – 13 моle/ day
Other acids – from 0.03 to 0.08 моle/ day
рН of blood plasma
7.4 = 6.1 + lg [НСО3–]/ [СО2]
Слайд 161. A buffer consists of 0,5 moles of equivalent NH3 and
2. What is the pH of buffer made of
60 ml of 0,10M NH3 with 40 ml of 0,10M NH4Cl. Kb=1,8*10-5.
3. What volume of 0,6M CH3COONa must be added to 600 ml of 0,2M CH3COOH to produce a buffer with pH=4,75? Ka(CH3COOH)=1,75*10-5.
Слайд 174. What volume of 0,01M NaOH should be added to 100
5. A buffer was prepared of 500 ml NaН2РО4 and 500 ml Na2НРO4 . After addition of 1 ml 0.1N HCl the change of buffer pH = 0.03. Calculate buffer capacity Ba.
6. Choose a buffer with Вa > Вb:
a). 100 ml 0.2M NaHCO3 + 100ml 0.4M H2CO3
b). 100 ml 0.4M NaHCO3 + 100ml 0.2M H2CO3
c). 100 ml 0.2M NaHCO3 + 100ml 0.2M H2CO3








![[НСО3–]:[СО2] = 20:1 Вa > ВbН2СО3 – 13 моle/](/img/tmb/5/493706/d3e32ab16ee511e36d1dd099b7954c3d-800x.jpg)








