- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Бензен як представник ароматичних вуглеводнів презентация
Содержание
- 1. Бензен як представник ароматичних вуглеводнів
- 2. Мета уроку: познайомитися з ароматичними вуглеводнями, особливостями
- 3. Ароматичні вуглеводні – це сполуки Карбону та
- 4. Історія відкриття бензену Вперше бензен описав
- 5. У 1833-1835 рр.. німецький хімік Е.
- 6. Структуру бензену встановив німецький хімік Фрідріх Серпень
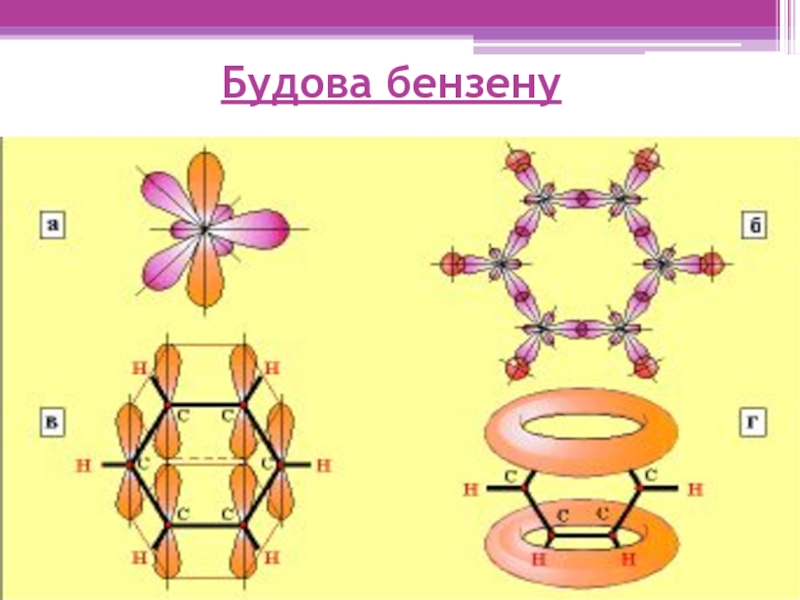
- 7. Будова бензену
- 8. Тип гібридизації атомів Карбону SP2 Кут між
- 9. Фізичні властивості бензену. 1. Безбарвна рідина.
- 10. Це цікаво! Дослідження смолеподібної речовини, отриманої з
- 11. Хімічні властивості бензену.
- 12. І. Реакції окиснення: Горіння (Горить бензен яскраво-червоним
- 13. 2) Розчин перманганату калію не знебарвлюється, тобто бензен стійкий до дії окисників.
- 14. ІІ. Реакції заміщення (подібно до насичених
- 15. Б) Нітрування - взаємодія з нітратною кислотою
- 16. ІІІ. Реакції приєднання (подібно до ненасичених
- 17. Б) Приєднання галогенів
- 18. Незважаючи на високу ненасиченість молекули бензену (за
- 19. Бензен та його похідні Розчинники
- 20. Розв’яжіть задачі 1. Визначити молекулярну формулу
- 21. Домашнє завдання: Повторити §19- 23 Підготуватися до уроку – семінару.
Слайд 2Мета уроку: познайомитися з ароматичними вуглеводнями, особливостями будови ароматичного зв’язку, фізичними
План уроку:
1. Історія відкриття бензену
2. Будова бензену
3. Фізичні властивості бензену.
4. Хімічні властивості бензену.
5. Застосування бензену та його похідних.
Слайд 3Ароматичні вуглеводні – це сполуки Карбону та Гідрогену в молекулах яких
Загальна формула ароматичних вуглеводнів: СnH2n-6, де n ≥ 6.
Молекулярна формула бензену: С6Н6
Слайд 4Історія відкриття бензену
Вперше бензен описав німецький хімік Іоганн Глаубер у
Тому своє друге народження бензен отримав завдяки роботам Фарадея. У 1825 році Майкл Фарадей добув бензен із рідкого конденсата світильного газу.
Слайд 5
У 1833-1835 рр.. німецький хімік Е. Митчерлих досліджував цю речовину, визначив
Пізніше його співвітчизник Ю. Лібіх запропонував нове ім'я сполуки – бензол (бензен), яке прижилося і в українській номенклатурі.
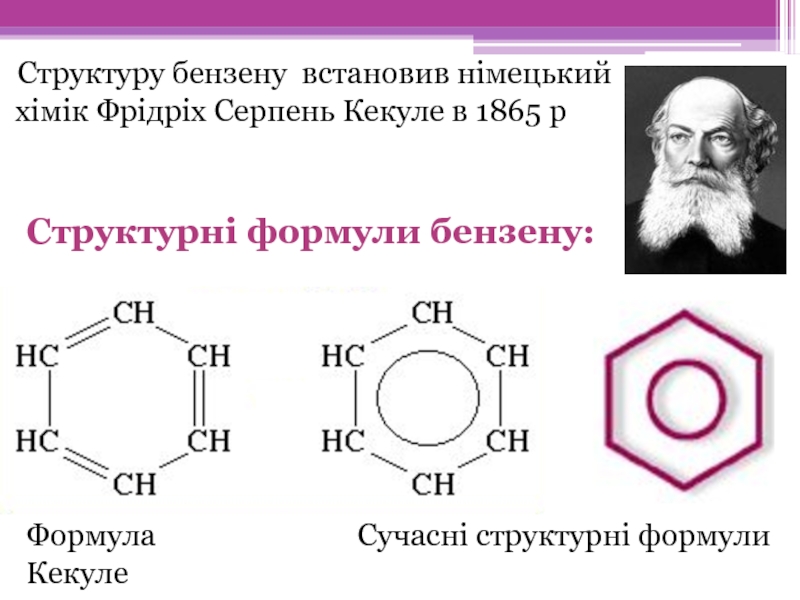
Слайд 6Структуру бензену встановив німецький хімік Фрідріх Серпень Кекуле в 1865 р
Формула
Сучасні структурні формули
Структурні формули бензену:
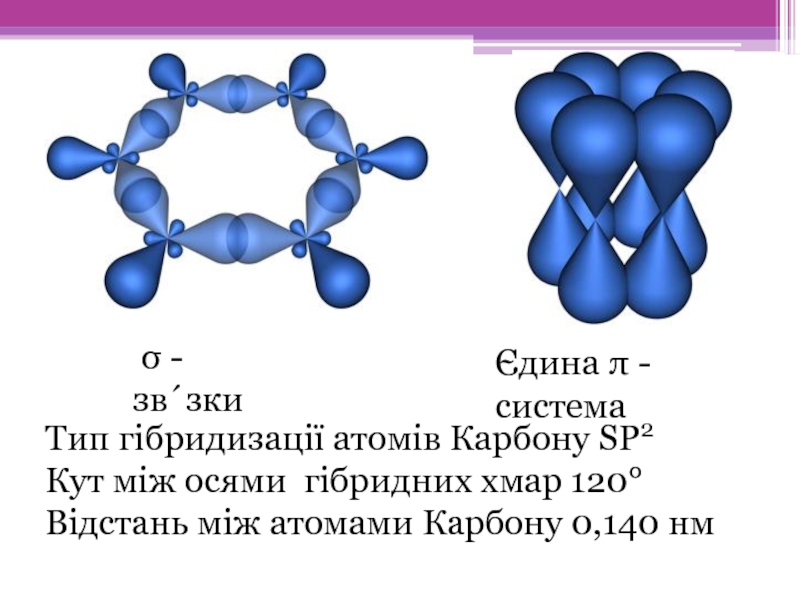
Слайд 8Тип гібридизації атомів Карбону SP2
Кут між осями гібридних хмар 120°
Відстань між
σ - зв´зки
Єдина π - система
Слайд 9Фізичні властивості бензену.
1. Безбарвна рідина.
2. Із характерним запахом.
3. tпл = 5,5°С;
4. Нерозчинний у воді
5. Легший за воду (ρ = 0, 88 г/см3)
6. Є добрим розчинником.
7. Вдихання парів бензену викликає головну біль, запаморочення. Подразнює слизові оболонки.
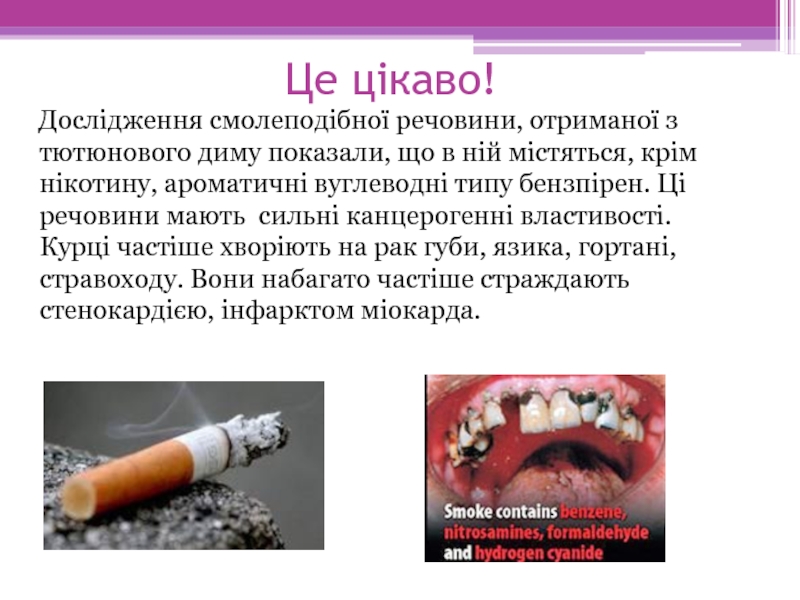
Слайд 10Це цікаво!
Дослідження смолеподібної речовини, отриманої з тютюнового диму показали, що в
Слайд 12І. Реакції окиснення:
Горіння (Горить бензен яскраво-червоним кіптявим полум’ям) .
(запишіть рівняння реакції)
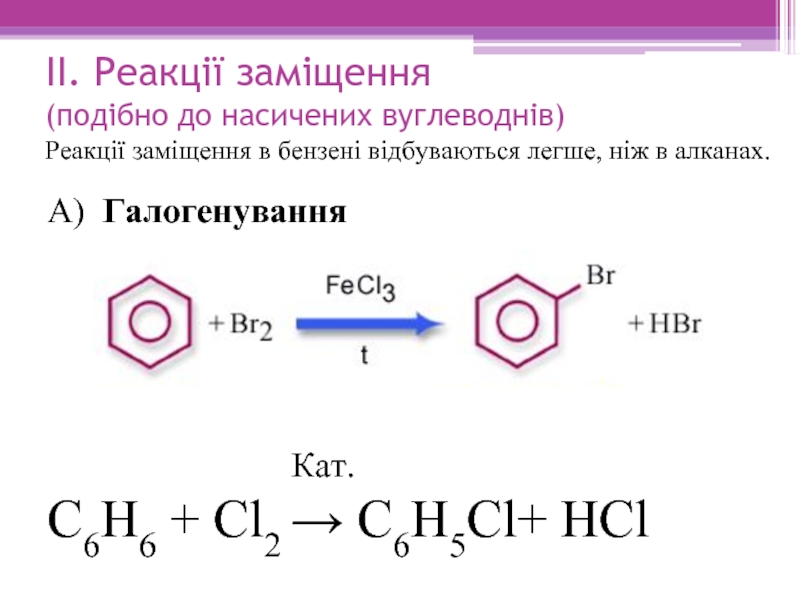
Слайд 14ІІ. Реакції заміщення (подібно до насичених вуглеводнів) Реакції заміщення в бензені відбуваються
А) Галогенування
Кат.
С6Н6 + Сl2 → С6Н5Cl+ НCl
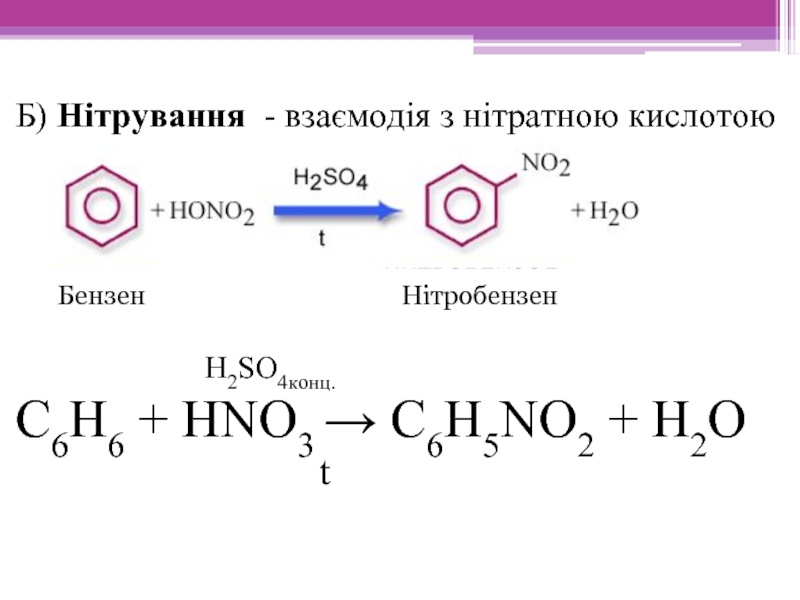
Слайд 15Б) Нітрування - взаємодія з нітратною кислотою
С6Н6 + HNO3 → С6Н5NO2 + Н2O
t
Бензен
Нітробензен
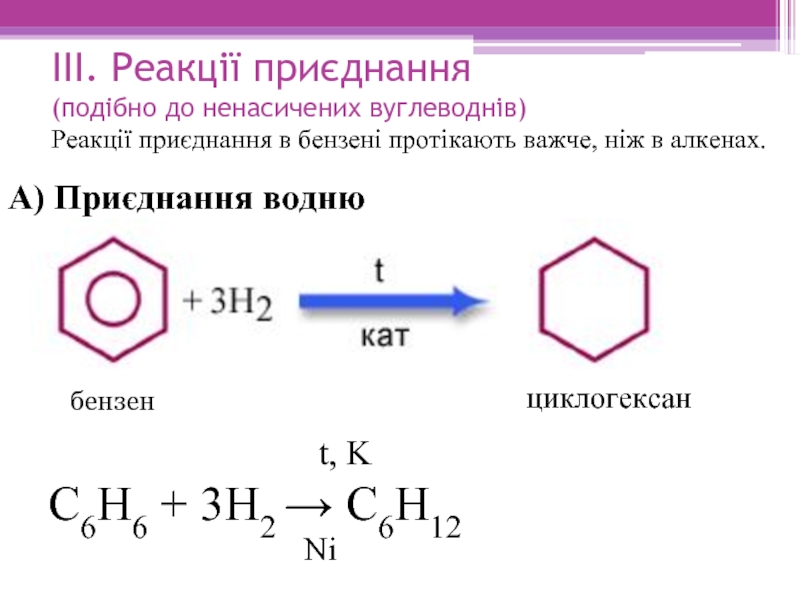
Слайд 16ІІІ. Реакції приєднання (подібно до ненасичених вуглеводнів) Реакції приєднання в бензені протікають
А) Приєднання водню
t, K
С6Н6 + 3Н2 → С6Н12
Ni
циклогексан
бензен
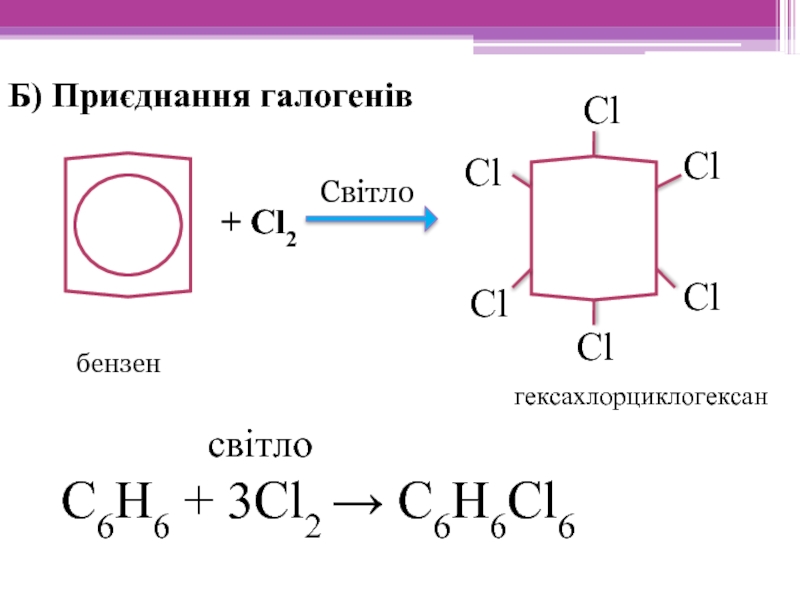
Слайд 17Б) Приєднання галогенів
світло
С6Н6 + 3Сl2 → С6Н6Cl6
Cl
Cl
Cl
Cl
Cl
Cl
Cвітло
бензен
гексахлорциклогексан
Слайд 18Незважаючи на високу ненасиченість молекули бензену (за складом), він не дає
Це пов'язано з особливою будовою молекули бензену.
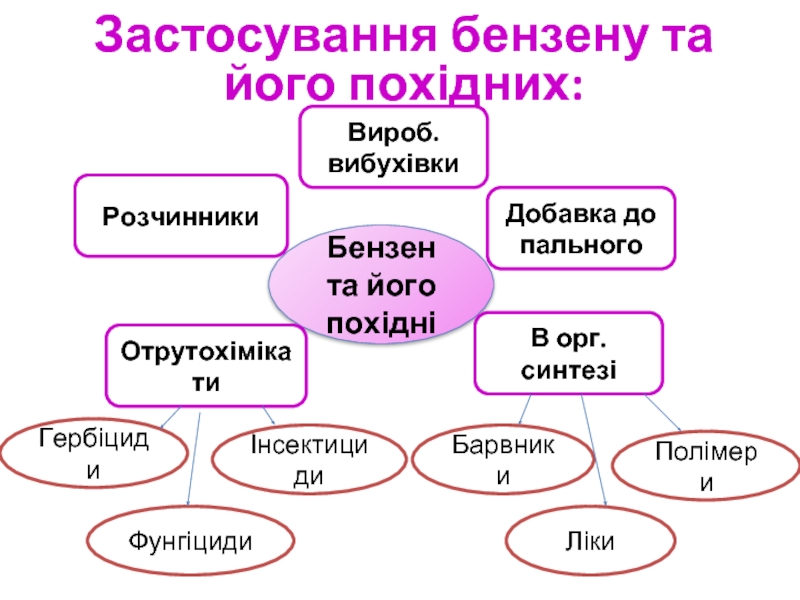
Слайд 19Бензен та його похідні
Розчинники
В орг. синтезі
Отрутохімікати
Добавка до
Вироб. вибухівки
Фунгіциди
Інсектициди
Гербіциди
Барвники
Ліки
Полімери
Застосування бензену та його похідних:
Слайд 20Розв’яжіть задачі
1. Визначити молекулярну формулу вуглеводню, густина його за воднем становить
2. Масова частка Карбону в молекулі вуглеводню 85,7%. Густина речовини за повітрям – 1,45. Визначте молекулярну формулу сполуки.