- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Белки. Определение презентация
Содержание
- 1. Белки. Определение
- 2. Белки-это природные высокомолекулярные органические соединения, построенные из
- 3. Полипептидная цепь представляет собой продукт поликонденсации аминокислот.
- 4. Полипептидная цепь имеет неразветвленное строение и состоит
- 5. Глицин
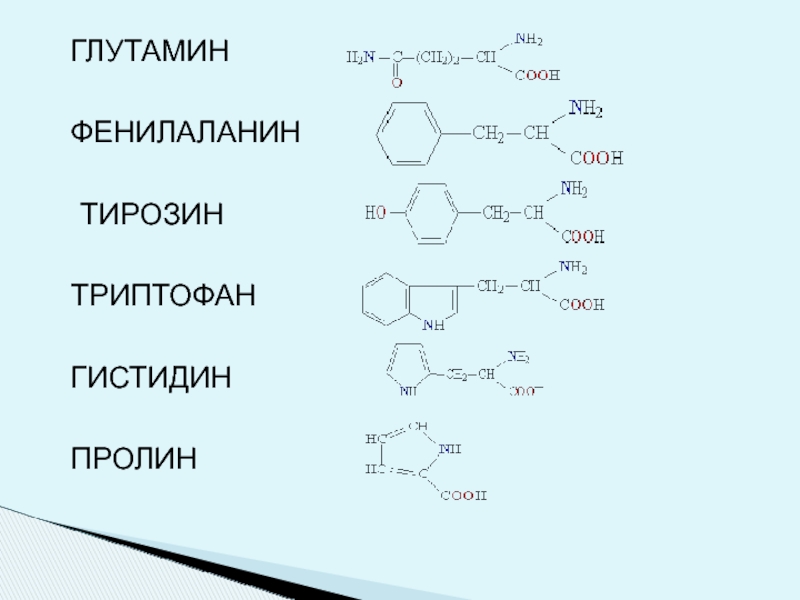
- 6. ГЛУТАМИН ФЕНИЛАЛАНИН ТИРОЗИН
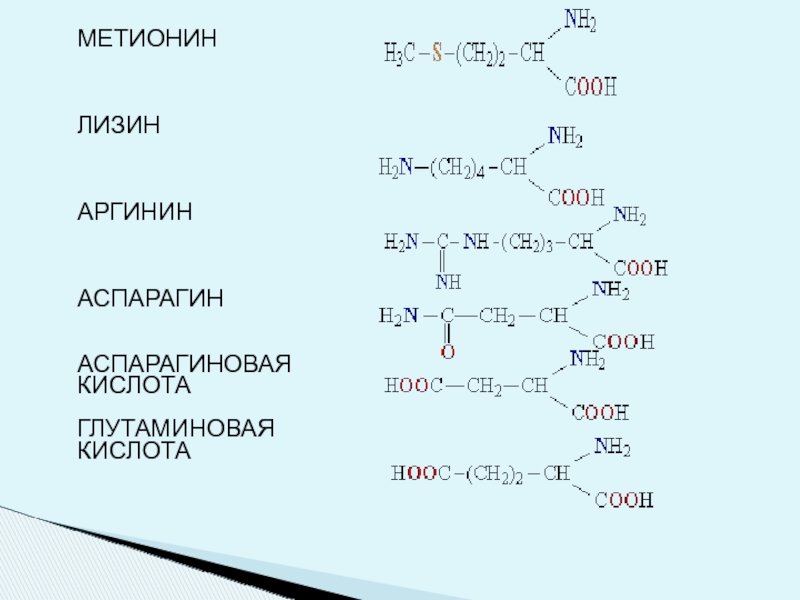
- 7. МЕТИОНИН
- 8. Заменимые- могут синтезироваться в организме человека: гли,
- 9. Аминокислоты незаменимые Триптофан Фенилаланин Лизин
- 10. Простые (протеины):состоят в основном из 20 остатков
- 11. Протеин-белок куриного яйца- альбумин. Протеид-гемоглобин. Состав гемоглобина
- 12. Первичная структура белка – это число и
- 13. Нарушение последовательности чередования аминокислот в цепи резко
- 14. Один из первых белков, первичная структура которого
- 15. Инсулин как полипептид
- 16. Вторичная структура белка – это α-
- 17. В одном витке спирали содержится 3,6 аминокислотных
- 18. Третичная структура белка – это конфигурация, которую принимает в пространстве закрученная в спираль полипептидная цепь.
- 19. Спиралевидная цепь способна сворачиваться в клубок. Она
- 20. Разные способы изображения трёхмерной структуры белка
- 21. Четвертичная структура белка – это соединенные друг
- 22. По растворимости: фибриллярные и глобулярные. Фибриллярные белки
- 23. По агрегатному состоянию различают твердые, жидкие или полужидкие (студнеобразные) белки.
- 24. Белки содержат различные функциональные группы, поэтому их
- 25. 1.Гидролиз- необратимое разрушение первичной структуры. Гидролиз бывает
- 26. Ферментативный гидролиз протекает селективно, т.е. ферменты расщепляют
- 27. Гидролиз белков в организме
- 28. 2) денатурация – нарушение природной структуры белка
- 29. При действии органических растворителей, продуктов
- 30. Первичная структура белка при денатурации сохраняется. Денатурация
- 31. Для аминокислот, постоянно встречающихся в составе белков,
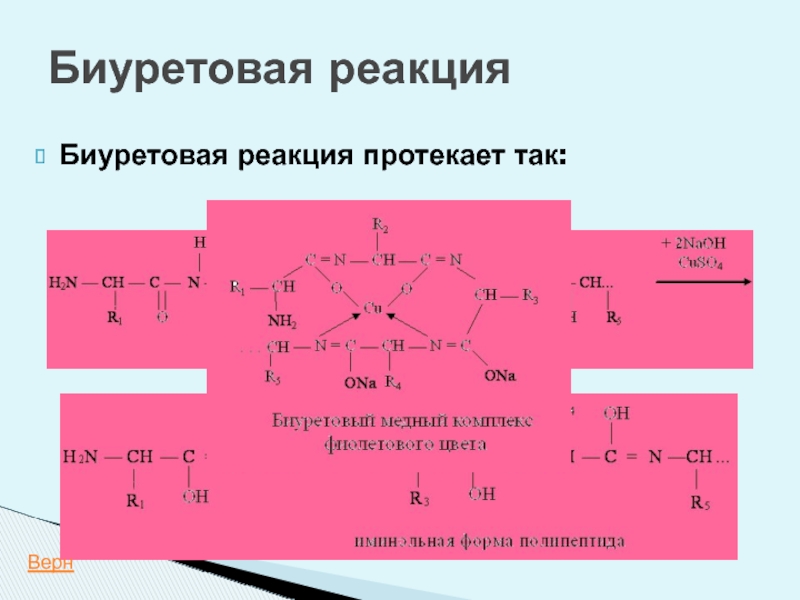
- 32. Биуретовая реакция Определяет наличие пептидной связи
- 34. Биуретовая реакция Биуретовая реакция протекает так: +CuSO4 +NaOH Верн
- 35. Определяет присутствие в белке ароматических и гетероциклических
- 36. Ксантопротеиновая реакция При действии концентрированной НNО3 на
- 37. Цистеиновая реакция.
Слайд 2Белки-это природные высокомолекулярные органические соединения, построенные из остатков α- аминокислот, соединенных
Все природные белки содержат 5 химических элементов:
C, Н, О, N,S.
Определение
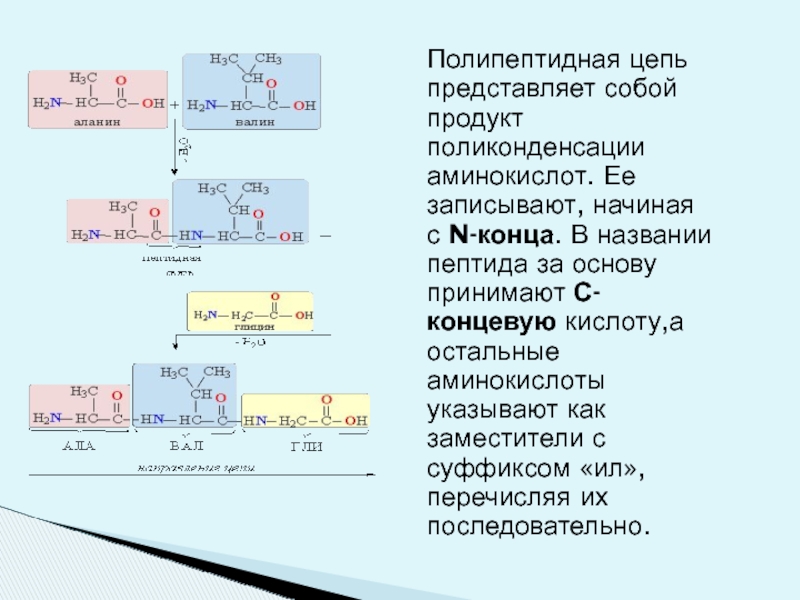
Слайд 3Полипептидная цепь представляет собой продукт поликонденсации аминокислот. Ее записывают, начиная с
Слайд 4 Полипептидная цепь имеет неразветвленное строение и состоит из чередующихся метиновых (CH)
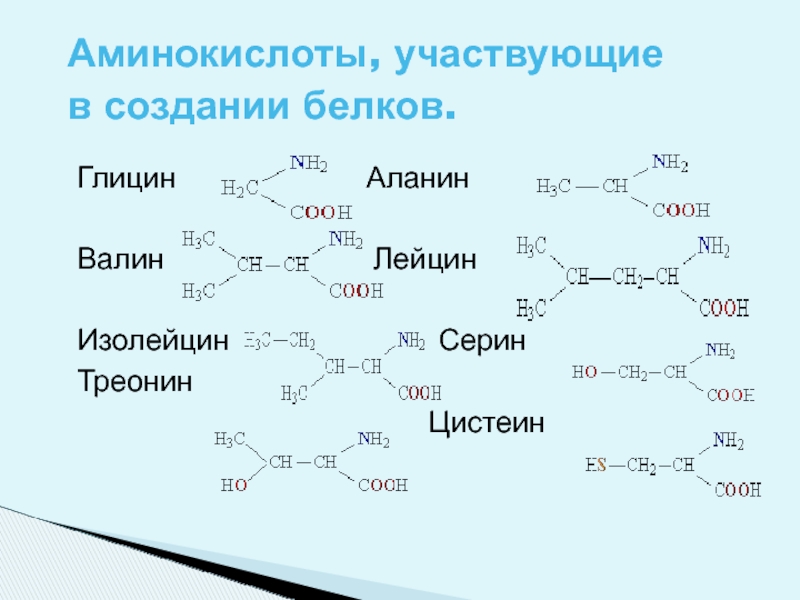
Слайд 5Глицин Аланин
Валин Лейцин
Изолейцин Серин
Треонин
Цистеин
Аминокислоты, участвующие в создании белков.
Слайд 8Заменимые- могут синтезироваться в организме человека: гли, ала, сер, цис, тир,
Незаменимые- не могут синтезироваться в организме человека; должны поступать в организм в составе белков пищи: фен, вал, лиз.
Природные аминокислоты делятся на:
Слайд 10Простые (протеины):состоят в основном из 20 остатков аминокислот.
Сложные (протеиды):помимо остатков аминокислот
Классификация белков
Слайд 11Протеин-белок куриного яйца- альбумин.
Протеид-гемоглобин. Состав гемоглобина выражается формулой
Примеры простых и сложных белков.
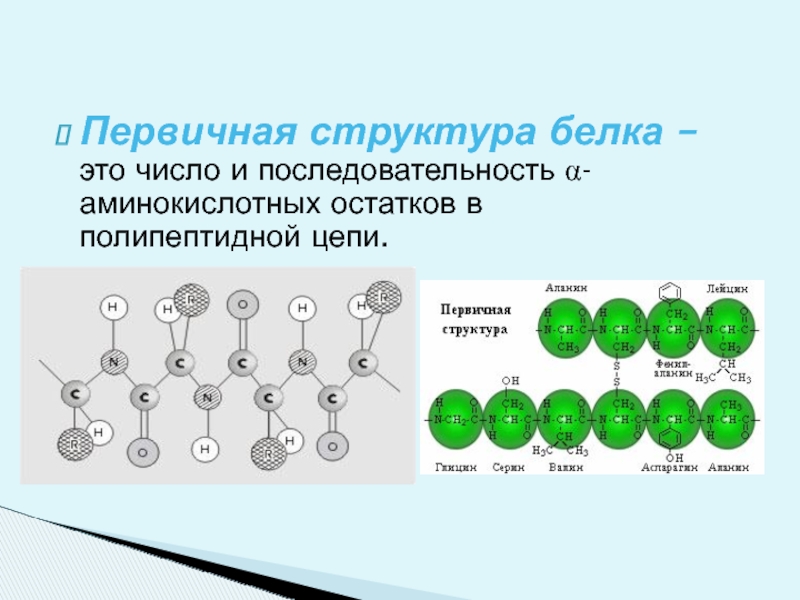
Слайд 12Первичная структура белка – это число и последовательность α- аминокислотных остатков
Структура белка
Слайд 13Нарушение последовательности чередования аминокислот в цепи резко изменяет свойство белка. Например,
Слайд 14Один из первых белков, первичная структура которого была установлена- гормон инсулин,
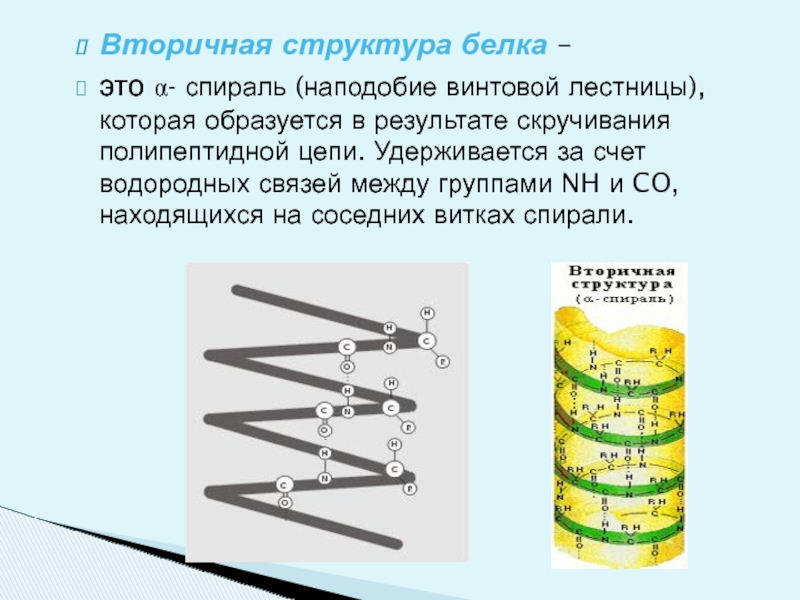
Слайд 16Вторичная структура белка –
это α- спираль (наподобие винтовой лестницы),которая образуется
Слайд 17В одном витке спирали содержится 3,6 аминокислотных остатка.
Все боковые радикалы находятся
Вторичная структура белка была установлена американским химиком Полингом в 1951 году.
Слайд 18Третичная структура белка – это конфигурация, которую принимает в пространстве закрученная
Слайд 19Спиралевидная цепь способна сворачиваться в клубок. Она поддерживается за счет взаимодействия
Слайд 21Четвертичная структура белка – это соединенные друг с другом макромолекулы белков.
Слайд 22По растворимости:
фибриллярные и глобулярные.
Фибриллярные белки нерастворимы в воде. Они имеют линейное
Глобулярные белки (альбумин) растворимы в воде или образуют коллоидные растворы. Имею сложную трехмерную структуру, свернуты в компактные клубочки.
Физические свойства белков.
Слайд 24Белки содержат различные функциональные группы, поэтому их нельзя отнести к определенному
Белки- это высшая форма существования органических веществ.
Белки обладают амфотерными свойствами.
Химические свойства белков.
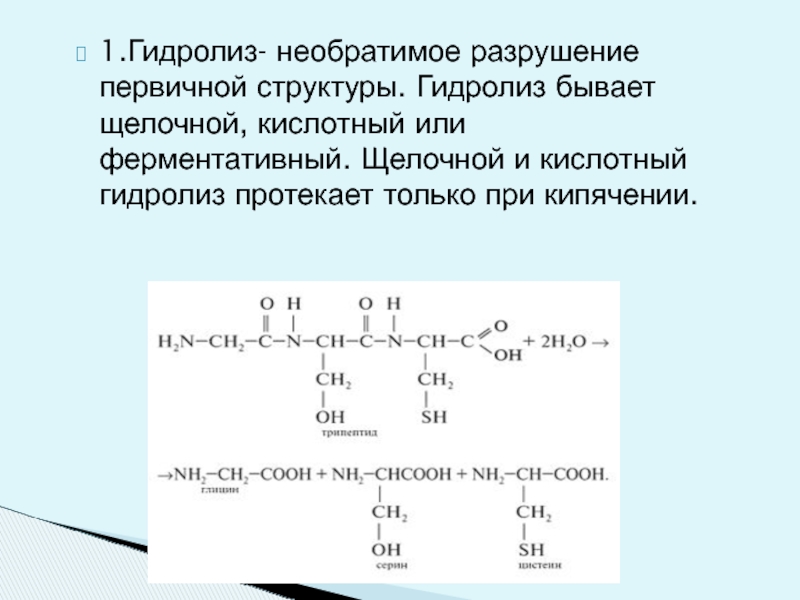
Слайд 251.Гидролиз- необратимое разрушение первичной структуры. Гидролиз бывает щелочной, кислотный или ферментативный.
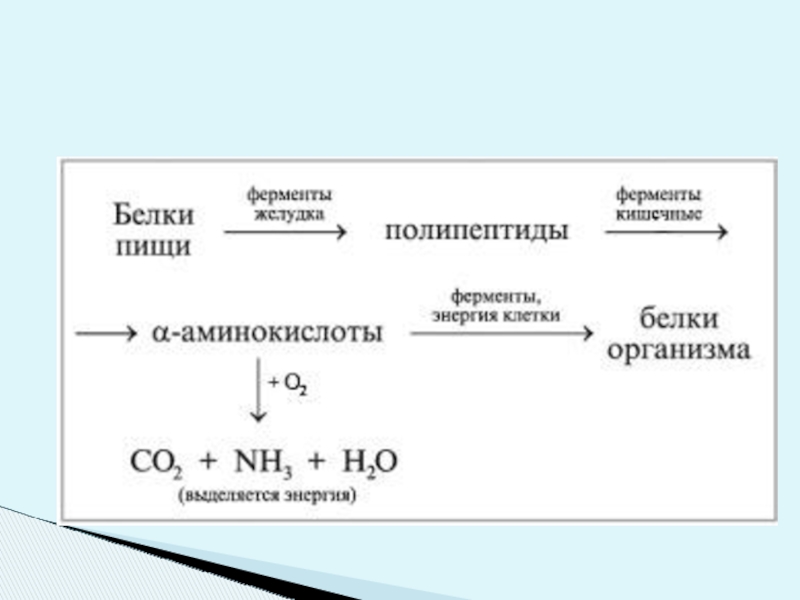
Слайд 26Ферментативный гидролиз протекает селективно, т.е. ферменты расщепляют строго определенные участки цепи;
Слайд 282) денатурация – нарушение природной структуры белка (под действием нагревания и
Слайд 29 При действии органических растворителей, продуктов жизнедеятельности некоторых бактерий (молочнокислое
Слайд 30 Первичная структура белка при денатурации сохраняется. Денатурация может быть обратимой (так
Слайд 31Для аминокислот, постоянно встречающихся в составе белков, разработано множество цветных (в
Надо помнить, что все качественные реакции – это реакции не собственно на белки, а на определенные аминокислоты, входящие в их состав.
3.Качественные реакции на белки.
Слайд 32Биуретовая реакция
Определяет наличие пептидной связи в растворе исследуемого соединения.
Белок
пептидная связь
Слайд 35Определяет присутствие в белке ароматических и гетероциклических α - аминокислот :
триптофана,
фенилаланина,
тирозина,
гистидина.
Ксантопротеиновая реакция
Слайд 36Ксантопротеиновая реакция
При действии концентрированной НNО3 на раствор белка образуется нитросоединение, окрашенное