- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Біохімія білків презентация
Содержание
- 1. Біохімія білків
- 2. Білки – високомолекулярні полімерні азотомісні сполуки, що
- 3. Функції білків Структурна – білки є обов'язковим
- 4. Функції білків Каталітична (ферментативна) – тільки білки
- 5. Функції білків Захисна – тільки білки виконують
- 6. Функції білків Газообмінна (дихальна) – перенесення газів:
- 7. Функції білків Транспортна – лише білки здатні
- 8. Функції білків Підтримання гомеостазу – білки формують
- 9. Властивості білків Білки володіють низкою властивостей, характерних
- 10. Властивості білків Здатність до коагуляції: при втраті
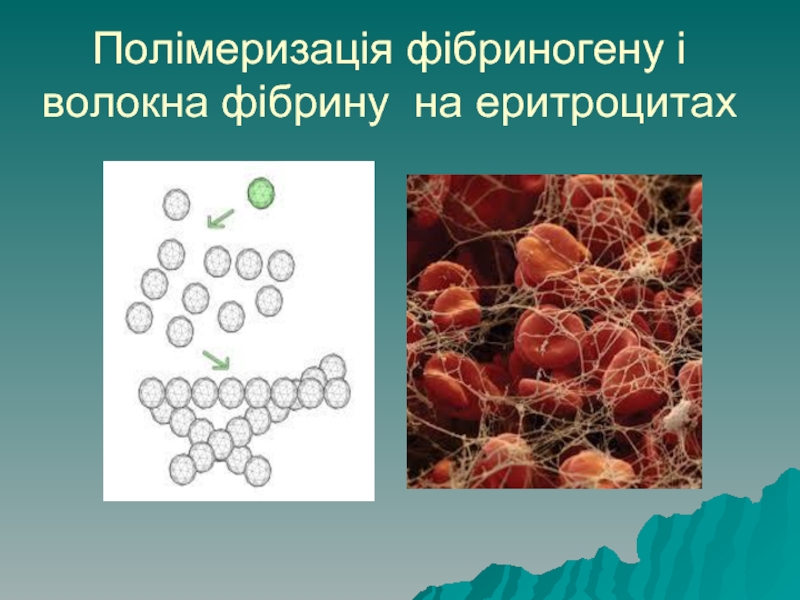
- 11. Полімеризація фібриногену і волокна фібрину на еритроцитах
- 12. Властивості білків Висолювання – здатність білків під
- 13. Будова амінокислот Амінокислоти – мономери білків, є
- 14. Загальна формула амінокислот
- 15. Будова амінокислот До складу білків входить 19
- 16. Властивості амінокислот Для амінокислот характерна амфотерність –
- 17. Амфотерність амінокислот
- 18. Класифікація амінокислот Амінокислоти класифікують за двома ознаками:
- 19. Класифікація амінокислот За будовою радикала амінокислоти поділяють
- 20. Класифікація амінокислот Молекула моноамінокарбонових амінокислот містить одну
- 21. Структура моноаміномонокарбонової амінокислоти - аланіну
- 22. Структура моноаміномонокарбонової амінокислоти - цистеїну
- 23. Класифікація амінокислот Моноамінодикарбонові кислоти мають одну аміногрупу
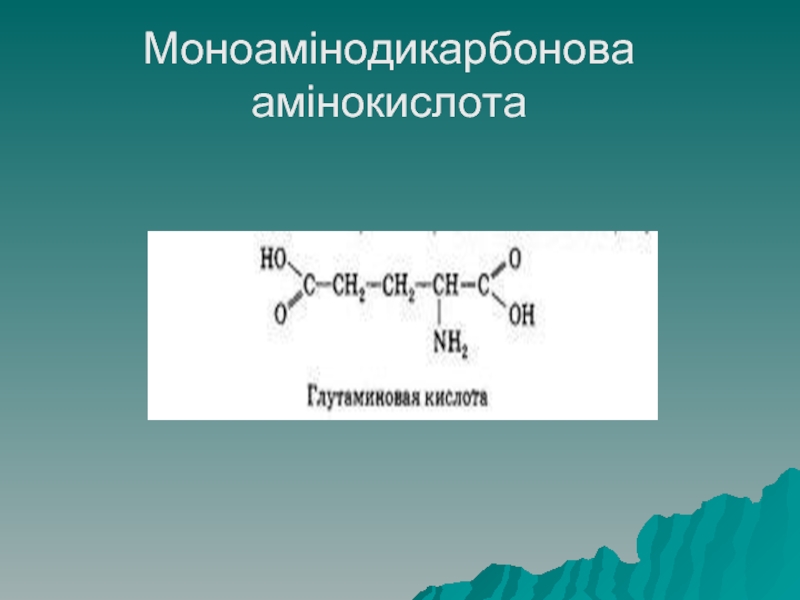
- 24. Моноамінодикарбонова амінокислота
- 25. Класифікація амінокислот Диаміномонокарбонові – містять дві аміногрупи
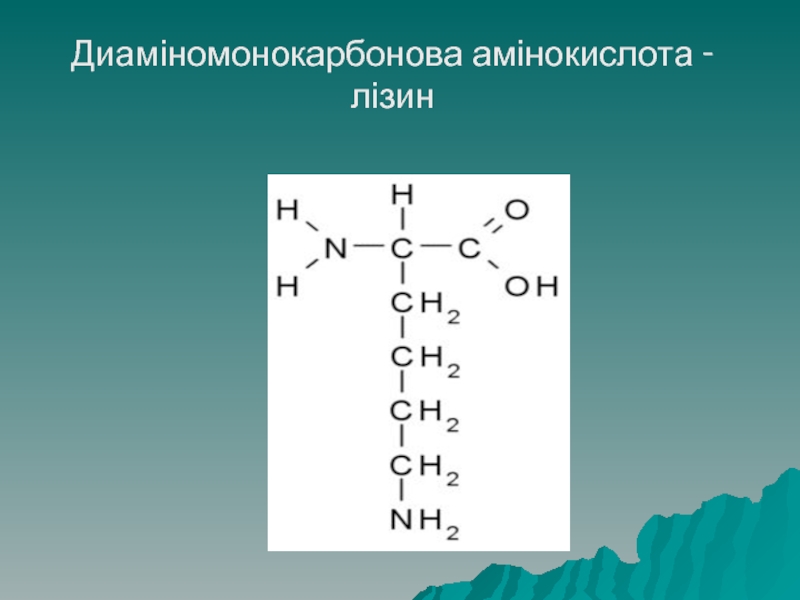
- 26. Диаміномонокарбонова амінокислота - лізин
- 27. Класифікація амінокислот Циклічні амінокислоти поділяють на гомоциклічні,
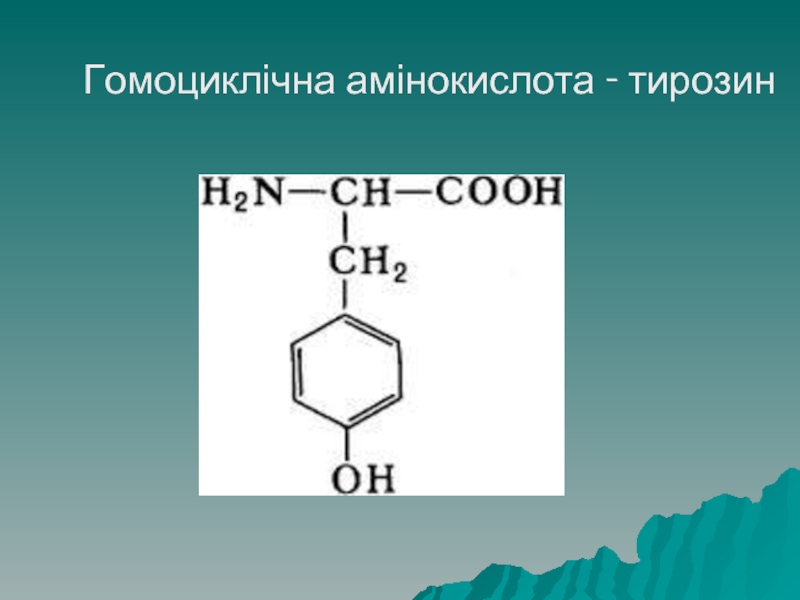
- 28. Гомоциклічна амінокислота - тирозин
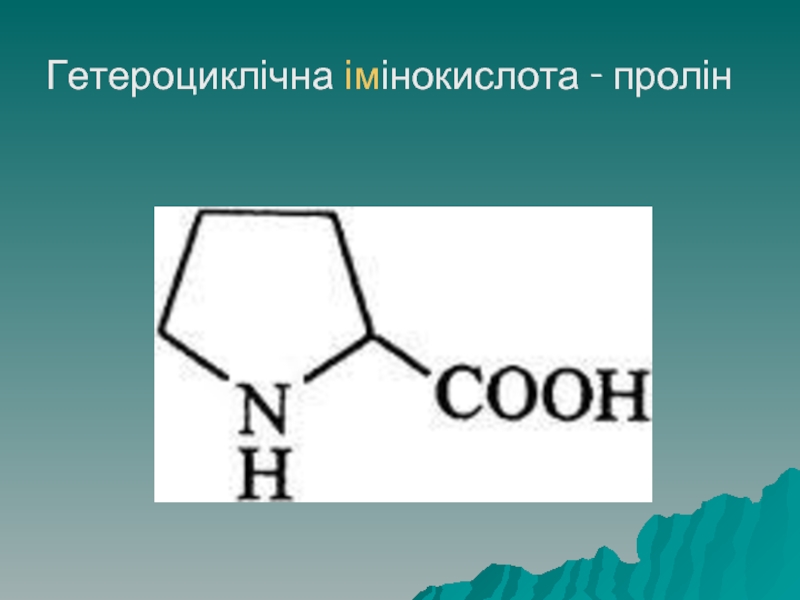
- 29. Класифікація амінокислот До гетероциклічних належать триптофан, гістидин і імінокислота - пролін
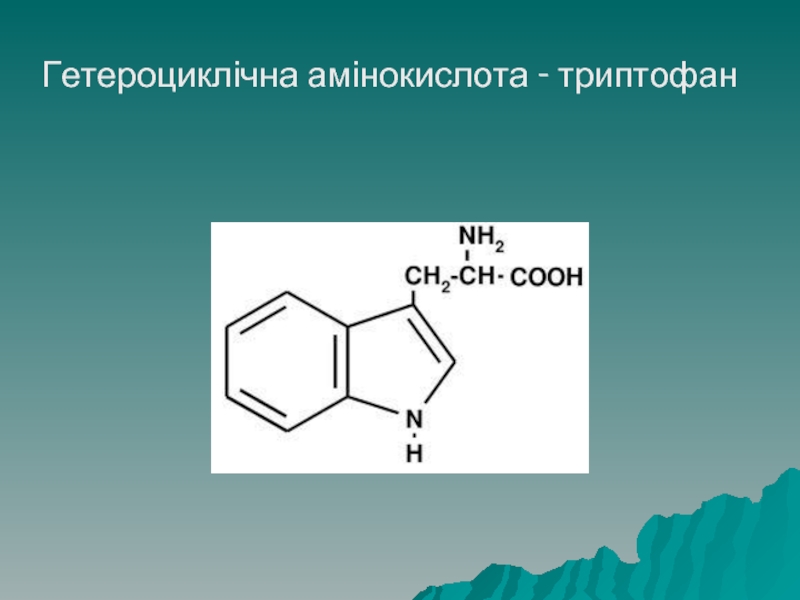
- 30. Гетероциклічна амінокислота - триптофан
- 31. Гетероциклічна імінокислота - пролін
- 32. Структура білків Амінокислоти здатні взаємодіяти між собою
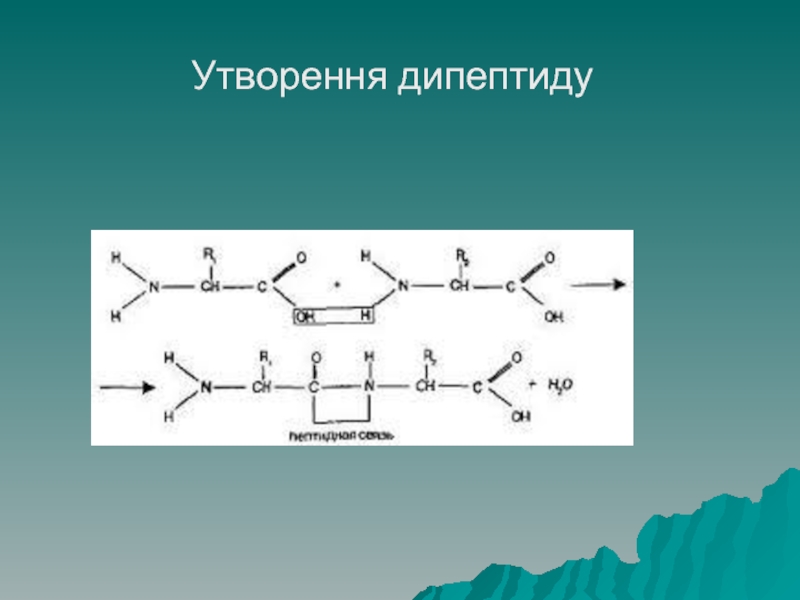
- 33. Утворення дипептиду
- 34. Структура білків Якщо пептидним зв'язком зв'язані дві
- 35. Структура білків Білки мають 4 рівні структурної
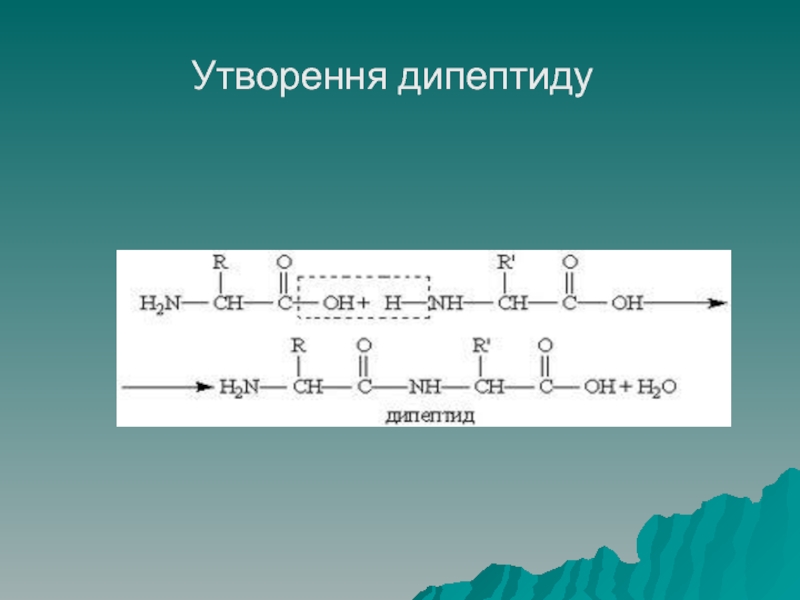
- 36. Утворення дипептиду
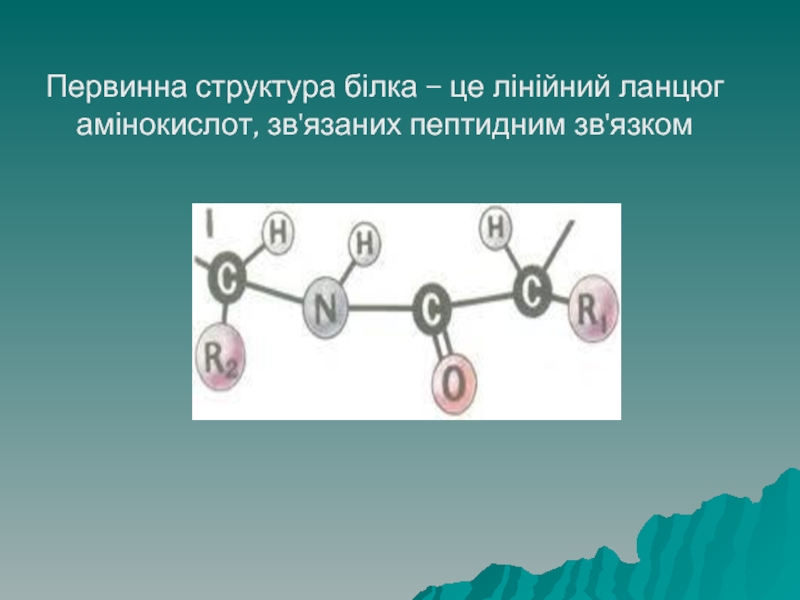
- 37. Первинна структура білка – це лінійний ланцюг амінокислот, зв'язаних пептидним зв'язком
- 38. Структура білків Вторинна структура буває двох видів
- 39. Вторинна структура - альфа - спіраль звязком
- 40. Структура білків Бета – складчастий шар –
- 41. Вторинна структура – бета-складчастий шар
- 42. Структура білків Третинна структура білків – це
- 43. Третинна структура білка
- 44. Структура білків Четвертинна структура – це декілька
- 45. Четвертинна структура білків
- 46. Рівні структурної організації білків
- 47. Структура білків Домени – це специфічні структури,
- 48. Доменні структури у молекулі білка
- 49. Утворення доменів
- 50. Хімічні зв'язки білків Структуру білків підтримують ряд
- 51. Хімічні зв'язки білків Третинну структуру підтримують дисульфідні
- 52. Хімічні зв'язки білків
- 53. Класифікація білків Існує дві класифікації білків: за
- 54. Глобулярні білки Глобулярні білки мають округлу форму
- 55. Глобулярні білки у розчинах електролітів. Надзвичайно легко осаджуються (розведеними розчинами електролітів).
- 56. Фібрилярні білки Фібрилярні білки – мають ниткоподібну
- 57. Глобулярні білки
- 58. Фібрилярні білки
- 59. Структура білків Глобулярні білки можуть об'єднуватись у
- 60. Поєднання фібрилярної і глобулярної структур білків м'язів
- 61. Прості і складні білки За складністю будови
- 62. Фосфопротеїди Фосфопротеїди у якості небілкової групи містять
- 63. Казеїн - фосфопротеїд
- 64. Нуклепротеїди Нуклеопротеїди – це білки, зв'язані з
- 65. Нуклепротеїди – гістони і ДНК
- 66. Хромопротеїди Хромопротеїди – клас складних білків, що
- 67. Гем – небілкова частина хромопротеїдів
- 68. Глікопротеїди Глікопротеїди – складні білки, що містять
- 69. Імуноглобуліни - глікопротеїди
- 70. Білки - пріони Існує група патогенних білків
- 71. Висновок Таким чином білки – надзвичайно важливі
Слайд 1Біохімія білків
Загальна характеристика білків
Біохімія амінокислот
Структурна організація білкової молекули
Класифікація білків
Слайд 2Білки – високомолекулярні полімерні азотомісні сполуки, що складаються з амінокислот, зв'язаних
пептидним зв'язком.
Білки відіграють ряд важливих функцій, є специфічними для кожного організму, тому з білками пов'язують існування життя. Інша назва білків – протеїни (proteins) означає найперший, найважливіший.
Білки відіграють ряд важливих функцій, є специфічними для кожного організму, тому з білками пов'язують існування життя. Інша назва білків – протеїни (proteins) означає найперший, найважливіший.
Слайд 3Функції білків
Структурна – білки є обов'язковим компонентом клітинних мембран, з білків
побудовані сухожилля, зв'язки, найбільш важливим структурним білком є колаген – основа дерми, окістя. З білків побудовані похідні епідермісу – пір'я, волос, роги, нігті, лусочки тощо.
Слайд 4Функції білків
Каталітична (ферментативна) – тільки білки є природними каталізаторами, прискорювачами хімічних
реакцій. Без ферментів у живих організмах не відбувається жодна хімічна реакція, а отже і жодний фізіологічний процес. До ферментів належать: амілаза, пепсин, ліпаза, целюлаза тощо.
Слайд 5Функції білків
Захисна – тільки білки виконують функцію захисту від чужорідних тіл,
це: імуноглобуліни (антитіла), що смнтезуються лейкоцитами, специфічний антивірусний білок крові – інтерферон, антибактеріальний – пропердин, захисний білок секретів – лізоцим.
Слайд 6Функції білків
Газообмінна (дихальна) – перенесення газів: кисню, вуглекислого газу. У крові
цю функцію виконує гемоглобін, у м'язах – міоглобін.
Слайд 7Функції білків
Транспортна – лише білки здатні переносити інші речовини: ліпіди, вітаміни,
мінерали, пігменти. Білок трансферин переносить Fe, церулоплазмін – Cu.
Слайд 8Функції білків
Підтримання гомеостазу – білки формують білкову буферну систему, що підтримує
рН крові, білки створюють в'язкість крові, білки створюють особливу форму осмотичного тиску – онкотичний.
Слайд 9Властивості білків
Білки володіють низкою властивостей, характерних лише для даного класу сполук:
Специфічність
– кожен живий організм має свій, притаманний лише йому, специфічний набір білків, будова яких генетично запрограмована.
Слайд 10Властивості білків
Здатність до коагуляції: при втраті електричного заряду та сольватної оболонки
білки злипаються між собою, випадають в осад – коагулюють. Коагуляція білка фібриногену – перетворення його у фібрин є основою згортання крові і попередження крововиливів.
Слайд 12Властивості білків
Висолювання – здатність білків під впливом електролітів (солей) втрачати молекули
води, що знаходяться всередині молекули білка, зморщуватись і випадати в осад.
Набухання – збільшення молекули білка при видаленні солей
Набухання – збільшення молекули білка при видаленні солей
Слайд 13Будова амінокислот
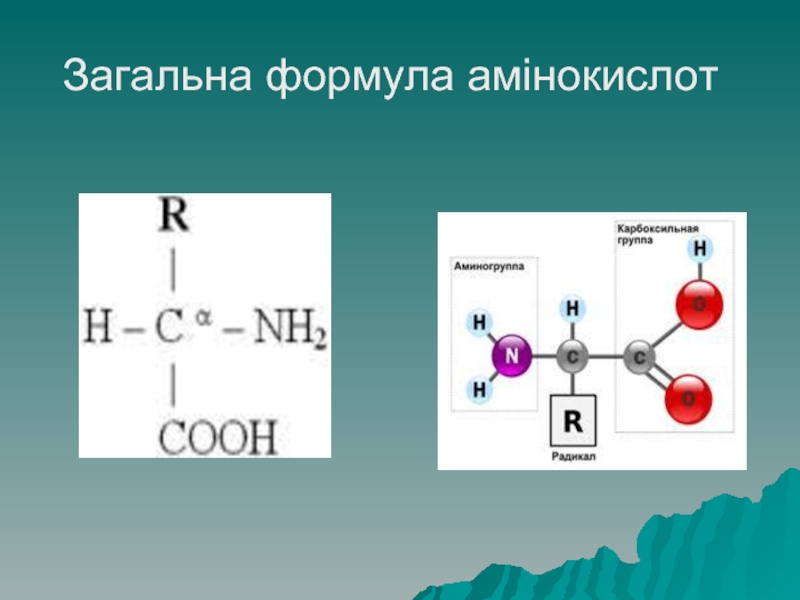
Амінокислоти – мономери білків, є похідними органічних кислот, всі амінокислоти,
що входять до складу білків (протеїногенні) належать до α (альфа) – амінокислот, це означає, що до наступного за карбоксильною групою атому Карбону приєднана аміногрупа – NH2
Слайд 15Будова амінокислот
До складу білків входить 19 різних амінокислот, які відрізняються за
будовою радикала (R), який може бути атомом Гідрогену –Н (гліцин) або складною циклічною групою як у триптофана, одна імінокислота – містить іміногрупу – NH (пролін)
Слайд 16Властивості амінокислот
Для амінокислот характерна амфотерність – здатність одночасно проявляти кислі та
лужні властивості. Кислі властивості проявляються за рахунок карбоксильної групи –СООН, лужні властивості – за рахунок аміногрупи.
Слайд 18Класифікація амінокислот
Амінокислоти класифікують за двома ознаками: за зарядом радикала амінокислот (позитивно
заряджені, негативно заряджені, неполярні (не заряджені), за будовою радикала (кількістю аміно- та карбоксильних груп)
Слайд 19Класифікація амінокислот
За будовою радикала амінокислоти поділяють на лінійні та циклічні. Лінійні
поділяють у залежності від кількості аміно- та карбоксильних груп на: моноамінокарбонові, диаміномонокарбонові, моно- амінодикарбонові
Слайд 20Класифікація амінокислот
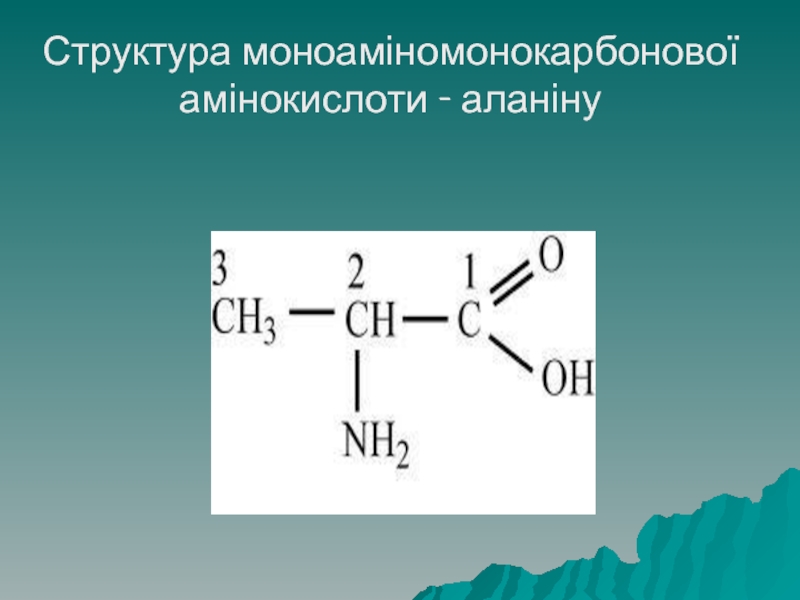
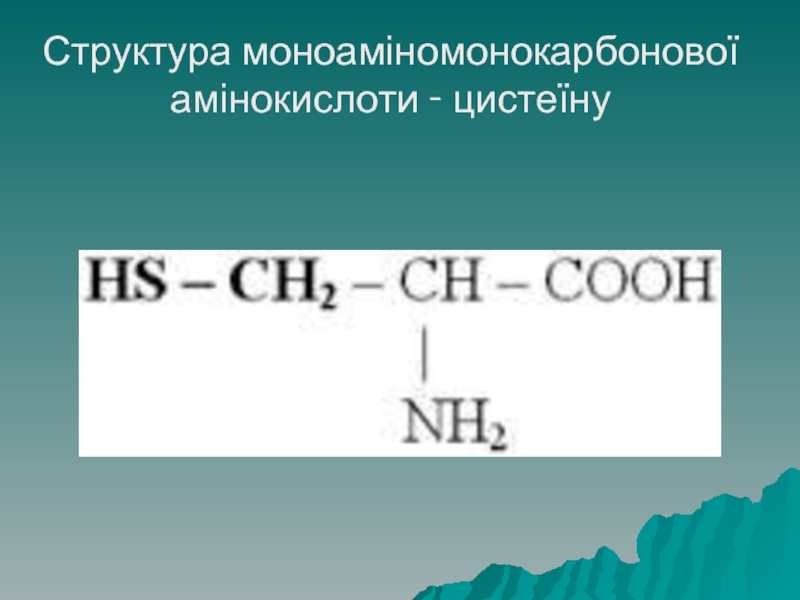
Молекула моноамінокарбонових амінокислот містить одну (моно-) аміногрупу і одну карбоксильну
групу. До даного класу належать: гліцин, аланін, серин, цистеїн, метіонін, треонін, лейцин, ізолейцин
Слайд 23Класифікація амінокислот
Моноамінодикарбонові кислоти мають одну аміногрупу і дві каррбоксильні, до даної
групи належать: аспарагінова кислота та глутамінова кислота
Слайд 25Класифікація амінокислот
Диаміномонокарбонові – містять дві аміногрупи і одну карбоксильну, до даної
групи належать: аргінін, лізіин, орнітин
Слайд 27Класифікація амінокислот
Циклічні амінокислоти поділяють на гомоциклічні, у яких цикл однорідний (складається
лише з атомів Карбону) і гетероциклічні, радикал яких містить як Карбон, так і Нітроген.
До гомоциклічних належать: фенілаланін, тирозин.
До гомоциклічних належать: фенілаланін, тирозин.
Слайд 29Класифікація амінокислот
До гетероциклічних належать триптофан, гістидин і імінокислота - пролін
Слайд 32Структура білків
Амінокислоти здатні взаємодіяти між собою ( реакція конденсації) утворюючи полімерні
ланцюги.
При взаємодії амінокислот утворюється специфічна форма ковалентного зв'язку – пептидний, цей зв’язок характерний лише для білків
При взаємодії амінокислот утворюється специфічна форма ковалентного зв'язку – пептидний, цей зв’язок характерний лише для білків
Слайд 34Структура білків
Якщо пептидним зв'язком зв'язані дві амінокислоти, то таке утворення називають
дипептидом, три – трипептидом і т.д., якщо у сполуці до 10 амінокислот, то її називають олігопептидом, більше 10 – поліпептидом.
Слайд 35Структура білків
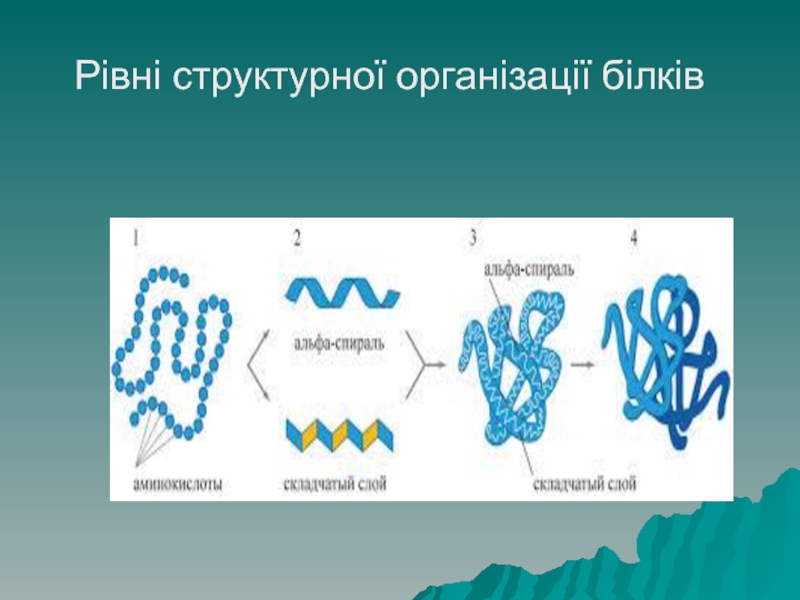
Білки мають 4 рівні структурної організації молекули.
Первинна структура білка
– це лінійний ланцюг, що складається з амінокислот, зв'язаних пептидним зв'язком (поліпептид). Послідовність амінокислот генетично запрограмована в ДНК
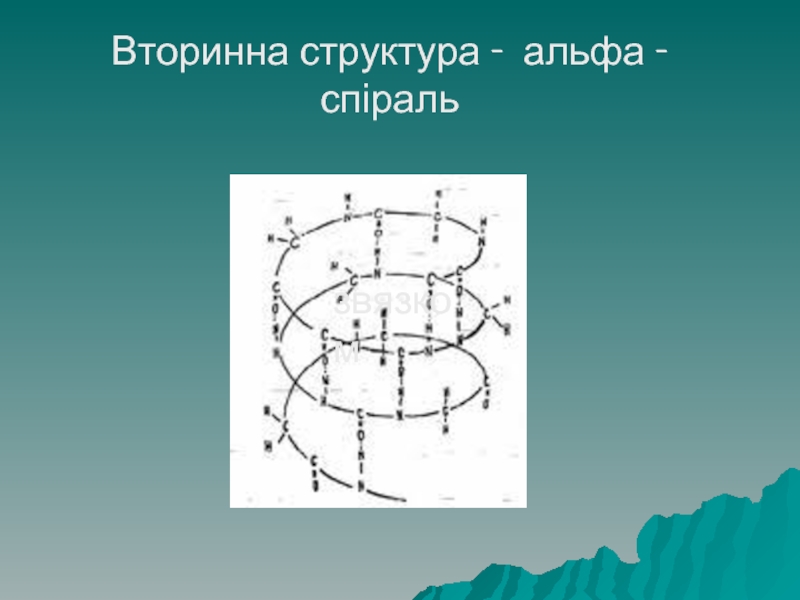
Слайд 38Структура білків
Вторинна структура буває двох видів – у вигляді α –
спіралі: правозакручена спіраль, висота одного оберту – 0,54 нм, в одному оберті спіралі міститься 3,6 амінокислотних залишки.
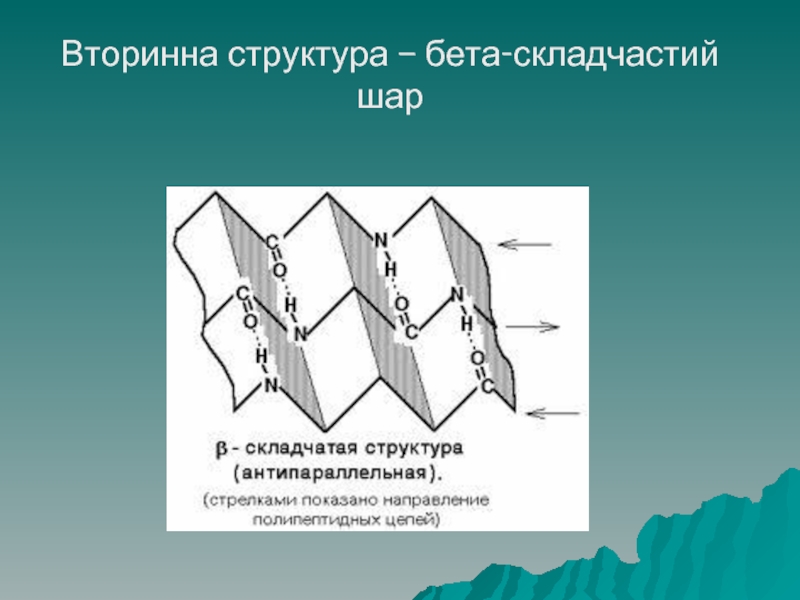
Слайд 40Структура білків
Бета – складчастий шар – другий вид вторинної структури: поліпептидні
ланцюги знаходяться на одній площині, протилежно направлені і зв'язані між собою водневими зв'язками, схожі на складчасту тканину, таку структуру має колаген.
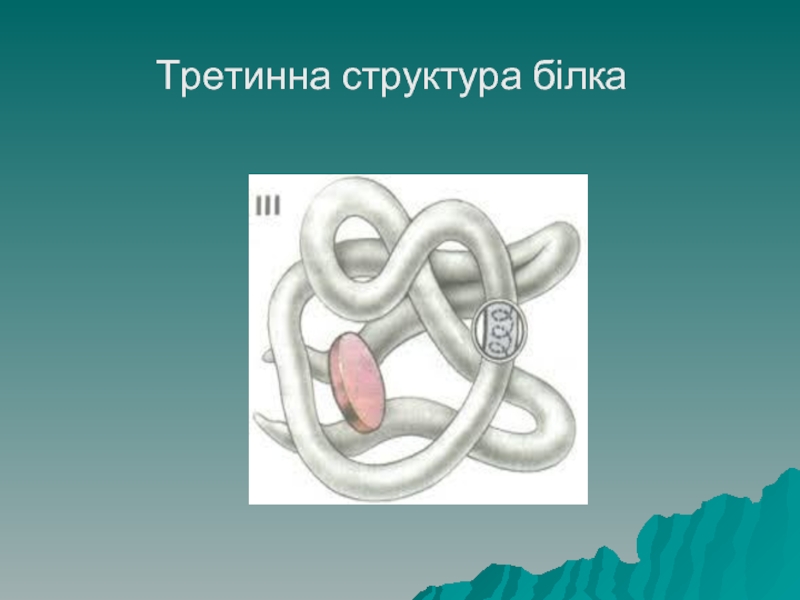
Слайд 42Структура білків
Третинна структура білків – це компактно (щільно) викладена у просторі
вторинна структура, найчастіше має вигляд глобули - кульки
Слайд 44Структура білків
Четвертинна структура – це декілька глобул третинної структури з'єднаних між
собою, найчастіше кількість глобул кратна 4, кожну окрему глобулу третинної структури називають протомером, а всю четвертинну структуру – мультимером. У гемоглобіну 4 протомери.
Слайд 47Структура білків
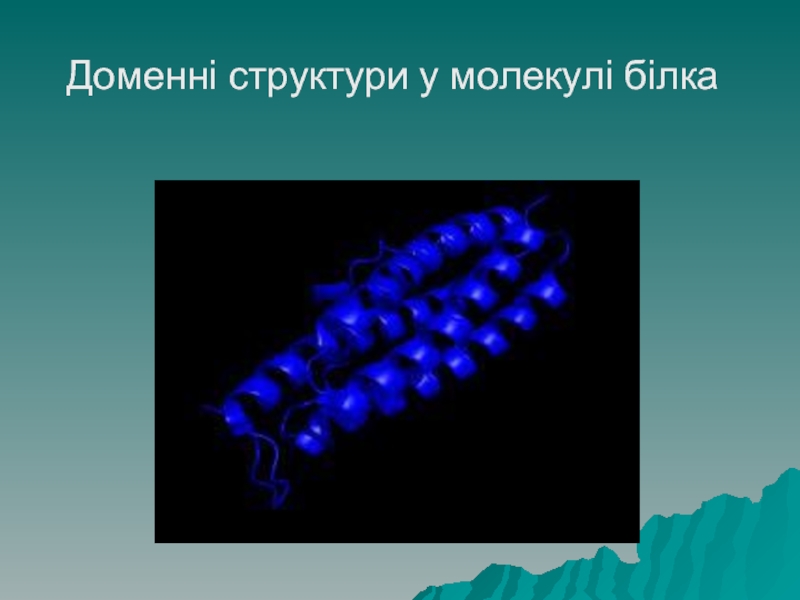
Домени – це специфічні структури, що мають вигляд спіралі, однак
вона побудована не з первинної, а з глобул третинної структури (намисто закручене у спіраль, кожна намистина – глобула третинної структури) на малюнку зображені стрілками
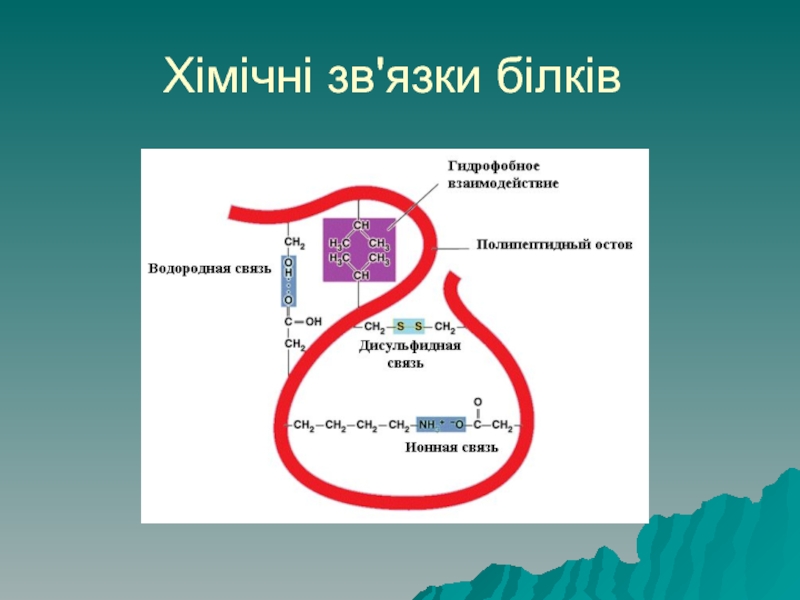
Слайд 50Хімічні зв'язки білків
Структуру білків підтримують ряд хімічних зв'язків:
Первинну структуру забезпечують пептидні
зв'язки (ковалентні).
Вторинну структуру стабілізують водневі зв'язки – між Н+ то ОН-, електростатичні – між позитивними NH3+ та негативними СОО-
Вторинну структуру стабілізують водневі зв'язки – між Н+ то ОН-, електростатичні – між позитивними NH3+ та негативними СОО-
Слайд 51Хімічні зв'язки білків
Третинну структуру підтримують дисульфідні зв'язки (ковалентні) між атомами сульфуру
амінокислоти цистеїну –S-S-.
Гідрофобні – незаряджені (гідрофобні) радикали намагаються відштовхнутись від води і ввертаються у середину глобули третинної структури
Гідрофобні – незаряджені (гідрофобні) радикали намагаються відштовхнутись від води і ввертаються у середину глобули третинної структури
Слайд 53Класифікація білків
Існує дві класифікації білків: за формою молекули та за складністю
будови.
За формою молекули білки поділяють на: глобулярні та фібрилярні.
За формою молекули білки поділяють на: глобулярні та фібрилярні.
Слайд 54Глобулярні білки
Глобулярні білки мають округлу форму і у свою чергу поділяються
на: альбуміни і глобуліни.
Альбуміни – мають еліпсоподібну форму, добре розчинні у воді і у розчинах електролітів, стійкі до осадження. Глобуліни – чітко округлі, нерозчинні у воді, розчинні
Альбуміни – мають еліпсоподібну форму, добре розчинні у воді і у розчинах електролітів, стійкі до осадження. Глобуліни – чітко округлі, нерозчинні у воді, розчинні
Слайд 55Глобулярні білки
у розчинах електролітів. Надзвичайно легко осаджуються (розведеними розчинами електролітів).
Слайд 56Фібрилярні білки
Фібрилярні білки – мають ниткоподібну форму, структурною одиницею є три
поліпептидні ланцюги, заплетені у вигляді косички. За хімічною будовою є неповноцінні – містять лише 10 з 20 амінокислот, нерозчинні у воді і розчинах слабких електролітів. Хімічно стійки.
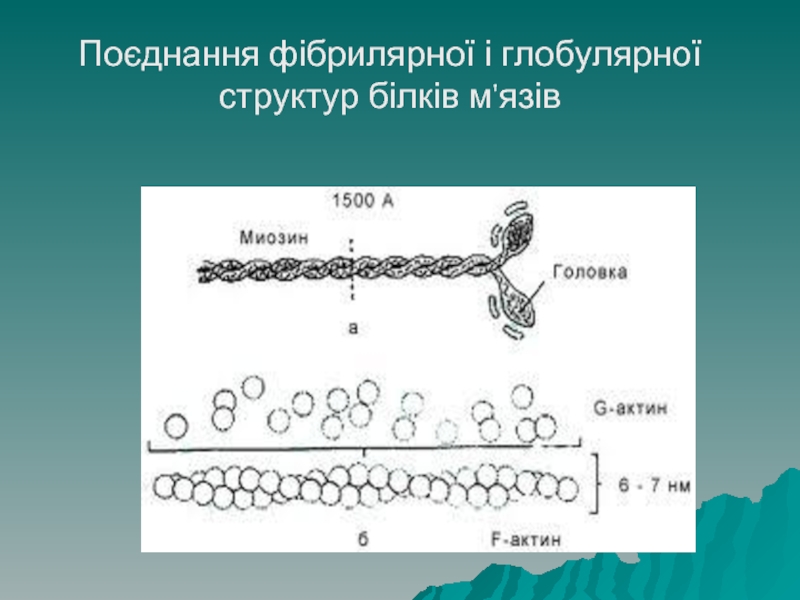
Слайд 59Структура білків
Глобулярні білки можуть об'єднуватись у лінійні структури, які є фібрилярними.
Прикладом є білок м'язів – актин. Молекула актину має фібрилярну структуру (F-актин), однак він складається з окремих глобулярних структур (G-актин).
Слайд 61Прості і складні білки
За складністю будови білки поділяються на прості –
протеїни, складаються лише з поліпептидного ланцюга.
Складні білки – протеїди, окрім поліпептидного ланцюга містять небілкову групу. У залежності від природи небілкової групи складні білки поділяють на класи.
Складні білки – протеїди, окрім поліпептидного ланцюга містять небілкову групу. У залежності від природи небілкової групи складні білки поділяють на класи.
Слайд 62Фосфопротеїди
Фосфопротеїди у якості небілкової групи містять залишки фосфатної кислоти, у більшості
це резервні білки, ферменти: білок молока – казеїн, фермент шлунку – пепсин тощо.
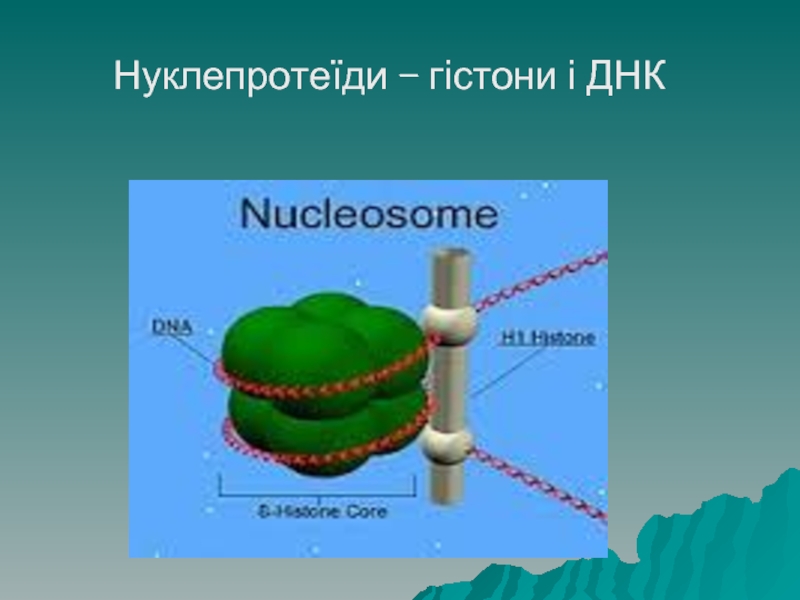
Слайд 64Нуклепротеїди
Нуклеопротеїди – це білки, зв'язані з нуклеїновими кислотами. Прикладом є білки.
Що утворюють нуклеосоми хромосом.
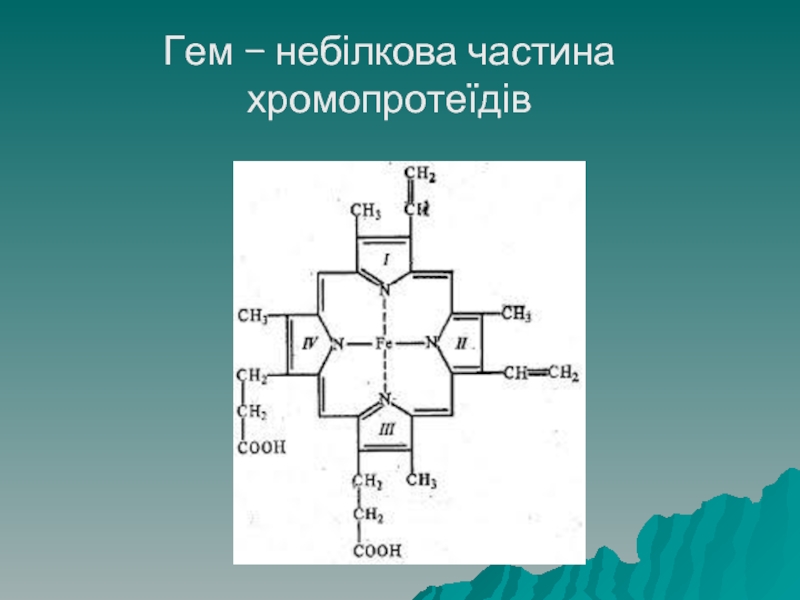
Слайд 66Хромопротеїди
Хромопротеїди – клас складних білків, що мають різноманітне забарвлення, яке їм
надає небілкова група, що містить метал, наприклад гемоглобін червоного кольору завдяки гему – складному утворенню з 4 циклів у центрі якого знаходиться Fe, у молюсків є дихальні білки голубого кольору.
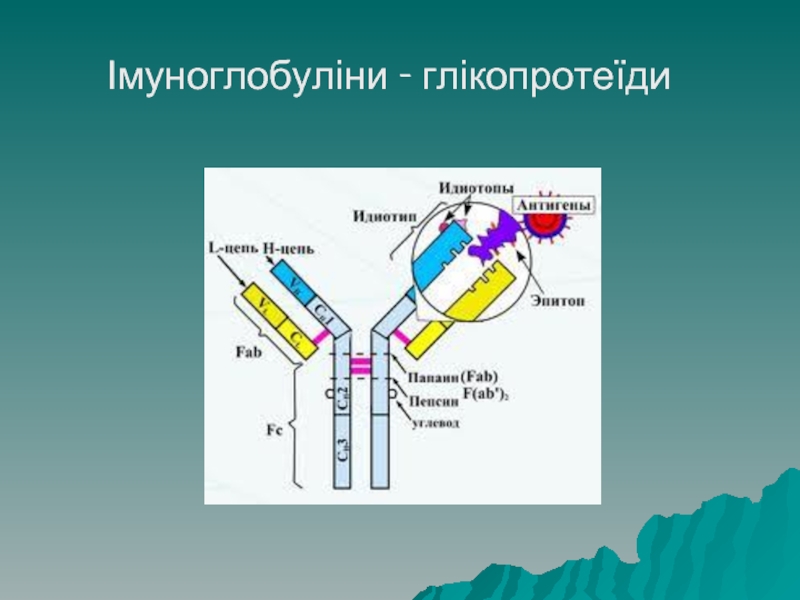
Слайд 68Глікопротеїди
Глікопротеїди – складні білки, що містять вуглеводний компонент, у якості такого
можуть бути похідні глюкози, галактози, складіні вуглеводні утворення – нейрамінові кислоти, хондроїтинсульфат тощо. До класу глікопротеїдів належать білки імунної системи: імуноглобуліни, інтерферон, лізоцим.
Слайд 70Білки - пріони
Існує група патогенних білків – пріонів (від слів: protein
та infection), які здатні без участі нуклеїнових кислот змінювати структуру нормальних білків. Пріони є збудниками губчатої енцефалопатії ВРХ (коров'ячий сказ), почесухи овець (скрейпі)
Слайд 71Висновок
Таким чином білки – надзвичайно важливі сполуки, що забезпечують будову і
всі життєво важливі функції, білки входять до неклітинних форм живого – вірусів.
Дякую за увагу!
Дякую за увагу!