- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Азотсодержащие органические соединения презентация
Содержание
- 1. Азотсодержащие органические соединения
- 2. КЛАССИФИКАЦИЯ в эту группу соединений объединяют несколько
- 3. АМИНЫ Амины могут быть рассмотрены как производные
- 4. КЛАССИФИКАЦИИ В зависимости от количества атомов водорода
- 5. По типу радикалов амины делят на: Предельные;
- 6. НОМЕНКЛАТУРА Рациональная. Название амина строят из двух
- 10. ИЗОМЕРИЯ Положения аминогрупп Структурная (углеродного скелета) Метамерия
- 11. ФИЗИЧЕСКИЕ СВОЙСТВА Метиламин, диметиламин, триметиламин представляют собой
- 12. СПОСОБЫ ПОЛУЧЕНИЯ В 1850 году немецкий ученый
- 14. Наиболее биологически активными являются первичные амины. Их
- 15. В промышленности первичные амины получают восстановлением нитросоединений и нитрилов кислот.
- 16. Алкилирование спиртов
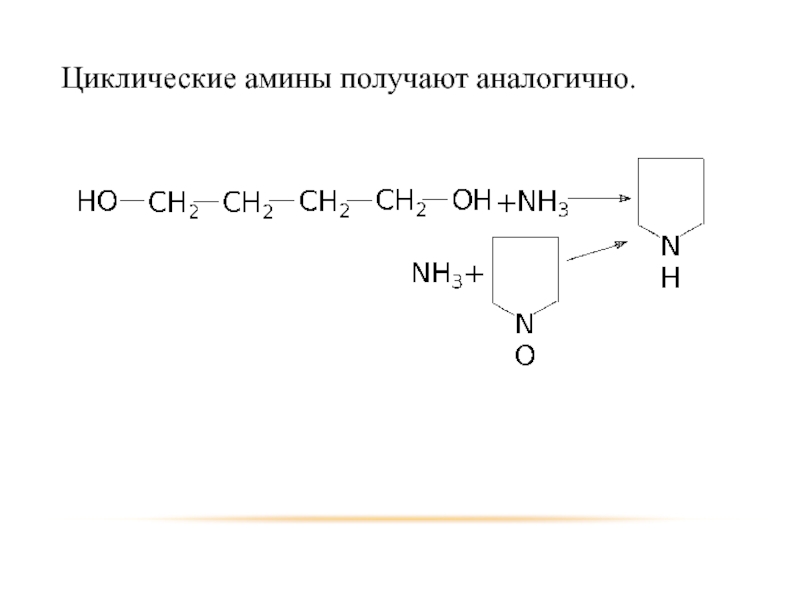
- 17. Циклические амины получают аналогично.
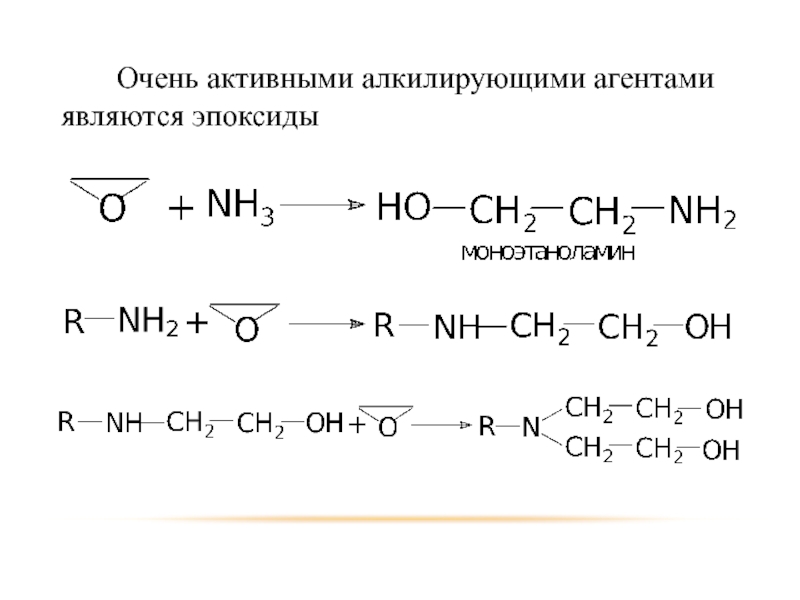
- 18. Очень активными алкилирующими агентами являются эпоксиды
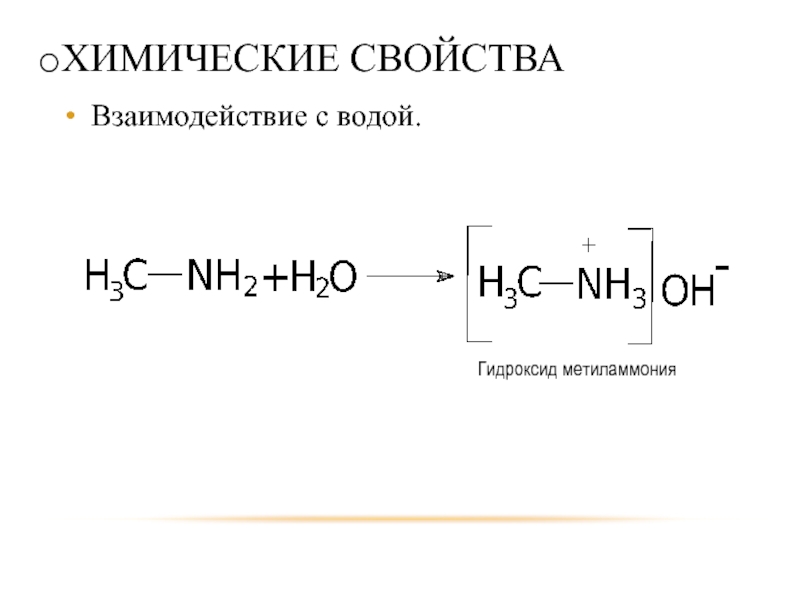
- 19. ХИМИЧЕСКИЕ СВОЙСТВА Взаимодействие с водой. Гидроксид метиламмония
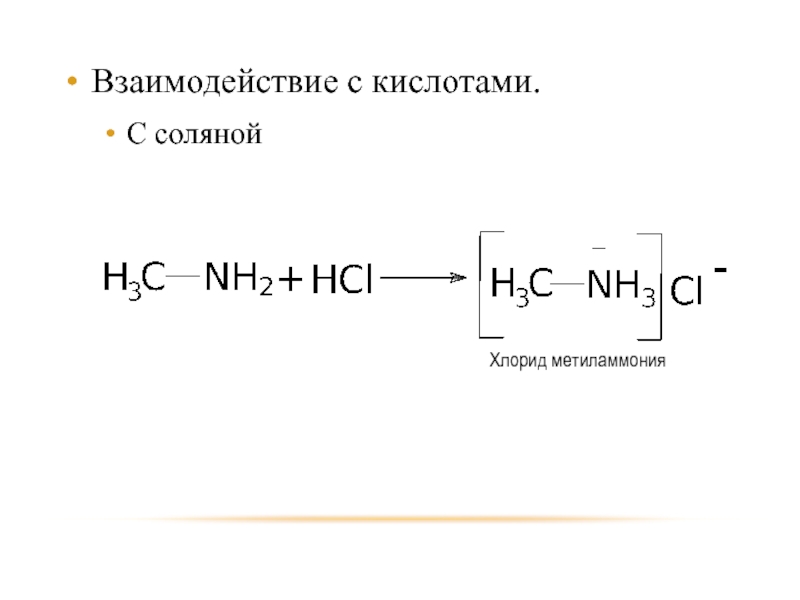
- 20. Взаимодействие с кислотами. С соляной
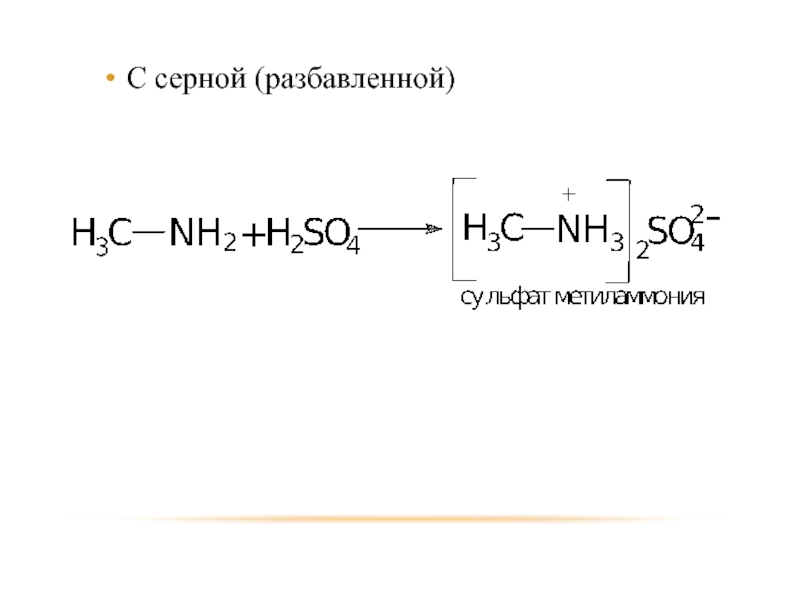
- 21. С серной (разбавленной)
- 22. Взаимодействие с азотистой кислотой При взаимодействии первичных аминов с азотистой кислотой образуются первичные спирты.
- 23. Вторичные амины при взаимодействии с азотистой кислотой образуют нитрозамины (окрашенные соединения желто-оранжевого цвета).
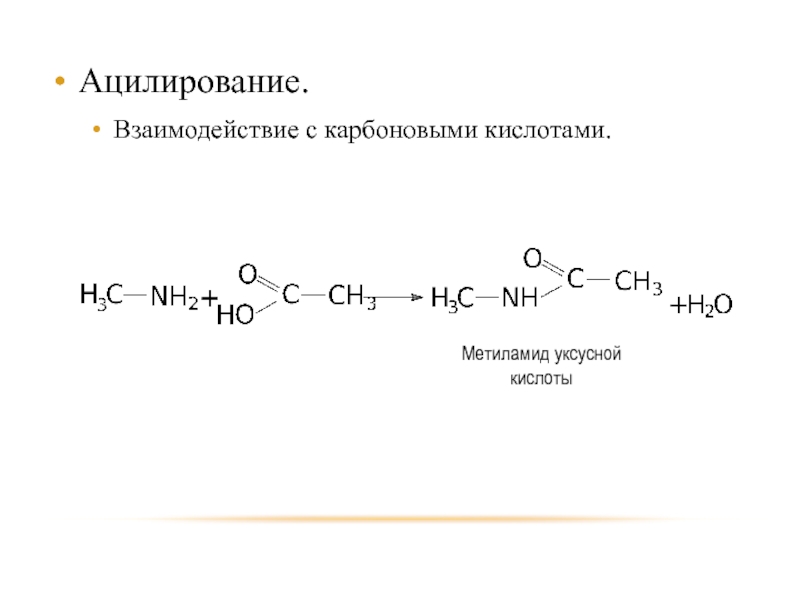
- 24. Ацилирование. Взаимодействие с карбоновыми кислотами.
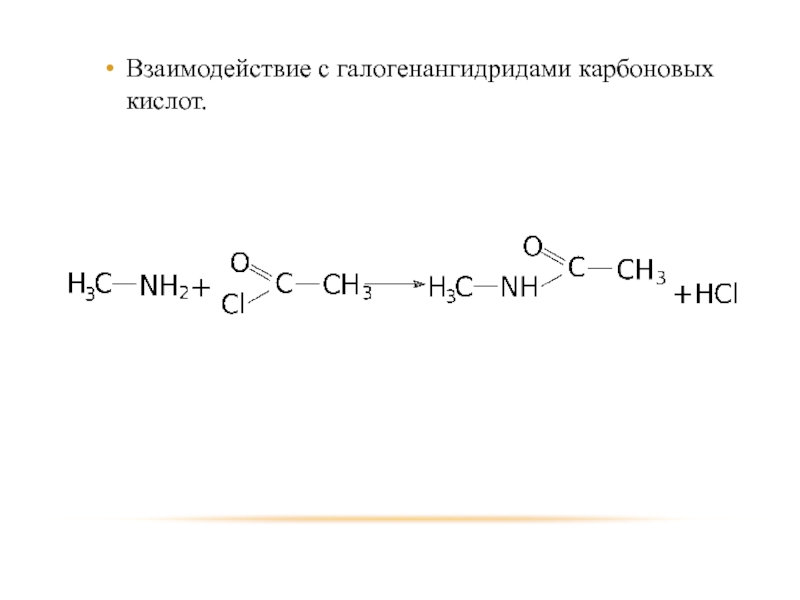
- 25. Взаимодействие с галогенангидридами карбоновых кислот.
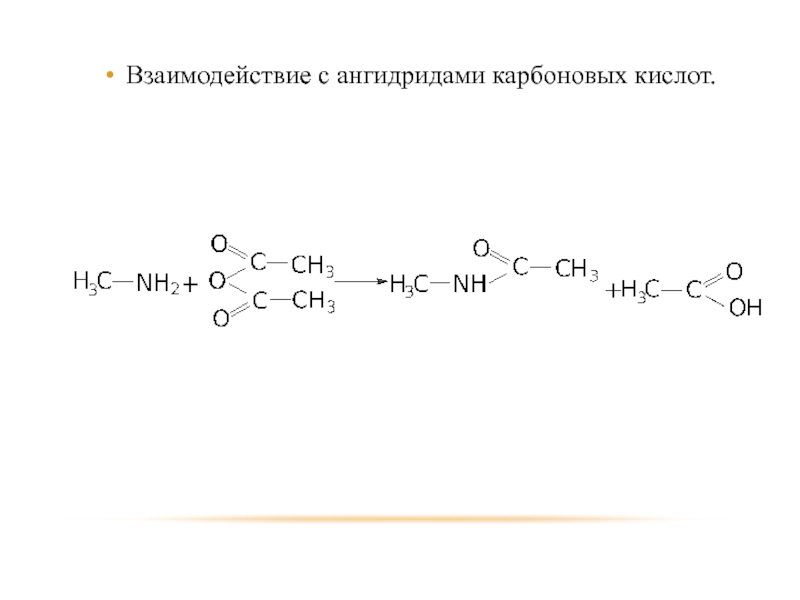
- 26. Взаимодействие с ангидридами карбоновых кислот.
- 27. Горение.
- 28. Окисление. протекает трудно, а результат зависит от структуры. Окисление первичных аминов приводит к образованию нитросоединений.
- 29. Окисление вторичных аминов приводит к образованию диалкилгидроксиламинов.
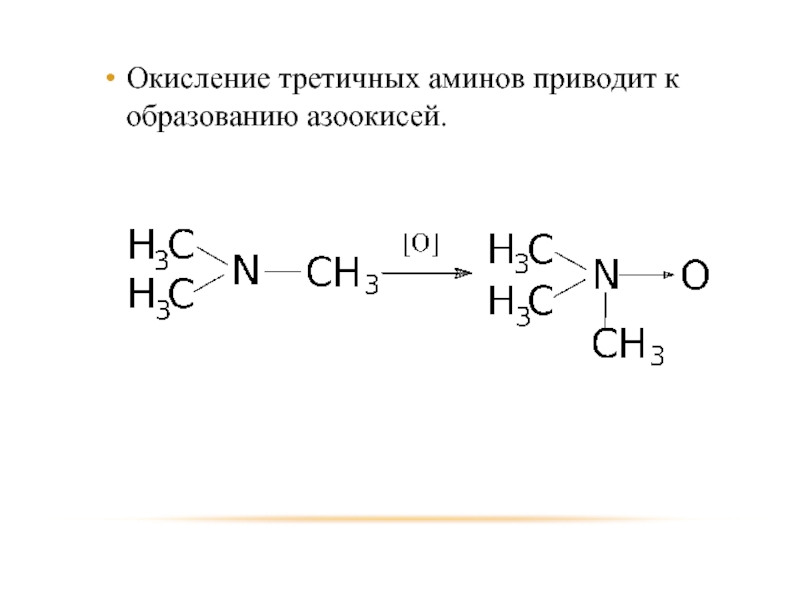
- 30. Окисление третичных аминов приводит к образованию азоокисей.
- 31. АРОМАТИЧЕСКИЕ АМИНЫ
- 32. Это соединения, в молекулах которых аминогруппа связана
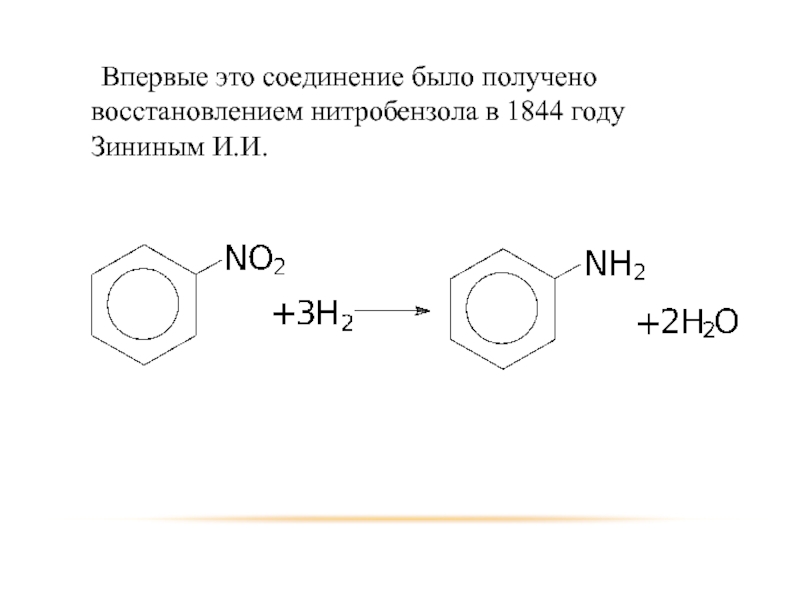
- 33. Впервые это соединение было получено восстановлением нитробензола в 1844 году Зининым И.И.
- 34. ФИЗИЧЕСКИЕ СВОЙСТВА Анилин – бесцветная, быстро буреющая на воздухе, жидкость. Плохо растворяется в воде.
- 35. ХИМИЧЕСКИЕ СВОЙСТВА обусловлены как аминогруппой, так и
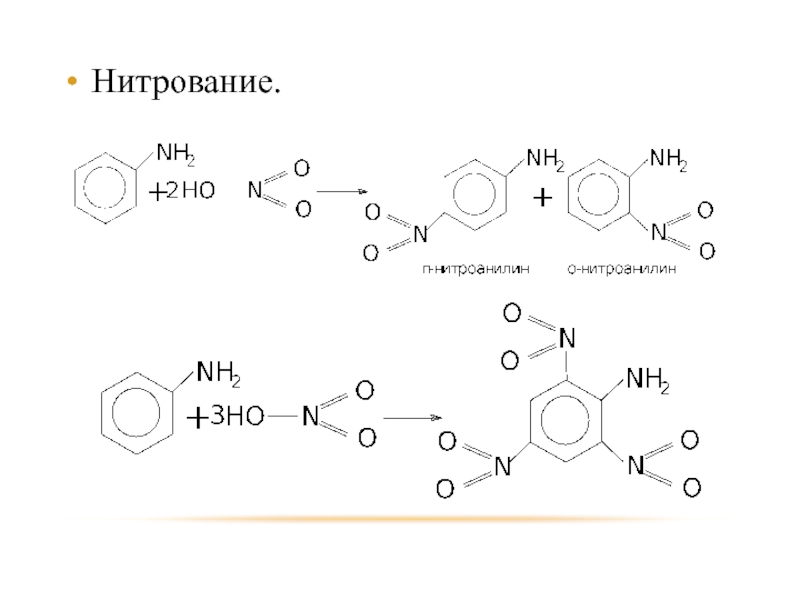
- 36. Нитрование.
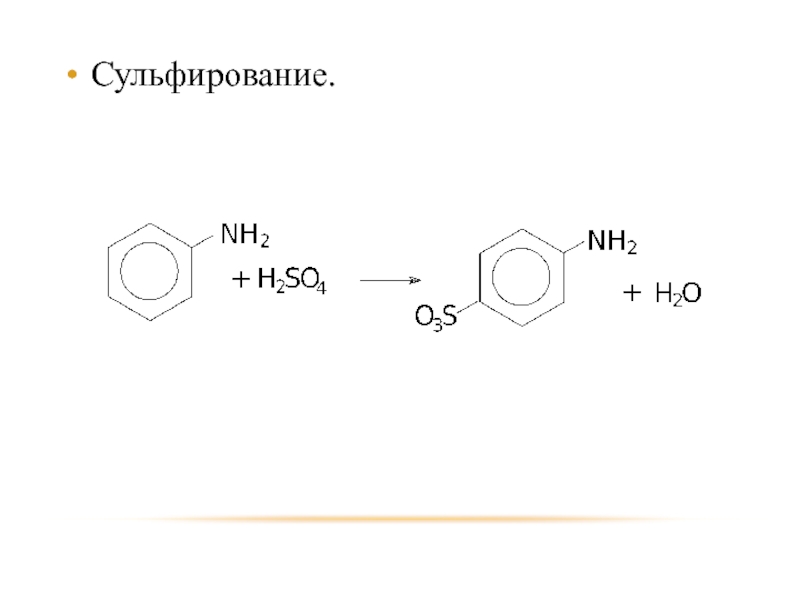
- 37. Сульфирование.
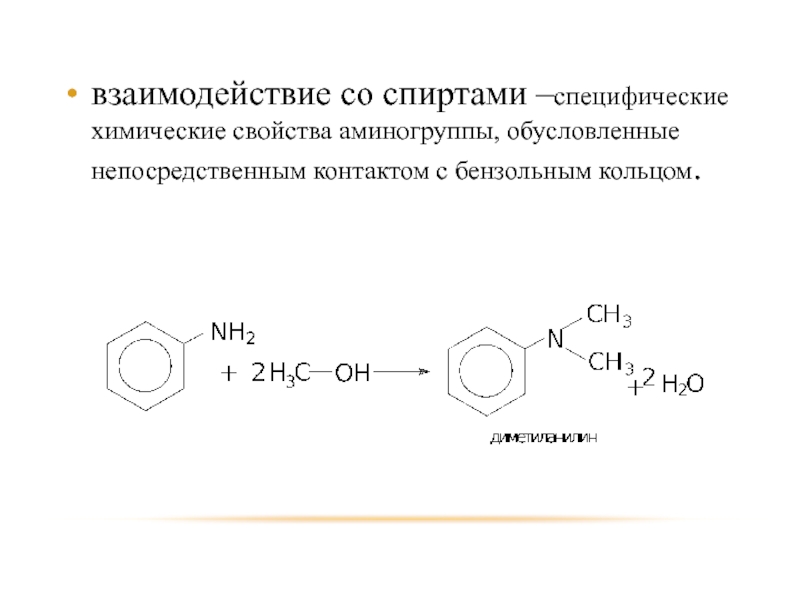
- 38. взаимодействие со спиртами –специфические химические свойства аминогруппы, обусловленные непосредственным контактом с бензольным кольцом.
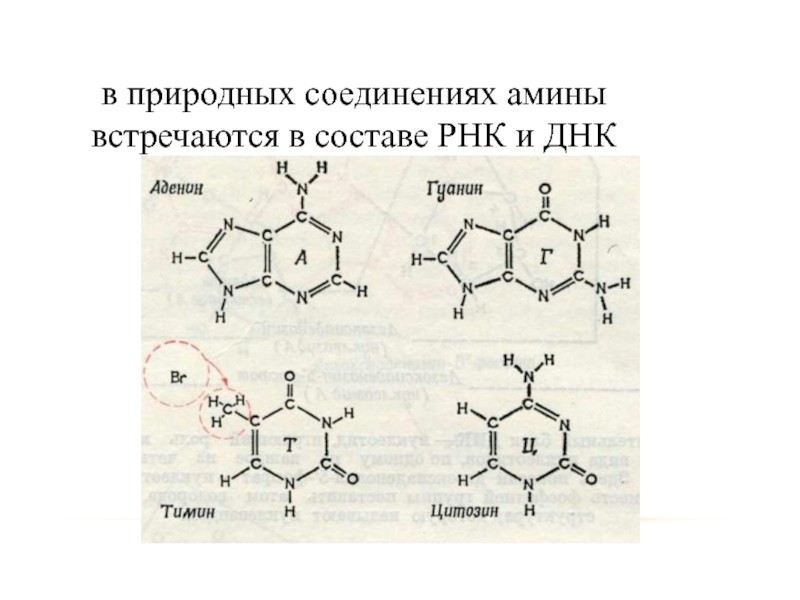
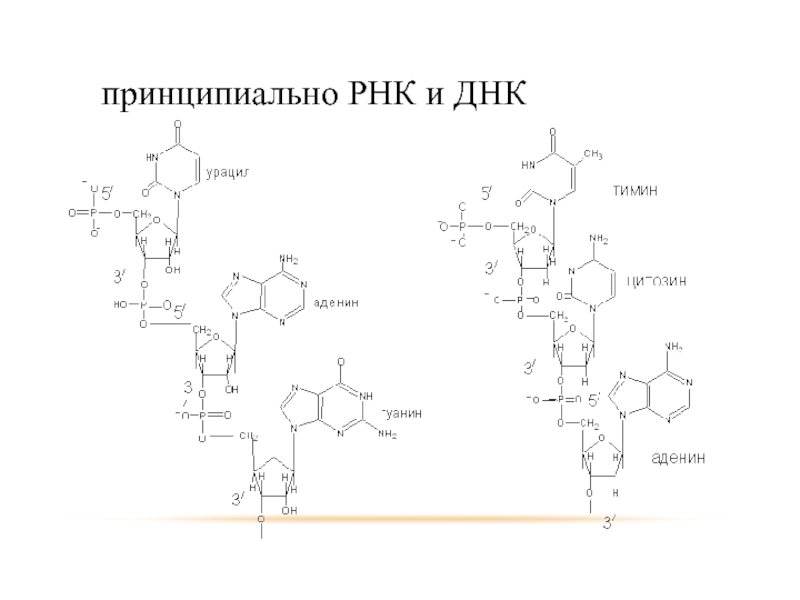
- 39. в природных соединениях амины встречаются в составе РНК и ДНК
- 40. принципиально РНК и ДНК
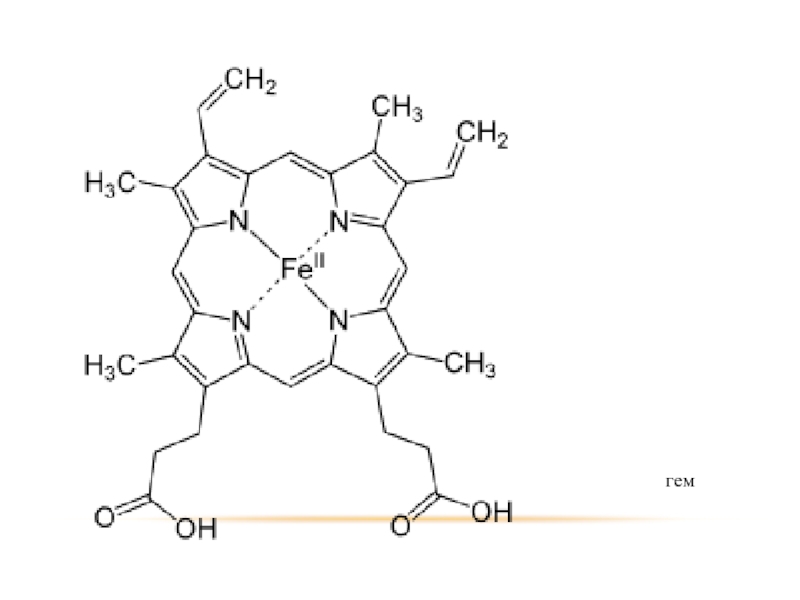
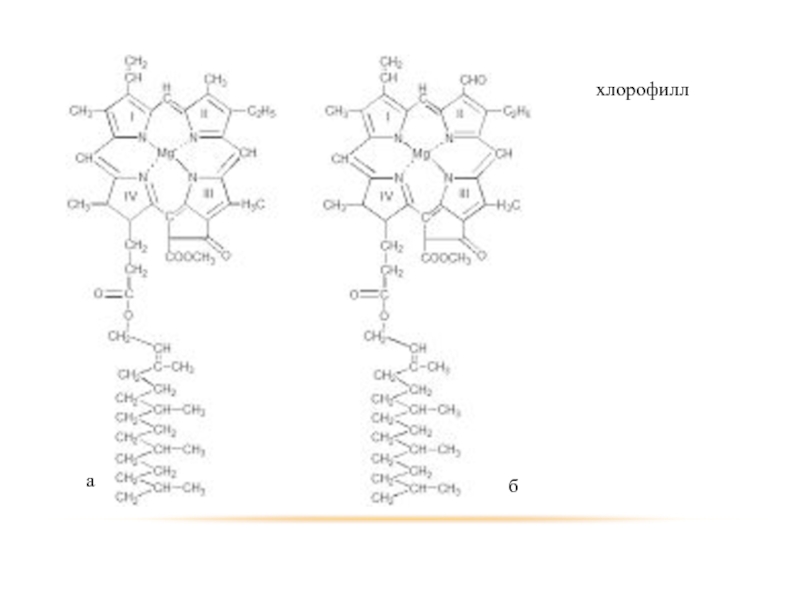
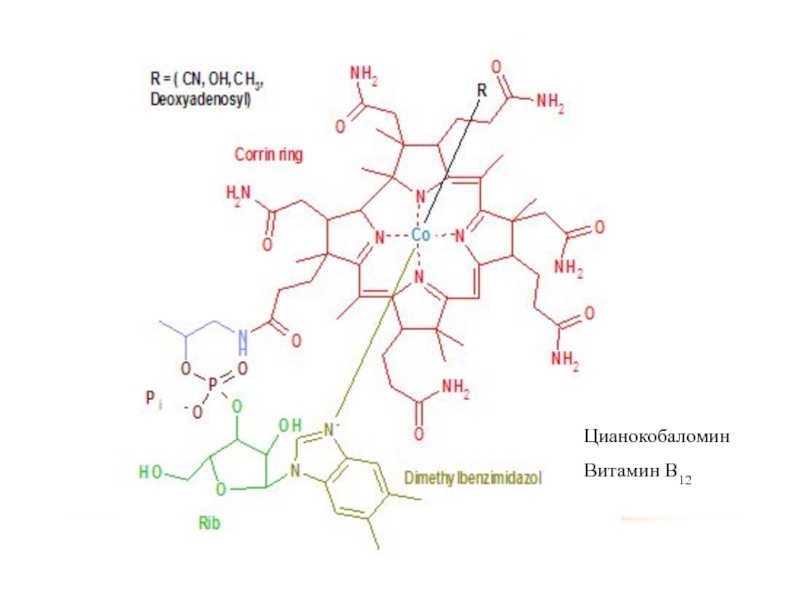
- 41. Кроме того амины входят в состав некоторых других соединений.
- 42. порфин
- 43. гем
- 44. хлорофилл а б
- 45. Цианокобаломин Витамин В12
- 46. АМИДЫ
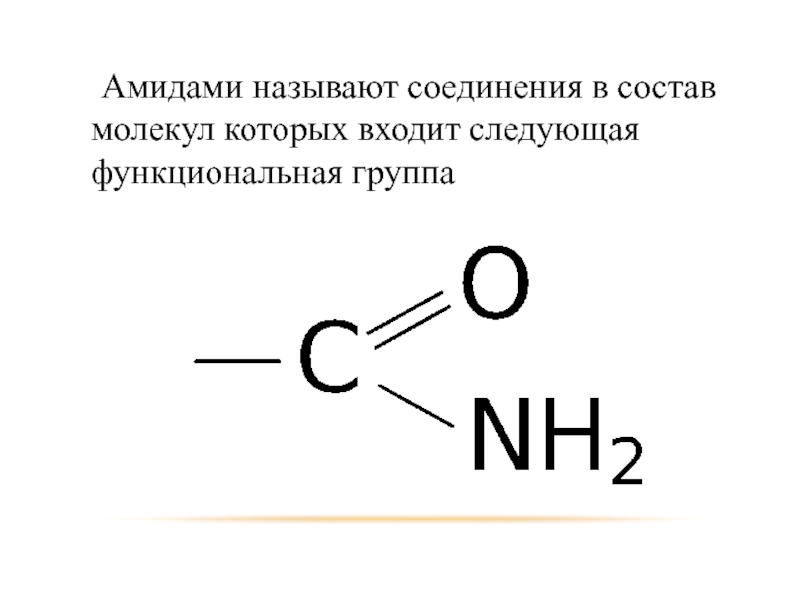
- 47. Амидами называют соединения в состав молекул которых входит следующая функциональная группа
- 48. Простейшим представителем является амиды угольной кислоты.
- 49. МОЧЕВИНА является полным амидом угольной кислоты. Широко
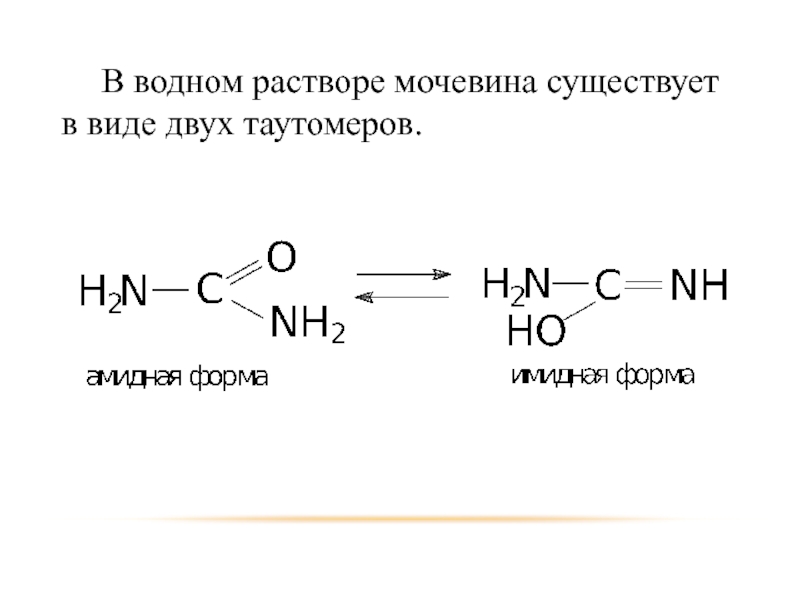
- 50. В водном растворе мочевина существует в виде двух таутомеров.
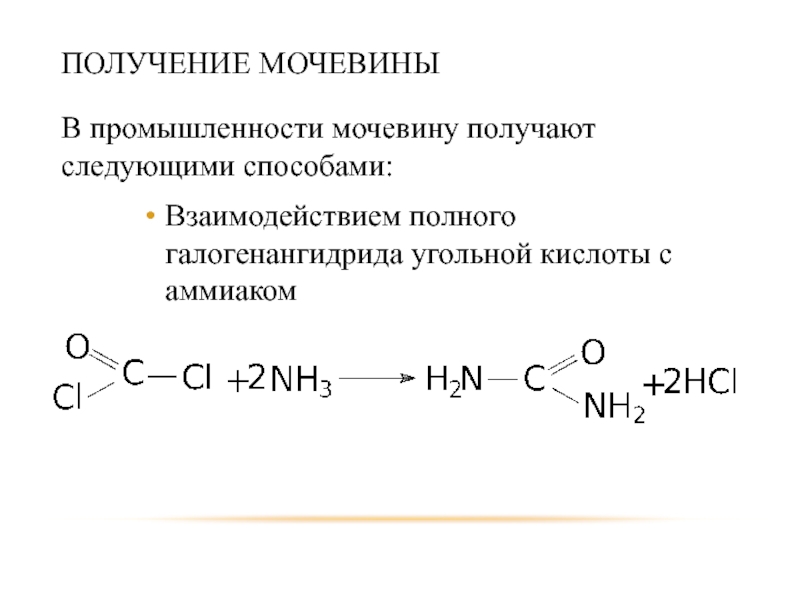
- 51. ПОЛУЧЕНИЕ МОЧЕВИНЫ В промышленности мочевину получают следующими способами: Взаимодействием полного галогенангидрида угольной кислоты с аммиаком
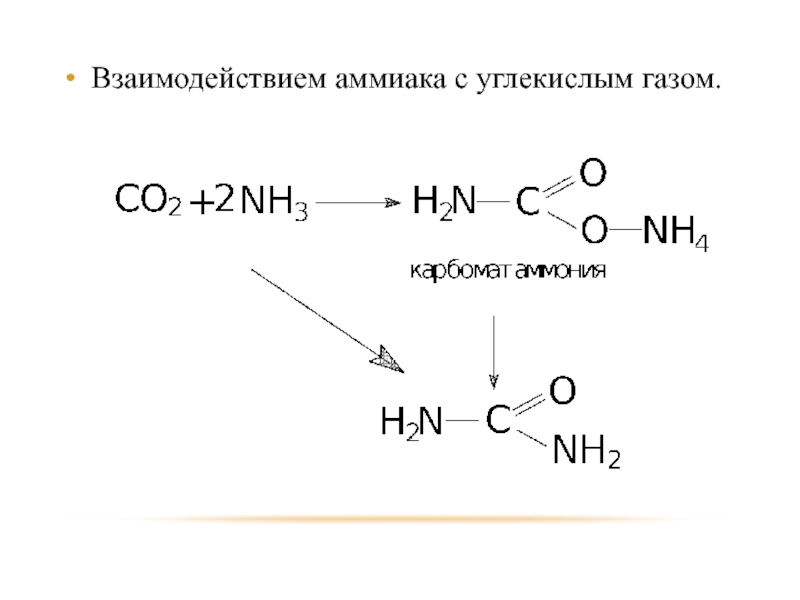
- 52. Взаимодействием аммиака с углекислым газом.
- 53. ХИМИЧЕСКИЕ СВОЙСТВА МОЧЕВИНЫ Гидролиз мочевины
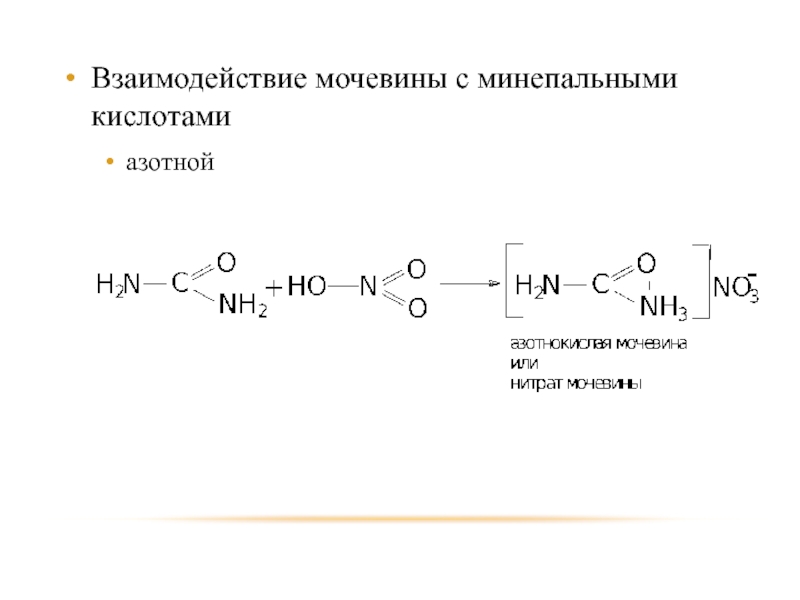
- 54. Взаимодействие мочевины с минепальными кислотами азотной
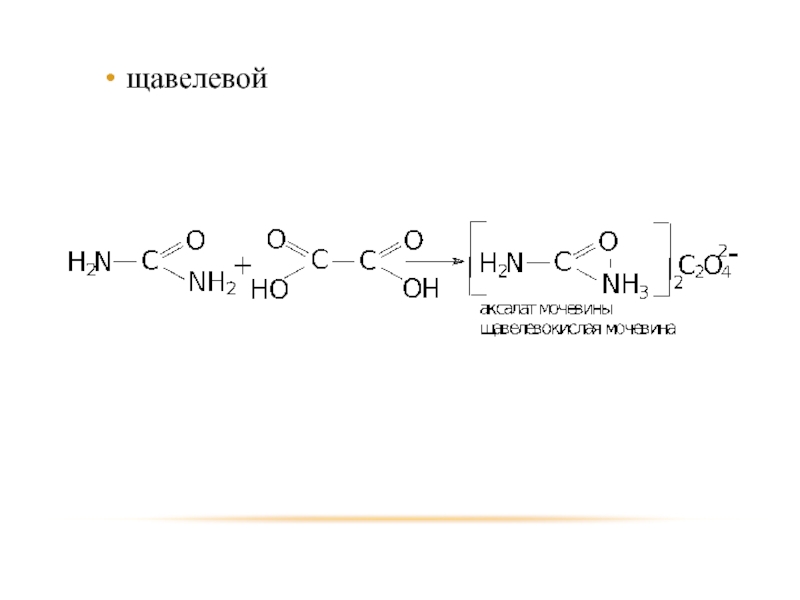
- 55. щавелевой
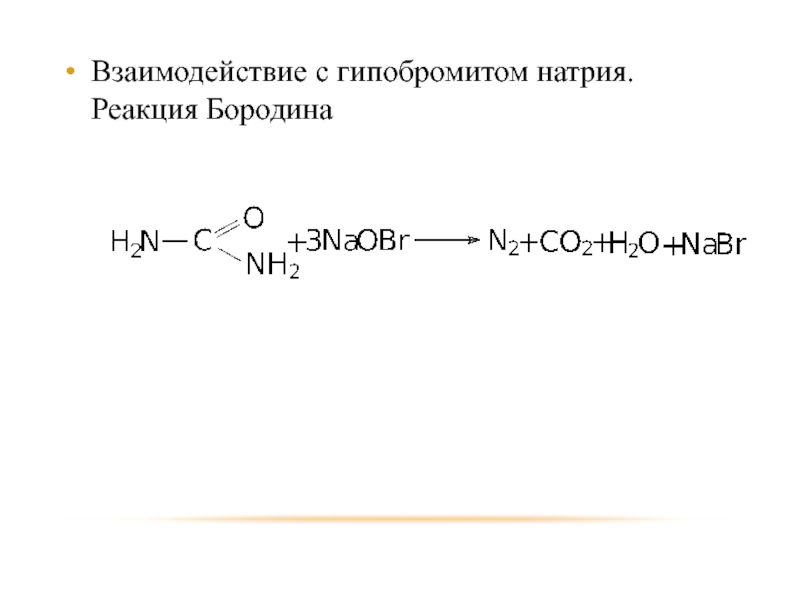
- 56. Взаимодействие с гипобромитом натрия. Реакция Бородина.
- 57. Взаимодействие с формалином
- 58. За счет разрыва двойных связей диметиленмочевина подвергается полимеризации с образованием мочевино-формальдегидных смол.
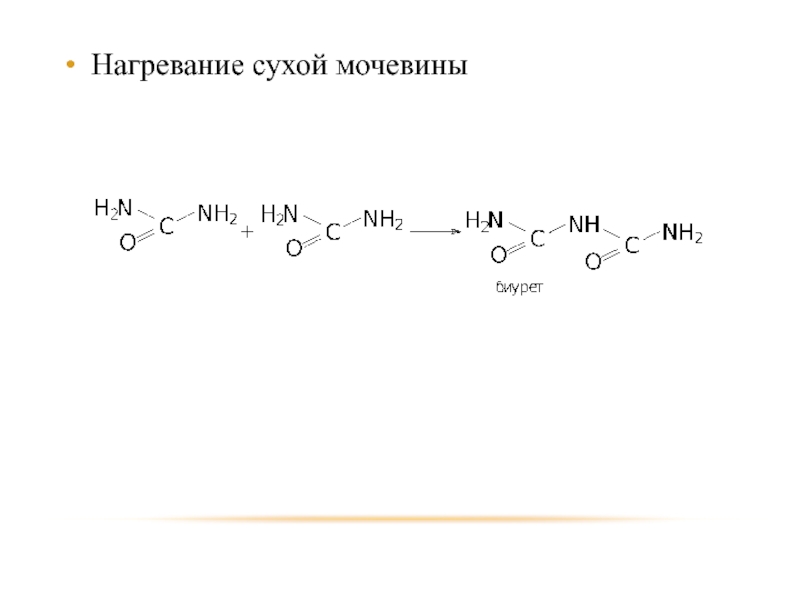
- 59. Нагревание сухой мочевины
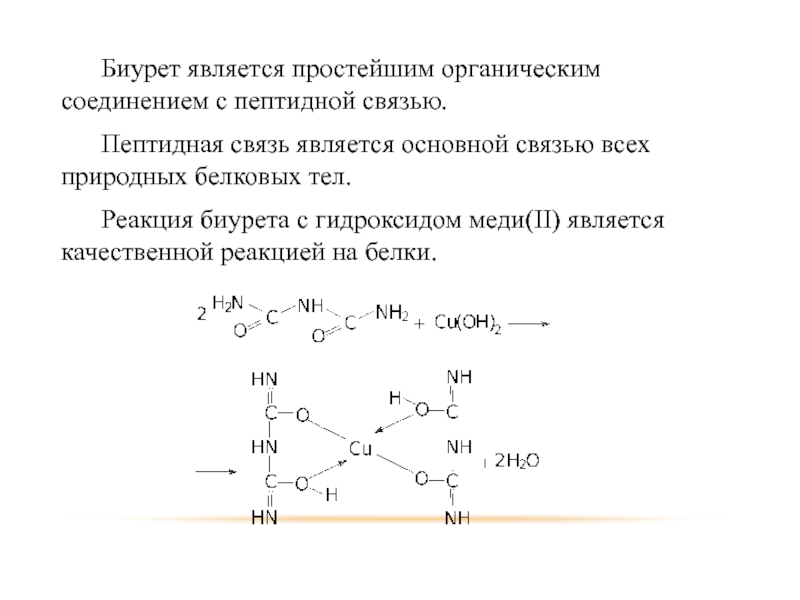
- 60. Биурет является простейшим органическим соединением с пептидной
- 61. Образование уреидов кислот
- 62. АМИНОКИСЛОТЫ
- 63. Аминокислотами называют такие производные карбоновых кислот, которые
- 64. КЛАССИФИКАЦИИ В зависимости от количества карбоксильных групп: Одноосновные Двухосновные Многоосновные
- 65. В зависимости от количества аминогрупп: Моно-аминокислоты Ди-аминокислоты
- 66. НОМЕНКЛАТУРА УНИВЕРСАЛЬНАЯ: правила построения названий такие же
- 67. ИЗОМЕРИЯ Изомерия положения аминогруппы относительно карбоксильной группы.
- 68. ПОЛУЧЕНИЕ α-Аминокислоты получают из природных веществ и
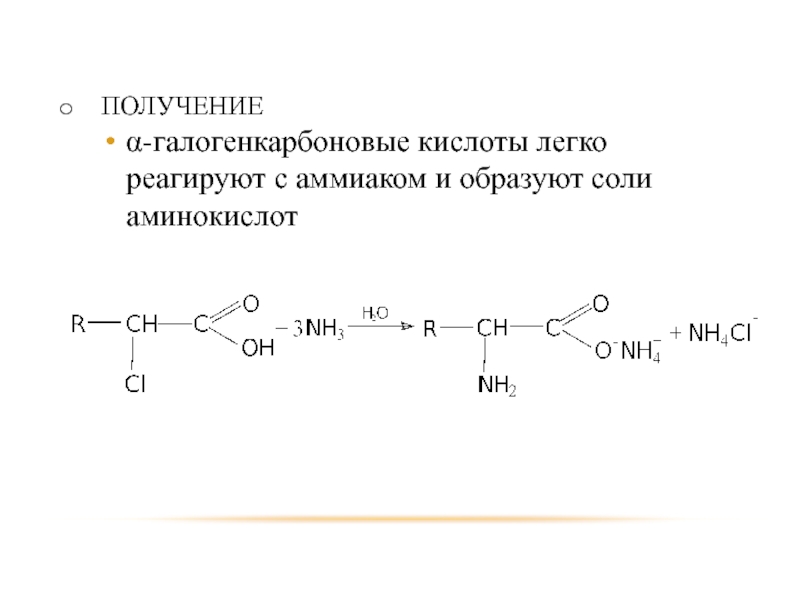
- 69. ПОЛУЧЕНИЕ α-галогенкарбоновые кислоты легко реагируют с аммиаком и образуют соли аминокислот
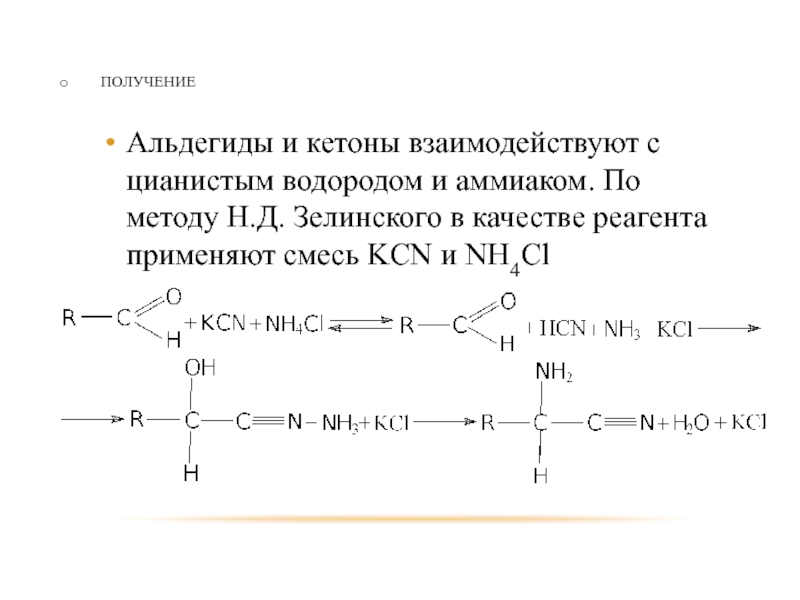
- 70. ПОЛУЧЕНИЕ Альдегиды и кетоны взаимодействуют с цианистым
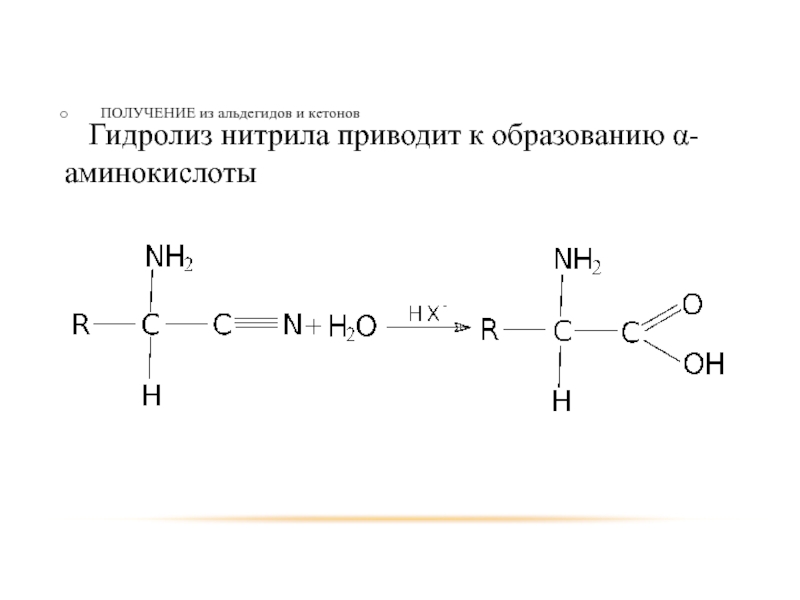
- 71. ПОЛУЧЕНИЕ из альдегидов и кетонов Гидролиз нитрила приводит к образованию α-аминокислоты
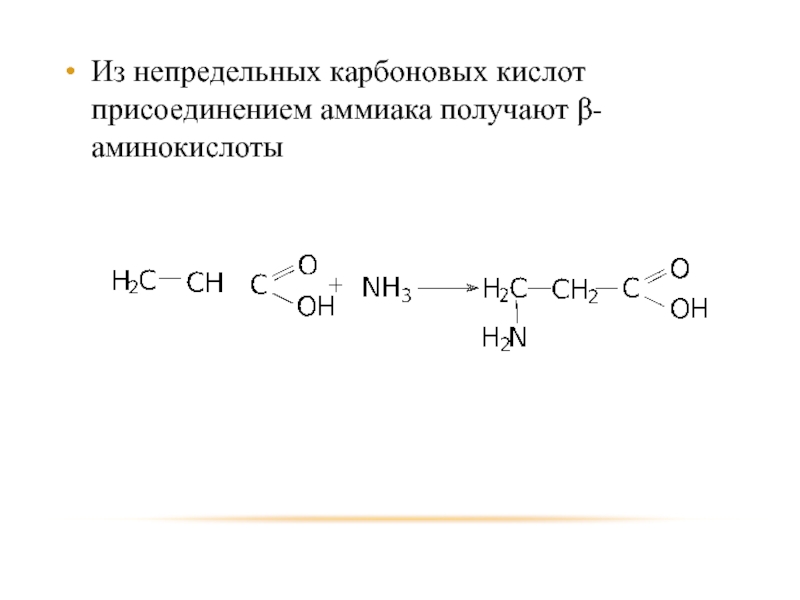
- 72. Из непредельных карбоновых кислот присоединением аммиака получают β-аминокислоты
- 73. ФИЗИЧЕСКИЕ СВОЙСТВА Аминокислоты – бесцветные кристаллические вещества,
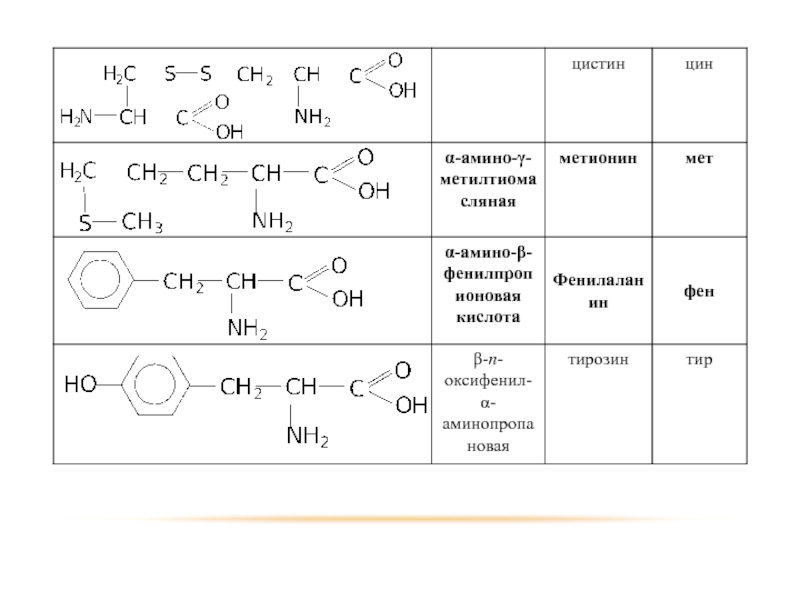
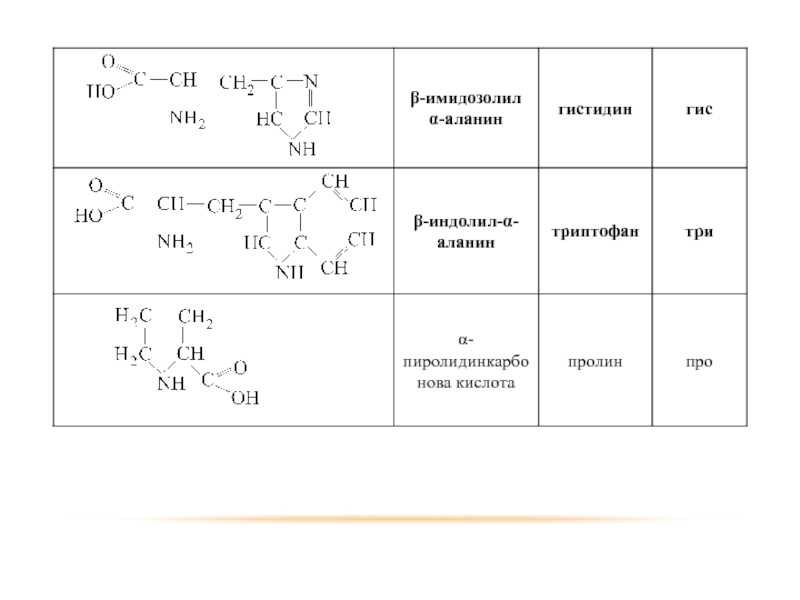
- 74. МОНОАМИНОКИСЛОТЫ
- 75. ГОМОЛОГИЧЕСКИЙ РЯД
- 76. ХИМИЧЕСКИЕ СВОЙСТВА РЕАКЦИИ КАРБОКСИЛЬНОЙ ГРУППЫ Взаимодействие с гидроксидами щелочными
- 77. D-элементов
- 78. При взаимодействии аминокислот со спиртами в присутствии хлороводорода образуются эфиры (обычно в виде солей)
- 79. Ациламинокислоты при взаимодействии с тионилхлоридом или окись-трихлоридом
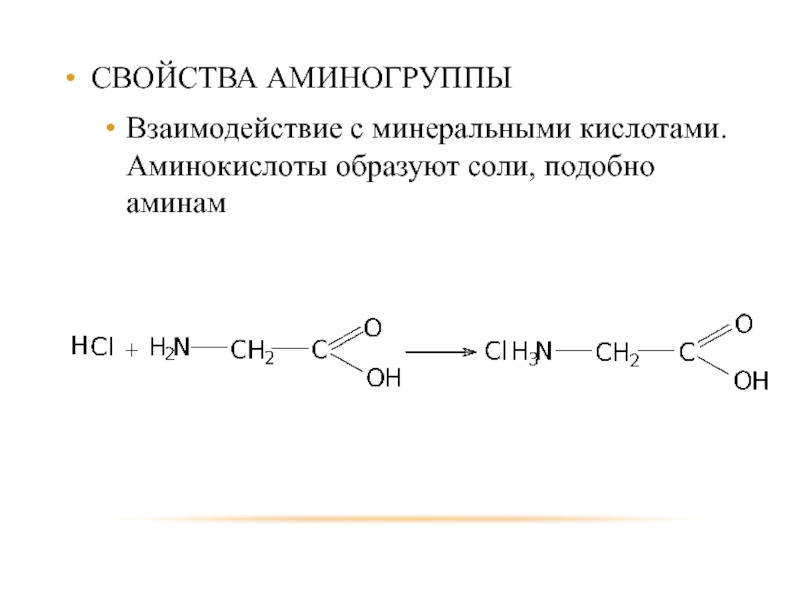
- 80. СВОЙСТВА АМИНОГРУППЫ Взаимодействие с минеральными кислотами. Аминокислоты образуют соли, подобно аминам
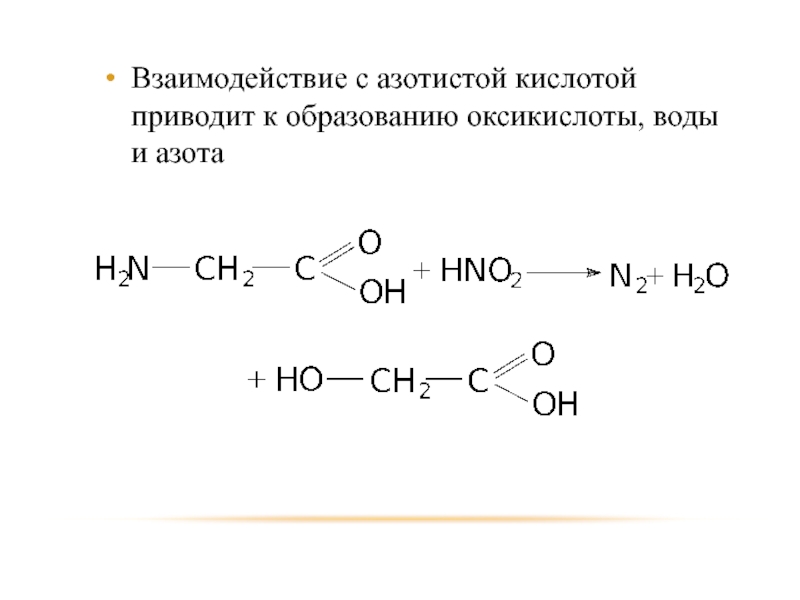
- 81. Взаимодействие с азотистой кислотой приводит к образованию оксикислоты, воды и азота
- 82. Аминокислоты взаимодействуют с хлорангидридами и ангидридами кислот,
- 83. Взаимодействие с формалином аминокислот с первичной аминогруппой
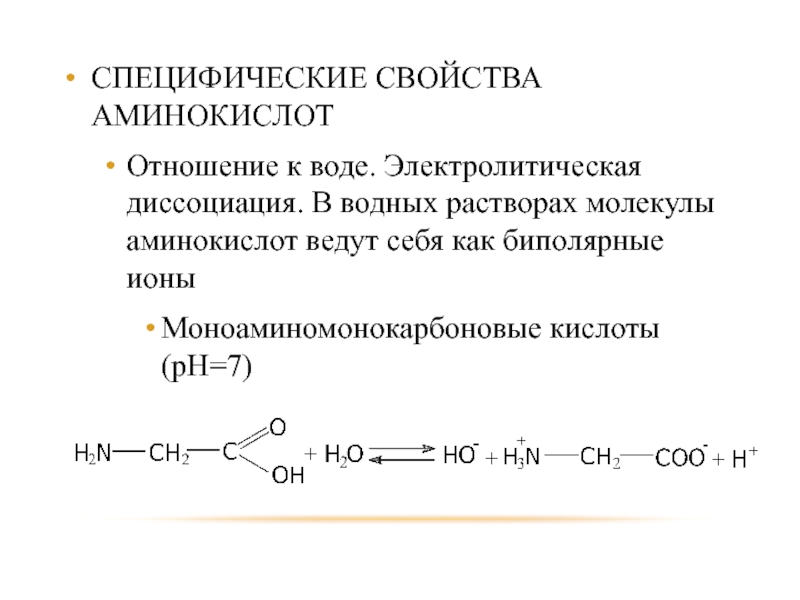
- 84. СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ Отношение к воде. Электролитическая
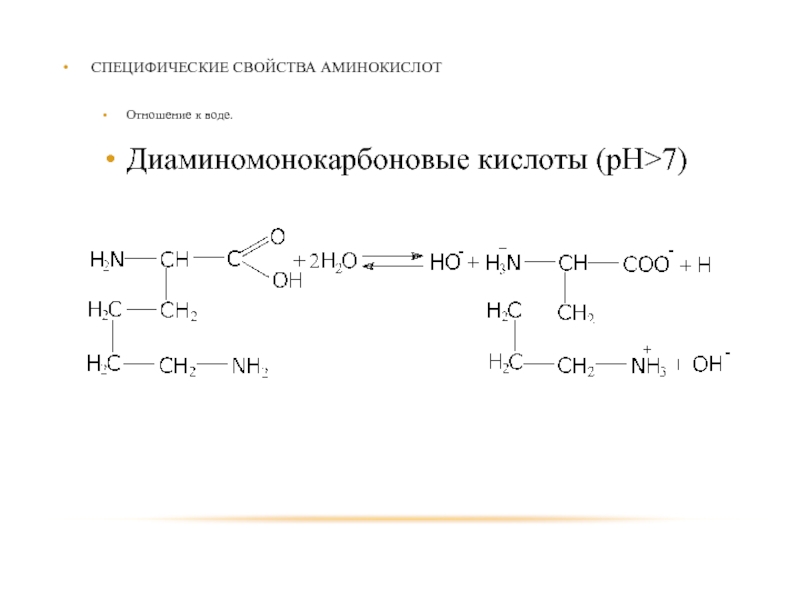
- 85. СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ Отношение к воде. Диаминомонокарбоновые кислоты (рН>7)
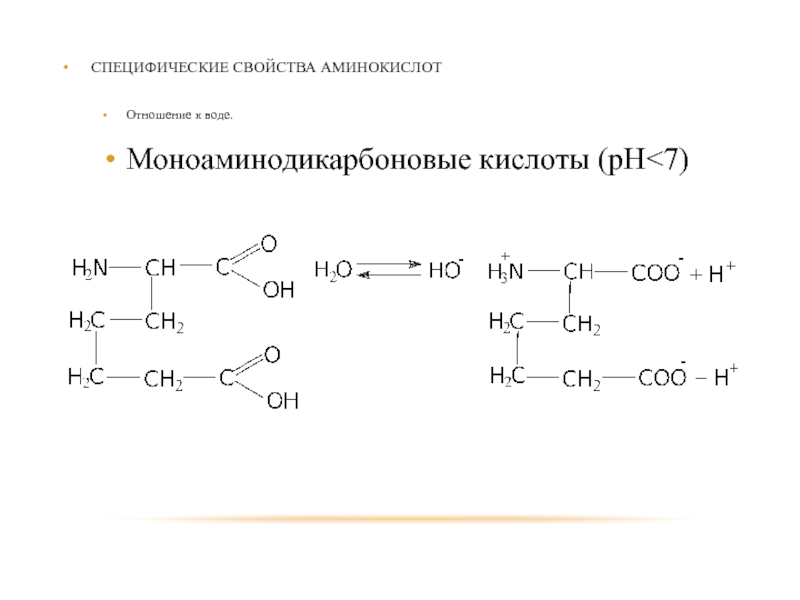
- 86. СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ Отношение к воде. Моноаминодикарбоновые кислоты (рН
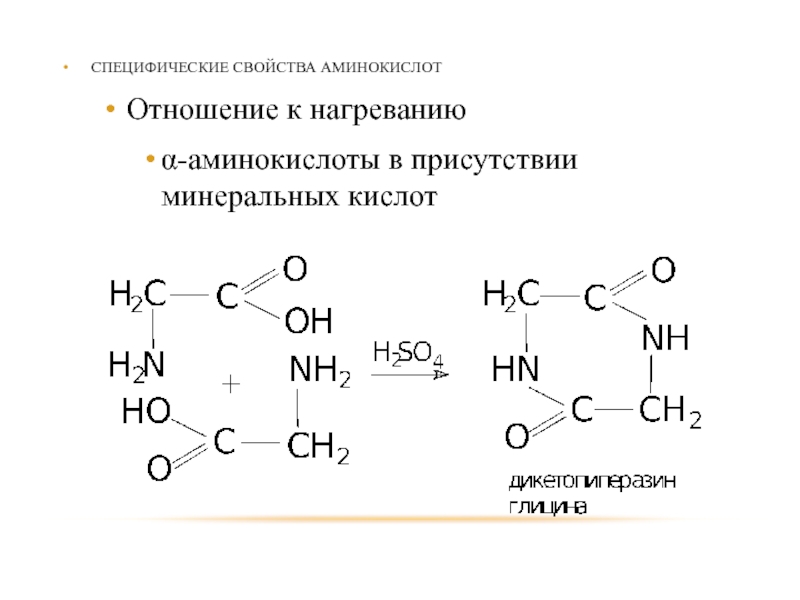
- 87. СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ Отношение к нагреванию α-аминокислоты в присутствии минеральных кислот
- 88. β-аминокислоты образуют α-ненасыщенные кислоты
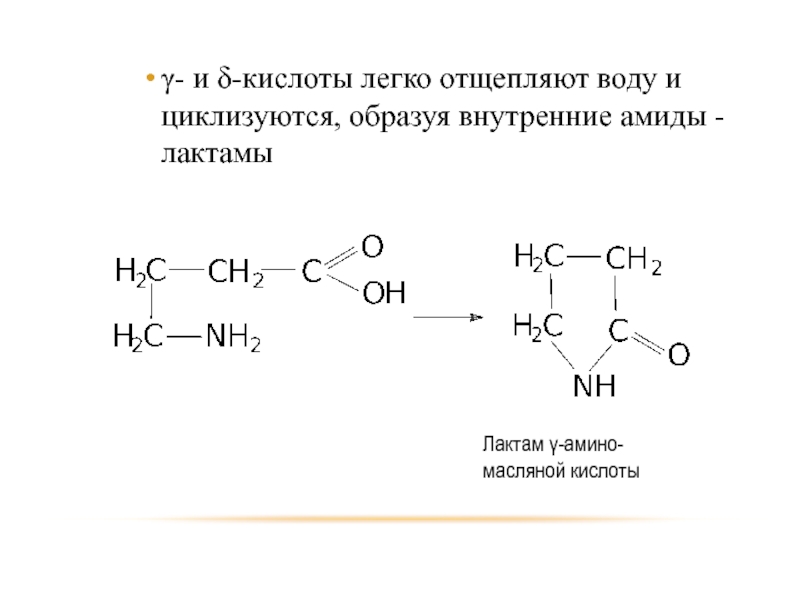
- 89. γ- и δ-кислоты легко отщепляют воду и циклизуются, образуя внутренние амиды - лактамы
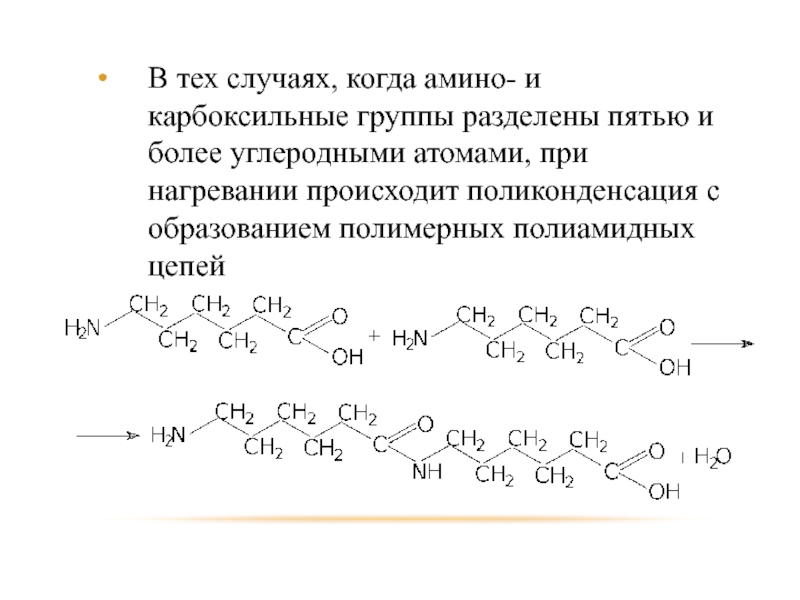
- 90. В тех случаях, когда амино- и карбоксильные
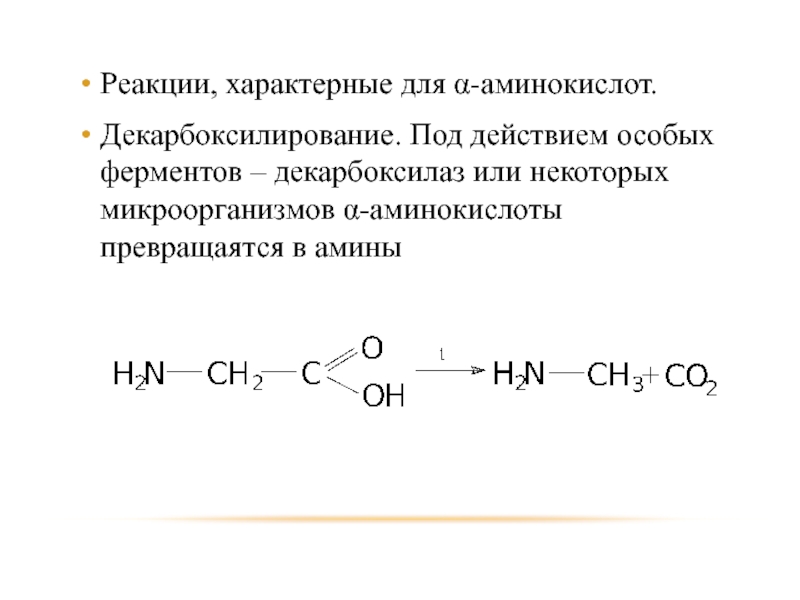
- 91. Реакции, характерные для α-аминокислот. Декарбоксилирование. Под действием
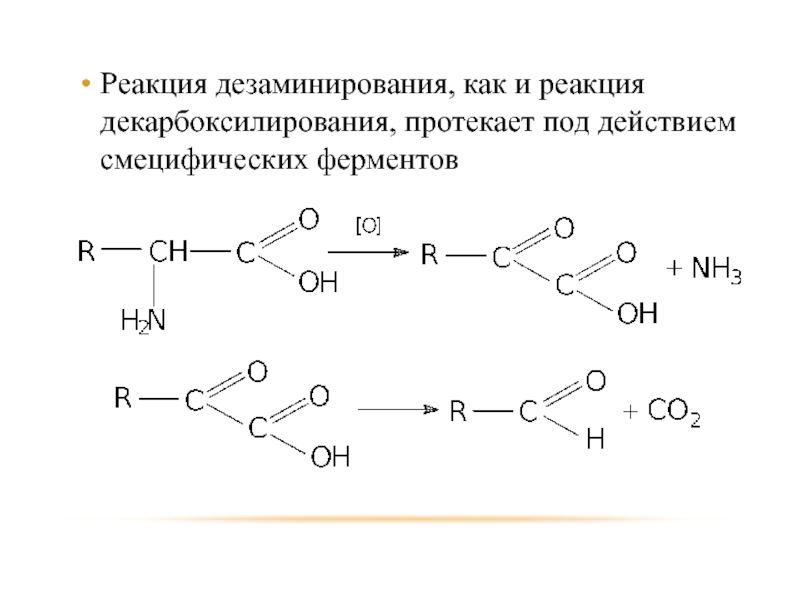
- 92. Реакция дезаминирования, как и реакция декарбоксилирования, протекает под действием смецифических ферментов
- 93. Реакция переаминирования, как и реакции дезаминирования и декарбоксилирования, протекает под действием смецифических ферментов
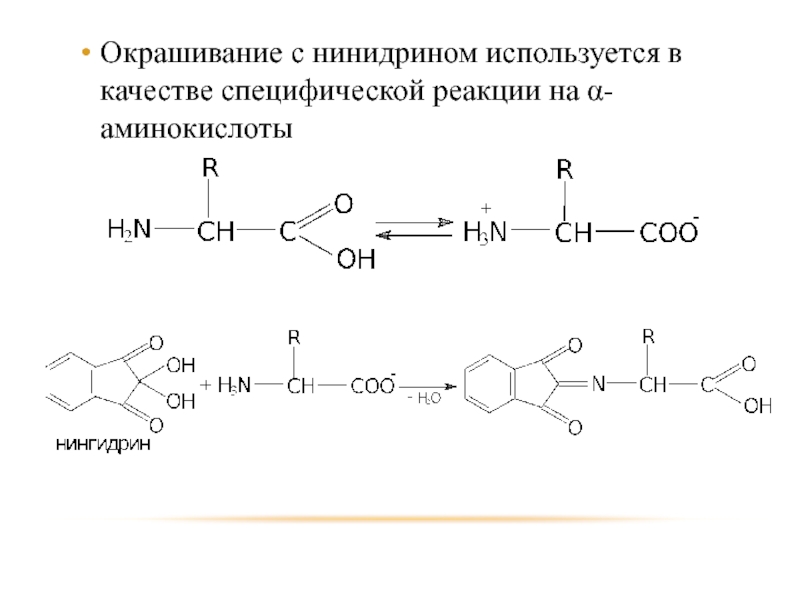
- 94. Окрашивание с нинидрином используется в качестве специфической реакции на α-аминокислоты
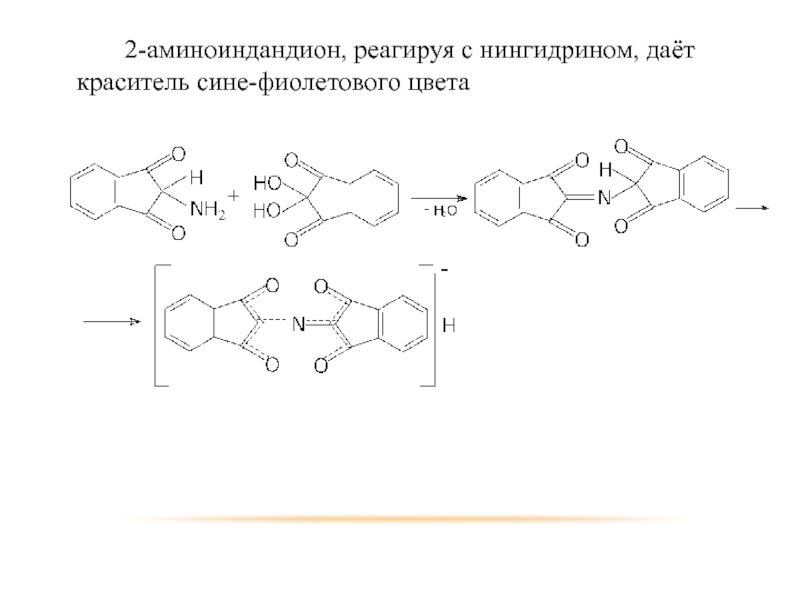
- 95. Продукт конденсации путём перегруппировки и гидролиза образует 2-аминоиндандион
- 96. 2-аминоиндандион, реагируя с нингидрином, даёт краситель сине-фиолетового цвета
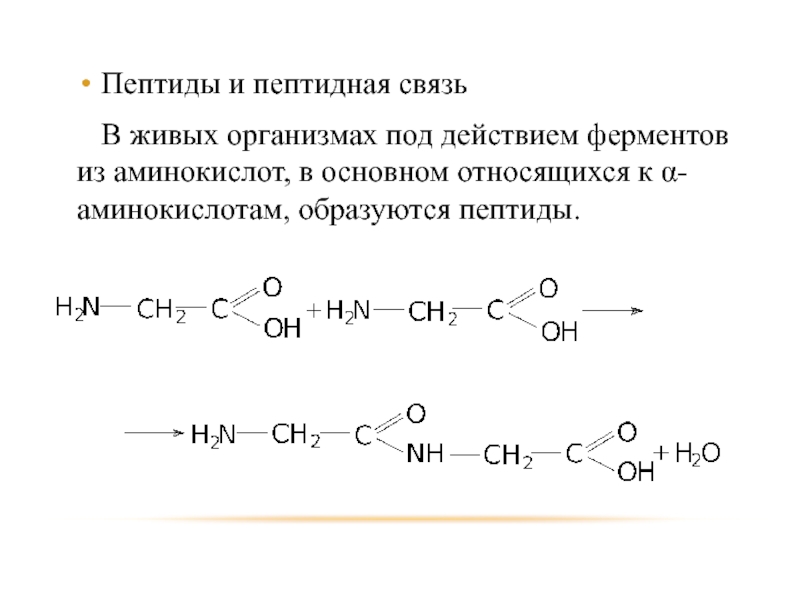
- 97. Пептиды и пептидная связь В живых организмах
- 98. Пептид состоящий из двух молекул аминокислот называют
- 99. Чтобы соединить две аминокислоты пептидной связью, необходимо:
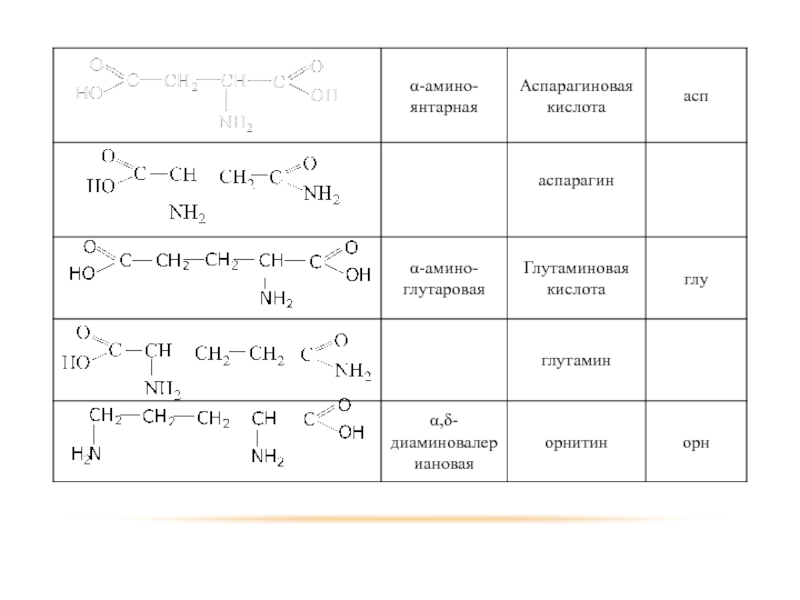
- 100. ДВУХОСНОВНЫЕ АМИНОКИСЛОТЫ
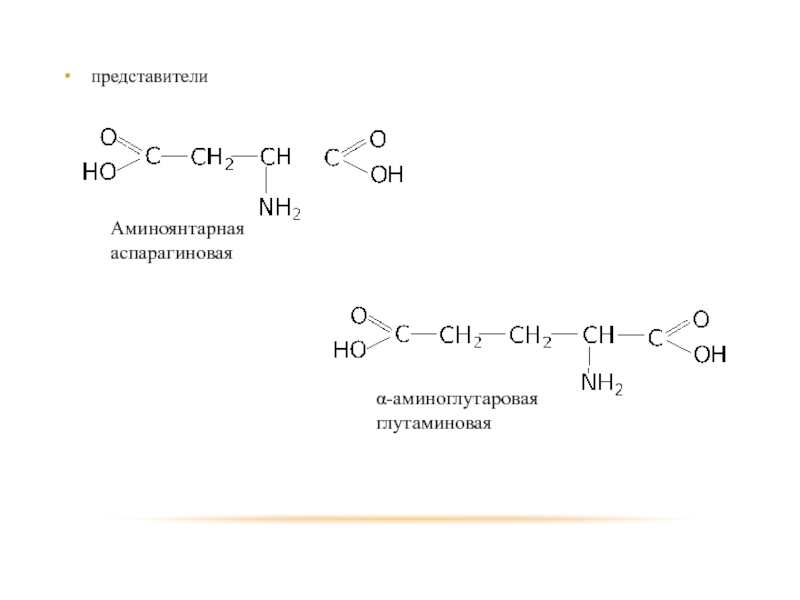
- 101. представители
- 102. Двухосновные аминокислоты способны образовывать внутренние соли. Обе
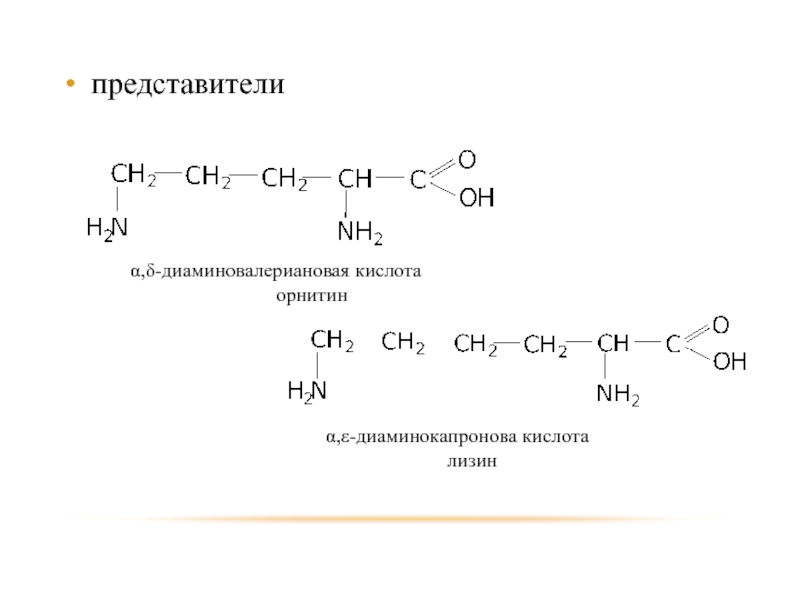
- 103. ДИАМИНОКИСЛОТЫ
- 104. представители α,δ-диаминовалериановая кислота орнитин α,ε-диаминокапронова кислота лизин
- 105. Декарбоксилирование орнитин лизин
- 106. α-аминокислоты участвуют в синтезе белка.
- 112. БЕЛКИ Белками, или белковыми веществами, называют высокомолекулярные
- 113. БЕЛКИ Различают первичную, вторичную, третичную и четвертичную
- 114. БЕЛКИ Глобулины – не растворимы в чистой
- 115. БЕЛКИ Пртеиды – сложные белки, в состав
Слайд 2КЛАССИФИКАЦИЯ
в эту группу соединений объединяют несколько классов:
Амины
Амиды
Имиды
Аминокислоты
Нитросоединения
Нитрозосоединения
Азосоединения
Диазосоединения.
Слайд 3АМИНЫ
Амины могут быть рассмотрены как производные аммиака.
Аминами называют органические соединения, которые
получают замещением атомов водорода в аммиаке углеводородными радикалами.
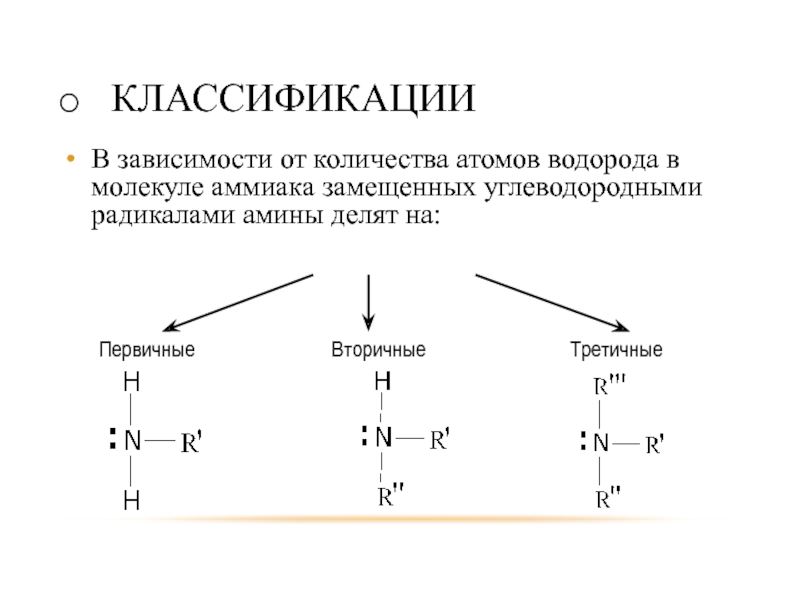
Слайд 4КЛАССИФИКАЦИИ
В зависимости от количества атомов водорода в молекуле аммиака замещенных углеводородными
радикалами амины делят на:
Слайд 5По типу радикалов амины делят на:
Предельные;
Непредельные;
Ароматические.
По количеству аминогрупп амины делят на:
Моноамины;
Диамины;
Полиамины.
Слайд 6НОМЕНКЛАТУРА
Рациональная.
Название амина строят из двух слов: названия углеводородных радикалов по радикальной
номенклатуре и слова «амин».
Универсальная.
Употребляется для построения названий только первичных аминов. В основе лежит название углеводорода и приставка «амино-» перед которой цифрой указывают положение аминогруппы. Иногда вместо приставки используют суффикс «амин».
Универсальная.
Употребляется для построения названий только первичных аминов. В основе лежит название углеводорода и приставка «амино-» перед которой цифрой указывают положение аминогруппы. Иногда вместо приставки используют суффикс «амин».
Слайд 11ФИЗИЧЕСКИЕ СВОЙСТВА
Метиламин, диметиламин, триметиламин представляют собой газы. Остальные низшие амины –
жидкости. Высшие амины – твердые вещества.
Амины обладают неприятным запахом «селедочного рассола», который у низших выражен ярче, а у высших – слабее (или отсутствует).
Низшие амины (первые представители) довольно хорошо растворимы в воде (подобно аммиаку), их растворы имеют основную реакцию среды.
Амины обладают неприятным запахом «селедочного рассола», который у низших выражен ярче, а у высших – слабее (или отсутствует).
Низшие амины (первые представители) довольно хорошо растворимы в воде (подобно аммиаку), их растворы имеют основную реакцию среды.
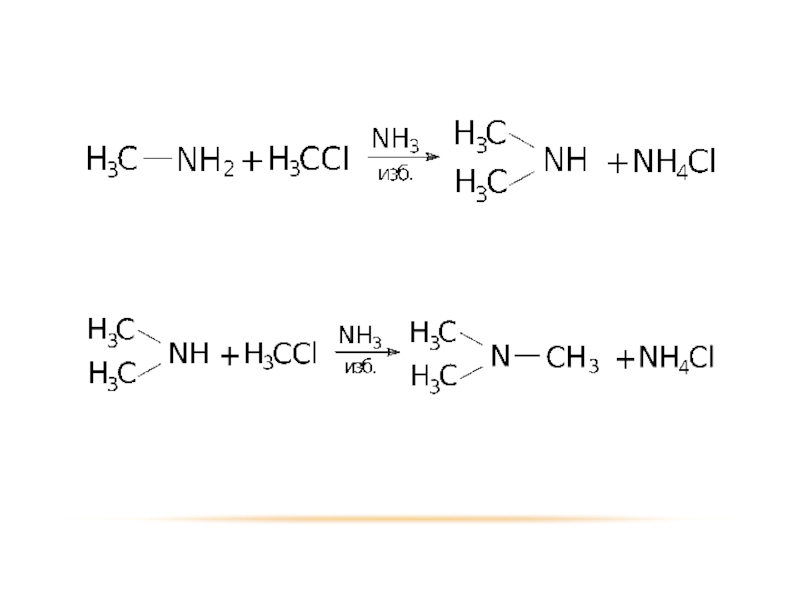
Слайд 12СПОСОБЫ ПОЛУЧЕНИЯ
В 1850 году немецкий ученый Гофман впервые получил амин в
результате химической реакции взаимодействия галогенпроизводного углеводорода с избытком аммиака
Избыток аммиака нужен для получения чистого амина. При недостатке аммиака всегда образуется смесь.
Избыток аммиака нужен для получения чистого амина. При недостатке аммиака всегда образуется смесь.
Слайд 14Наиболее биологически активными являются первичные амины. Их получили разложением амидов кислот
(перегруппировка Гофмана).
Этот способ широко используется в лабораторной практике.
Этот способ широко используется в лабораторной практике.
Амид пропионовой кислоты
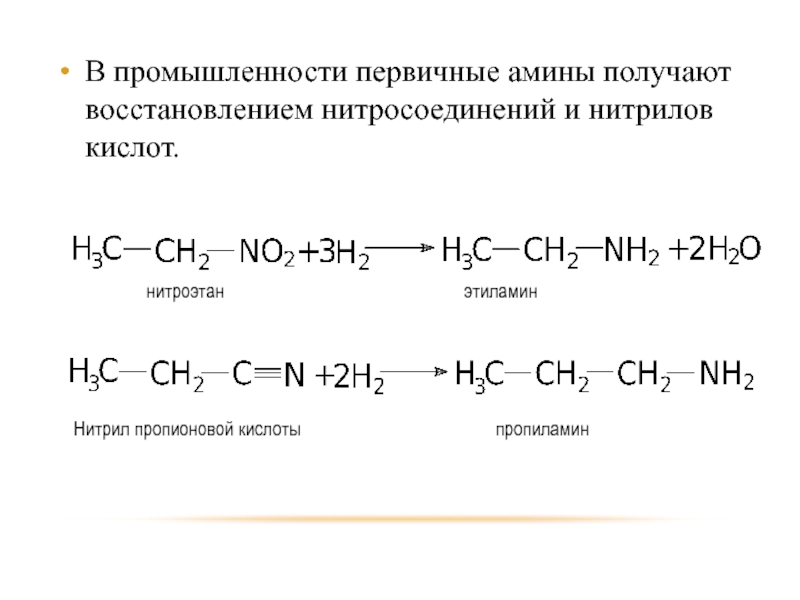
Слайд 15В промышленности первичные амины получают восстановлением нитросоединений и нитрилов кислот.
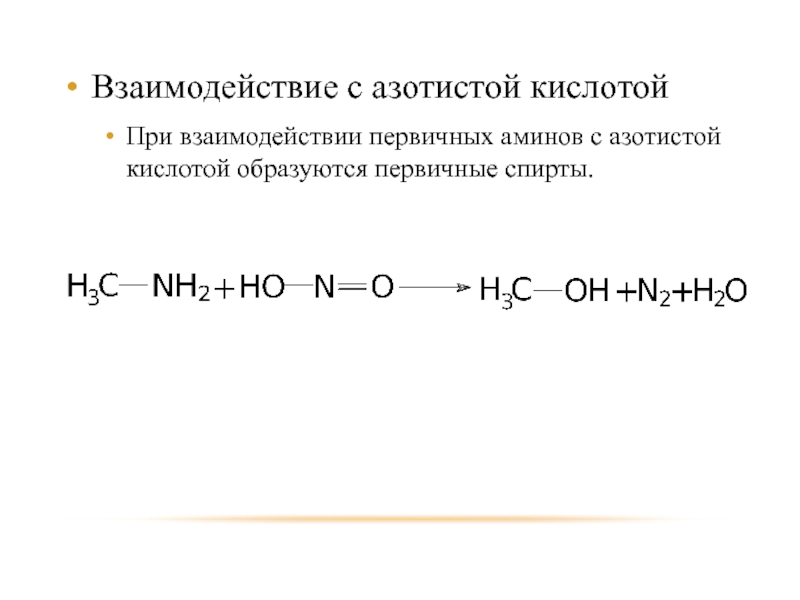
Слайд 22Взаимодействие с азотистой кислотой
При взаимодействии первичных аминов с азотистой кислотой образуются
первичные спирты.
Слайд 23Вторичные амины при взаимодействии с азотистой кислотой образуют нитрозамины (окрашенные соединения
желто-оранжевого цвета).
Слайд 28Окисление.
протекает трудно, а результат зависит от структуры.
Окисление первичных аминов приводит к
образованию нитросоединений.
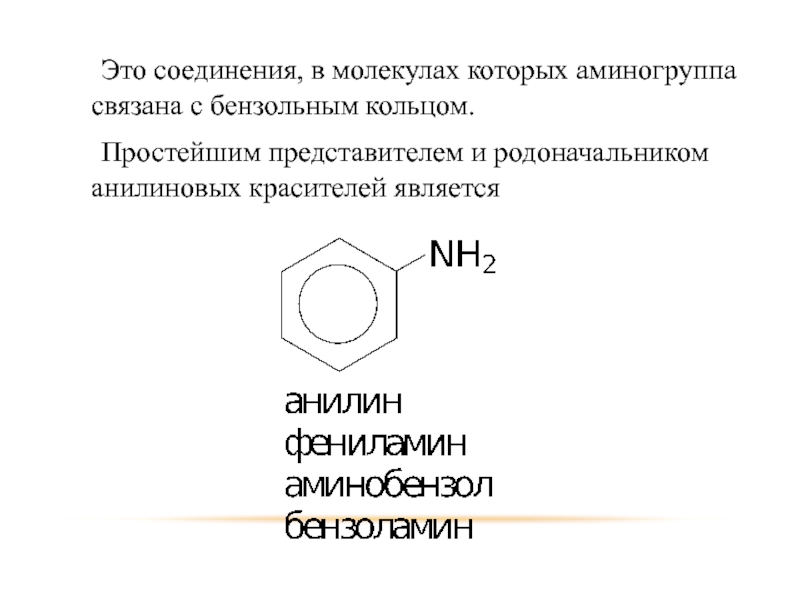
Слайд 32 Это соединения, в молекулах которых аминогруппа связана с бензольным кольцом.
Простейшим представителем
и родоначальником анилиновых красителей является
Слайд 34ФИЗИЧЕСКИЕ СВОЙСТВА
Анилин – бесцветная, быстро буреющая на воздухе, жидкость. Плохо растворяется
в воде.
Слайд 35ХИМИЧЕСКИЕ СВОЙСТВА
обусловлены как аминогруппой, так и бензольным кольцом. Аминогруппа – заместитель
электроннодонорный и свойства анилина обусловленные бензольным кольцом следующие:
Слайд 38взаимодействие со спиртами –специфические химические свойства аминогруппы, обусловленные непосредственным контактом с
бензольным кольцом.
Слайд 47 Амидами называют соединения в состав молекул которых входит следующая функциональная группа
Слайд 49МОЧЕВИНА
является полным амидом угольной кислоты. Широко распространена в природе. Является конечным
продуктом белкового обмена.
При обычных условиях мочевина – твердое кристаллическое вещество, плавящееся при температуре 133°С. Хорошо растворима в полярных и абсолютно нерастворима в неполярных растворителях.
Обладает слабыми основными свойствами, но они выражены слабее, чем у аминов, из-за карбонильной группы.
При обычных условиях мочевина – твердое кристаллическое вещество, плавящееся при температуре 133°С. Хорошо растворима в полярных и абсолютно нерастворима в неполярных растворителях.
Обладает слабыми основными свойствами, но они выражены слабее, чем у аминов, из-за карбонильной группы.
Слайд 51ПОЛУЧЕНИЕ МОЧЕВИНЫ
В промышленности мочевину получают следующими способами:
Взаимодействием полного галогенангидрида угольной кислоты
с аммиаком
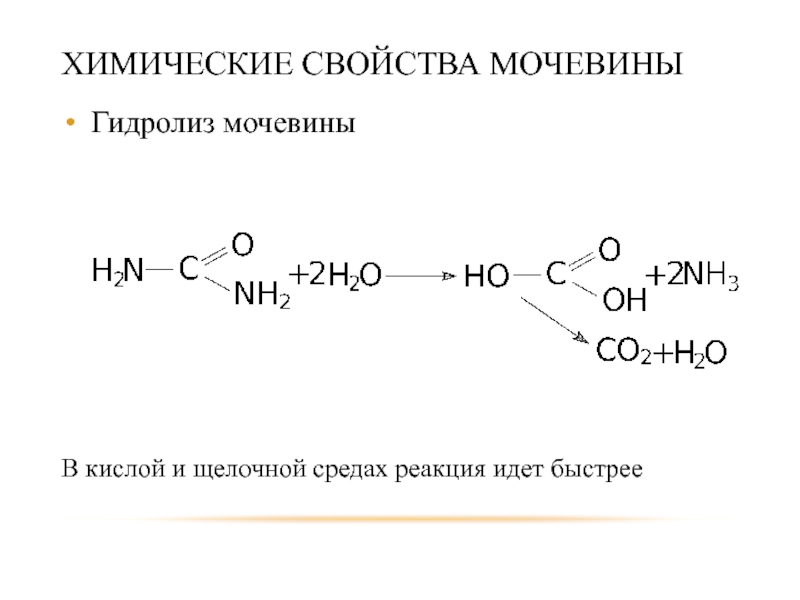
Слайд 53ХИМИЧЕСКИЕ СВОЙСТВА МОЧЕВИНЫ
Гидролиз мочевины
В кислой и щелочной средах реакция идет быстрее
Слайд 58 За счет разрыва двойных связей диметиленмочевина подвергается полимеризации с образованием мочевино-формальдегидных
смол.
Слайд 60 Биурет является простейшим органическим соединением с пептидной связью.
Пептидная связь является основной
связью всех природных белковых тел.
Реакция биурета с гидроксидом меди(II) является качественной реакцией на белки.
Реакция биурета с гидроксидом меди(II) является качественной реакцией на белки.
Слайд 63 Аминокислотами называют такие производные карбоновых кислот, которые можно получить замещением одного
или нескольких атомов водорода в радикале кислоты аминогруппами.
Слайд 64КЛАССИФИКАЦИИ
В зависимости от количества карбоксильных групп:
Одноосновные
Двухосновные
Многоосновные
Слайд 65В зависимости от количества аминогрупп:
Моно-аминокислоты
Ди-аминокислоты
Три-аминокислоты
В зависимости от строения радикала:
С открытой цепью
Циклические
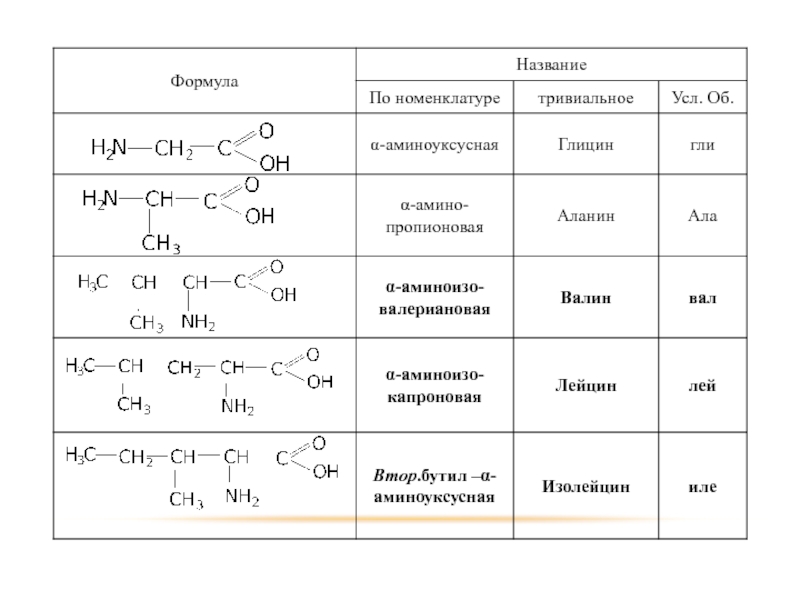
Слайд 66НОМЕНКЛАТУРА
УНИВЕРСАЛЬНАЯ: правила построения названий такие же как для карбоновых кислот только
с указанием в префиксе наличия, количества и положения аминогрупп.
РАЦИОНАЛЬНАЯ: положение аминогрупп указывается буквами греческого алфавита + слово «амино» + название карбоновой кислоты по рациональной номенклатуре.
РАЦИОНАЛЬНАЯ: положение аминогрупп указывается буквами греческого алфавита + слово «амино» + название карбоновой кислоты по рациональной номенклатуре.
Слайд 67ИЗОМЕРИЯ
Изомерия положения аминогруппы относительно карбоксильной группы. Различают α-, β-, γ-, δ-,
ε- и т.д.
Структурная изомерия
Оптическая изомерия
Структурная изомерия
Оптическая изомерия
Слайд 68ПОЛУЧЕНИЕ
α-Аминокислоты
получают из природных веществ и синтетически
Белки при гидролизе в водных растворах
в присутствии кислот, щелочей или ферментов распадаются на смесь α-аминокислот, из которой различными способами можно выделить индивидуальные кислоты.
Для синтеза аминокислот исходными веществами могут быть α-галогенкарбоновые кислоты, альдегиды, галогенуглеводороды.
Для синтеза аминокислот исходными веществами могут быть α-галогенкарбоновые кислоты, альдегиды, галогенуглеводороды.
Слайд 70ПОЛУЧЕНИЕ
Альдегиды и кетоны взаимодействуют с цианистым водородом и аммиаком. По методу
Н.Д. Зелинского в качестве реагента применяют смесь KCN и NH4Cl
Слайд 73ФИЗИЧЕСКИЕ СВОЙСТВА
Аминокислоты – бесцветные кристаллические вещества, обладающие высокими показателями температуры плавления.
Не летучи. Плавятся с разложением. Хорошо растворяются в воде и плохо растворяются в органических растворителях. Обладают оптической активностью.
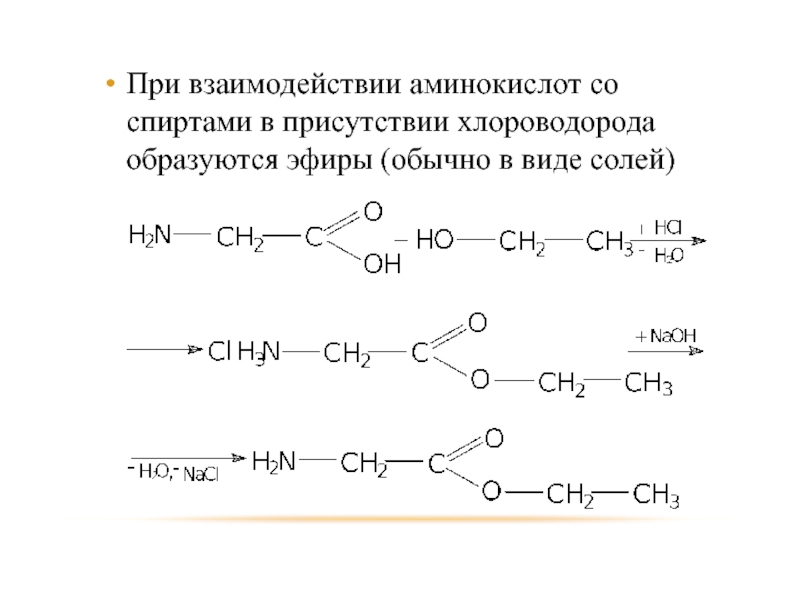
Слайд 78При взаимодействии аминокислот со спиртами в присутствии хлороводорода образуются эфиры (обычно
в виде солей)
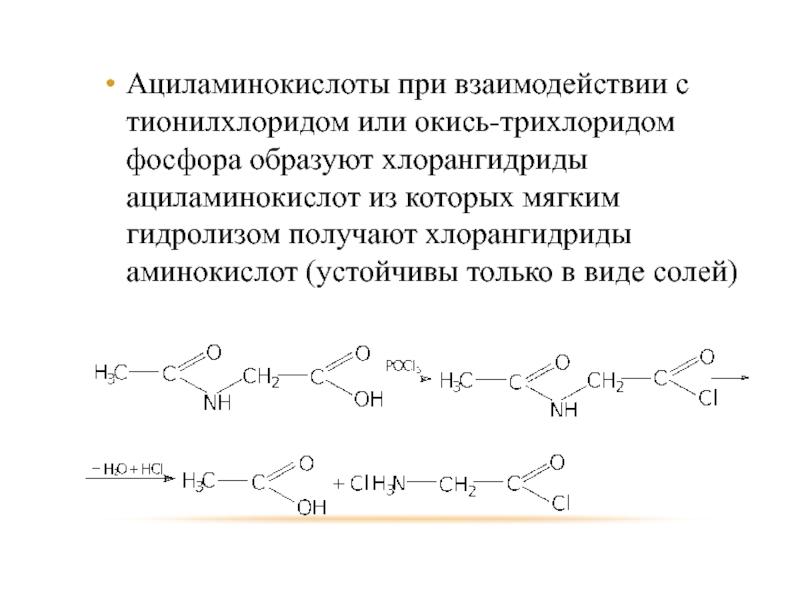
Слайд 79Ациламинокислоты при взаимодействии с тионилхлоридом или окись-трихлоридом фосфора образуют хлорангидриды ациламинокислот
из которых мягким гидролизом получают хлорангидриды аминокислот (устойчивы только в виде солей)
Слайд 80СВОЙСТВА АМИНОГРУППЫ
Взаимодействие с минеральными кислотами. Аминокислоты образуют соли, подобно аминам
Слайд 82Аминокислоты взаимодействуют с хлорангидридами и ангидридами кислот, образуя N-ацильные производные аминокислот,
которые имеют большое значение при синтезе пептидов
Слайд 83Взаимодействие с формалином аминокислот с первичной аминогруппой (в растворе с pH=9)
приводит к образованию N-метиленовых производных
Слайд 84СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
Отношение к воде. Электролитическая диссоциация. В водных растворах молекулы
аминокислот ведут себя как биполярные ионы
Моноаминомонокарбоновые кислоты (рН=7)
Моноаминомонокарбоновые кислоты (рН=7)
Слайд 87СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
Отношение к нагреванию
α-аминокислоты в присутствии минеральных кислот
Слайд 90В тех случаях, когда амино- и карбоксильные группы разделены пятью и
более углеродными атомами, при нагревании происходит поликонденсация с образованием полимерных полиамидных цепей
Слайд 91Реакции, характерные для α-аминокислот.
Декарбоксилирование. Под действием особых ферментов – декарбоксилаз или
некоторых микроорганизмов α-аминокислоты превращаятся в амины
Слайд 92Реакция дезаминирования, как и реакция декарбоксилирования, протекает под действием смецифических ферментов
Слайд 93Реакция переаминирования, как и реакции дезаминирования и декарбоксилирования, протекает под действием
смецифических ферментов
Слайд 97Пептиды и пептидная связь
В живых организмах под действием ферментов из аминокислот,
в основном относящихся к α-аминокислотам, образуются пептиды.
Слайд 98Пептид состоящий из двух молекул аминокислот называют дипептидом, из трёх –
трипептидом, из четырёх – тетропептидом и т.д., свыше 10 – полипептидами, а свыше 150 – белками.
К настоящему времени разработано много методов превращения α-аминокислот в пептиды.
К настоящему времени разработано много методов превращения α-аминокислот в пептиды.
Слайд 99Чтобы соединить две аминокислоты пептидной связью, необходимо: а) защитить карбоксильную группу
одной кислоты (например: превратив её в эфирную) и аминогруппу другой кислоты (ацелированием); б) образовать пептидную связь; в) снять защитные группы, обычно реакцией гидролиза, но в таких условиях, что бы не пострадала пептидная связь.
Слайд 102 Двухосновные аминокислоты способны образовывать внутренние соли. Обе встречаются среди продуктов гидролиза
белковых тел.
Аспарагиновая кислота в свободном виде встречается в животных и растительных организмах. Играет важную роль в азотистом обмене. Образует амид – аспаргин.
Глутаминовая кислота используется при лечении психических расстройств. Образует амид – глутамин.
Аспарагиновая кислота в свободном виде встречается в животных и растительных организмах. Играет важную роль в азотистом обмене. Образует амид – аспаргин.
Глутаминовая кислота используется при лечении психических расстройств. Образует амид – глутамин.
Слайд 106 α-аминокислоты участвуют в синтезе белка.
В состав белковых тел входят
и такие аминокислоты, которые кроме аминогрупп содержат и другие функциональные группы.
По своей значимости для организма все аминокислоты делятся на:
Заменимые (синтезируются в организме)
Не заменимые (запас пополняется только с пищей)
По своей значимости для организма все аминокислоты делятся на:
Заменимые (синтезируются в организме)
Не заменимые (запас пополняется только с пищей)
Слайд 112БЕЛКИ
Белками, или белковыми веществами, называют высокомолекулярные органические соединения, молекулы которых построены
из остатков α-аминокислот, связанных между собой пептидными связями. Количество последних может колебаться очень сильно и достигать иногда нескольких тысяч.
Структура белков очень сложная. Отдельные пептидные цепи или их участки могут быть связаны между собой дисульфидными , солевыми или водородными связями.
Солевые связи образуются между свободными аминогруппами (например, концевая аминогруппа, расположенная на одном конце полипептидной цепи или ε-аминогруппа лизина) и свободными карбоксильными группами (концевая карбоксильная группа цепи или свободные карбоксильные группы двухосновных аминокислот);
Водородные связи могут возникать между атомом кислорода карбонильной группы и атомом водорода аминогруппы, а также за счет гидроксогрупп оксиаминокислот и кислорода пептидных групп.
Структура белков очень сложная. Отдельные пептидные цепи или их участки могут быть связаны между собой дисульфидными , солевыми или водородными связями.
Солевые связи образуются между свободными аминогруппами (например, концевая аминогруппа, расположенная на одном конце полипептидной цепи или ε-аминогруппа лизина) и свободными карбоксильными группами (концевая карбоксильная группа цепи или свободные карбоксильные группы двухосновных аминокислот);
Водородные связи могут возникать между атомом кислорода карбонильной группы и атомом водорода аминогруппы, а также за счет гидроксогрупп оксиаминокислот и кислорода пептидных групп.
Слайд 113БЕЛКИ
Различают первичную, вторичную, третичную и четвертичную структуры белковых молекул.
Все белки, независимо
от того к какой группе они относятся и какие функции выполняют, построены из относительно небольшого набора (обычно 20) аминокислот, которые расположены в различной, но всегда строго определенной для данного вида белка последовательности.
Белки подразделяют на протеины и протеиды.
Протеины – простые белки, состоящие только из остатков аминокислот.
Альбумины – обладают сравнительно небольшой молекулярной массой, хорошо растворимы в воде, при нагревании свертываются.
Белки подразделяют на протеины и протеиды.
Протеины – простые белки, состоящие только из остатков аминокислот.
Альбумины – обладают сравнительно небольшой молекулярной массой, хорошо растворимы в воде, при нагревании свертываются.
Слайд 114БЕЛКИ
Глобулины – не растворимы в чистой воде, но растворимы в теплом
10%-ном растворе NaCl.
Проламины – незначительно растворимы в воде, но растворимы в 60÷80%-ном водном этиловом спирте.
Глютелины – растворимы только в 0,2%-ной щелочи.
Протамины – совершенно не содержат серы.
Пртеиноиды – нерастворимые белки.
Фосфопротеины – содержат фосфорную кислоту (козеин).
Проламины – незначительно растворимы в воде, но растворимы в 60÷80%-ном водном этиловом спирте.
Глютелины – растворимы только в 0,2%-ной щелочи.
Протамины – совершенно не содержат серы.
Пртеиноиды – нерастворимые белки.
Фосфопротеины – содержат фосфорную кислоту (козеин).
Слайд 115БЕЛКИ
Пртеиды – сложные белки, в состав которых наряду с аминокислотами входят
углеводы, липиды, гетероциклические соединения, нуклеиновые кислоты, фосфорная кислота.
Липопротеиды – гидролизуются на простой белок и липиды. (зерна хлорофила, протоплазма клеток).
Гликопротеиды – гидролизуются на простые белки и высокомолекулярные углеводы. (слизистые выделения животных).
Хромопротеиды – гидролизуются на простые белки и красящие вещества (гемоглобин)
Нуклеопротеиды – гидролизуются на простые белки (обычно протамины) и нуклеиновые кислоты
Липопротеиды – гидролизуются на простой белок и липиды. (зерна хлорофила, протоплазма клеток).
Гликопротеиды – гидролизуются на простые белки и высокомолекулярные углеводы. (слизистые выделения животных).
Хромопротеиды – гидролизуются на простые белки и красящие вещества (гемоглобин)
Нуклеопротеиды – гидролизуются на простые белки (обычно протамины) и нуклеиновые кислоты