- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Азотовмісні сполуки презентация
Содержание
- 1. Азотовмісні сполуки
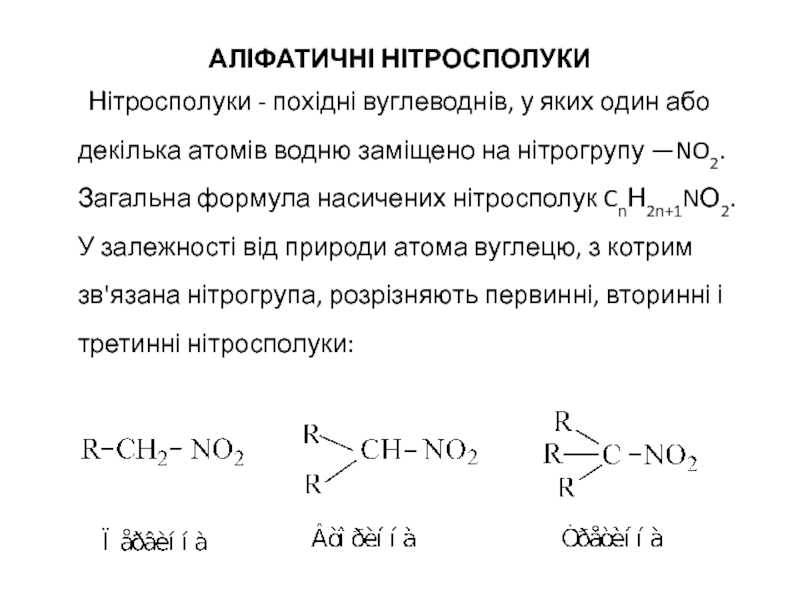
- 2. АЛІФАТИЧНІ НІТРОСПОЛУКИ Нітросполуки - похідні вуглеводнів,
- 4. МЕТОДИ ОДЕРЖАННЯ НІТРОСПОЛУК 1. Нітрування алканів
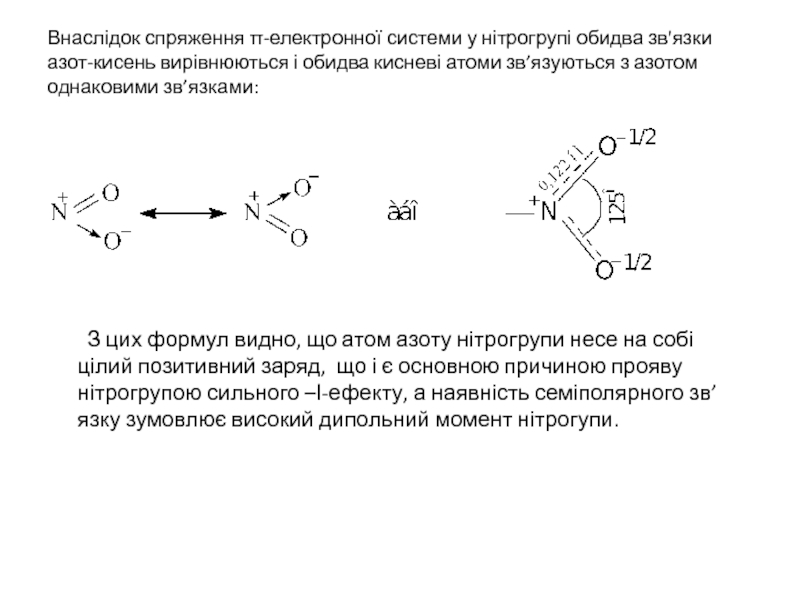
- 5. Внаслідок спряження π-електронної системи у нітрогрупі обидва
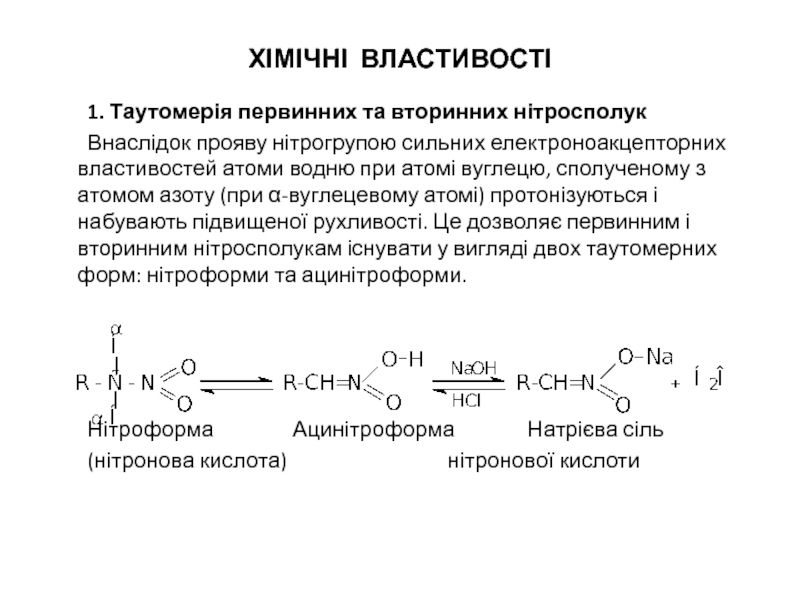
- 6. ХІМІЧНІ ВЛАСТИВОСТІ 1. Таутомерія первинних та
- 7. Ациформа хоча і має кислі властивості, але
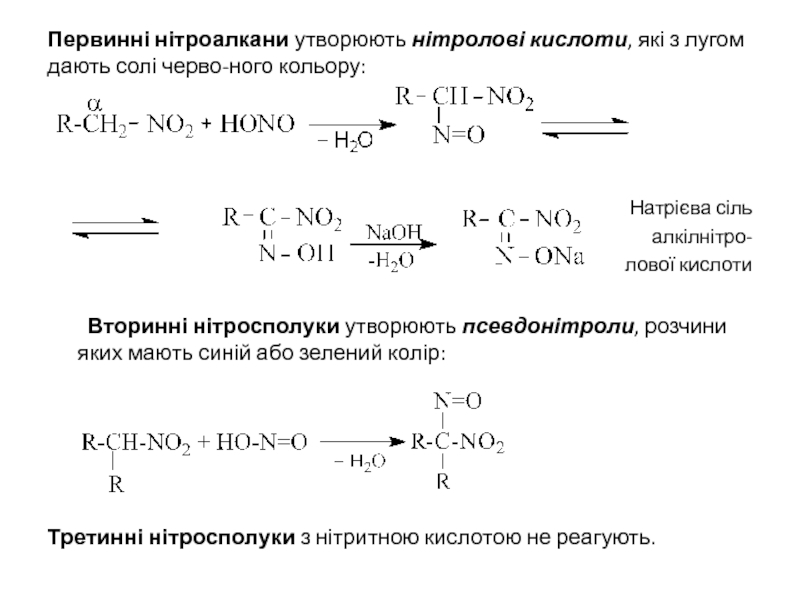
- 8. Первинні нітроалкани утворюють нітролові кислоти, які з
- 9. 4. Взаємодія з альдегідами або кетонами При
- 10. АЛIФАТИЧНI АМIНИ Аміни можна розглядати як
- 12. За замісниковою номенклатурою IUPAC назви амінів утворюють
- 13. МЕТОДИ ОДЕРЖАННЯ Відновлення нітросполук у присутності
- 14. Алкілювання аміаку алкілгалогенідами (А.Гофман, 1849)
- 15. З амідів кислот за Гофманом
- 16. ФІЗИЧНІ ВЛАСТИВОСТІ Алкіламіни - це гази
- 17. ХІМІЧНІ ВЛАСТИВОСТІ 1. Основність амінів Азот
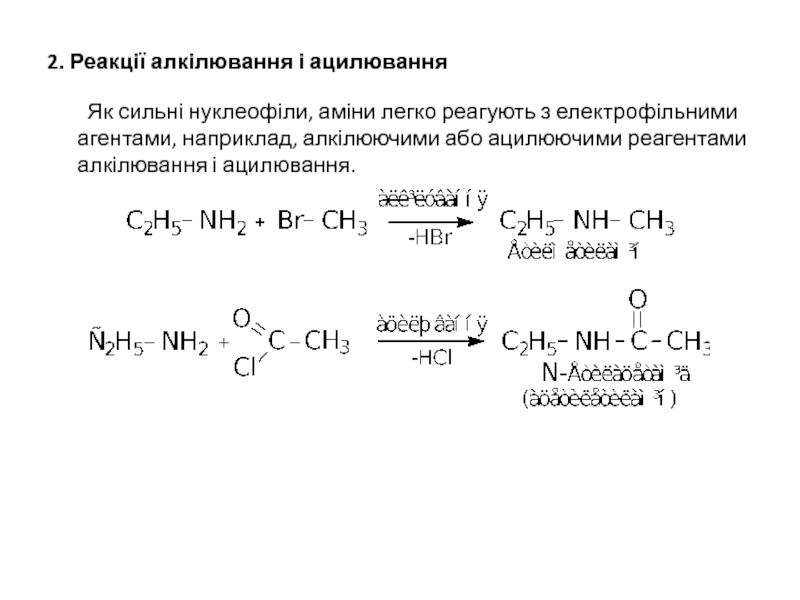
- 18. 2. Реакції алкілювання і ацилювання Як
- 19. 3. Взаємодія з нітритною кислотою За
- 20. ДІАМІНИ Аміни, що містять у молекулі
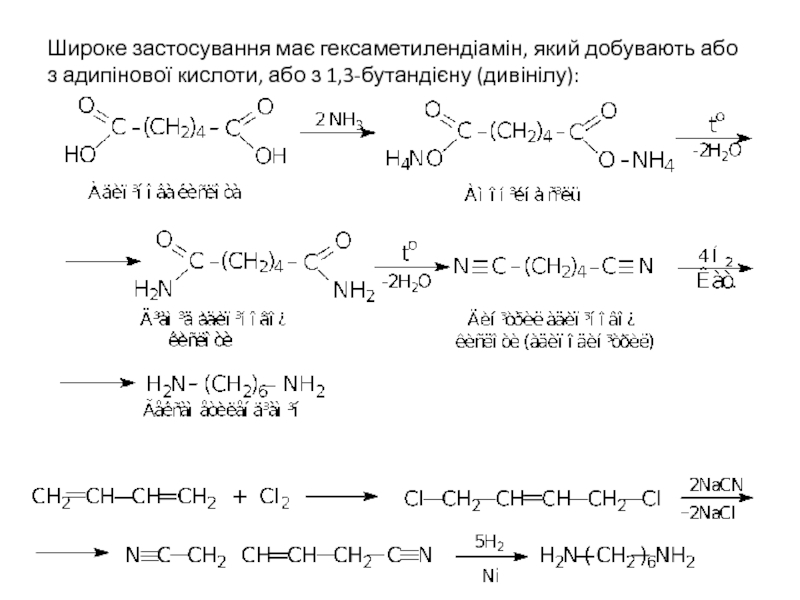
- 21. Широке застосування має гексаметилендіамін, який добувають або
- 22. Реакцією поліконденсації гексаметилендіаміну з двоосновними карбоновими кислотами
Слайд 1АЗОТОВМІСНІ СПОЛУКИ
До азотовмісних органічних сполук відносять такі, що містять атоми азоту,
Найбільше значення мають нітросполуки та аміни.
Слайд 2АЛІФАТИЧНІ НІТРОСПОЛУКИ
Нітросполуки - похідні вуглеводнів, у яких один або декілька атомів
Слайд 4МЕТОДИ ОДЕРЖАННЯ НІТРОСПОЛУК
1. Нітрування алканів (див.стор.).
2. Взаємодія алкілгалогенідів з нітритом натрію
ФІЗИЧНІ ВЛАСТИВОСТІ
Нітросполуки аліфатичного ряду - висококиплячі, малорозчинні у воді, сильнополярні рідини або кристалічні речовини з густиною, як правило, більшою за 1.
Причина сильної полярності нітрогрупи полягає в її будові. Нітрогрупа містить семіполярний зв'язок.
Слайд 5Внаслідок спряження π-електронної системи у нітрогрупі обидва зв'язки азот-кисень вирівнюються і
З цих формул видно, що атом азоту нітрогрупи несе на собі цілий позитивний заряд, що і є основною причиною прояву нітрогрупою сильного –І-ефекту, а наявність семіполярного зв’язку зумовлює високий дипольний момент нітрогупи.
Слайд 6ХІМІЧНІ ВЛАСТИВОСТІ
1. Таутомерія первинних та вторинних нітросполук
Внаслідок прояву нітрогрупою сильних електроноакцепторних
Нітроформа Ацинітроформа Натрієва сіль
(нітронова кислота) нітронової кислоти
Слайд 7Ациформа хоча і має кислі властивості, але не володіє електропровідністю. Такі
2. Відновлення нітросполук
3. Реакція з нітритною кислотою
Ця реакція дозволяє розпізнати первинні, вторинні та третинні нітросполуки.
Слайд 8Первинні нітроалкани утворюють нітролові кислоти, які з лугом дають солі черво-ного
Натрієва сіль
алкілнітро-
лової кислоти
Вторинні нітросполуки утворюють псевдонітроли, розчини яких мають синій або зелений колір:
Третинні нітросполуки з нітритною кислотою не реагують.
Слайд 94. Взаємодія з альдегідами або кетонами
При взаємодії первинних і вторинних нітросполук
5. Дія сильних кислот (80-90% Н2SО4 )
Первинні нітроалкани утворюють в кислому середовищі карбонові кислоти і гідроксиламін (промисловий метод добування гідроксиламіну). Реакція протікає через стадію утворення гідроксамової кислоти.
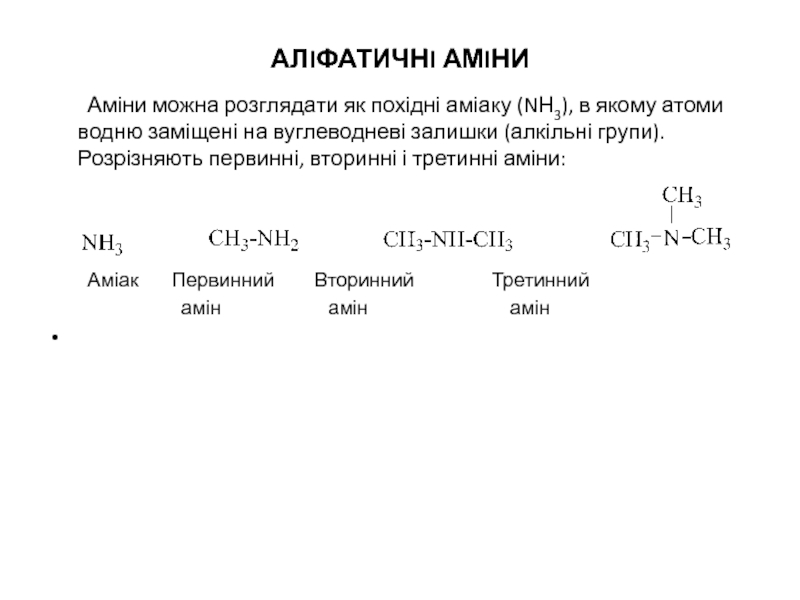
Слайд 10АЛIФАТИЧНI АМIНИ
Аміни можна розглядати як похідні аміаку (NН3), в якому атоми
Аміак Первинний Вторинний Третинний
амін амін амін
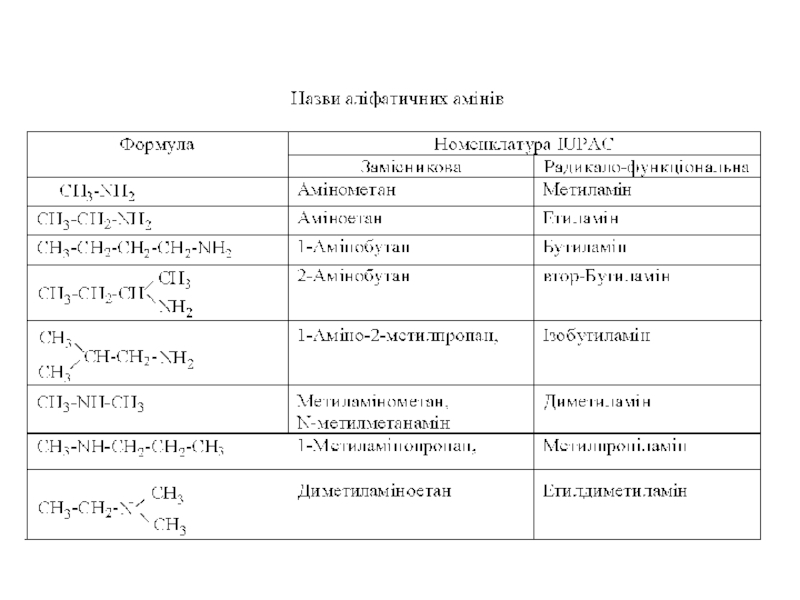
Слайд 12За замісниковою номенклатурою IUPAC назви амінів утворюють шляхом додавання префікса "аміно"
За радикало-функціональною номенклатурою IUPAC перелічують за алфавітним порядком назви алкільних залишків, що сполучені з азотом і додають суфікс "амін.
Слайд 13МЕТОДИ ОДЕРЖАННЯ
Відновлення нітросполук у присутності каталізаторів
Відновлення інших азотовмісних сполук
Нітрил Первинний амін
Ізонітрил Вторинний
Алкілювання аміаку спиртами
Цетиловий спирт
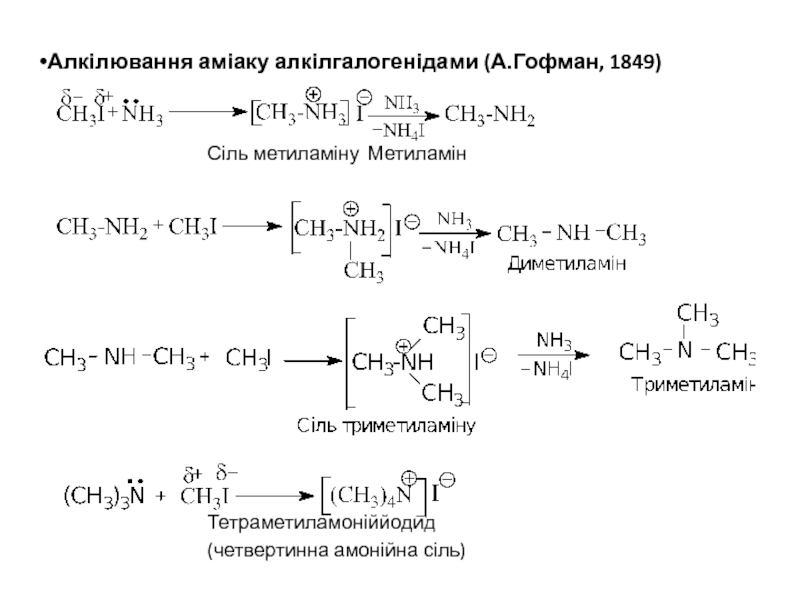
Слайд 14Алкілювання аміаку алкілгалогенідами (А.Гофман, 1849)
Сіль метиламіну Метиламін
Тетраметиламоніййодид
(четвертинна амонійна сіль)
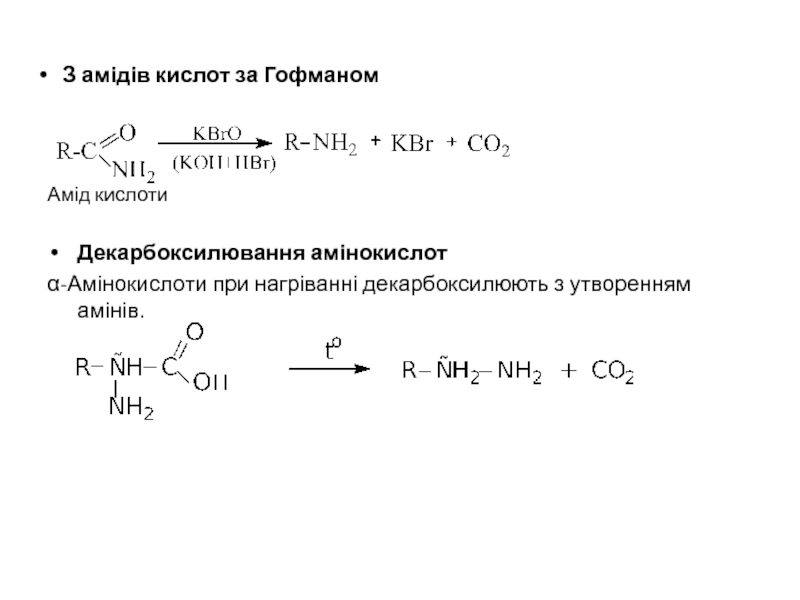
Слайд 15 З амідів кислот за Гофманом
Амід кислоти
Декарбоксилювання амінокислот
α-Амінокислоти при нагріванні
Слайд 16ФІЗИЧНІ ВЛАСТИВОСТІ
Алкіламіни - це гази або рідини з неприємним запахом. Середні
Аміни побудовані аналогічно аміаку і мають пірамідальну молекулу з атомом азоту у вершині піраміди з кутами між зв'язками приблизно 106-108о.
Якщо з атомом азоту зв'язані три різних замісники, то такі третинні аміни проявляють оптичну активність. Роль четвертого замісника виконує орбіталь з неподіленою парою електронів атома азоту.
Слайд 17ХІМІЧНІ ВЛАСТИВОСТІ
1. Основність амінів
Азот аміногрупи має рухливу неподілену пару електронів і
При взаємодії з мінеральними кислотами аміни утворюють солі:
Алкіламонійхлорид
Основність амінів зменшується при переході від третинних до первинних.
Слайд 182. Реакції алкілювання і ацилювання
Як сильні нуклеофіли, аміни легко реагують з
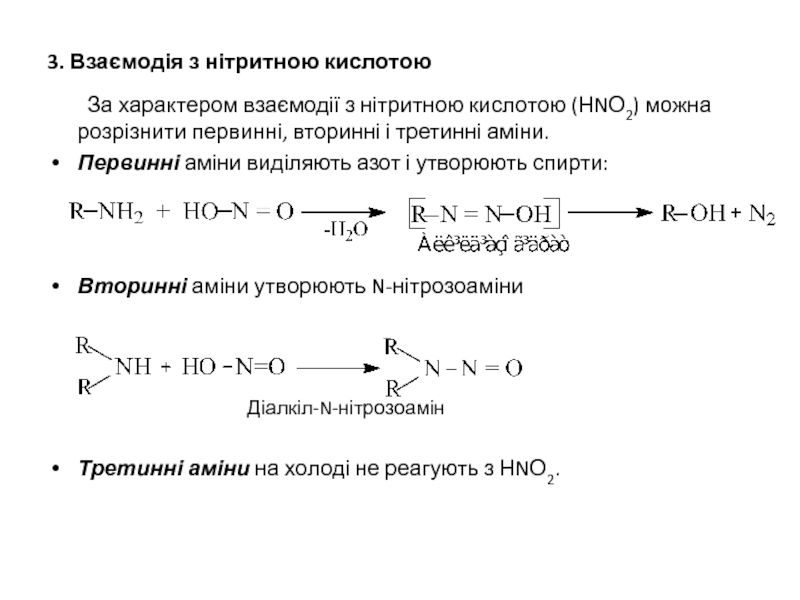
Слайд 193. Взаємодія з нітритною кислотою
За характером взаємодії з нітритною кислотою (НNО2)
Первинні аміни виділяють азот і утворюють спирти:
Вторинні аміни утворюють N-нітрозоаміни
Діалкіл-N-нітрозоамін
Третинні аміни на холоді не реагують з НNО2.
Слайд 20ДІАМІНИ
Аміни, що містять у молекулі дві аміногрупи називають діамінами. Назви їх
Діаміни одержують тими ж методами, що й моноаміни.
Слайд 21Широке застосування має гексаметилендіамін, який добувають або з адипінової кислоти, або
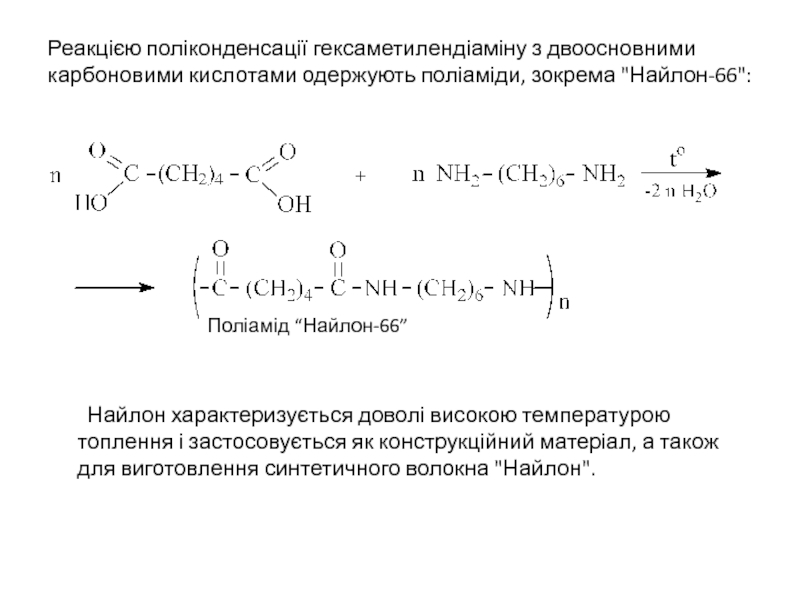
Слайд 22Реакцією поліконденсації гексаметилендіаміну з двоосновними карбоновими кислотами одержують поліаміди, зокрема "Найлон-66":
Поліамід “Найлон-66”
Найлон характеризується доволі високою температурою топлення і застосовується як конструкційний матеріал, а також для виготовлення синтетичного волокна "Найлон".