Жильцова Марина Юрьевна
Фамилия, имя, отчество
Лицей № 36 Открытого Акционерного Общества «Российские железные дороги», г. Иркутск
Образовательное учреждение, район
На тему:
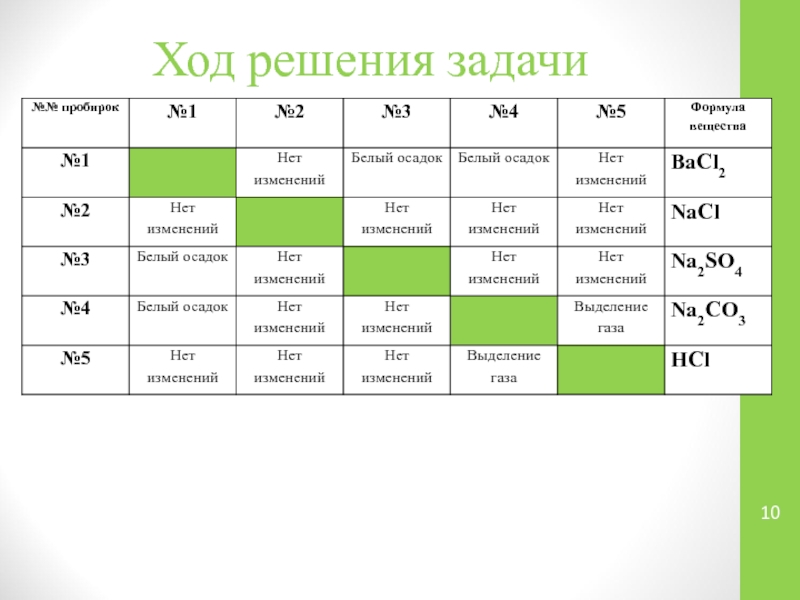
Методическая разработка урока химии в 9 классе «Исследовательская деятельность при решении экспериментальных задач»