- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ароматичні сульфонові кислоти (аренсульфокислоти) та їх похідні презентация
Содержание
- 1. Ароматичні сульфонові кислоти (аренсульфокислоти) та їх похідні
- 2. СПОСОБИ ОДЕРЖАННЯ 1. Дія концентрованої Н2SO4 на
- 4. У випадку сульфування алкілбензенів сульфогрупа направляється в
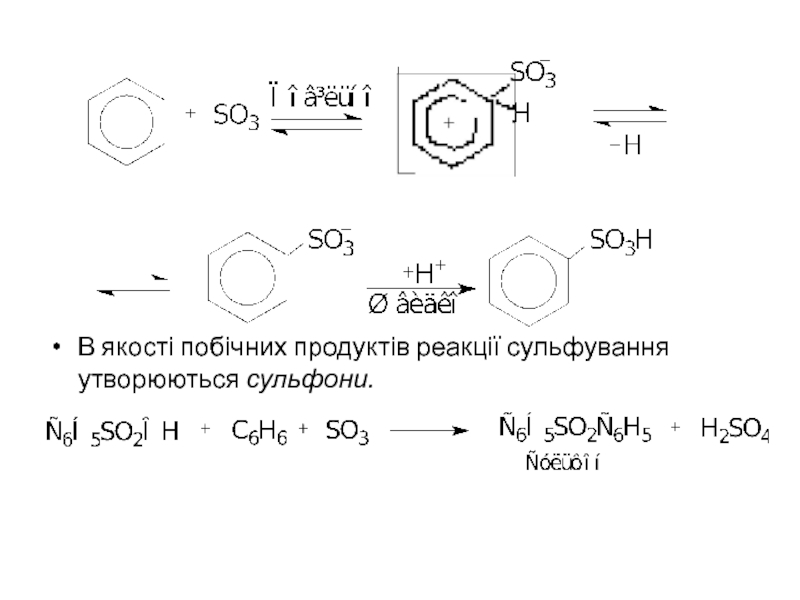
- 5. В якості побічних продуктів реакції сульфування утворюються сульфони.
- 6. Введення в бензинове ядро двох сульфогруп (сульфування
- 7. ФІЗИЧНІ І ХІМІЧНІ ВЛАСТИВОСТІ Аренсульфонові кислоти
- 8. 1.Реакції сульфогрупи Утворення солей Утворення
- 9. Утворення сульфонамідів Атоми водню
- 10. Відновлення сульфогрупи 2. Реакції
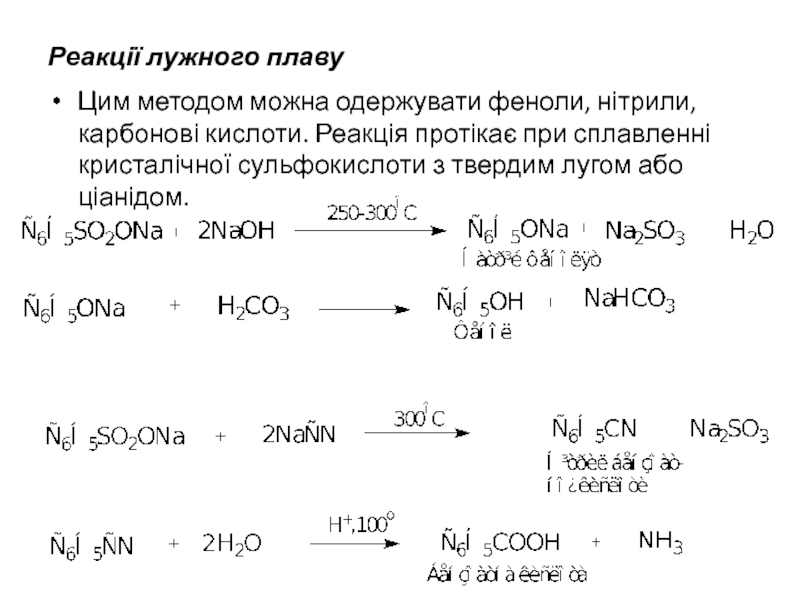
- 11. Реакції лужного плаву Цим методом можна одержувати
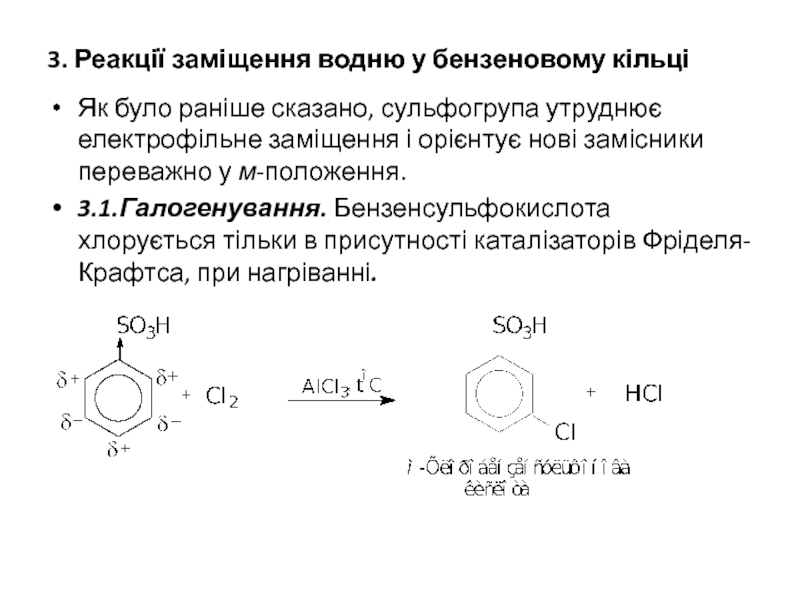
- 12. 3. Реакції заміщення водню у бензеновому кільці
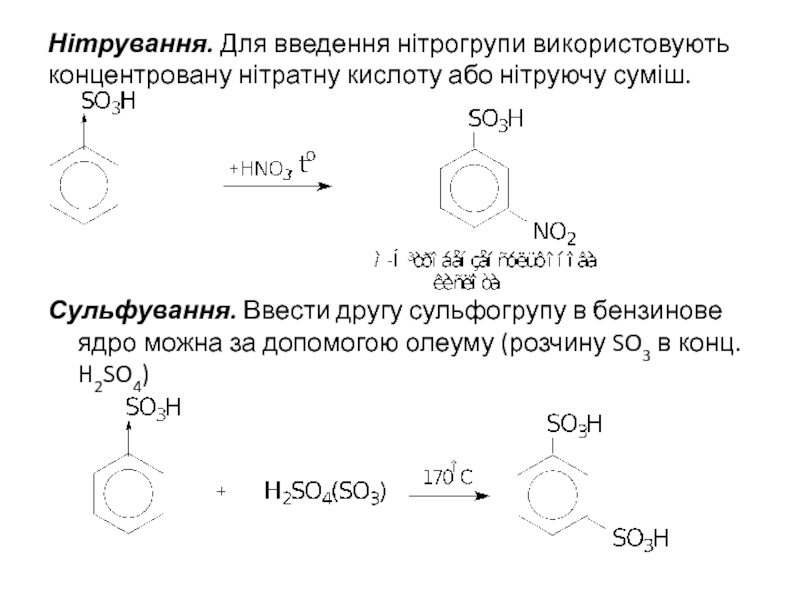
- 13. Нітрування. Для введення нітрогрупи використовують концентровану нітратну
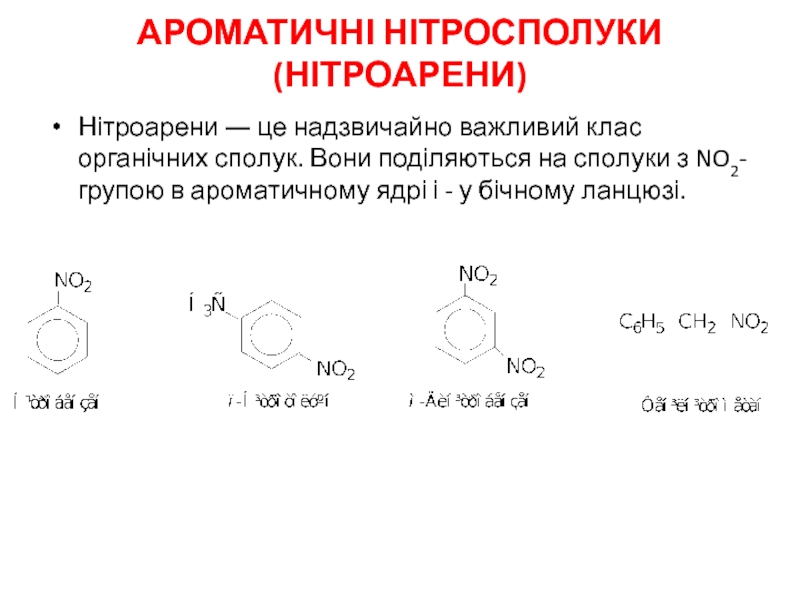
- 14. АРОМАТИЧНІ НІТРОСПОЛУКИ (НІТРОАРЕНИ) Нітроарени ― це
- 15. МЕТОДИ ОДЕРЖАННЯ 1. Пряме нітрування аренів
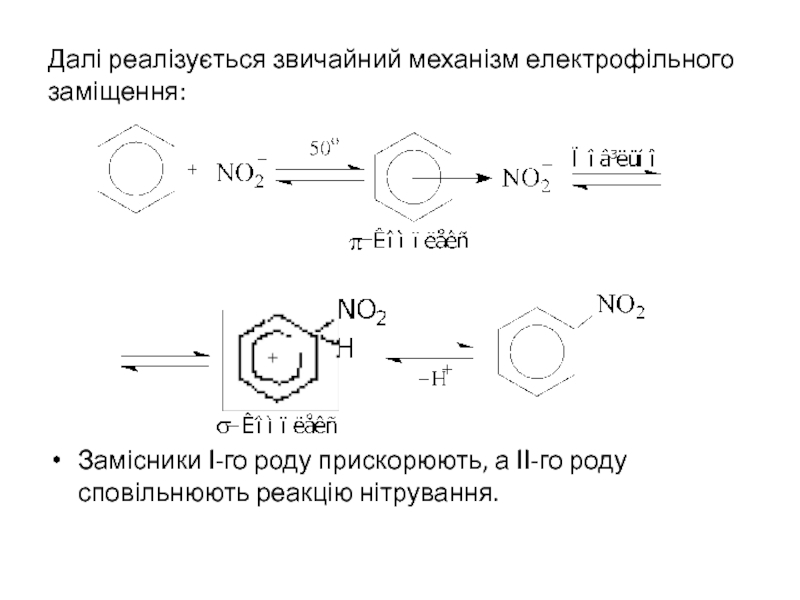
- 16. Далі реалізується звичайний механізм електрофільного заміщення:
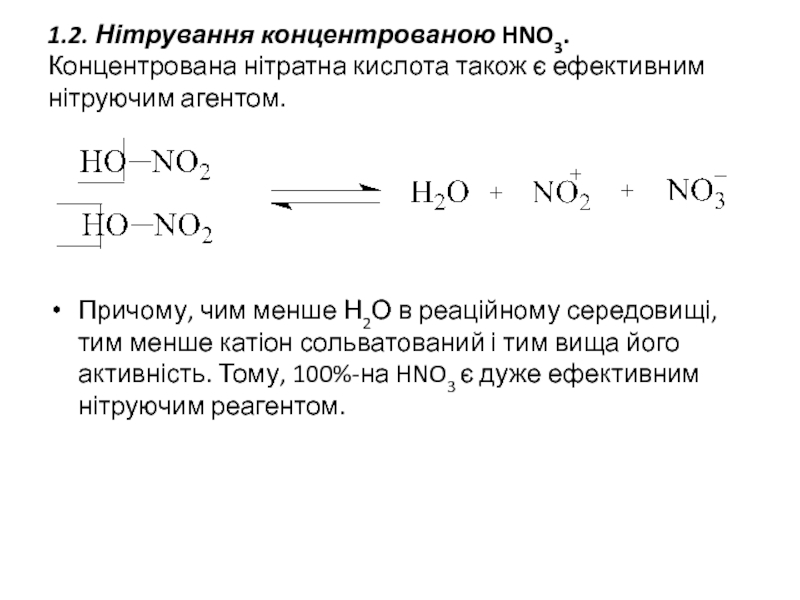
- 17. 1.2. Нітрування концентрованою HNO3. Концентрована нітратна кислота
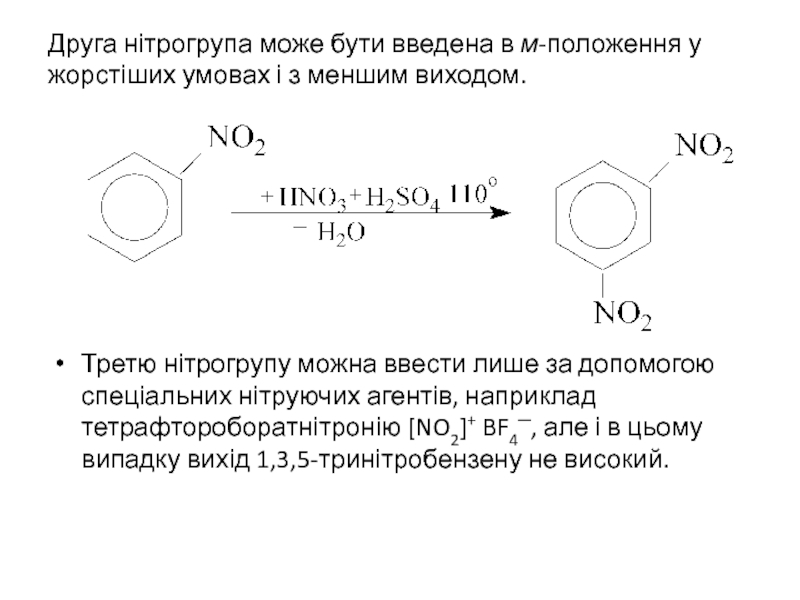
- 18. Друга нітрогрупа може бути введена в м-положення
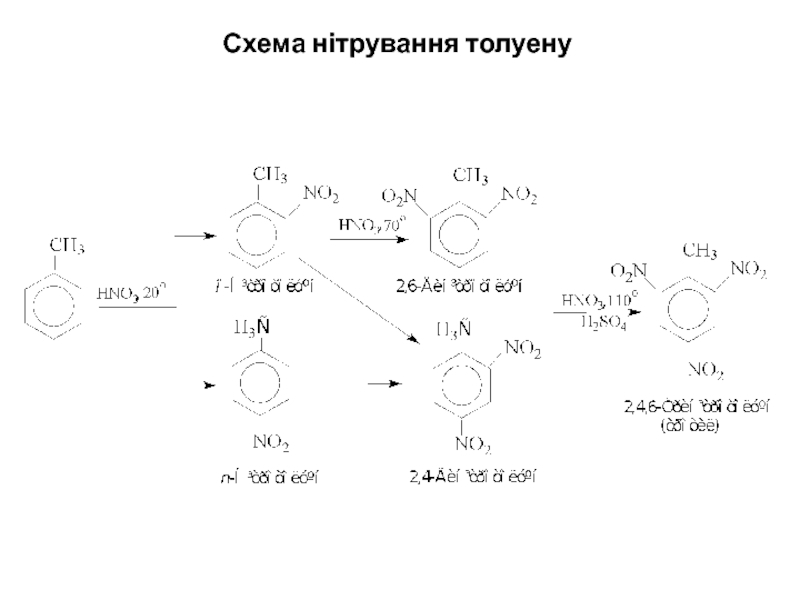
- 19. Схема нітрування толуену
- 20. 2. Нітрування бічного ланцюга аренів Нітрування
- 21. ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ Мононітроарени –
- 22. Середовище кисле та нейтральне (рН ≤ 7).
- 23. Середовище лужне (рН > 7). Спочатку реакція
- 24. 2. Реакції електрофільного заміщення SE Нітрогрупа
- 25. Реакції нуклеофільного заміщення SN. Наявність в бензеновому
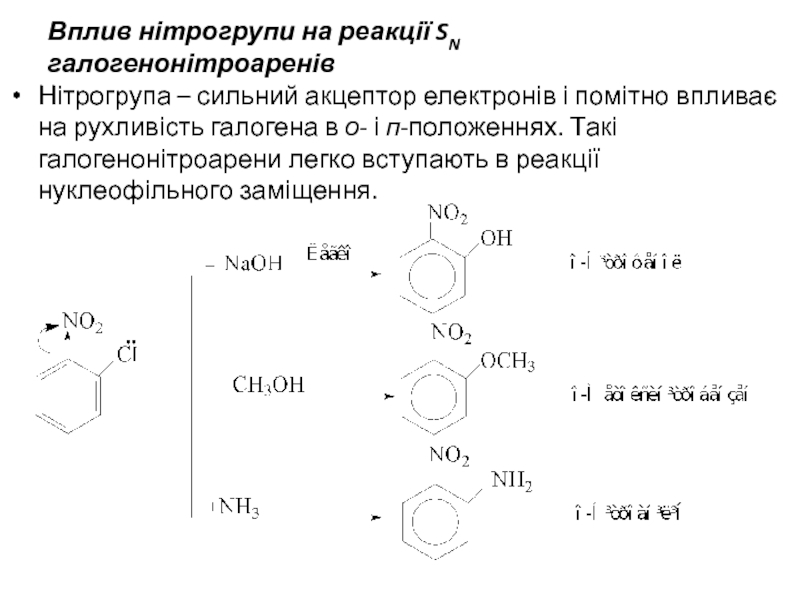
- 26. Вплив нітрогрупи на реакції SN галогенонітроаренів
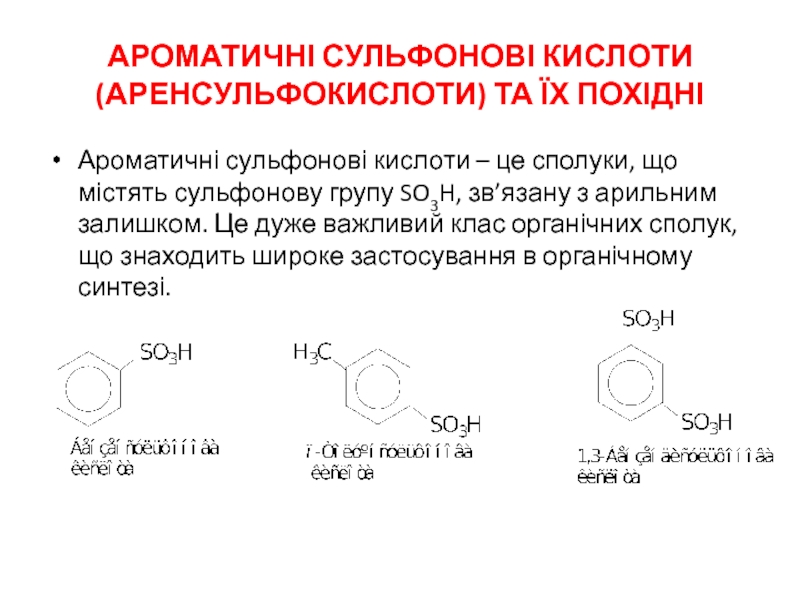
Слайд 1АРОМАТИЧНІ СУЛЬФОНОВІ КИСЛОТИ (АРЕНСУЛЬФОКИСЛОТИ) ТА ЇХ ПОХІДНІ
Ароматичні сульфонові кислоти – це
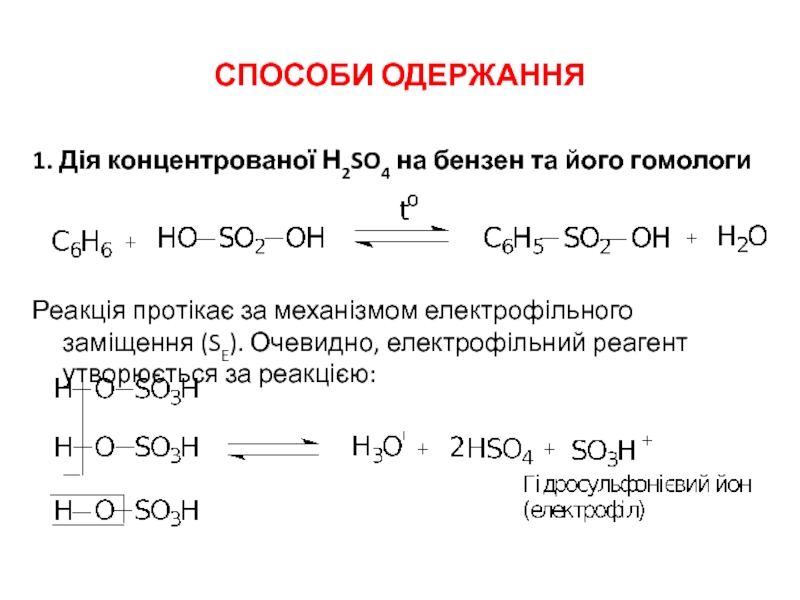
Слайд 2СПОСОБИ ОДЕРЖАННЯ
1. Дія концентрованої Н2SO4 на бензен та його гомологи
Реакція протікає
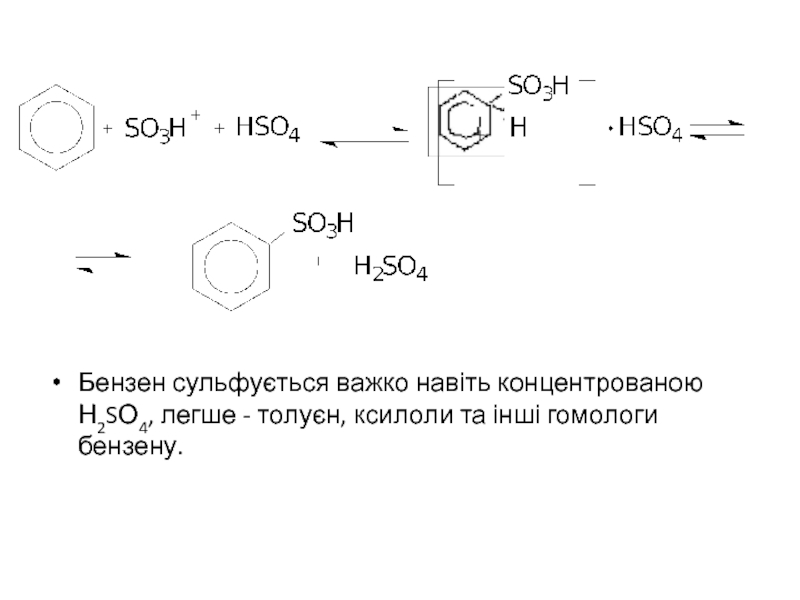
Слайд 3
Бензен сульфується важко навіть концентрованою Н2SО4, легше - толуєн, ксилоли та
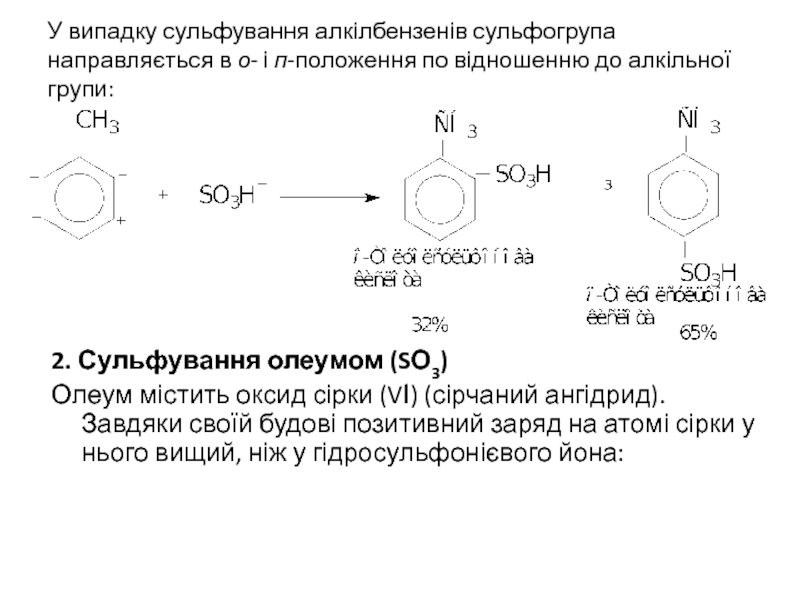
Слайд 4У випадку сульфування алкілбензенів сульфогрупа направляється в о- і п-положення по
2. Сульфування олеумом (SО3)
Олеум містить оксид сірки (VІ) (сірчаний ангідрид). Завдяки своїй будові позитивний заряд на атомі сірки у нього вищий, ніж у гідросульфонієвого йона:
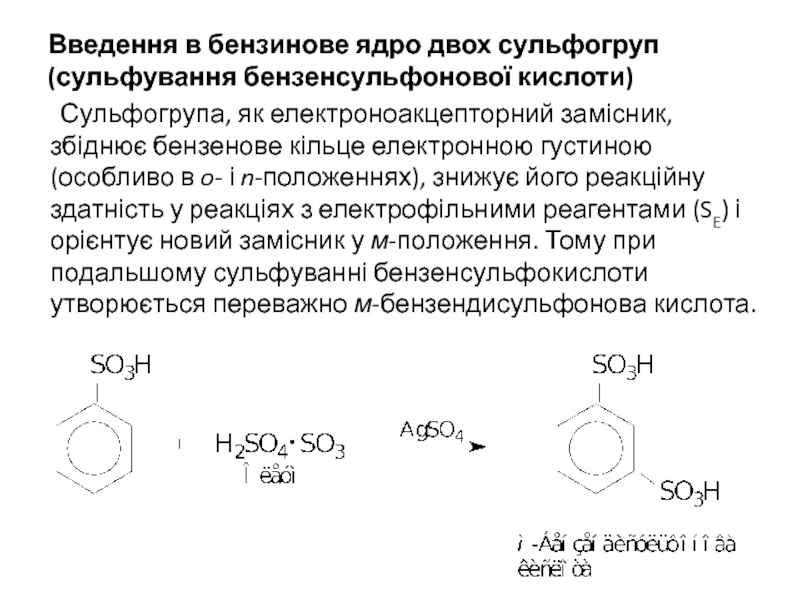
Слайд 6Введення в бензинове ядро двох сульфогруп (сульфування бензенсульфонової кислоти)
Сульфогрупа, як
Слайд 7ФІЗИЧНІ І ХІМІЧНІ ВЛАСТИВОСТІ
Аренсульфонові кислоти - переважно кристалічні речовини, розчинні у
Сульфогрупа є дуже реакційноздатною і для аренсульфонових кислот характерні такі типи перетворень:
1.Реакції сульфогрупи;
2.Реакції заміщення сульфогрупи на інші функціональні групи;
3.Реакції заміщення водню в бензеновому кільці.
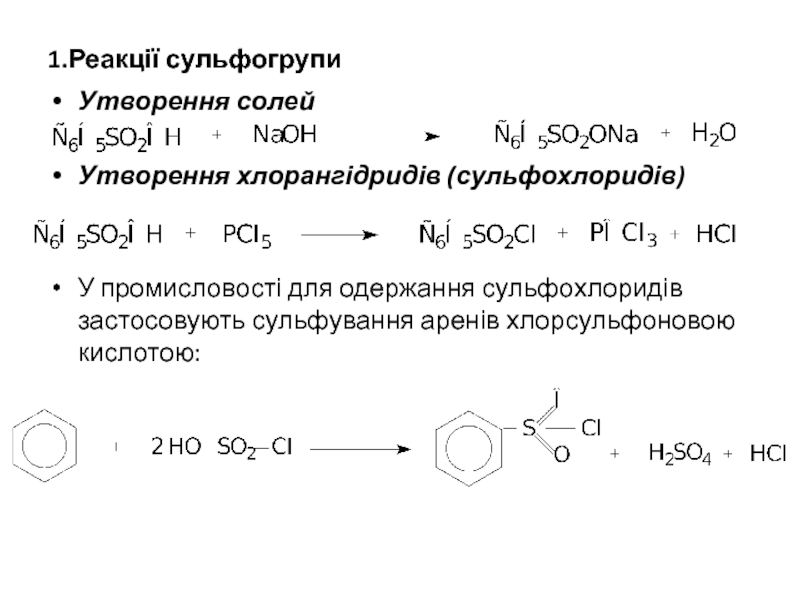
Слайд 81.Реакції сульфогрупи
Утворення солей
Утворення хлорангідридів (сульфохлоридів)
У промисловості для одержання сульфохлоридів застосовують сульфування
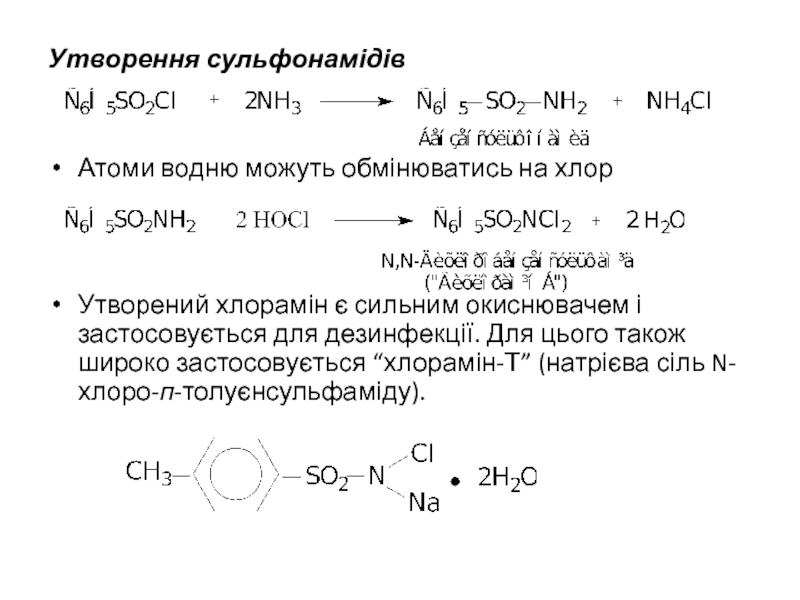
Слайд 9Утворення сульфонамідів
Атоми водню можуть обмінюватись на хлор
Утворений хлорамін є сильним окиснювачем
Слайд 10Відновлення сульфогрупи
2. Реакції заміщення сульфогрупи
Сульфогрупа зв’язана з вуглецевим атомом бензенового кільця
Реакції гідролізу
Слайд 11Реакції лужного плаву
Цим методом можна одержувати феноли, нітрили, карбонові кислоти. Реакція
Слайд 123. Реакції заміщення водню у бензеновому кільці
Як було раніше сказано, сульфогрупа
3.1.Галогенування. Бензенсульфокислота хлорується тільки в присутності каталізаторів Фріделя-Крафтса, при нагріванні.
Слайд 13Нітрування. Для введення нітрогрупи використовують концентровану нітратну кислоту або нітруючу суміш.
Сульфування.
Слайд 14АРОМАТИЧНІ НІТРОСПОЛУКИ (НІТРОАРЕНИ)
Нітроарени ― це надзвичайно важливий клас органічних сполук. Вони
Слайд 15МЕТОДИ ОДЕРЖАННЯ
1. Пряме нітрування аренів та їх похідних
1.1.Нітрування нітруючою сумішшю
Реакція нітрування являється реакцією електрофільного заміщення.
Електрофіл ― нітроній катіон (NO2+) утворюється за реакцією:
Слайд 16Далі реалізується звичайний механізм електрофільного заміщення:
Замісники І-го роду прискорюють, а ІІ-го
Слайд 171.2. Нітрування концентрованою HNO3. Концентрована нітратна кислота також є ефективним нітруючим
Причому, чим менше Н2О в реаційному середовищі, тим менше катіон сольватований і тим вища його активність. Тому, 100%-на HNO3 є дуже ефективним нітруючим реагентом.
Слайд 18Друга нітрогрупа може бути введена в м-положення у жорстіших умовах і
Третю нітрогрупу можна ввести лише за допомогою спеціальних нітруючих агентів, наприклад тетрафтороборатнітронію [NO2]+ BF4─, але і в цьому випадку вихід 1,3,5-тринітробензену не високий.
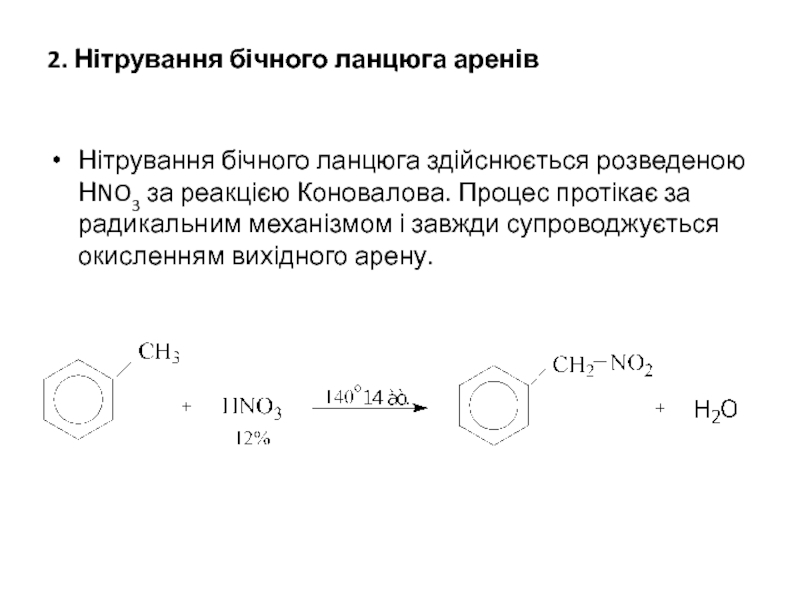
Слайд 202. Нітрування бічного ланцюга аренів
Нітрування бічного ланцюга здійснюється розведеною НNO3 за
Слайд 21ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ
Мононітроарени – рідкі або тверді речовини, мають запах
1. Реакції відновлення нітрогрупи
Відновлення NО2-групи в NH2 - це складний процес, напрямок протікання якого залежить, в основному, від рН-середовища. Вперше вказану реакцію відкрив Зінін М.М. у 1842 р.
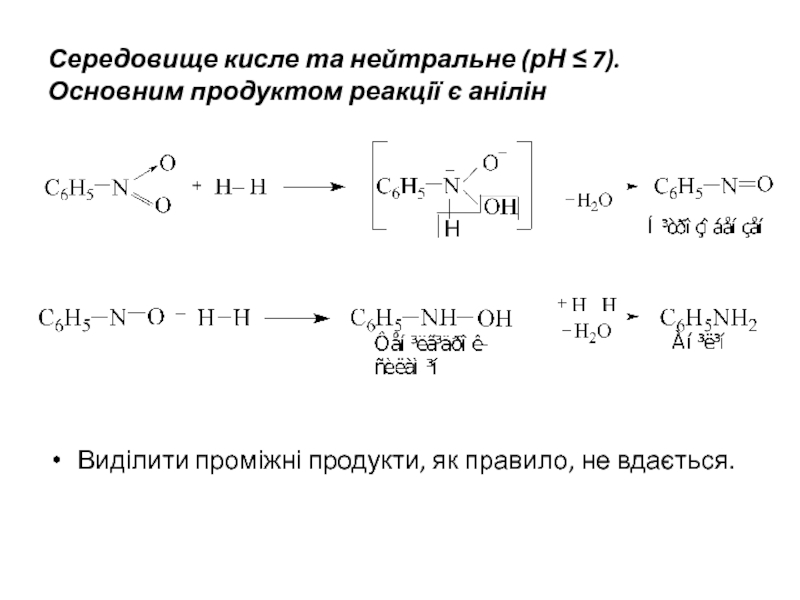
Слайд 22Середовище кисле та нейтральне (рН ≤ 7). Основним продуктом реакції є
Виділити проміжні продукти, як правило, не вдається.
Слайд 23Середовище лужне (рН > 7).
Спочатку реакція протікає за аналогією з вищенаведеною
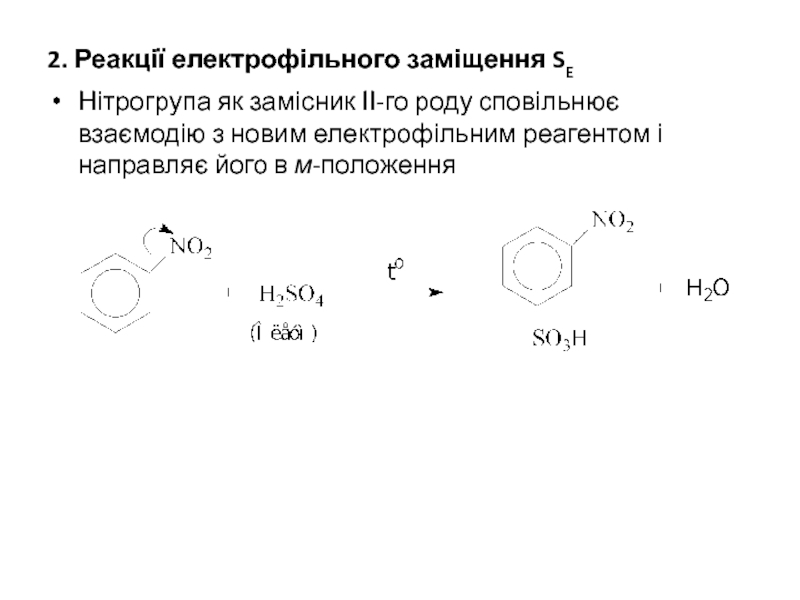
Слайд 242. Реакції електрофільного заміщення SE
Нітрогрупа як замісник ІІ-го роду сповільнює взаємодію
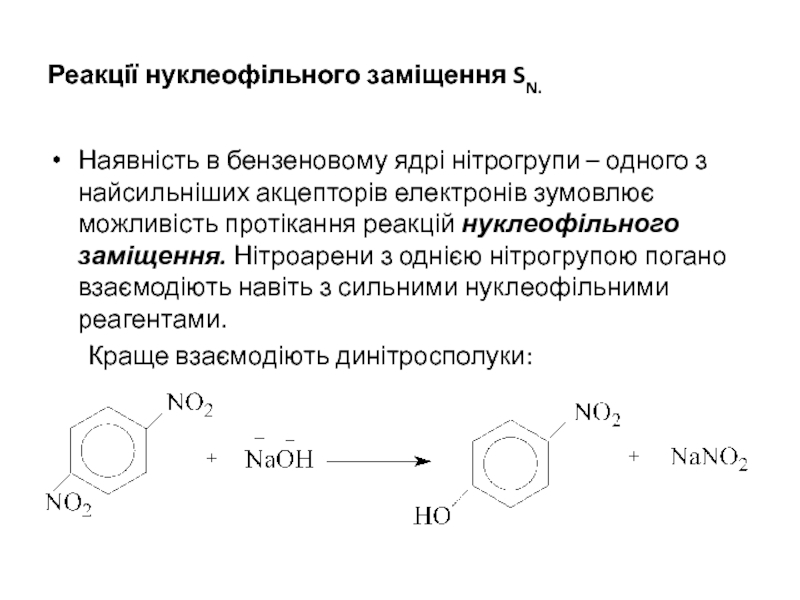
Слайд 25Реакції нуклеофільного заміщення SN.
Наявність в бензеновому ядрі нітрогрупи – одного з
Краще взаємодіють динітросполуки: