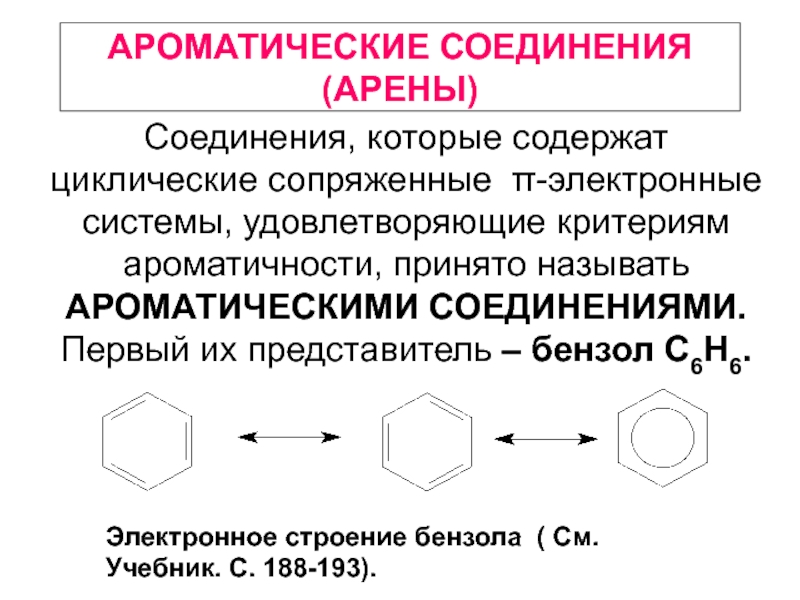
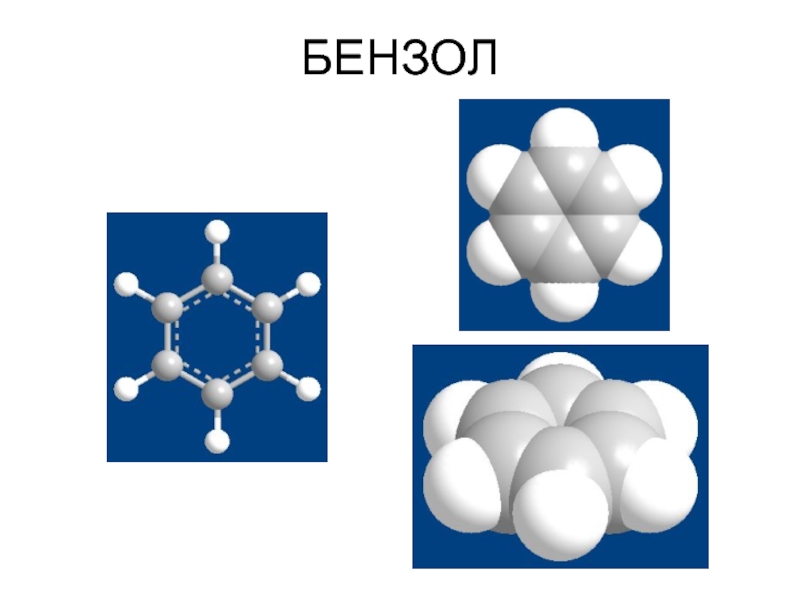
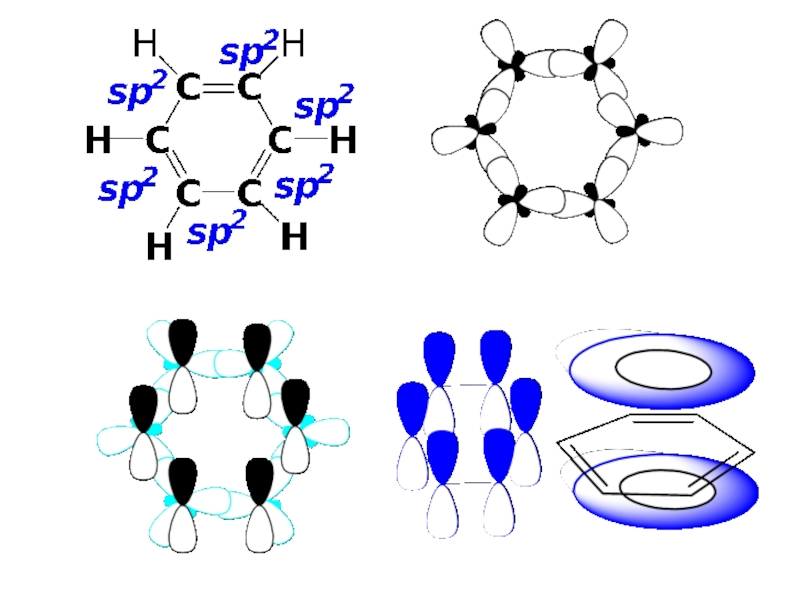
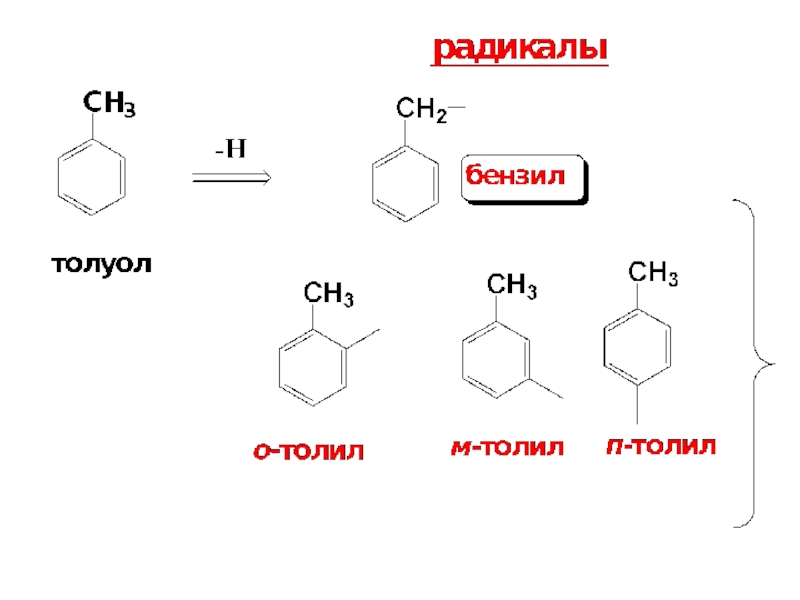
Электронное строение бензола ( См. Учебник. С. 188-193).
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ароматические соединения (арены) презентация
Содержание
- 1. Ароматические соединения (арены)
- 2. БЕНЗОЛ
- 4. Ароматичность как особое химическое качество характерно не
- 5. Соединения, содержащие 4n π-электронов в такой сопряженной
- 6. Ароматические:
- 7. Антиароматические:
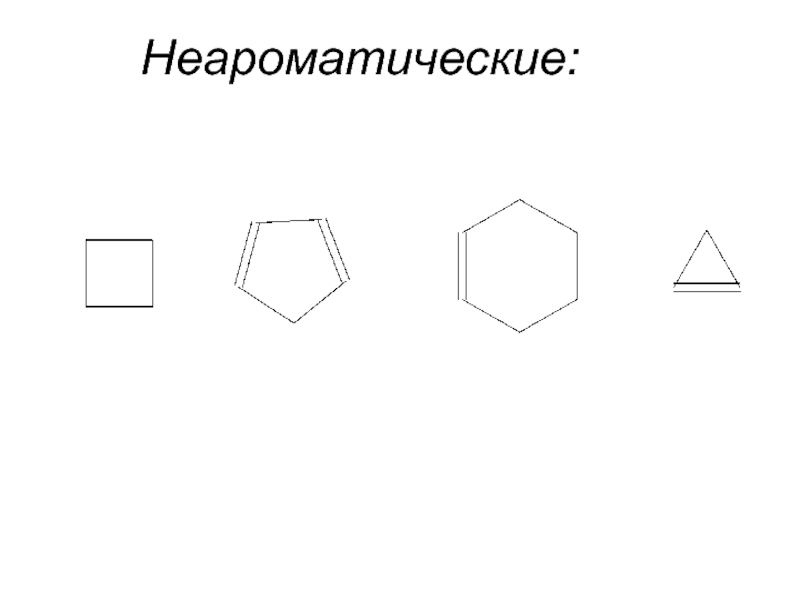
- 8. Неароматические:
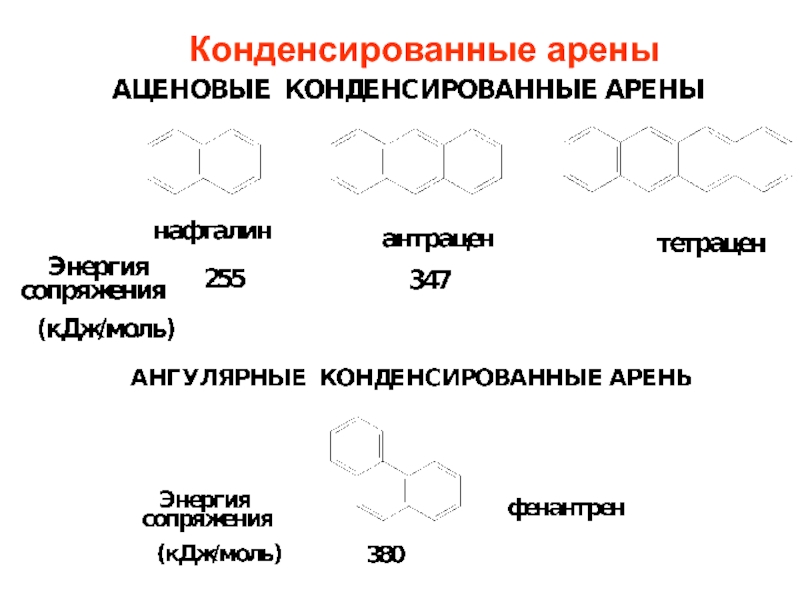
- 9. Конденсированные арены
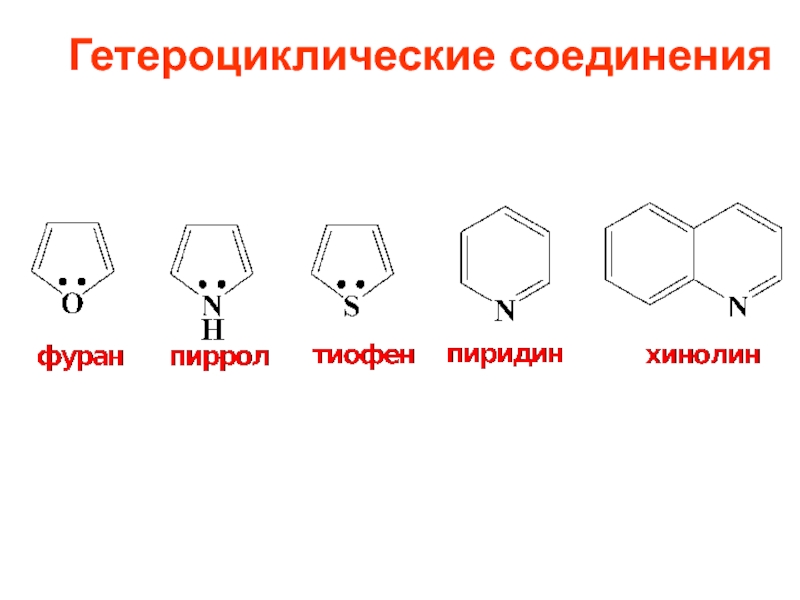
- 10. Гетероциклические соединения
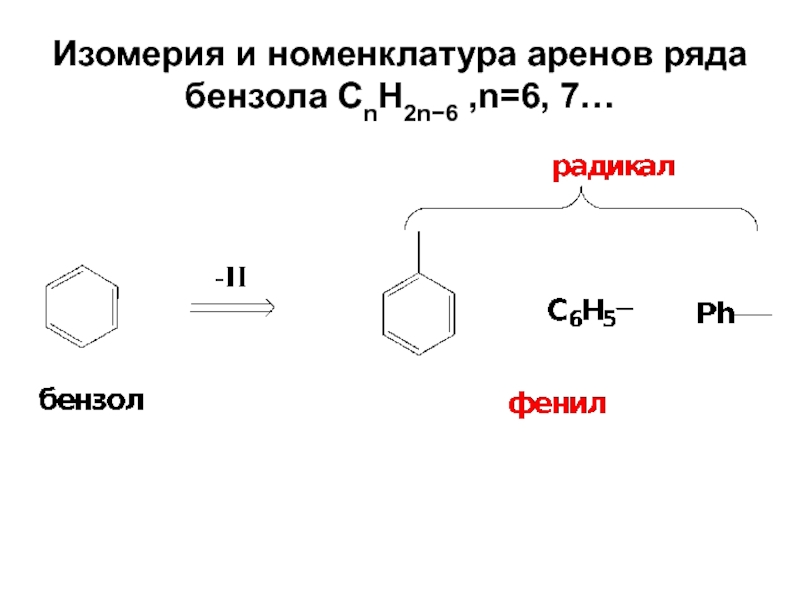
- 11. Изомерия и номенклатура аренов ряда бензола СnH2n−6 ,n=6, 7…
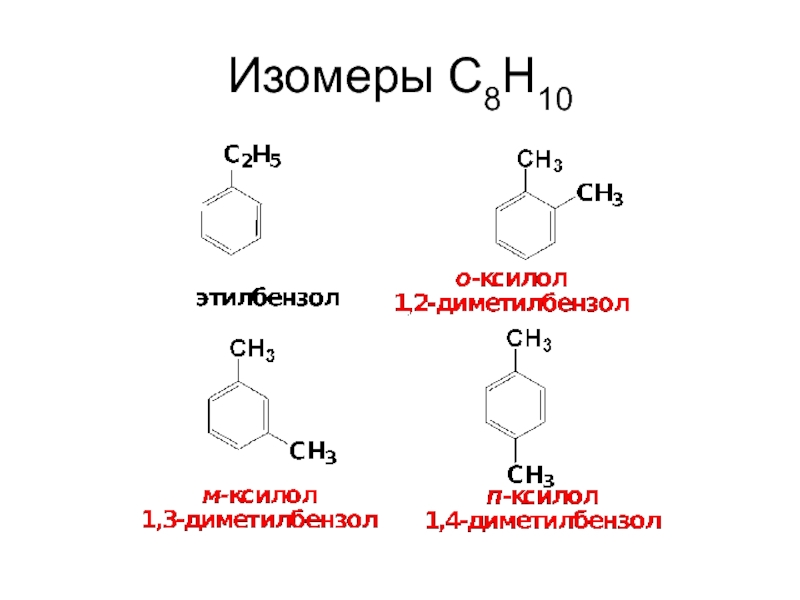
- 13. Изомеры С8Н10
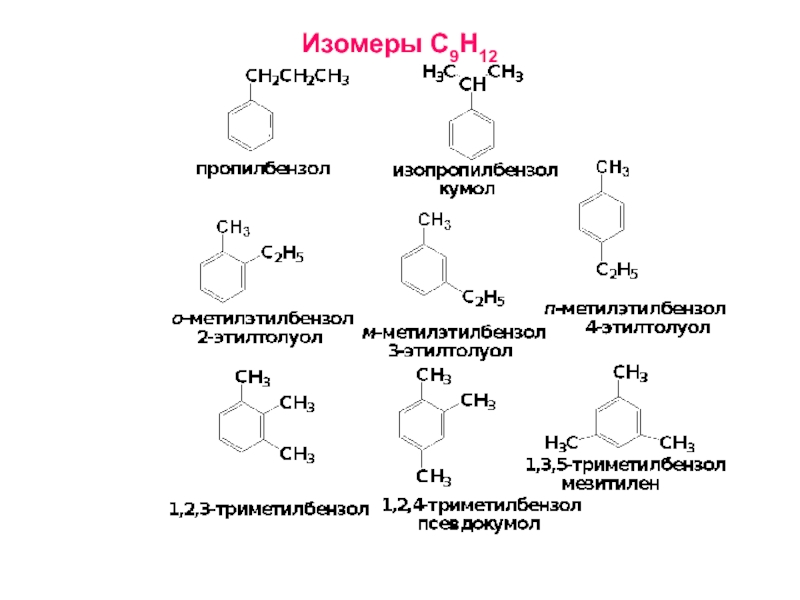
- 14. Изомеры С9Н12
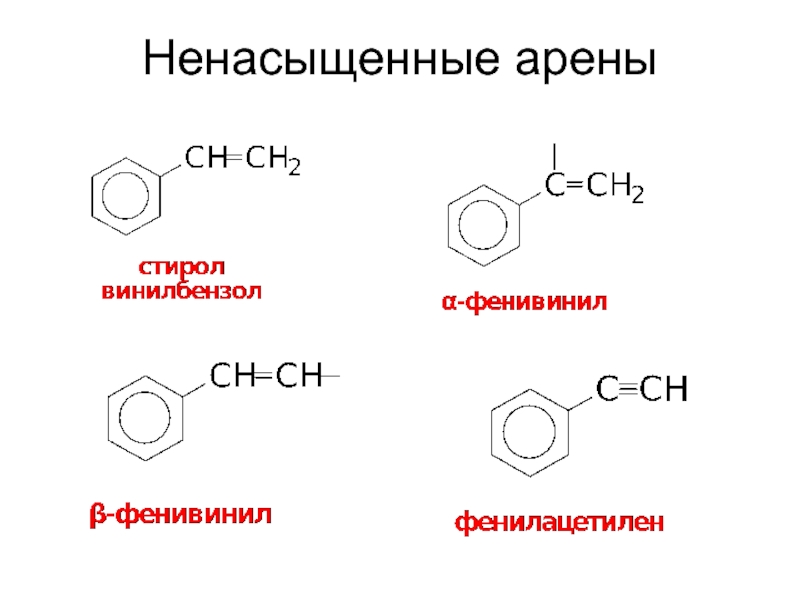
- 15. Ненасыщенные арены
- 16. СПОСОБЫ ПОЛУЧЕНИЯ Ряд промышленных способов основан на
- 17. 1. Ароматизация нефти Нефть состоит в основном
- 18. Гидродезметилирование : Потребность в бензоле больше, чем
- 19. 2. Получение алкилбензолов 2.1. Алкилирование по Фриделю-Крафтсу:
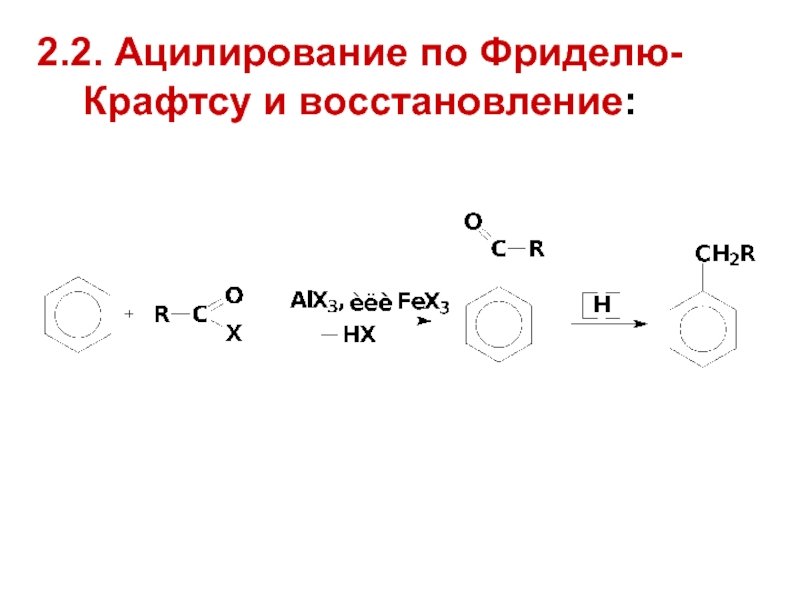
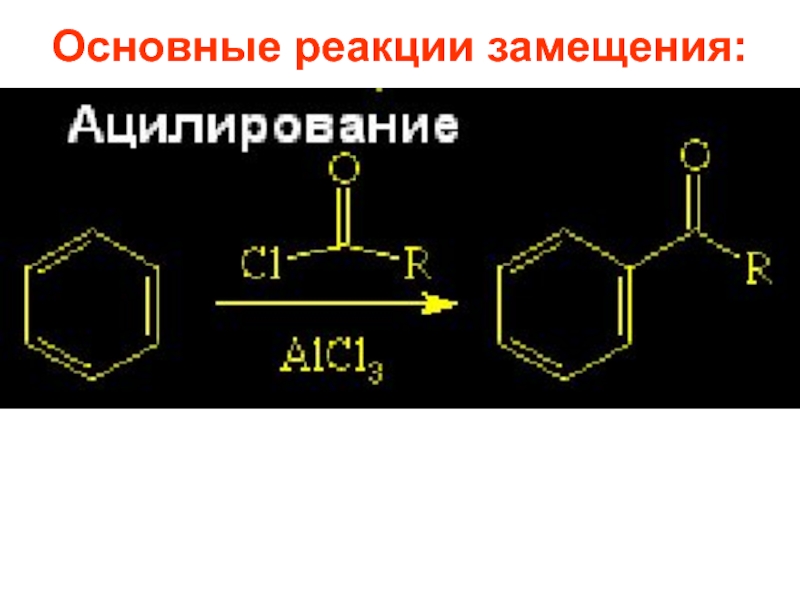
- 21. 2.2. Ацилирование по Фриделю-Крафтсу и восстановление:
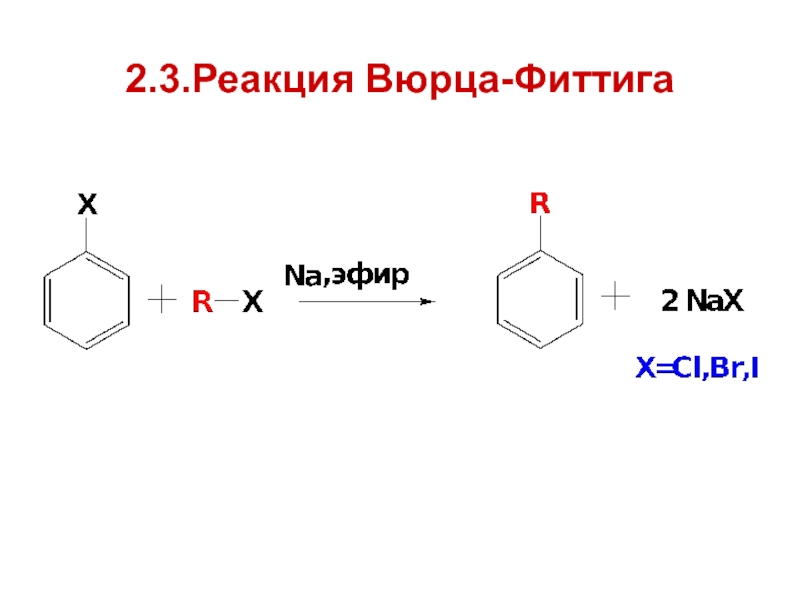
- 22. 2.3.Реакция Вюрца-Фиттига
- 23. 2.4.Реакция Ульмана
- 24. ХИМИЧЕСКИЕ СВОЙСТВА Для аренов характерны: Реакции
- 25. Несмотря на высокую степень ненасыщенности аренов, для
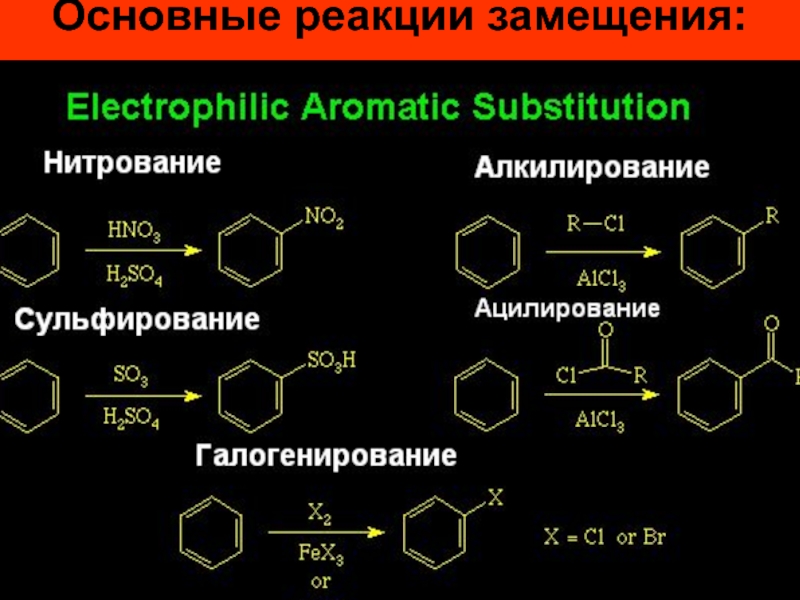
- 26. Основные реакции замещения:
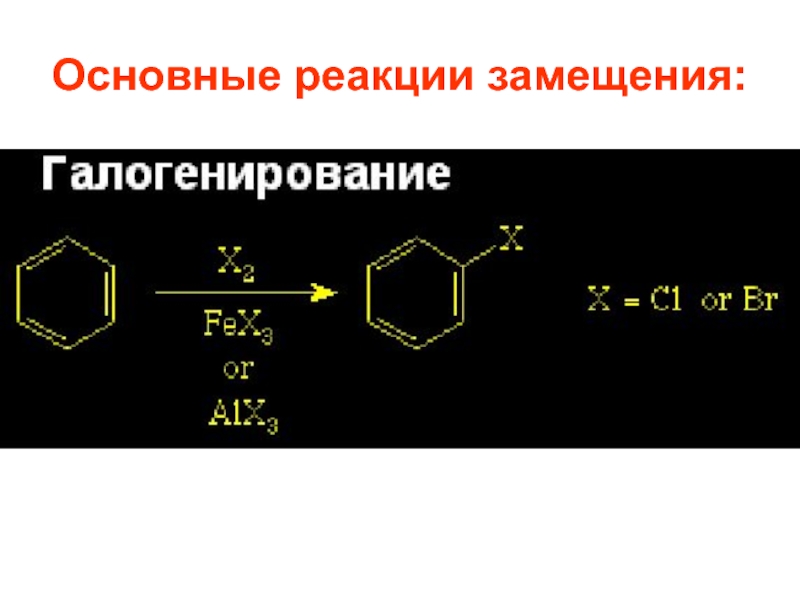
- 27. Реакции галогенирования, нитрования и сульфирования осуществляются почти
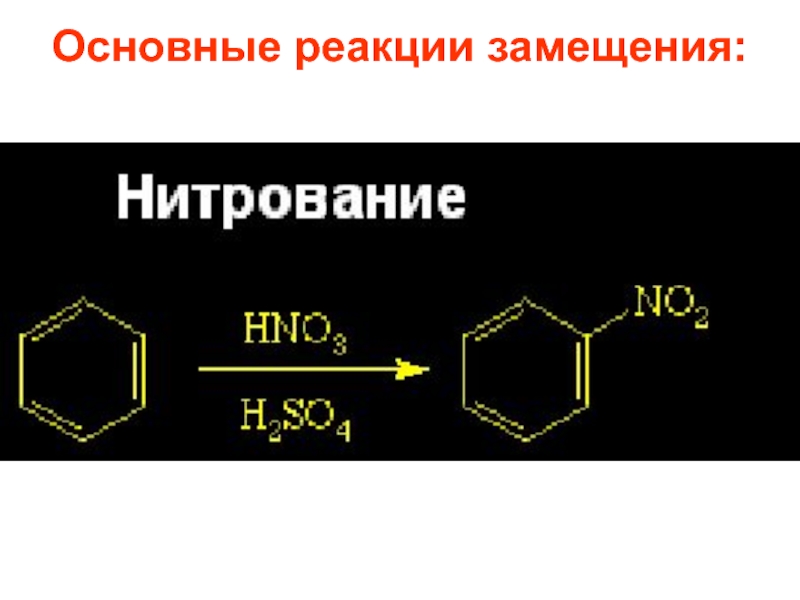
- 28. Основные реакции замещения:
- 29. Основные реакции замещения:
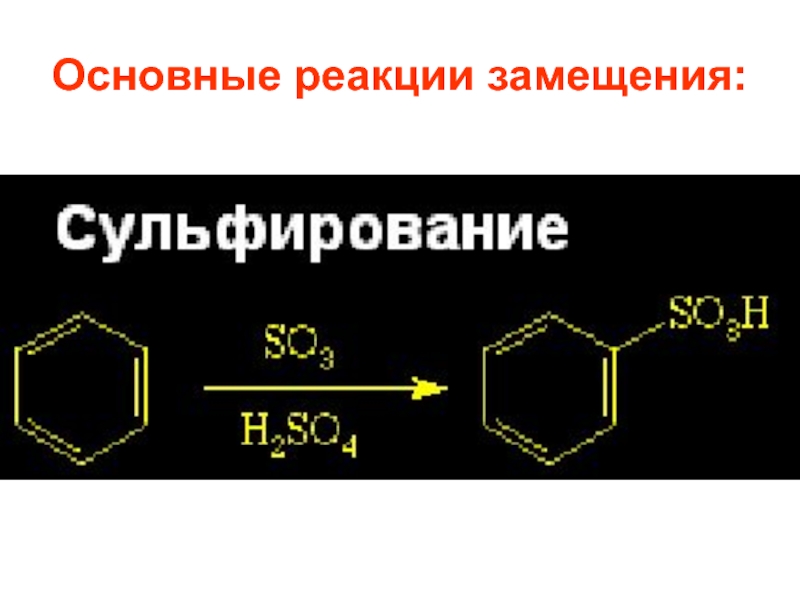
- 30. Основные реакции замещения:
- 31. Основные реакции замещения:
- 32. Основные реакции замещения:
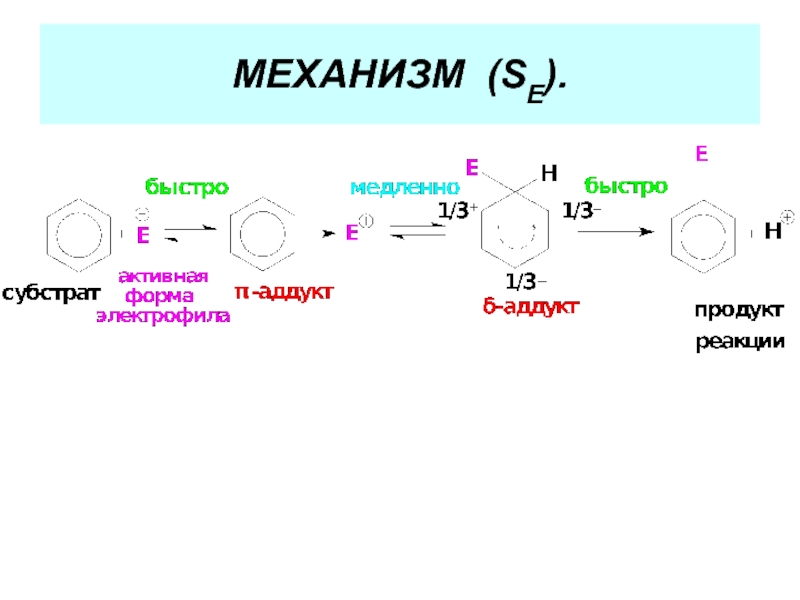
- 33. МЕХАНИЗМ РЕАКЦИЙ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ (SЕ). ( См.
- 34. МЕХАНИЗМ (SЕ).
- 35. ЗАМЕСТИТЕЛИ БЕНЗОЛЬНОГО КОЛЬЦА И ИХ ВЛИЯНИЕ НА
- 37. При рассмотрении таких реакций надо решать два
- 38. Правила ориентации в монозамещенных аренах По
- 39. Ориентирующее влияние заместителей обусловлено их электронными эффектами
- 40. Статический фактор отражает распределение электронной плотности в
- 41. Динамический фактор, то есть стабилизирующее или дестабилизирующее
- 42. Граничные структуры σ-аддукта, вносящие вклад в его
- 43. В анизоле интермедиаты, образующиеся при атаке в орто- и пара –положения стабилизированы больше
- 44. Электроноакцепторные заместители дестабилизируют все три возможных σ-аддукта,но
- 45. По влиянию статических и динамических факторов на
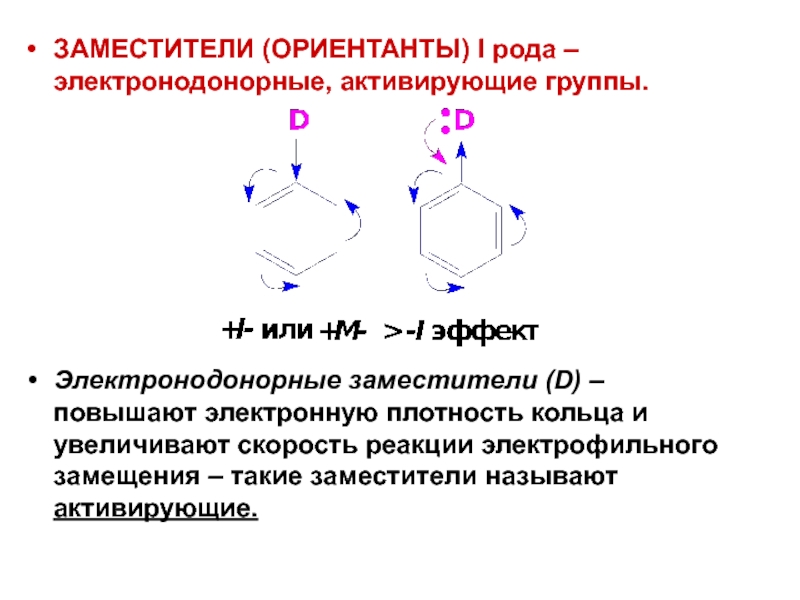
- 46. ЗАМЕСТИТЕЛИ (ОРИЕНТАНТЫ) I рода – электронодонорные, активирующие
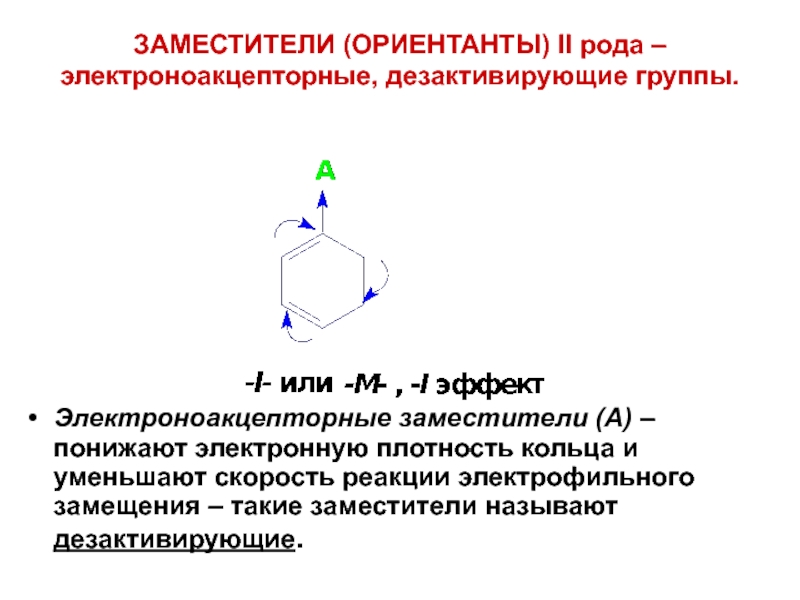
- 47. ЗАМЕСТИТЕЛИ (ОРИЕНТАНТЫ) II рода – электроноакцепторные, дезактивирующие
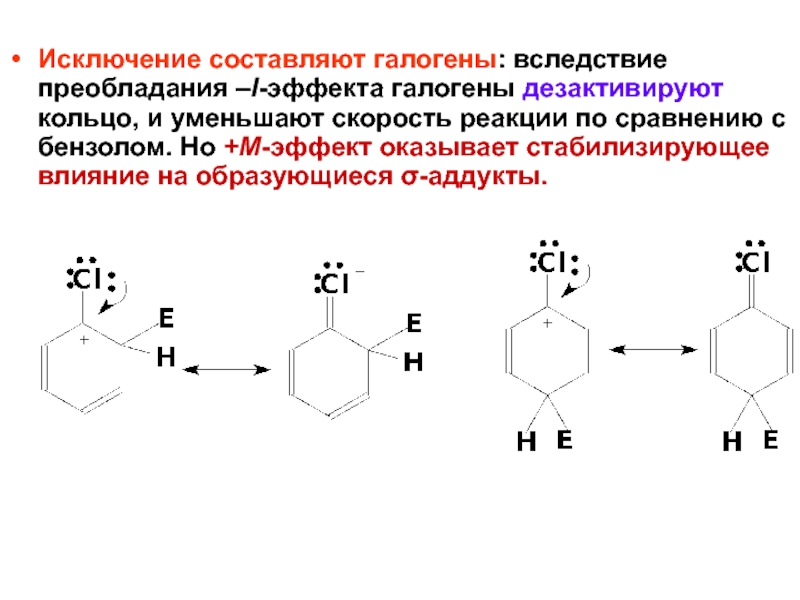
- 48. Исключение составляют галогены: вследствие преобладания –I-эффекта галогены
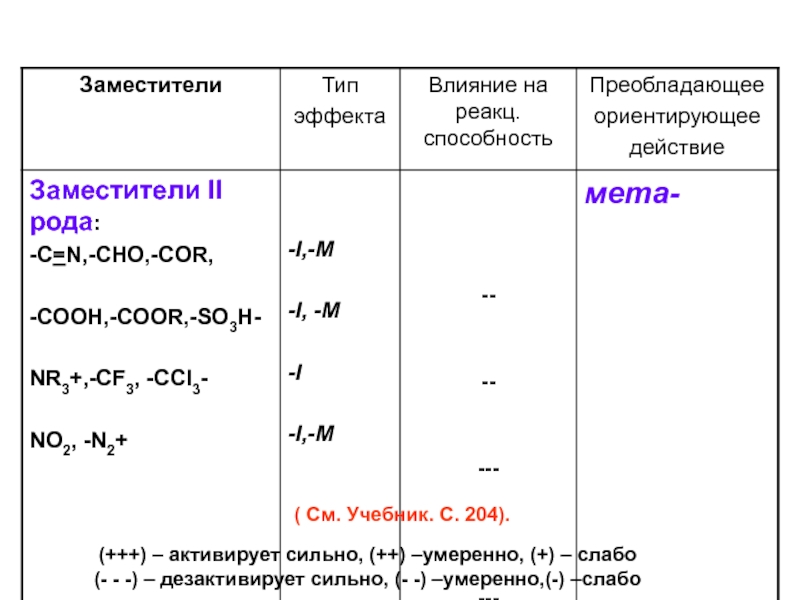
- 49. ВЛИЯНИЕ ЗАМЕСТИТЕЛЕЙ В БЕНЗОЛЬНОМ ЯДРЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ И ОРИЕНТАЦИЮ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ
- 50. (+++) – активирует сильно, (++) –умеренно, (+)
- 51. Правила ориентации позволяют предсказать преимущественное направление реакции
- 52. Правила ориентации в дизамещенных аренах В
- 53. В случае несогласованной ориентации ориентирующее влияние одного
- 54. В этих случаях можно предсказать основное направление
- 55. – при наличии активирующей и дезактивирующей групп,
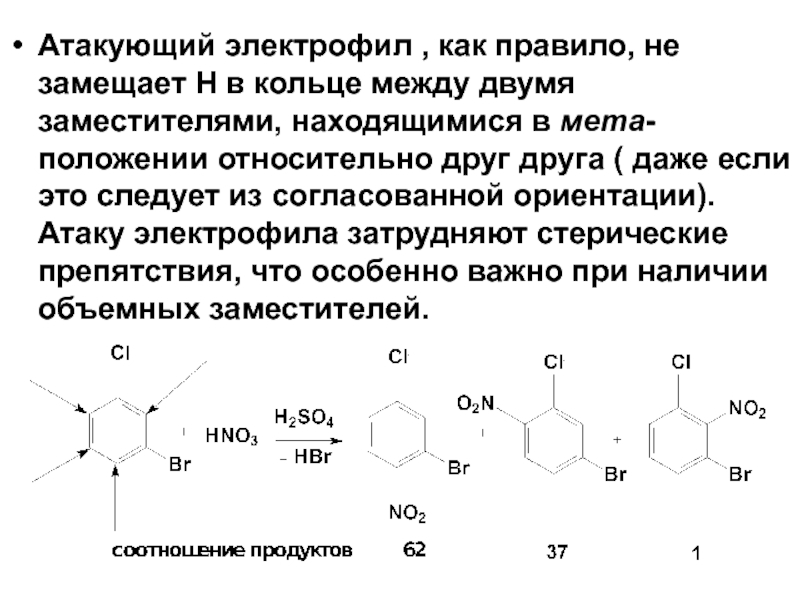
- 56. Атакующий электрофил , как правило, не замещает
- 57. Важнейшие реакции SE 1.1. Галогенирование. Бензол реагирует
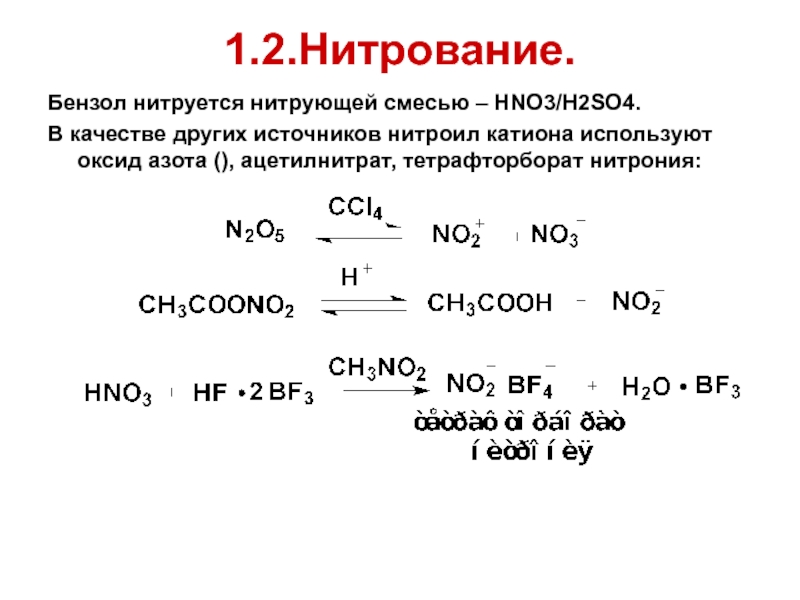
- 58. 1.2.Нитрование. Бензол нитруется нитрующей смесью – HNO3/H2SO4.
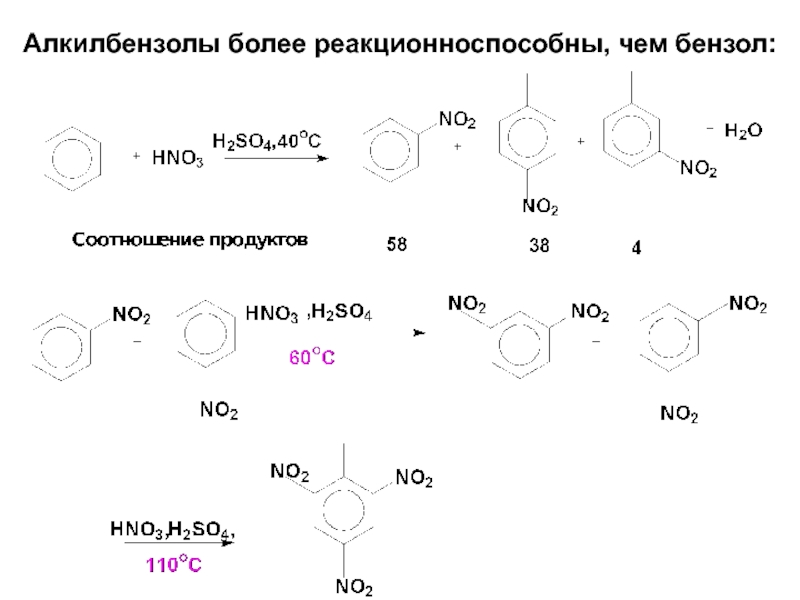
- 59. Алкилбензолы более реакционноспособны, чем бензол:
- 60. 1.3. Сульфирование Сульфирующие агенты –конц. серная кислота и олеум с различным содержанием серы (VI).
- 61. Каждая стадия сульфирования обратима и в целом
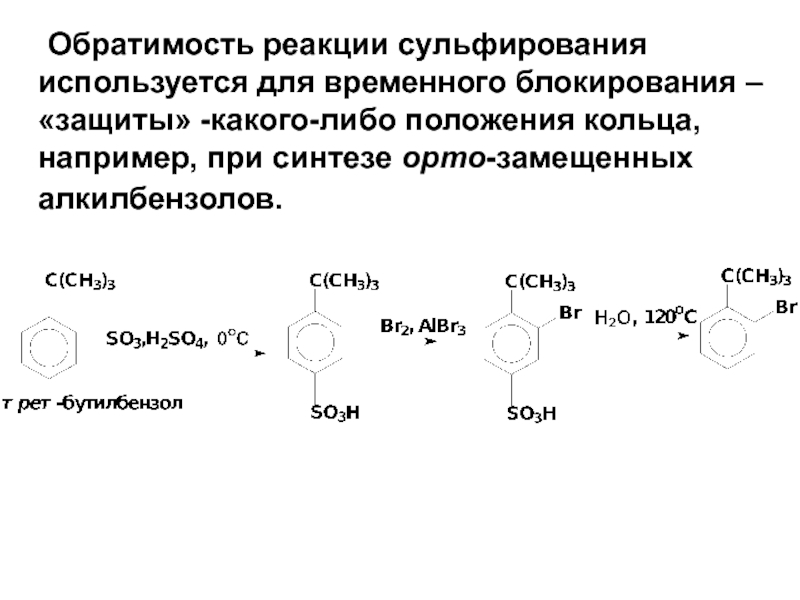
- 62. Обратимость реакции сульфирования используется для временного блокирования
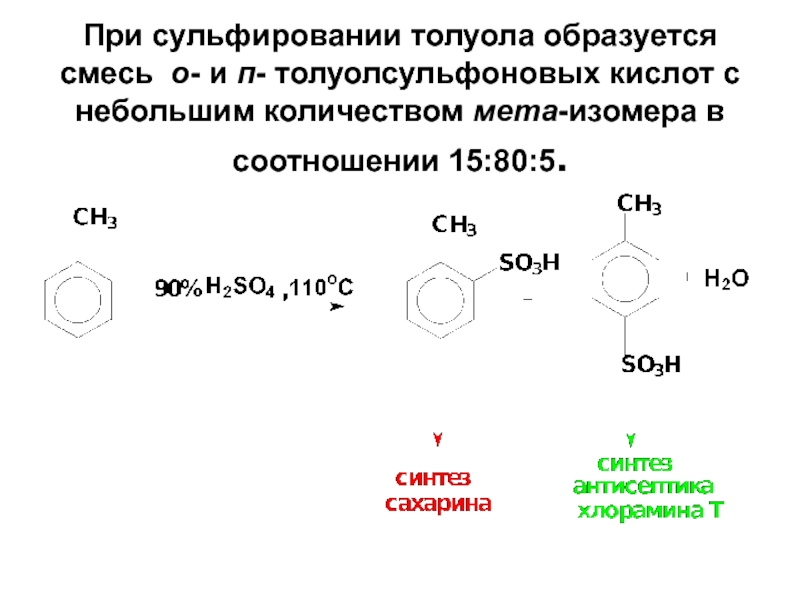
- 63. При сульфировании толуола образуется смесь о- и
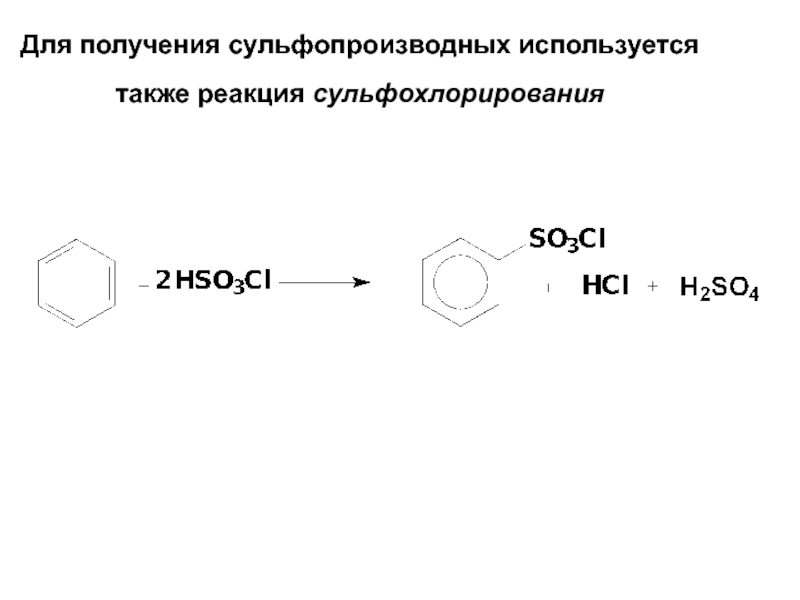
- 64. Для получения сульфопроизводных используется также реакция сульфохлорирования
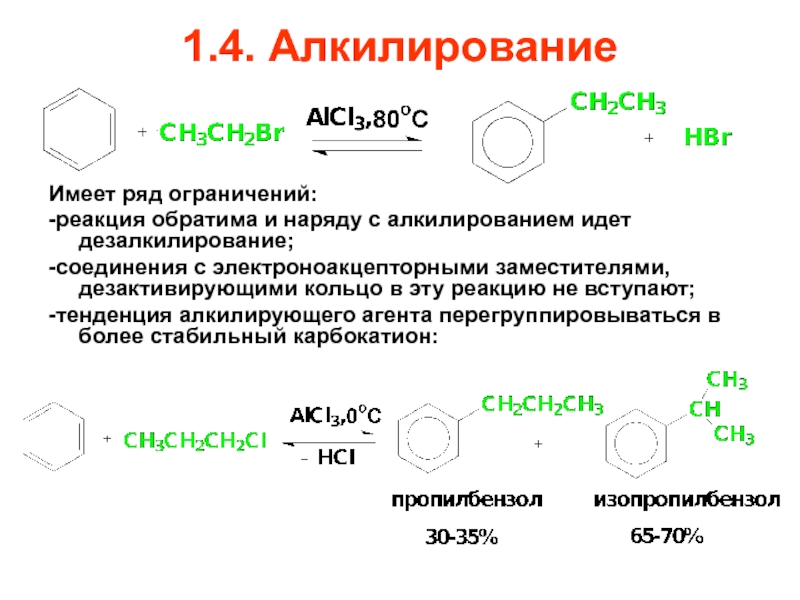
- 65. 1.4. Алкилирование Имеет ряд ограничений: -реакция обратима
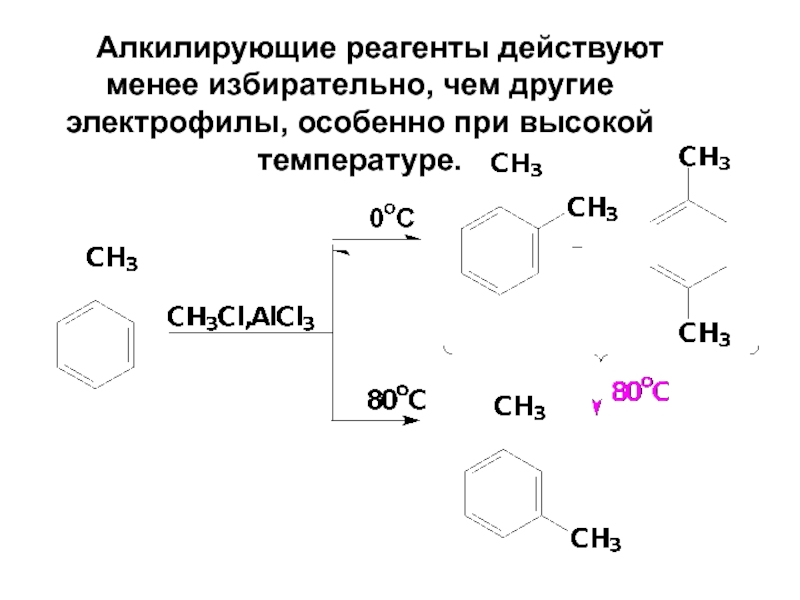
- 66. Алкилирующие реагенты действуют менее избирательно, чем другие электрофилы, особенно при высокой температуре.
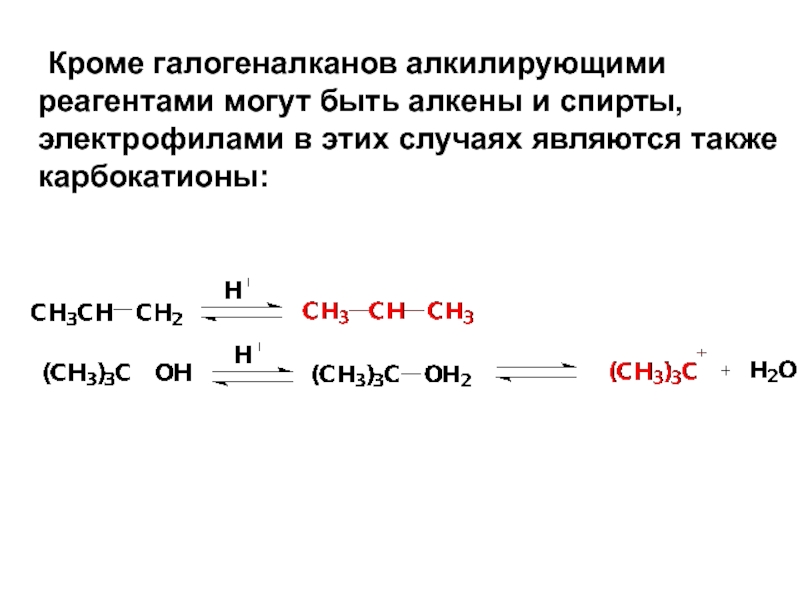
- 67. Кроме галогеналканов алкилирующими реагентами могут быть алкены
- 68. 1.5. Ацилирование Ацилирование – метод синтеза ароматических
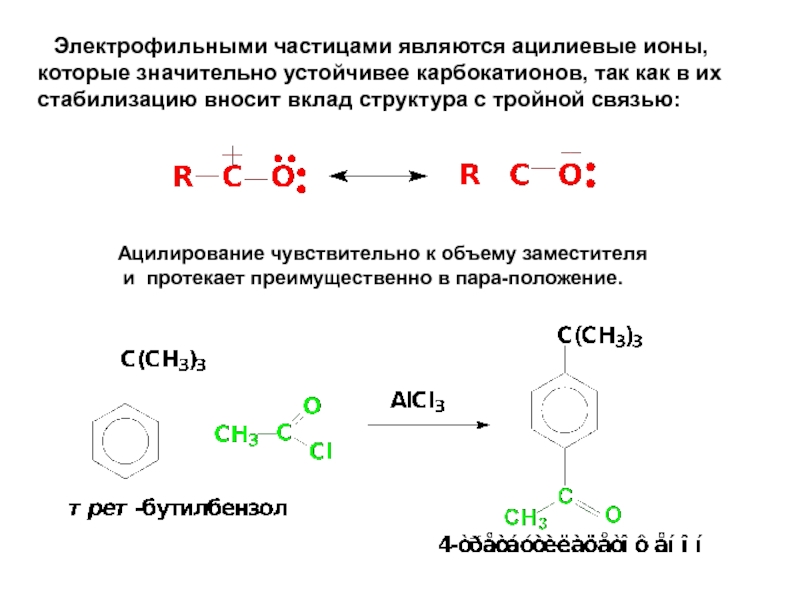
- 69. Электрофильными частицами являются ацилиевые ионы, которые
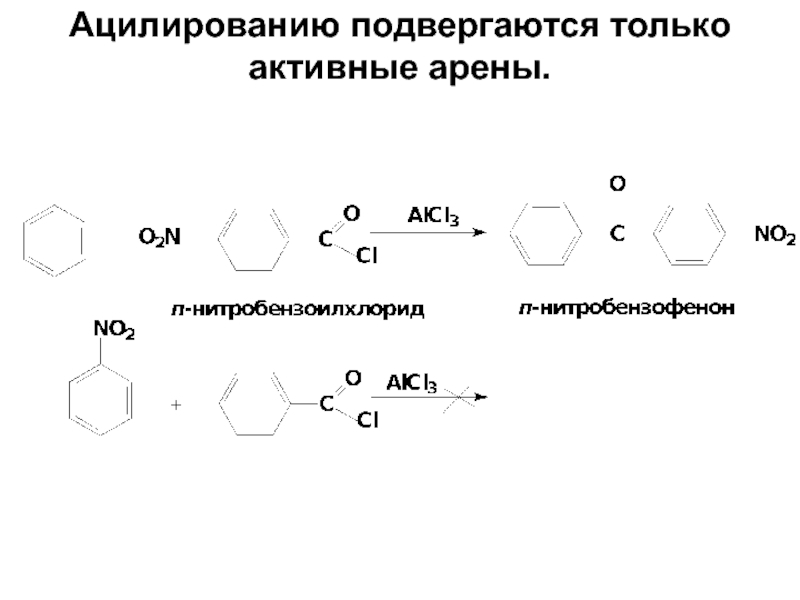
- 70. Ацилированию подвергаются только активные арены.
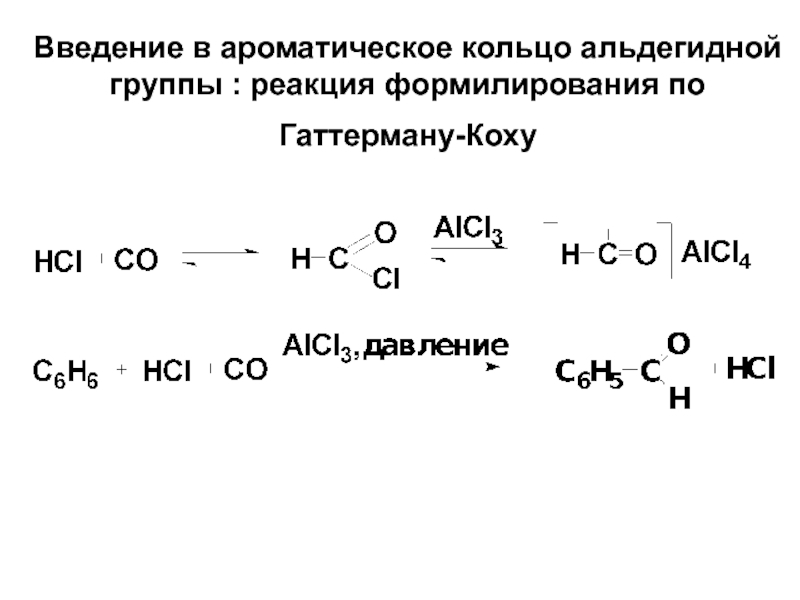
- 71. Введение в ароматическое кольцо альдегидной группы : реакция формилирования по Гаттерману-Коху
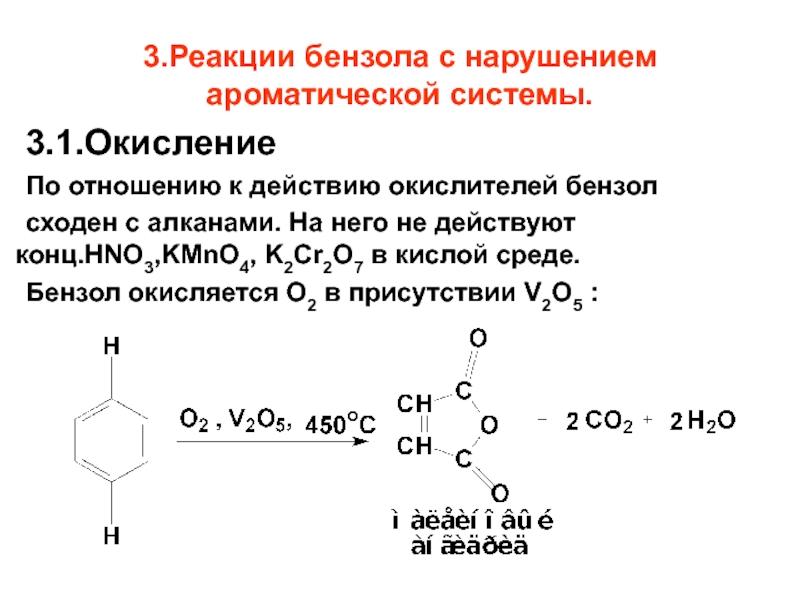
- 72. 3.Реакции бензола с нарушением ароматической системы. 3.1.Окисление
- 73. 3.2.Присоединение: а) гидрирование
- 74. б) Присоединение хлора Гексахлоран использовался
- 75. 3.3.Реакции боковых цепей в алкилбензолах. а) Галогенирования
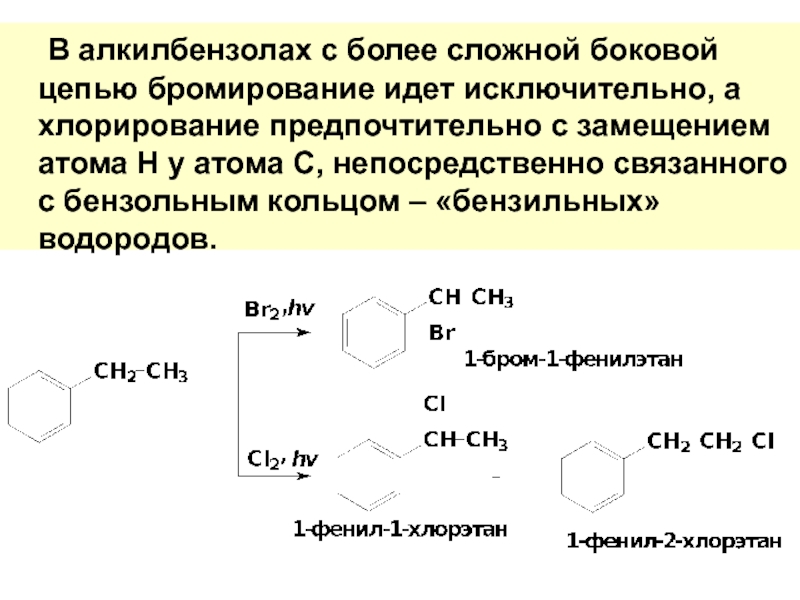
- 76. В алкилбензолах с более сложной боковой цепью
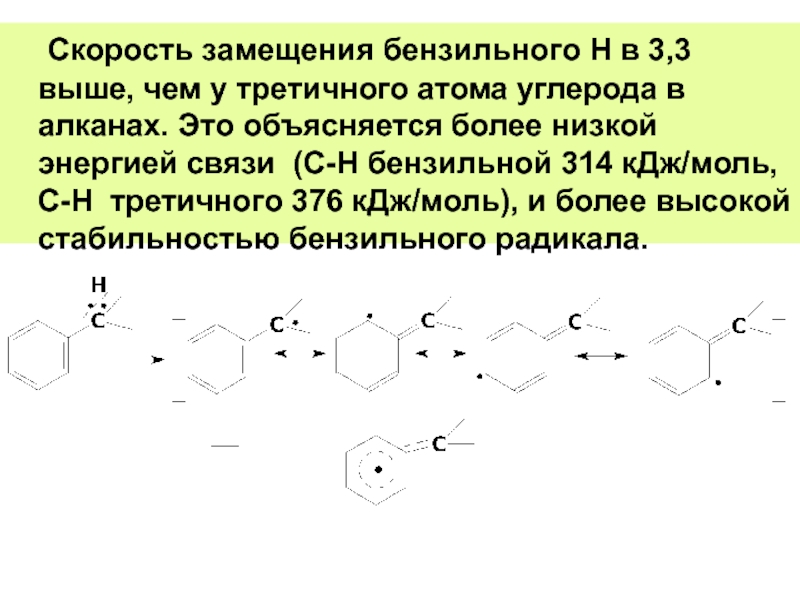
- 77. Скорость замещения бензильного Н в 3,3
- 78. Нитрование по Коновалову (Учебник. Стр. 216.).
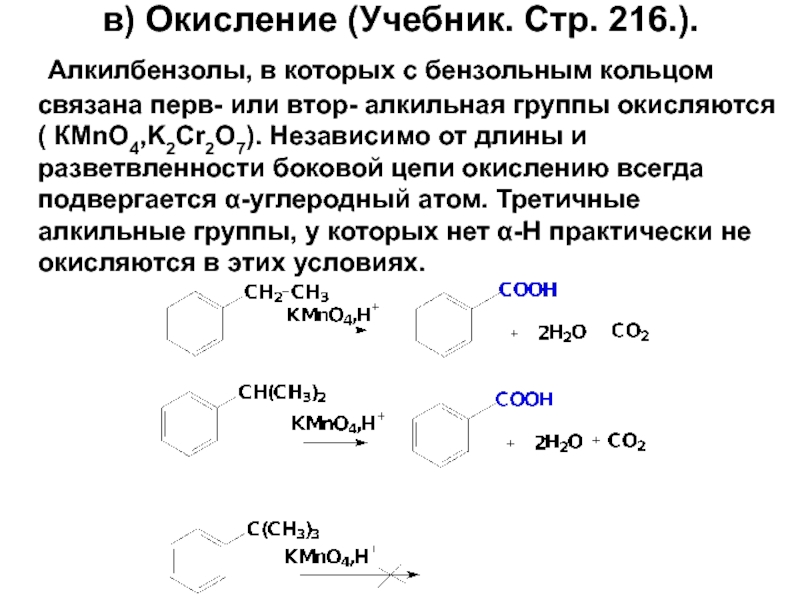
- 79. в) Окисление (Учебник. Стр. 216.). Алкилбензолы, в
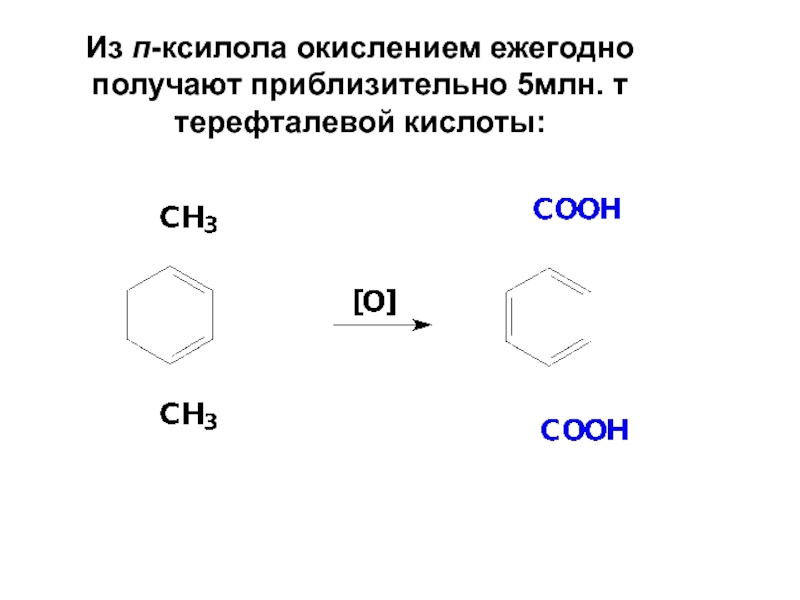
- 80. Из п-ксилола окислением ежегодно получают приблизительно 5млн. т терефталевой кислоты:
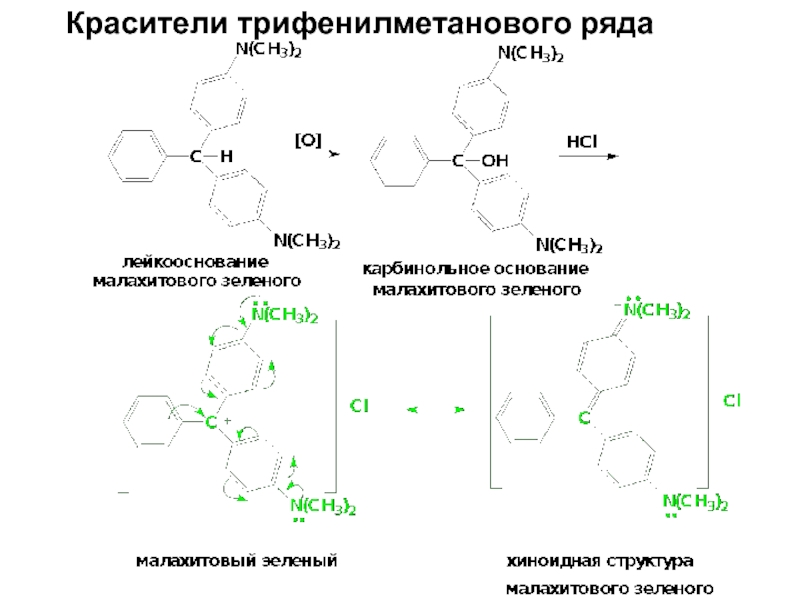
- 81. Красители трифенилметанового ряда
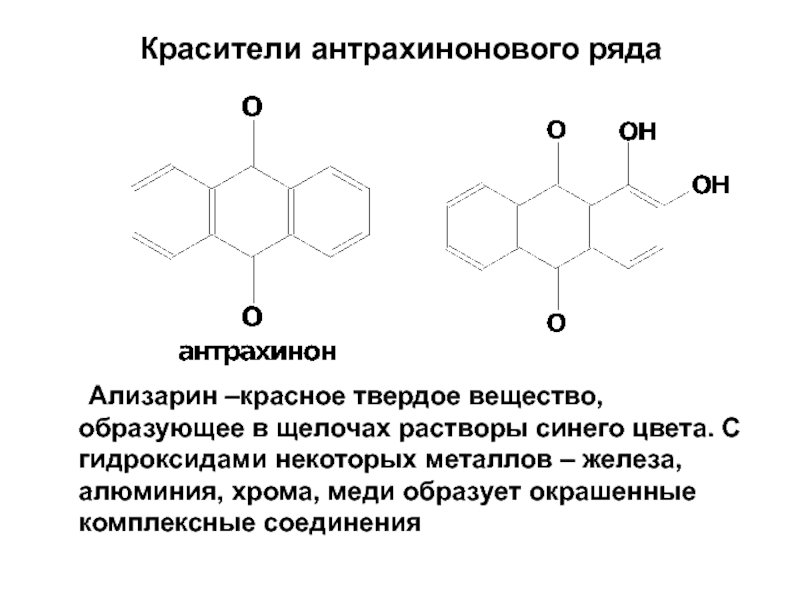
- 82. Красители антрахинонового ряда Ализарин –красное твердое вещество,
Слайд 1АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ (АРЕНЫ)
Соединения, которые содержат циклические сопряженные π-электронные системы, удовлетворяющие критериям
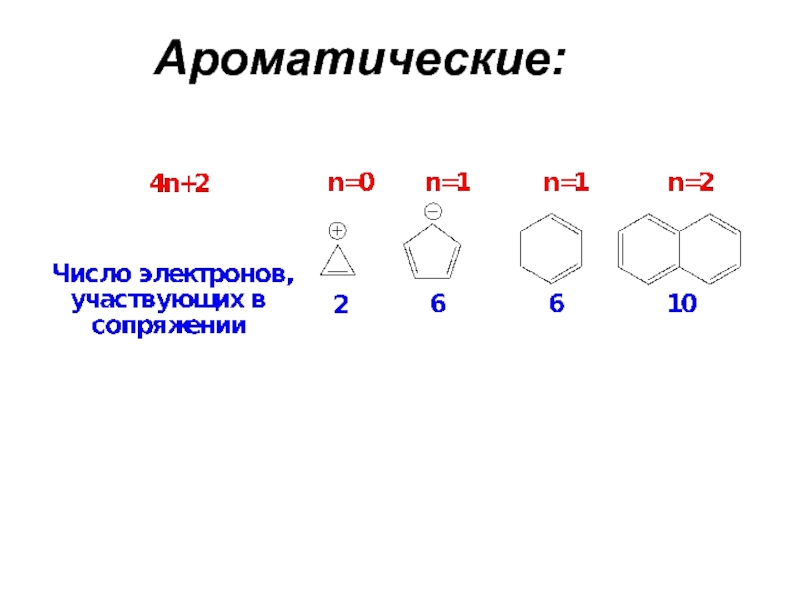
Слайд 4Ароматичность как особое химическое качество характерно не только для бензола. Существуют
Плоские моноциклические соединения, содержащие замкнутую сопряженную систему (4n+2) π-электронов , где n = 0,1,2,3...(т.е. соединения содержащие 2, 6, 10, 14… π-электронов в цикле), являются ароматическими.
Слайд 5Соединения, содержащие 4n π-электронов в такой сопряженной системе , являются антиароматическими.
Соединения, в которых отсутствует система сопряженных двойных связей, называют неароматической.
Слайд 16СПОСОБЫ ПОЛУЧЕНИЯ
Ряд промышленных способов основан на переработке угля и нефти.
Из 1
Продукт Количество(кг) Каменноугольной смолы 55
бензола 0,9
нафталина 2,3
толуола 0,2
ксилолов 0,045
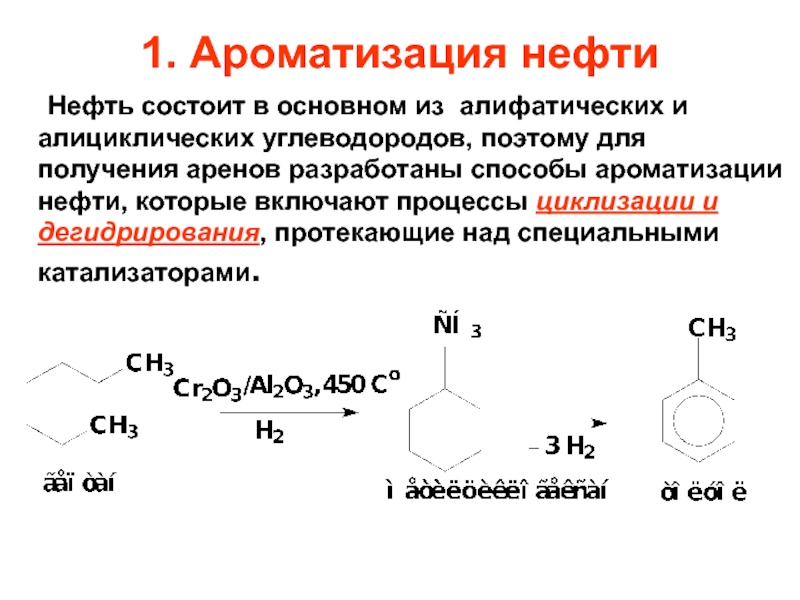
Слайд 171. Ароматизация нефти
Нефть состоит в основном из алифатических и алициклических углеводородов,
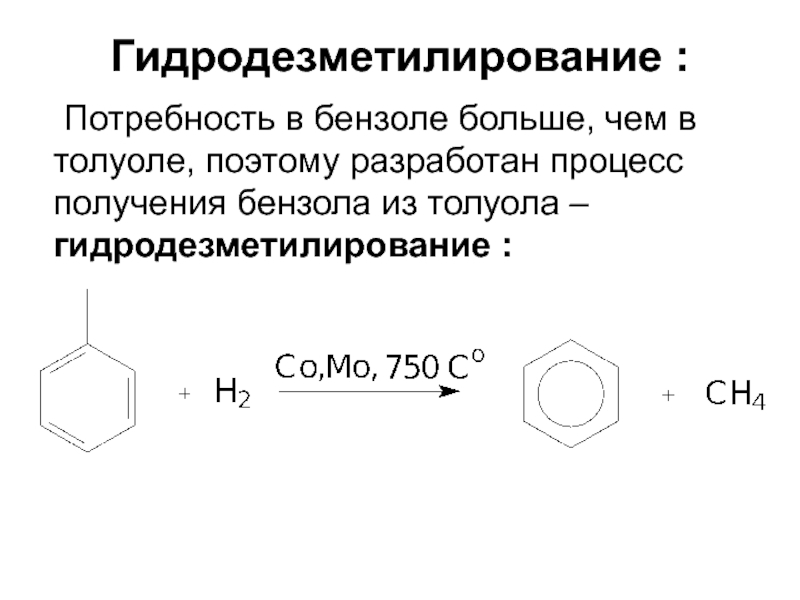
Слайд 18Гидродезметилирование :
Потребность в бензоле больше, чем в толуоле, поэтому разработан процесс
Слайд 24ХИМИЧЕСКИЕ СВОЙСТВА
Для аренов характерны:
Реакции электрофильного замещения (SЕ).
Реакции бензола с нарушением
Реакции боковых цепей в алкилбензолах.
Слайд 25Несмотря на высокую степень ненасыщенности аренов, для них не характерны реакции
Ненасыщенный характер бензола не выявляется с помощью обесцвечивания бромной воды или реакцией Вагнера. Наличие высокой энергии сопряжения ароматической системы кольца обуславливает его устойчивость, поэтому арены вступают предпочтительно в реакции с сохранением ароматичности, т. е. реакции замещения.
Слайд 27Реакции галогенирования, нитрования и сульфирования осуществляются почти со всеми ароматическими соединениями,
Слайд 33МЕХАНИЗМ РЕАКЦИЙ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ (SЕ).
( См. Учебник. С. 195-199).
Стадии реакции:
1. Активация
2. Стадия электрофильной атаки:
а) образование π-аддукта;
б) образование σ-аддукта.
3. Стадия отщепления протона.
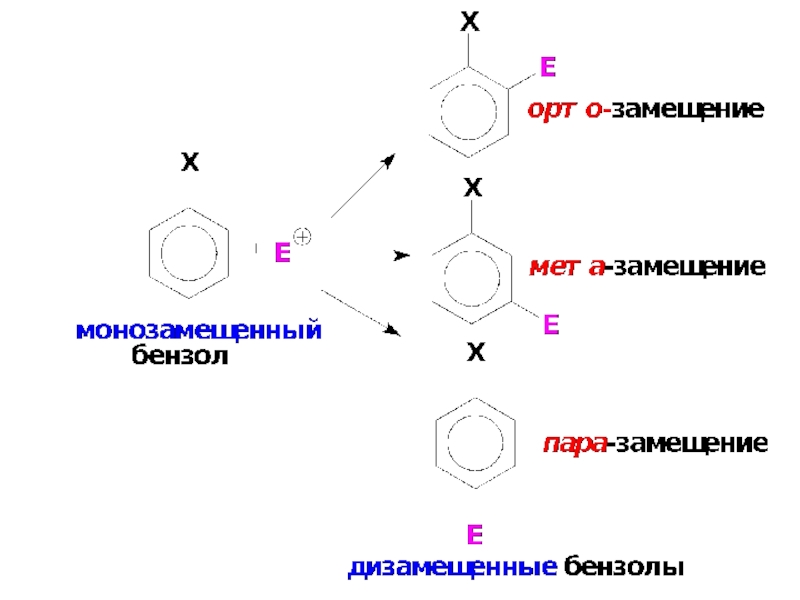
Слайд 35ЗАМЕСТИТЕЛИ БЕНЗОЛЬНОГО КОЛЬЦА И ИХ ВЛИЯНИЕ НА СКОРОСТЬ И НАПРАВЛЕНИЕ SE (
Заместители в бензольном кольце нарушают равномерность распределения π-электронного облака и оказывают влияние на его реакционную способность.
Если бензольное кольцо содержит заместитель Х, то положения, остающиеся свободными, неравноценны. В общем случае замещение Н в монозамещенных бензолах может протекать в трёх направлениях:
Слайд 37При рассмотрении таких реакций надо решать два важных вопроса:
Какие изомеры преимущественно
В каком случае выше скорость реакции: в бензоле С6Н6 или в замещенном бензоле С6Н5Х, то есть какова относительная реакционная способность?
Слайд 38Правила ориентации в монозамещенных аренах
По влиянию на ориентацию в SE
Слайд 39Ориентирующее влияние заместителей обусловлено их электронными эффектами (статический фактор) и стабильностью
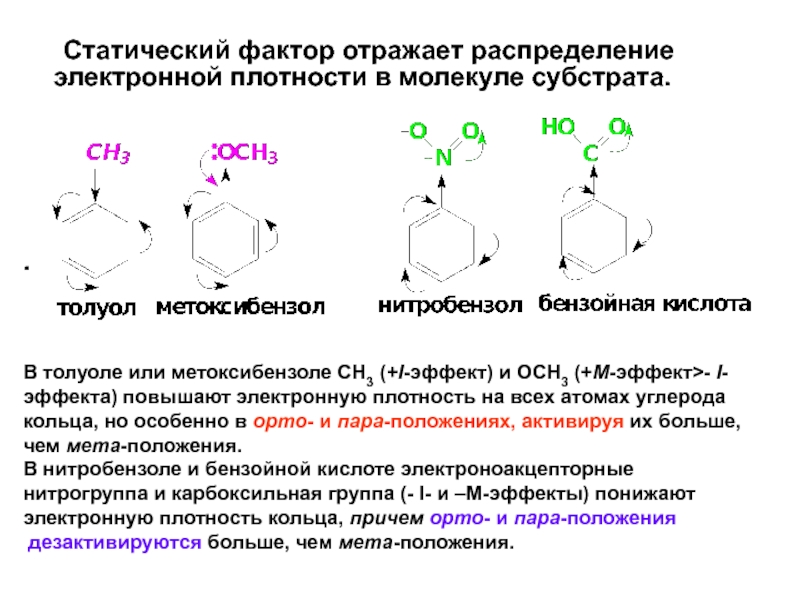
Слайд 40 Статический фактор отражает распределение электронной плотности в молекуле субстрата.
.
В
В нитробензоле и бензойной кислоте электроноакцепторные
нитрогруппа и карбоксильная группа (- I- и –М-эффекты) понижают
электронную плотность кольца, причем орто- и пара-положения
дезактивируются больше, чем мета-положения.
Слайд 41 Динамический фактор, то есть стабилизирующее или дестабилизирующее влияние заместителя на образующиеся
Слайд 42Граничные структуры σ-аддукта, вносящие вклад в его стабилизацию на примере толуола:
В структурах (1а) и (IIIб) + заряд заметно
компенсируется
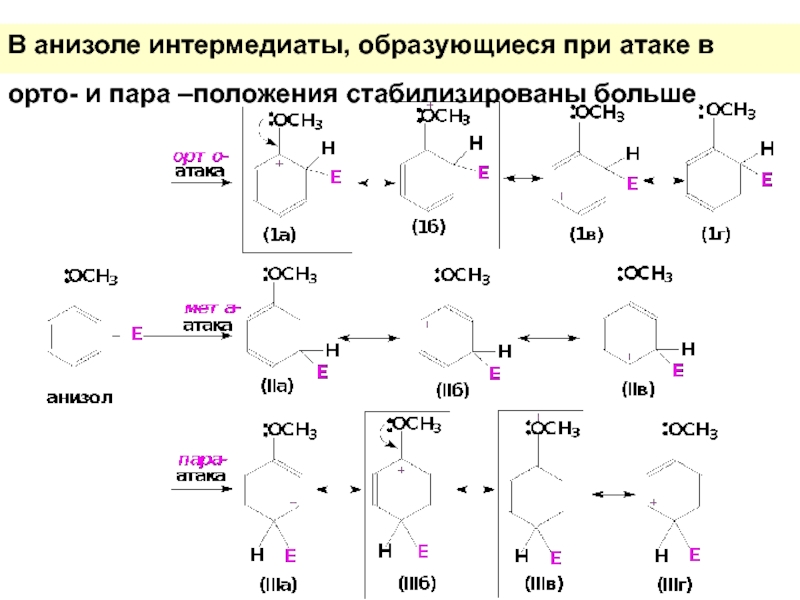
Слайд 43В анизоле интермедиаты, образующиеся при атаке в орто- и пара –положения
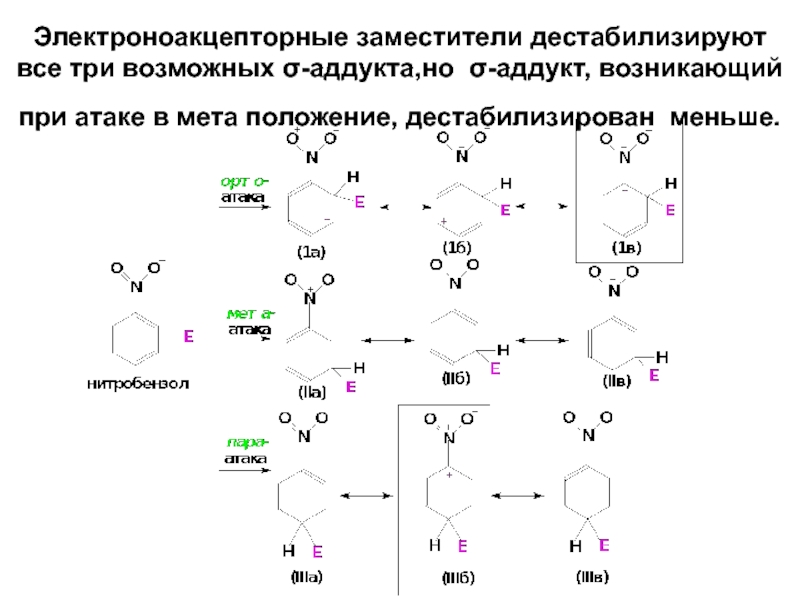
Слайд 44Электроноакцепторные заместители дестабилизируют все три возможных σ-аддукта,но σ-аддукт, возникающий при атаке
Слайд 45По влиянию статических и динамических факторов на реакционную способность и ориентацию
Слайд 46ЗАМЕСТИТЕЛИ (ОРИЕНТАНТЫ) I рода – электронодонорные, активирующие группы.
Электронодонорные заместители (D) –
Слайд 47ЗАМЕСТИТЕЛИ (ОРИЕНТАНТЫ) II рода – электроноакцепторные, дезактивирующие группы.
Электроноакцепторные заместители (А) –
Слайд 48Исключение составляют галогены: вследствие преобладания –I-эффекта галогены дезактивируют кольцо, и уменьшают
Слайд 49ВЛИЯНИЕ ЗАМЕСТИТЕЛЕЙ В БЕНЗОЛЬНОМ ЯДРЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ И ОРИЕНТАЦИЮ ЭЛЕКТРОФИЛЬНОГО
Слайд 50(+++) – активирует сильно, (++) –умеренно, (+) – слабо
(- - -)
( См. Учебник. С. 204).
Слайд 51Правила ориентации позволяют предсказать преимущественное направление реакции и преобладание того или
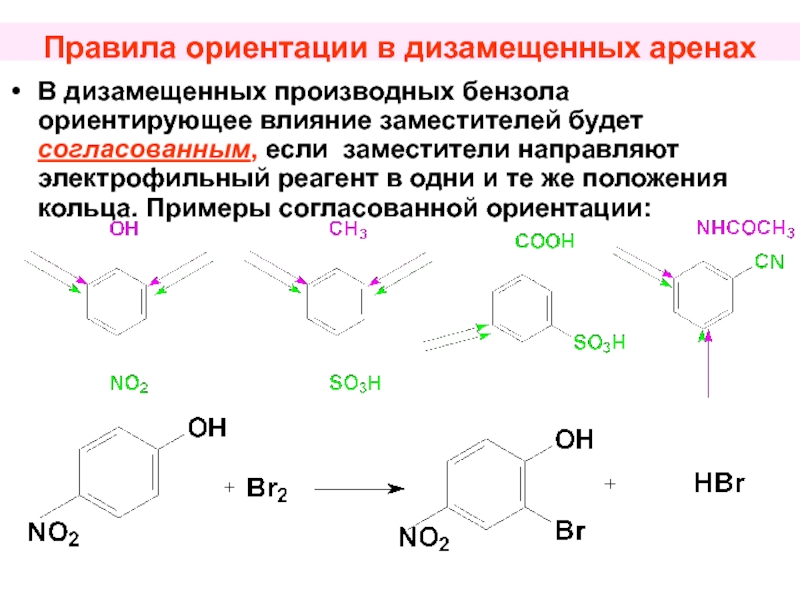
Слайд 52Правила ориентации в дизамещенных аренах
В дизамещенных производных бензола ориентирующее влияние
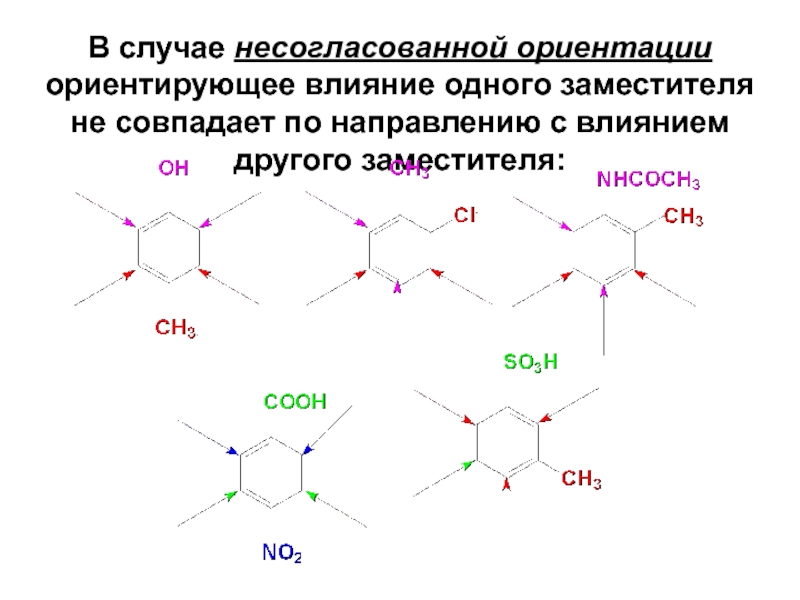
Слайд 53В случае несогласованной ориентации ориентирующее влияние одного заместителя не совпадает по
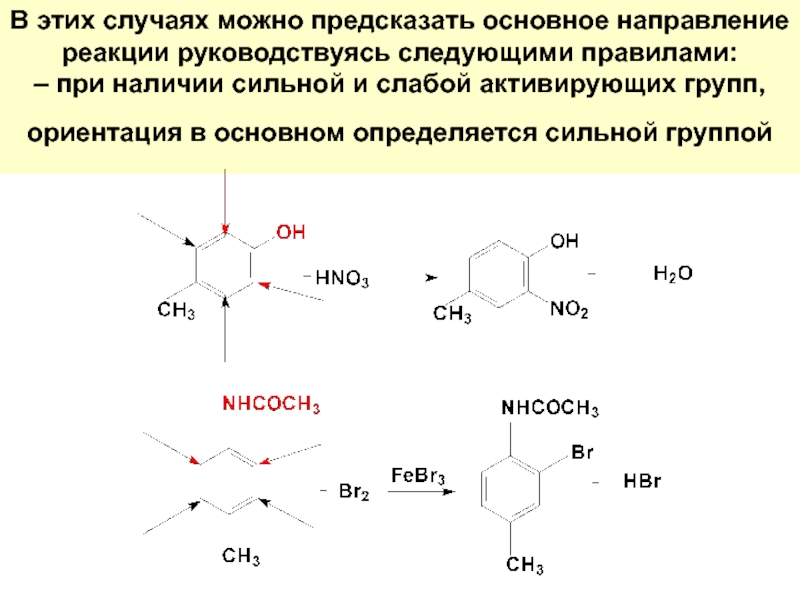
Слайд 54В этих случаях можно предсказать основное направление реакции руководствуясь следующими правилами: –
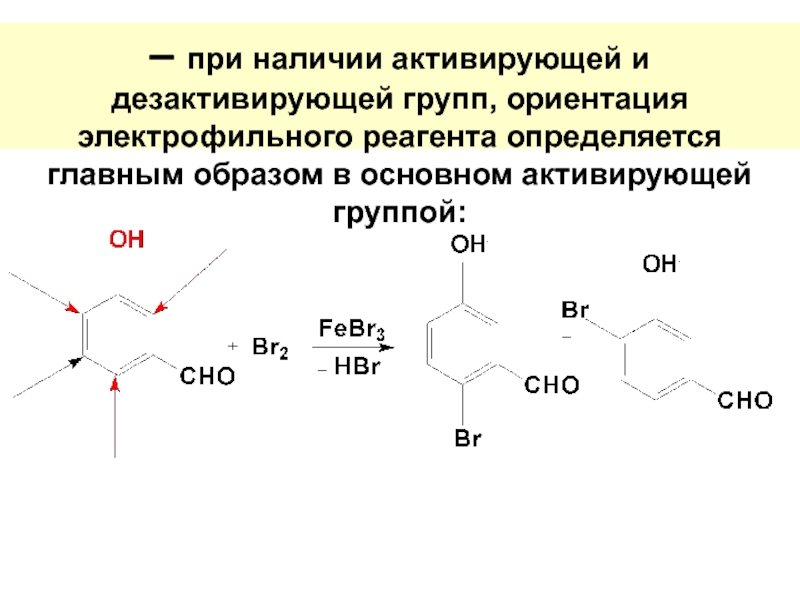
Слайд 55– при наличии активирующей и дезактивирующей групп, ориентация электрофильного реагента определяется
Слайд 56Атакующий электрофил , как правило, не замещает Н в кольце между
Слайд 57Важнейшие реакции SE
1.1. Галогенирование.
Бензол реагирует с Cl2 и Br2 в присутствии
Другие галoгенирующие агенты: Cl-Cl< AgClO4; хлорноватистая и бромноватистая кислоты в кислой среде HOBr, HClO.
Прямое фторирование можно осуществить F2 (разбавленным азотом) при -70оС.
В реакциях I2 реагирует только с активными аренами – анилин, фенол в щелочной среде. Для иодирования других aренов используют
I-Cl или I2/AgClO4.
Слайд 581.2.Нитрование.
Бензол нитруется нитрующей смесью – HNO3/H2SO4.
В качестве других источников нитроил катиона
Слайд 601.3. Сульфирование
Сульфирующие агенты –конц. серная кислота и олеум с различным содержанием
Слайд 61Каждая стадия сульфирования обратима и в целом весь процесс тоже обратимый.
Слайд 62 Обратимость реакции сульфирования используется для временного блокирования –«защиты» -какого-либо положения кольца,
Слайд 63При сульфировании толуола образуется смесь о- и п- толуолсульфоновых кислот с
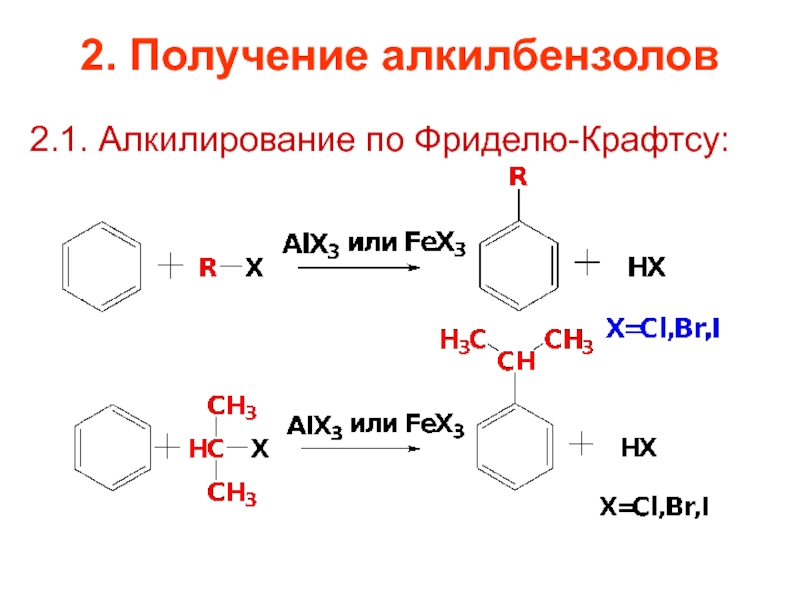
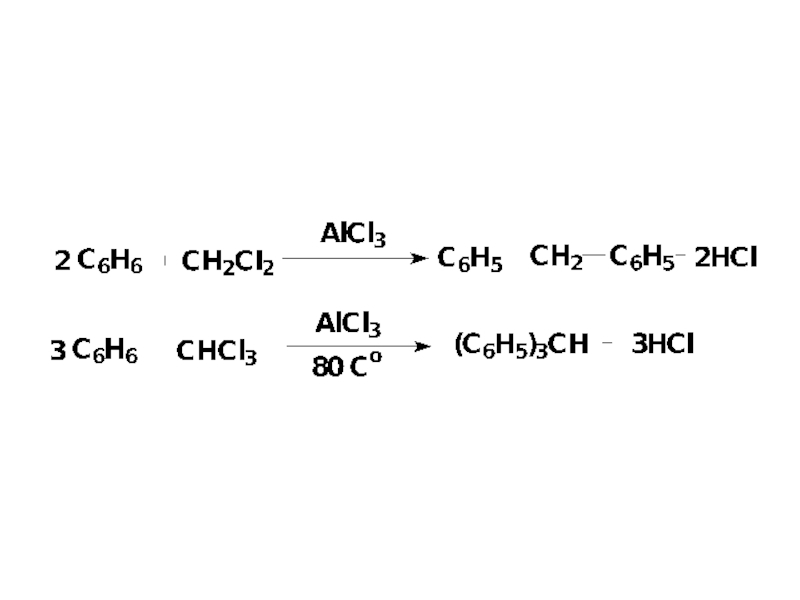
Слайд 651.4. Алкилирование
Имеет ряд ограничений:
-реакция обратима и наряду с алкилированием идет дезалкилирование;
-соединения
-тенденция алкилирующего агента перегруппировываться в более стабильный карбокатион:
Слайд 66 Алкилирующие реагенты действуют менее избирательно, чем другие электрофилы, особенно при высокой
Слайд 67 Кроме галогеналканов алкилирующими реагентами могут быть алкены и спирты, электрофилами в
Слайд 681.5. Ацилирование
Ацилирование – метод синтеза ароматических кетонов. В качестве ацилирующих агентов
Слайд 69 Электрофильными частицами являются ацилиевые ионы, которые значительно устойчивее карбокатионов, так
Ацилирование чувствительно к объему заместителя
и протекает преимущественно в пара-положение.
Слайд 71Введение в ароматическое кольцо альдегидной группы : реакция формилирования по Гаттерману-Коху
Слайд 723.Реакции бензола с нарушением ароматической системы.
3.1.Окисление
По отношению к действию окислителей бензол
сходен
Бензол окисляется O2 в присутствии V2O5 :
Слайд 74б) Присоединение хлора
Гексахлоран использовался ранее в качестве инсектицида.
Это сильный пищевой
(10-12г – смертельная доза для мух). Инсектицидным
действием обладает 1 из 9 стереоизомеров гексахлорциклогексана.
Слайд 753.3.Реакции боковых цепей в алкилбензолах.
а) Галогенирования (Учебник. Стр. 214-215).
Алкилбензолы вступают в
Для инициирования образования радикальных частиц
используется освещение ультрафиолотовым светом (фотолиз)
или высокие температуры -450-500оС (термолиз).
При бромировании толуола возможно
замещение не более 2 атомов водорода в боковой цепи.
Слайд 76 В алкилбензолах с более сложной боковой цепью бромирование идет исключительно, а
Слайд 77 Скорость замещения бензильного Н в 3,3 выше, чем у третичного
Слайд 79в) Окисление (Учебник. Стр. 216.).
Алкилбензолы, в которых с бензольным кольцом связана
Слайд 82Красители антрахинонового ряда
Ализарин –красное твердое вещество, образующее в щелочах растворы синего