- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Анти-краун-эфиры презентация
Содержание
- 1. Анти-краун-эфиры
- 2. Бидентатное координационное поведение таких хелатирующих лиган-
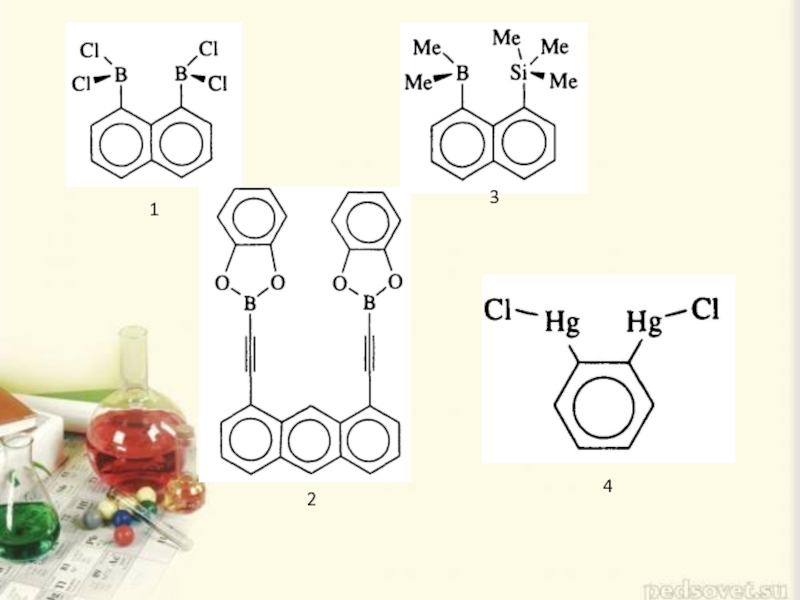
- 3. 1 2 3 4
- 4. Антикраун (5), содержащий четыре атома металла, получили
- 5. Вслед за (5) был получен ряд
- 6. 1) Соединение 6 дает 1:1-полимер
- 7. 3) Единственное соединение, которое реально капсулирует анион
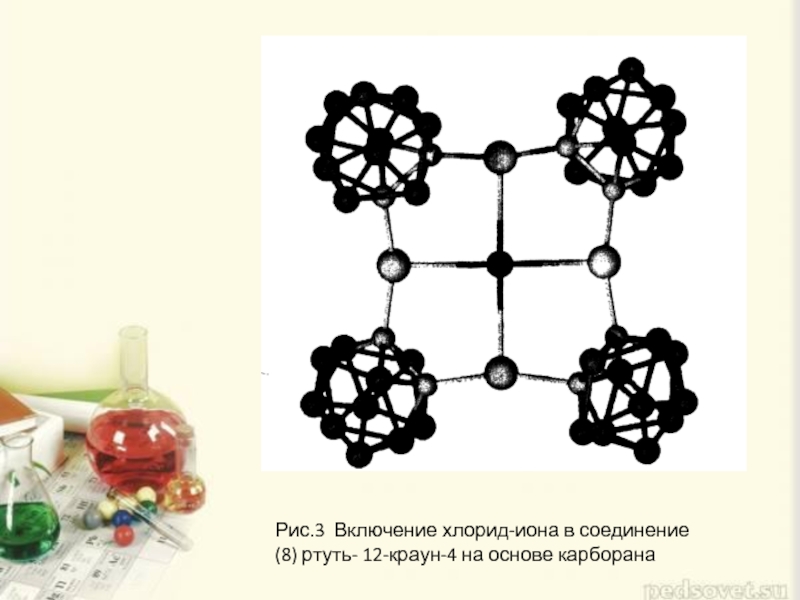
- 8. Рис.3 Включение хлорид-иона в соединение (8) ртуть- 12-краун-4 на основе карборана
- 9. Олово(IV), как кремний и ртуть, тоже способно
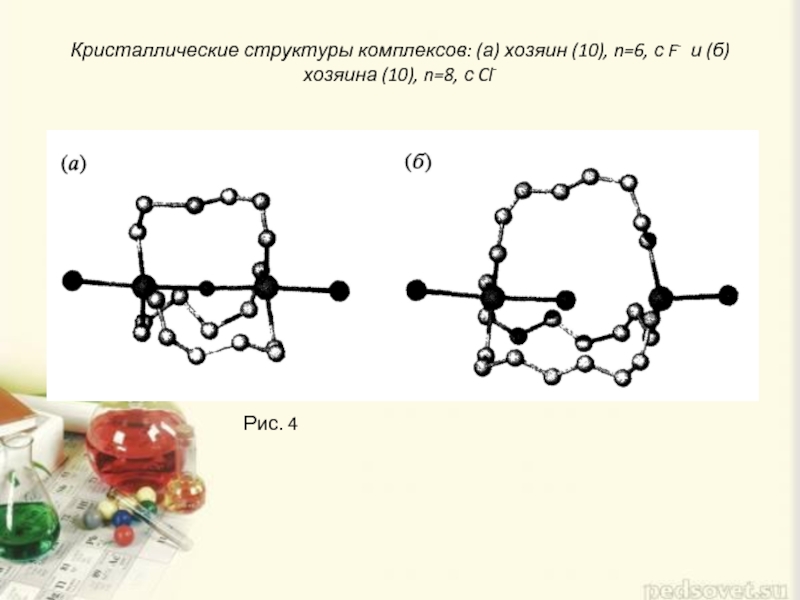
- 11. Кристаллические структуры комплексов: (а) хозяин (10), n=6,
- 12. БЛАГОДАРЮ ЗА ВНИМАНИЕ☺
Слайд 2Бидентатное координационное поведение таких хелатирующих лиган- дов на основе кислот Льюиса,
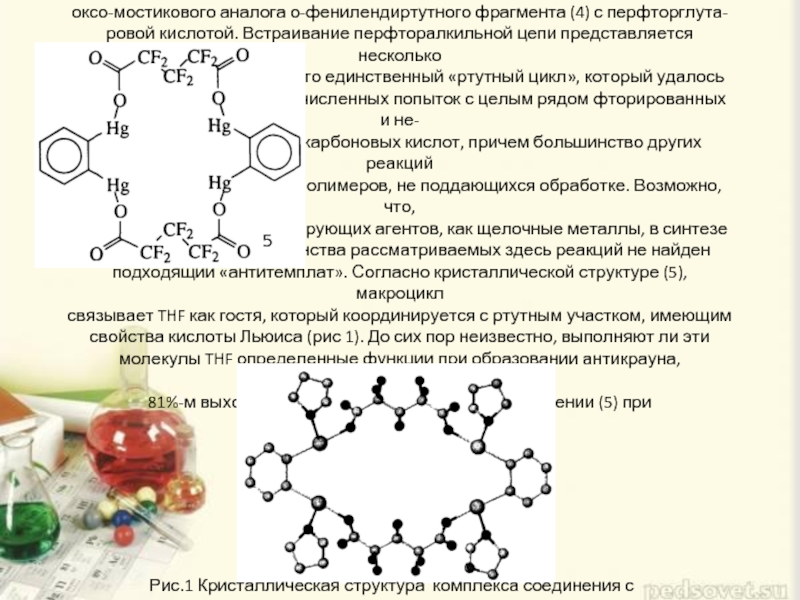
Слайд 4Антикраун (5), содержащий четыре атома металла, получили по реакции оксо-мостикового аналога
Рис.1 Кристаллическая структура комплекса соединения с ТHF
5
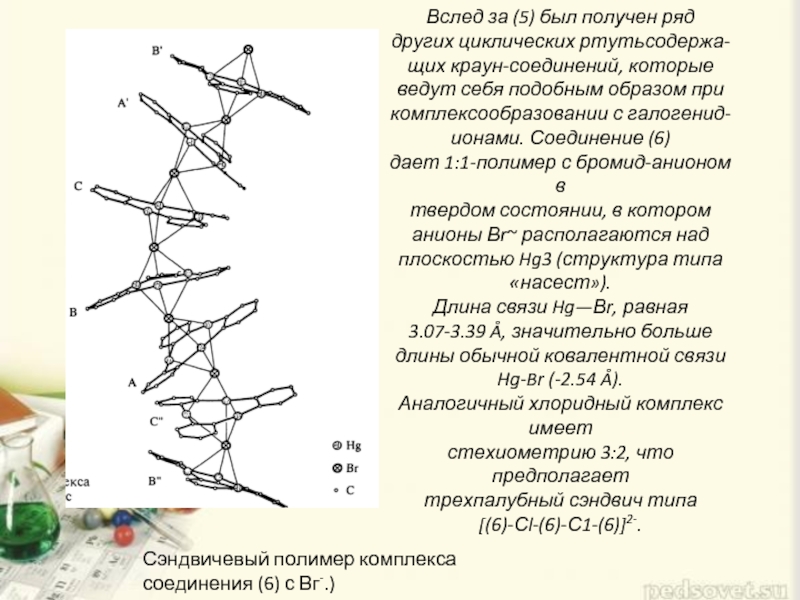
Слайд 5Вслед за (5) был получен ряд других циклических ртутьсодержа- щих краун-соединений,
Сэндвичевый полимер комплекса
соединения (6) с Вг-.)
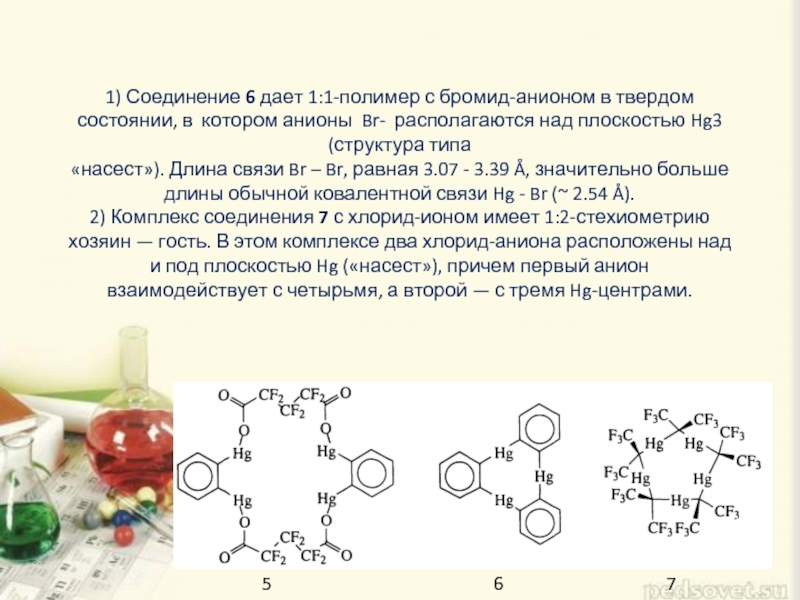
Слайд 6 1) Соединение 6 дает 1:1-полимер с бромид-анионом в твердом состоянии, в
5 6 7
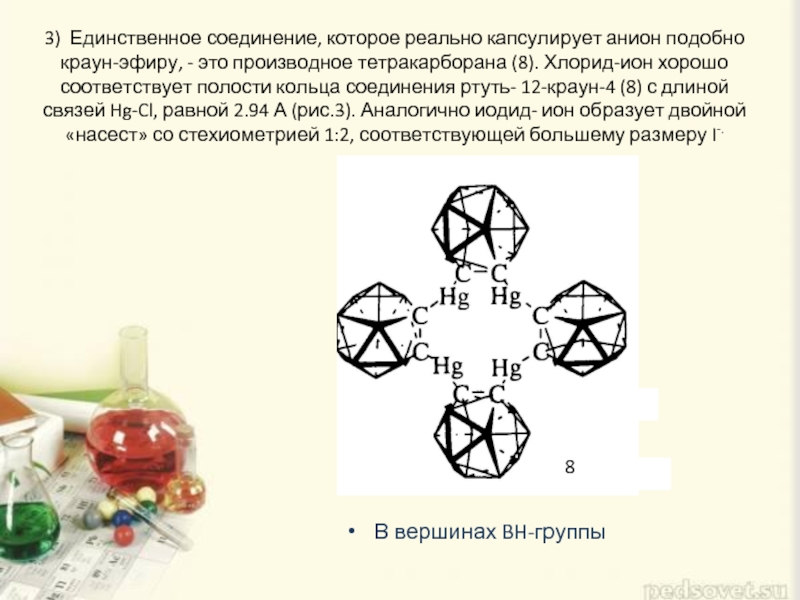
Слайд 73) Единственное соединение, которое реально капсулирует анион подобно краун-эфиру, - это
В вершинах BH-группы
8
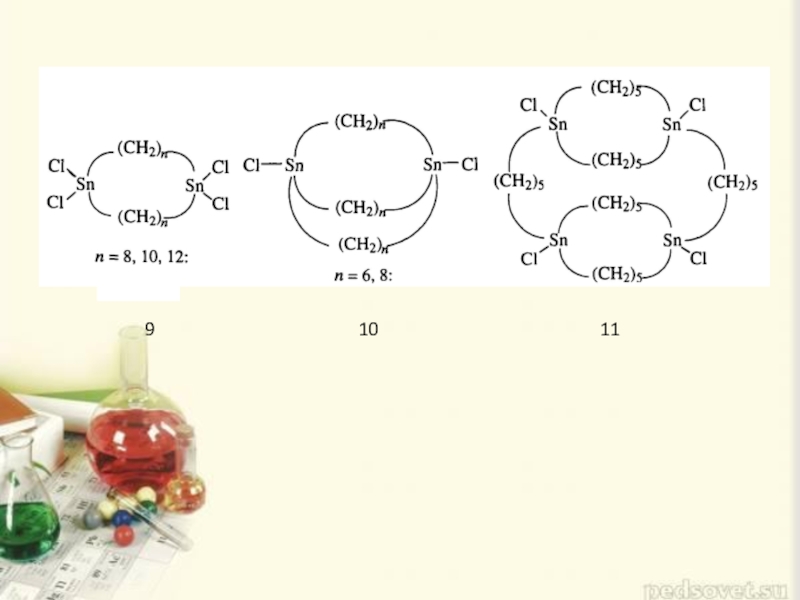
Слайд 9Олово(IV), как кремний и ртуть, тоже способно расширять свою координационную сферу
Слайд 11Кристаллические структуры комплексов: (а) хозяин (10), n=6, с F- и (б)хозяина
Рис. 4