равновесие.
Ионная сила растворов.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Анализ смеси катионов первойтретьей аналитических групп по систематическому анализу. Химическое равновесие презентация
Содержание
- 1. Анализ смеси катионов первойтретьей аналитических групп по систематическому анализу. Химическое равновесие
- 2. Логарифмы
- 3. Математика Логарифмы - характеристика и мантисса. Переход
- 4. План лекции: Химические методы обнаружения неорганических веществ.
- 5. Анализ смеси катионов первой-третьей аналитических групп по систематическому анализу
- 7. Анализ раствора без осадка Предварительные испытания –
- 8. CИСТЕМ.ХОД АНАЛИЗА НА 1ГРУППУ
- 9. ПРИНЦИПИАЛЬНОЕ ОТЛИЧИЕ УЧЕТ И УСТРАНЕНИЕ МЕШАЮЩЕГО ВЛИЯНИЯ ИОНОВ
- 10. Анализ смеси катионов Li+, Na+,
- 11. Первая аналитическая группа катионов -Li+, Na+, K+, NH4+
- 12. Анализ смеси катионов Li+, Na+,
- 13. Анализ смеси катионов II аналитической группы по систематическому анализу
- 14. Действие групповых реагентов –HCl, H2SO4
- 15. Растворимость хлорида свинца ρ*(PbCl2)=0,98г/100г воды ρ*(PbSO4)=0,0045г/100г воды
- 16. Парадоксальный вывод при образовании осадков при прибавлении
- 17. ОтделениеPbCl2 Осадок обрабатывают горячей водой, при этом PbCl2 растворяется. При необходимости процедуру повторяют несколько раз.
- 18. Реакция дитизона с ионами свинца, дитизонат свинца окрашивает слой хлороформа в красный цвет
- 19. Дополнение Экстракция – явление распределения вещества
- 20. Продолжение хода анализа Наличие осадка после удаления
- 21. ПРОДУКТЫ 2Hg22++ 4NH3+H2O = [OHg2NH2] + Hg0
- 22. Определение серебра К раствору, содержащему аммиакат серебра,
- 23. Анализ смеси катионов III аналитической группы по систематическому анализу
- 24. Осадок не образовался при действии H2SO4 или
- 25. Операции с осадком Перевод сульфатов в карбонаты
- 27. Обнаружение ионов бария Обнаружение ионов бария проводят
- 28. Обнаружение стронция Осадок 4 растворяют при нагревании
- 29. Обнаружение кальция Раствор 4 упаривают до небольшого
- 30. Химическое равновесие в растворах
- 31. Идеальные растворы Растворы, для которых наблюдается совпадение
- 32. Идеальность растворов Наблюдается лишь для предельно разбавленных растворов при невысоких (комнатных) температурах
- 33. Отклонения от идеальности В реальных растворах наблюдаются
- 34. Активность вещества в растворе Активность (α )
- 35. Размерность активности Размерность имеет ту же размерность,
- 36. Коэффициенты активности Отношение активности вещества в данном растворе к его концентрации называется коэффициентом активности.
- 37. Индивидуальные коэффициенты активности В зависимости от
- 38. Выражение коэффициентов активности
- 39. Среднеионные коэффициенты активности Для характеристики активности
- 40. Индивидуальные коэффициенты активности ионов: Характеризуют активность отдельных
- 41. Ионная сила раствора
- 42. Активность растворенного вещества Зависит от концентрации растворенного
- 43. Ионная сила раствора – математическое выражение
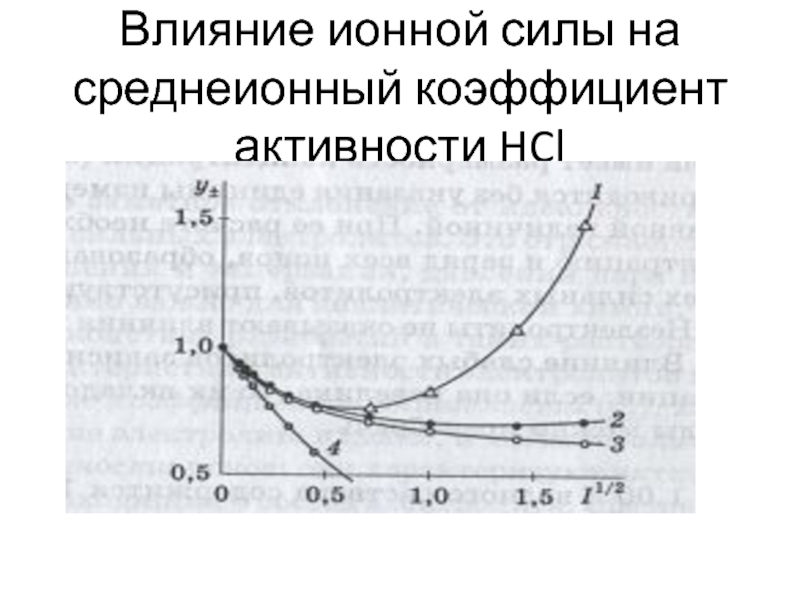
- 44. Влияние ионной силы на среднеионный коэффициент активности HCl
- 45. РАСЧЕТНЫЕ ФОРМУЛЫ Ионная сила раствора
- 46. Предельный закон Дебая-Хюккеля (I
- 47. Расширенное уравнение Дебая-Хюккеля (С=0,01-0,1 моль/литр)
- 48. Коэффициенты расширенного уравнения Дебая-Хюккеля А- аналогично предельному
- 49. Значения эмпирической константы а для некоторых ионов
- 50. Уравнение Дэвиса (I=0,1 – 1) В α =1
- 51. РАСЧЕТНЫЕ ЗАДАЧИ ПО ИОННОЙ СИЛЕ РАСТВОРА 1.
Слайд 1Тема лекции Анализ смеси катионов первой-третьей аналитических групп по систематическому анализу Химическое
Слайд 3Математика
Логарифмы - характеристика и мантисса.
Переход от логарифма к числу.
Логарифмы – натуральный
и десятичный, переход от одного к другому.
Слайд 4 План лекции:
Химические методы обнаружения неорганических веществ. Реакции обнаружения смеси катионов I
-3 аналитических групп.
2. ЛОГАРИФМЫ
3. Ионная сила растворов.
2. ЛОГАРИФМЫ
3. Ионная сила растворов.
Слайд 7Анализ раствора без осадка
Предварительные испытания – действие щелочью с целью обнаружить
ион аммония, подтверждение – реактив Несслера
Действие групповых реагентов – HCl, H2SO4
Слайд 10Анализ смеси катионов
Li+, Na+, K+, NH4+
Сразу удаляют аммоний прокаливаем
в щелочной среде, затем Li+– осаждением фторидом аммония или гидроортофосфатом натрия.
Ионы Na+, K+, определяют дробными реакциями
Ионы Na+, K+, определяют дробными реакциями
Слайд 12Анализ смеси катионов
Li+, Na+, K+, NH4+
Сразу удаляют аммоний прокаливаем
в щелочной среде, затем Li+– осаждением фторидом аммония или гидроортофосфатом натрия.
Ионы Na+, K+, определяют дробными реакциями
Ионы Na+, K+, определяют дробными реакциями
Слайд 14Действие групповых реагентов –HCl, H2SO4
Осадок при действии HCl - есть
катионы второй аналитической группы
Осадок при действии H2SO4 - есть катионы третьей аналитической группы и, возможно, Pb2+
Слайд 16Парадоксальный вывод при образовании осадков при прибавлении обеих кислот
В растворе могут
присутствовать только катионы свинца
Слайд 17ОтделениеPbCl2
Осадок обрабатывают горячей водой, при этом PbCl2 растворяется. При необходимости процедуру
повторяют несколько раз.
Слайд 18Реакция дитизона с ионами свинца, дитизонат свинца окрашивает слой хлороформа в
красный цвет
Слайд 19Дополнение
Экстракция – явление распределения вещества между двумя несмешивающимися жидкостями. Это
способ выделить соединение металла с органическими лигандами в слой органической фазы (В ДАННОМ СЛУЧАЕ ХЛОРОФОРМ)
Слайд 20Продолжение хода анализа
Наличие осадка после удаления PbCl2
Осадок обрабатывают раствором аммиака:
при этом AgCl растворяется с образованием [Ag(NH3)2]+ (раствор 2) и остается осадок. При наличии Hg22+ осадок чернеет – его отделяют центрифугированием.
Слайд 22Определение серебра
К раствору, содержащему аммиакат серебра, прибавляют азотную кислоту – выпадение
белого осадка AgCl указывает на наличие ионов Ag+. При добавлении иодида калия к раствору аммиаката серебра выпадает желтый осадок AgI.
Слайд 24Осадок не образовался при действии H2SO4 или (NH4)2SO4
Добавление этанола приводит к
выпадению сульфата кальция – в присутствии этанола его растворимость резко уменьшается.
Слайд 25Операции с осадком
Перевод сульфатов в карбонаты проводят посредством многократной обработки осадка
насыщенным раствором карбоната натрия при нагревании. Осадок карбонатов отделяют центрифугированием и промывают водой, растворяют в 2 М CH3COOH и в полученном растворе обнаруживают катионы III аналитической группы.
Слайд 27Обнаружение ионов бария
Обнаружение ионов бария проводят по реакции с K2Cr2O7 в
присутствии CH3COONa+ CH3COOН. Если выпадает желтый осадок, то ионы бария осаждают в виде BaCrO4 и отделяют центрифугированием , при этом в растворе остаются ионы Sr2+ и Ca2+ (раствор 2). Ионы Cr2O72- мешают обнаружению ионов Ca2+ и Sr2+, поэтому раствор 2 обрабатывают при нагревании раствором карбоната аммония. Выпавший осадок карбонатов стронция и кальция центрифугируют (осадок 4).
Слайд 28Обнаружение стронция
Осадок 4 растворяют при нагревании в 2 М CH3COOH (раствор
3). К раствору 3 прибавляют насыщенный раствор сульфата аммония и нагревают. Выпавший осадок SrSO4 отфильтровывают (осадок 5). Фильтрат содержит ионы [Ca(SO4)2]2- (раствор4).
Слайд 29Обнаружение кальция
Раствор 4 упаривают до небольшого объема и проводят обнаружение ионов
кальция по реакции с (NH4)2C2O4. Выпадение белого осадка, нерастворимого в уксусной кислоте, указывает на наличие ионов Ca2+.
Слайд 31Идеальные растворы
Растворы, для которых наблюдается совпадение термодинамических свойств на основе расчета
концентраций на основе масс веществ, называются идеальными
Слайд 32Идеальность растворов
Наблюдается лишь для предельно разбавленных растворов при невысоких (комнатных) температурах
Слайд 33Отклонения от идеальности
В реальных растворах наблюдаются эффекты взаимного влияния ионов -
притяжение и отталкивание. Это приводит к отклонению от идеальности
Слайд 34Активность вещества в растворе
Активность (α ) – это такая концентрация вещества
в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора. Активность иногда называют эффективной или действующей концентрацией.
Слайд 35Размерность активности
Размерность имеет ту же размерность, что и величина, характеризующая состав
раствора, вместо которой эта активность используется. Например, активность в смысле «активная молярная концентрация» имеет размерность моль/л, в смысле «активная моляльность» - моль/кг.
Слайд 36Коэффициенты активности
Отношение активности вещества в данном растворе к его концентрации
называется коэффициентом активности.
Слайд 37Индивидуальные коэффициенты активности
В зависимости от способа описания количественного состава раствора
различают молярный (у), моляльный (ɣ) и рациональный (f) /на основе молярных долей вещества/ коэффициенты активности.
Слайд 39Среднеионные коэффициенты активности
Для характеристики активности электролитов используются среднеионные коэффициенты активности,
которые можно определть экспериментально;
Слайд 40Индивидуальные коэффициенты активности ионов:
Характеризуют активность отдельных ионов, входящих в состав электролита.
Поскольку отдельных ионов (только катионов или только анионов) в растворе не существует, их получают расчетным путем
Слайд 42Активность растворенного вещества
Зависит от концентрации растворенного электролита (для неэлектролитов она равна
нулю) и квадрата заряда ионов
Слайд 48Коэффициенты расширенного уравнения Дебая-Хюккеля
А- аналогично предельному уравнению;
В=0,328 – эмпирическая константа;
(α) -
эмпирическая константа, характеризующая размер ионной атмосферы в ангстремах (1Α – 0.1нм)
Слайд 51РАСЧЕТНЫЕ ЗАДАЧИ ПО ИОННОЙ СИЛЕ РАСТВОРА
1. ИОННАЯ СИЛА ОДНОГО ВЕЩЕСТВА
2.
ИОННАЯ СИЛА ДВУХ ВЕЩЕСТВ
3. ИОННАЯ СИЛА ПРИ ОБРАЗОВАНИИ ОСАДКА ( СТЕХИОМЕТРИЯ ИЛИ ИЗБЫТОК-НЕДОСТАТОК)
4. ИОННАЯ СИЛА ПРИ ОБРАЗОВАНИИ КОМПЛЕКСНОГО ИОНА (СТЕХИОМЕТРИЯ ИЛИ ИЗБЫТОК-НЕДОСТАТОК)
3. ИОННАЯ СИЛА ПРИ ОБРАЗОВАНИИ ОСАДКА ( СТЕХИОМЕТРИЯ ИЛИ ИЗБЫТОК-НЕДОСТАТОК)
4. ИОННАЯ СИЛА ПРИ ОБРАЗОВАНИИ КОМПЛЕКСНОГО ИОНА (СТЕХИОМЕТРИЯ ИЛИ ИЗБЫТОК-НЕДОСТАТОК)




















![ПРОДУКТЫ2Hg22++ 4NH3+H2O = [OHg2NH2] + Hg0](/img/tmb/4/398874/e54b5e4d2f8ee2aaaf8e9b45c1383233-800x.jpg)