- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алюминий (лат. Aluminium) презентация
Содержание
- 1. Алюминий (лат. Aluminium)
- 2. Al 13 Алюминий (лат. (лат. Aluminium(лат.
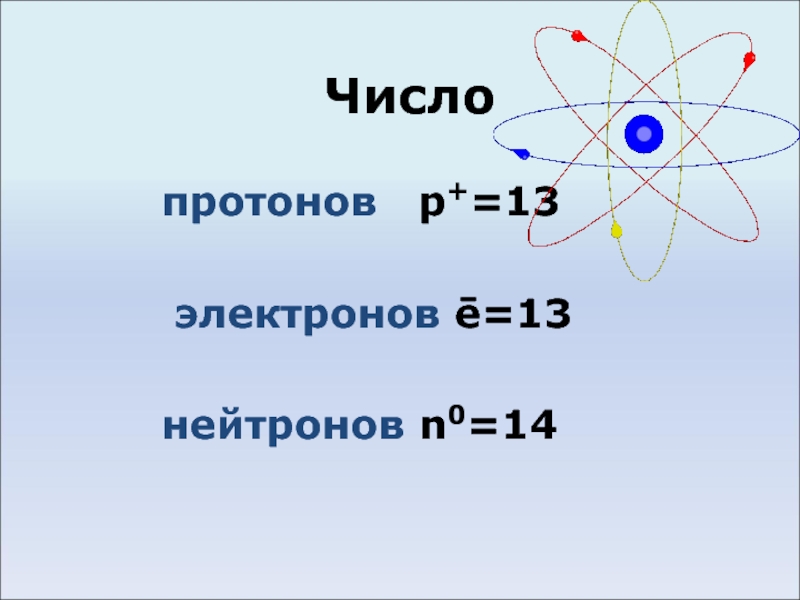
- 3. Число протонов p+=13 электронов ē=13 нейтронов n0=14
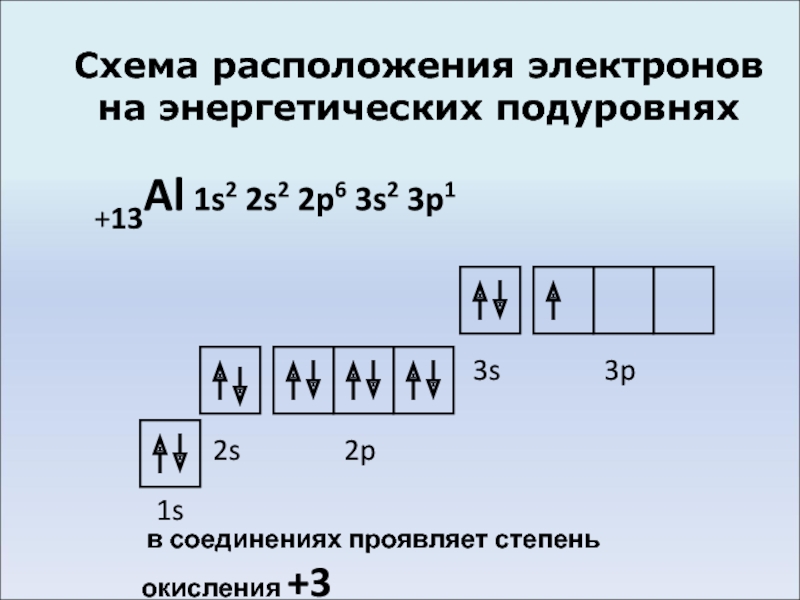
- 4. Схема расположения электронов на энергетических подуровнях +13Al
- 5. Al – типичный металл Восстановительные свойства
- 6. Физические свойства вещества Al – серебристо-белый металл,
- 7. Особенности физических и химических свойств алюминия, его
- 8. Алюминий реагирует с простыми веществами - неметаллами
- 9. Алюминий реагирует со сложными веществами: Алюминий растворяется
- 10. Алюминий реагирует со сложными веществами: 3. Алюминий
- 11. Алюминий реагирует со сложными веществами: 4.Так как
- 12. Получение алюминия Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6) и электролизом расплава AlCl3
- 13. Применение Al
- 14. Соединения алюминия В природе алюминий
- 15. Оксид алюминия Al2О3: Очень твердый (корунд, рубин)в
- 16. Белый нерастворимый в воде порошок. Проявляет амфотерные
- 17. Домашнее задание: 1) Пользуясь материалом презентации, и
Слайд 2Al
13
Алюминий
(лат. (лат. Aluminium(лат. Aluminium)
3
8
2
26,9815
3s2 3p1
Порядковый номер. Химический элемент III
Слайд 4Схема расположения электронов на энергетических подуровнях
+13Al 1s2 2s2 2p6 3s2 3p1
1s
2s
2p
3s
3p
Слайд 5Al – типичный металл
Восстановительные свойства
Al 0- 3ē
Тип химической связи -металлическая
Тип кристаллической решетки – кубическая гранецентрированная
Слайд 6Физические свойства вещества
Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло
ρ=2,7 г/см3
tпл.=6600С
Слайд 7Особенности физических и химических свойств алюминия, его нахождения в природе и
Алюминий – самый распространенный металл земной коры. Его ресурсы практически неисчерпаемы.
Обладает высокой коррозионной стойкостью и практически не нуждается в специальной защите.
Высокая химическая активность алюминия используется в алюминотермии.
Малая плотность в сочетании с высокой прочностью и пластичностью его сплавов делает алюминий незаменимым конструкционным материалом в самолетостроении и способствует расширению его применения в наземном и водном транспорте, а также в строительстве.
Относительно высокая электропроводность позволяет заменять им значительно более дорогую медь в электротехнике.
Слайд 8Алюминий реагирует с простыми веществами - неметаллами
4Al+3O2 = 2Al2O3
Поверхность покрывается пленкой оксида, в мелкораздробленном виде горит с выделением большого количества теплоты.
2. 2Al + 3Cl2 = 2 AlCl3
3. 2Al + 3S = Al2S3 - при нагревании
4. 4Al + 3С = Al4С3 - при нагревании
Слайд 9Алюминий реагирует со сложными веществами:
Алюминий растворяется в растворах кислот
2Al + 6HCl
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
Концентрированная серная и азотная кислоты пассивируют алюминий.
2. Алюминий реагирует с растворами солей менее активных металлов
2Al + 3СuCl2 = 2AlCl3 + 3Cu
Слайд 10Алюминий реагирует со сложными веществами:
3. Алюминий при высокой температуре реагирует с
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Слайд 11Алюминий реагирует со сложными веществами:
4.Так как алюминий – амфотерный металл, он
При этом образуется тетрагидроксоалюминат натрия и выделяется водород:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
5. При удалении оксидной пленки с поверхности алюминия, он реагирует с водой с образованием гидроксида алюминия и водорода:
2Al + 6H2O = 2Al(OH)3 +3H2
Слайд 12Получение алюминия
Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6) и
электролизом
Слайд 14 Соединения алюминия В природе алюминий встречается только в виде соединений и
Слайд 15Оксид алюминия Al2О3:
Очень твердый (корунд, рубин)в кристаллическом состоянии, порошок белого цвета,
Не растворяется в воде.
Амфотерный оксид, взаимодействует:
а) с кислотами Al2O3 + 6H+ = 2Al3+ + 3H2O
б) со щелочами Al2O3 + 2OH- = 2AlO-2 + H2O
Образуется:
а) при окислении или горении алюминия на воздухе
4Al + 3O2 = 2Al2O3
б) в реакции алюминотермии
2Al + Fe2O3 = Al2O3 + 2Fe
в) при термическом разложении гидроксида алюминия 2Al (OH)3 = Al2O3 + 3H2O
Слайд 16Белый нерастворимый в воде порошок.
Проявляет амфотерные свойства, взаимодействует:
а) с кислотами Al
б) со щелочами Al (OH)3 + Na OH = NaAlO2 + 2H2O
Разлагается при нагревании 2Al (OH)3 = Al2O3 + 3H2O
Образуется:
а) при взаимодействии растворов солей алюминия с растворами щелочей (без избытка)
Al3+ + 3OH- = Al (OH)3
б) при взаимодействии алюминатов с кислотами (без избытка)
AlO-2 + H+ + H2O = Al (OH)3
Гидроксид алюминия Al(ОН)3:
Слайд 17Домашнее задание:
1) Пользуясь материалом презентации, и учебника, выучить свойства алюминия и
2) Выполнить интерактивные задания по теме «Алюминий» на сайте лицея, записать правильные ответы в тетрадь.
3) Выполнить виртуальную практическую работу «Химические свойства алюминия», оформить ее в тетради.