- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алкины (ацетиленовые углеводороды) презентация
Содержание
- 1. Алкины (ацетиленовые углеводороды)
- 2. В образовании такой связи участвуют атомы углерода
- 3. 6.1. Строение тройной связи C≡C
- 4. π-Cвязи располагаются во взаимно перпендикулярных плоскостях:
- 5. 6.2. Номенклатура алкинов По систематической номенклатуре названия
- 6. 6.3. Изомерия алкинов Структурная изомерия Изомерия положения
- 7. 6.4. Свойства алкинов Физические свойства. Температуры
- 8. Характеристики химических связей в алкинах
- 9. 6.4.1. Реакции присоединения к алкинам 1. Гидрирование
- 10. 3. Гидрогалогенирование Присоединение галогеноводородов также идет
- 11. 4. Гидратация (реакция Кучерова) Присоединение воды происходит в
- 12. 5. Полимеризация 1. Димеризация под действием водно-аммиачного
- 13. 6.4.2. Образование солей Ацетилен и его гомологи
- 14. ОБРАЗОВАНИЕ СЕРОВАТО-БЕЛОГО ОСАДКА АЦЕТИЛЕНИДА СЕРЕБРА (ИЛИ КРАСНО-КОРИЧНЕВОГО
- 15. 6.4.3. Окисление алкинов Ацетилен и его гомологи
- 16. При сгорании алкинов происходит их полное окисление до CO2 и
- 17. 6.5. Получение алкинов Ацетилен является
- 18. Гидролиз карбида кальция: Карбид
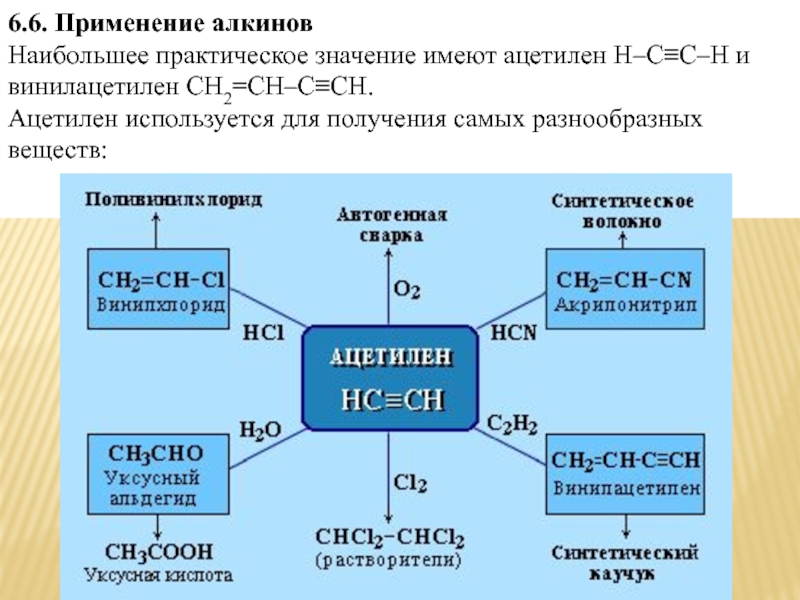
- 19. 6.6. Применение алкинов Наибольшее практическое
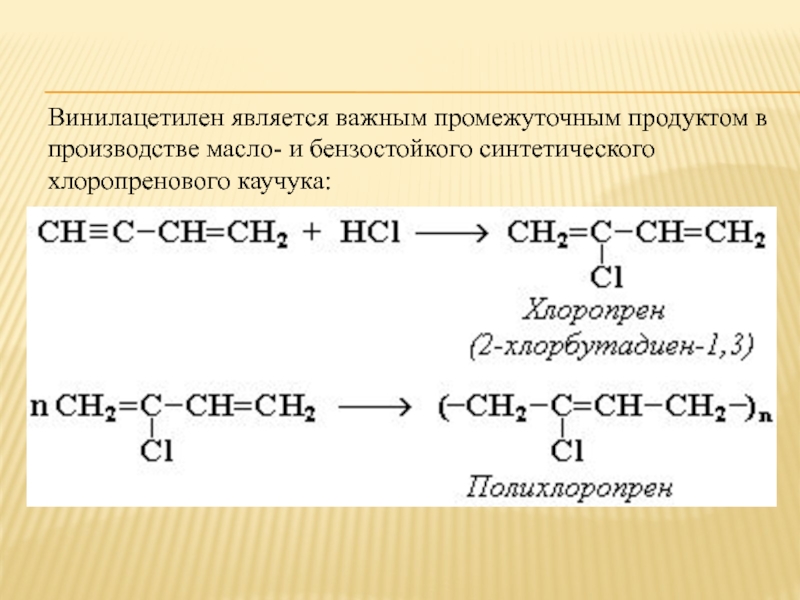
- 20. Винилацетилен является важным промежуточным продуктом в производстве
Слайд 1
6. АЛКИНЫ
Алкины (ацетиленовые углеводороды) – непредельные алифатические углеводороды, молекулы которых содержат
Общая формула алкинов с одной тройной связью СnH2n-2
Простейшие представители:
Тройную связь C≡C осуществляют 6 общих электронов:
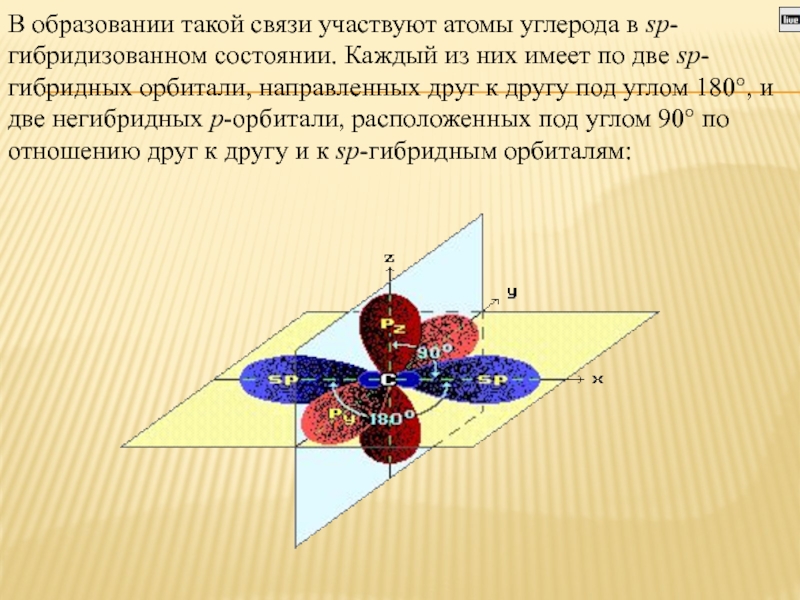
Слайд 2В образовании такой связи участвуют атомы углерода в sp-гибридизованном состоянии. Каждый из них
Слайд 3
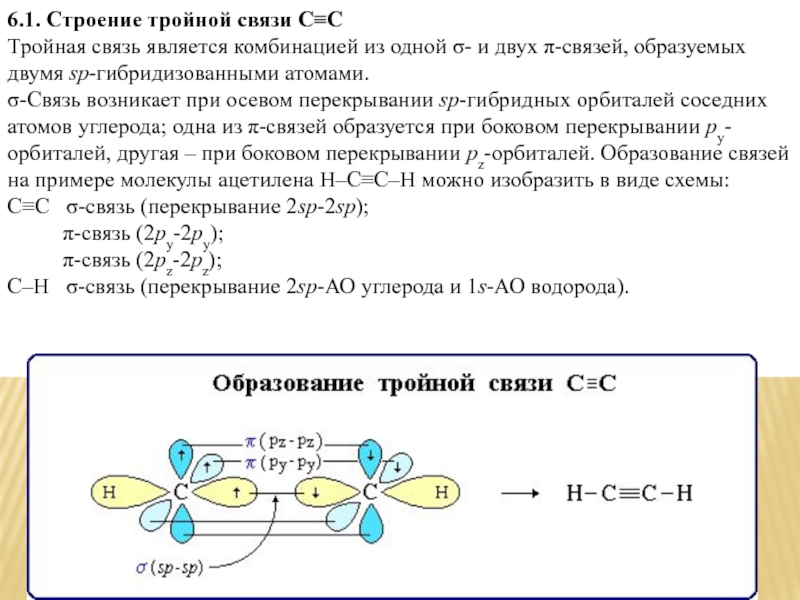
6.1. Строение тройной связи C≡C
Тройная связь является комбинацией из одной σ-
C≡C σ-связь (перекрывание 2sp-2sp); π-связь (2рy-2рy); π-связь (2рz-2рz); С–Н σ-связь (перекрывание 2sp-АО углерода и 1s-АО водорода).
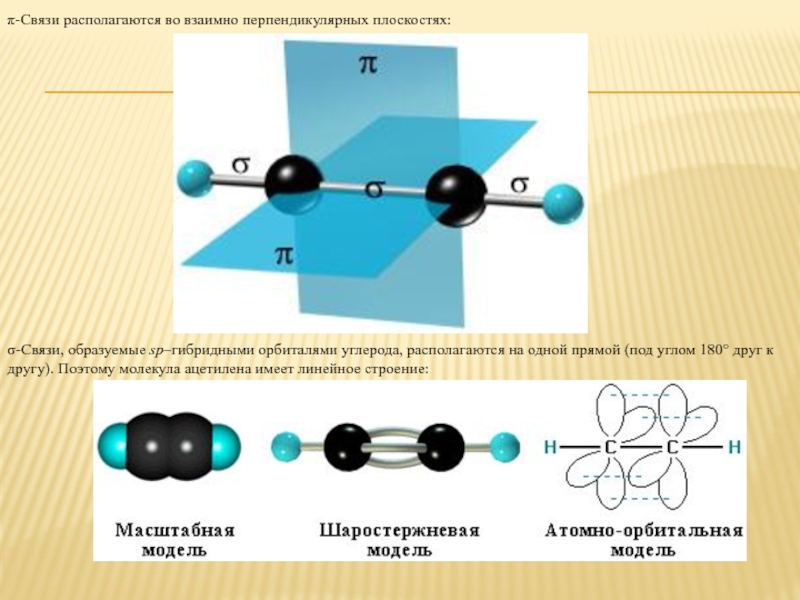
Слайд 4π-Cвязи располагаются во взаимно перпендикулярных плоскостях:
σ-Cвязи, образуемые sp–гибридными орбиталями углерода, располагаются
Слайд 56.2. Номенклатура алкинов
По систематической номенклатуре названия ацетиленовых углеводородов производят от названий
2 атома С → этан → этин; 3 атома С → пропан → пропин и т.д.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь (т.е. она может быть не самой длинной).
Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи. Цифра, обозначающая положение тройной связи, ставится обычно после суффикса –ин. Например:
Для простейших алкенов применяются также исторически сложившиеся названия: ацетилен (этин), аллилен (пропин),кротонилен (бутин-1), валерилен (пентин-1).
В номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкинов:
Слайд 66.3. Изомерия алкинов
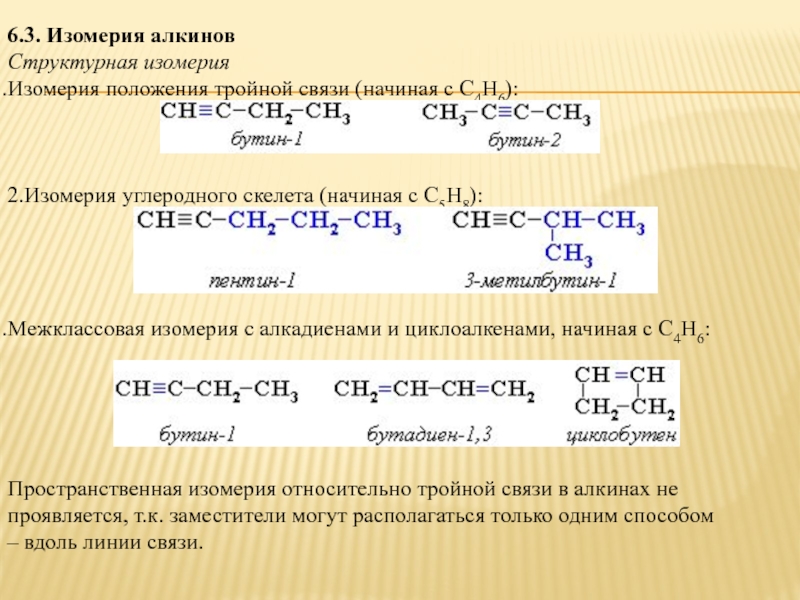
Структурная изомерия
Изомерия положения тройной связи (начиная с С4Н6):
2.Изомерия
Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:
Пространственная изомерия относительно тройной связи в алкинах не проявляется, т.к. заместители могут располагаться только одним способом – вдоль линии связи.
Слайд 7
6.4. Свойства алкинов
Физические свойства. Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с
Физические свойства алкинов и алкенов
Алкины плохо растворимы в воде, лучше – в органических растворителях.
Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью.
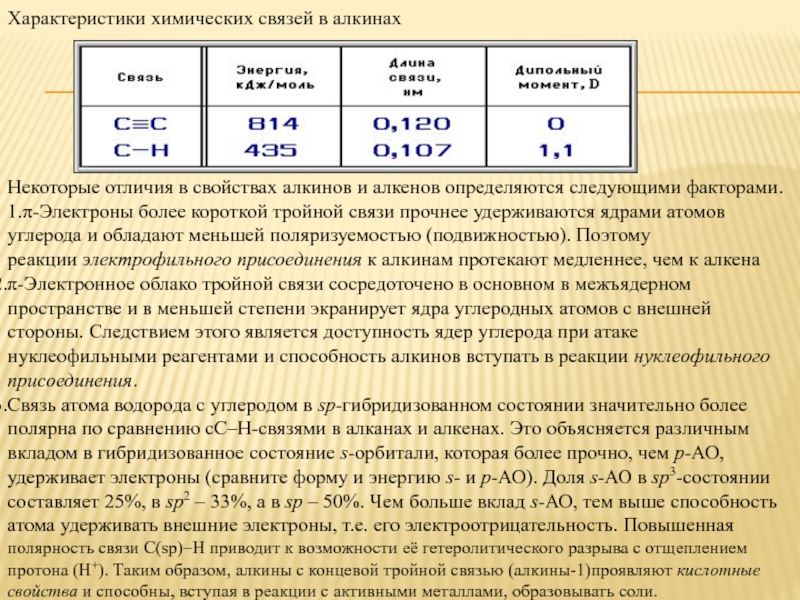
Слайд 8Характеристики химических связей в алкинах
Некоторые отличия в свойствах алкинов и
π-Электронное облако тройной связи сосредоточено в основном в межъядерном пространстве и в меньшей степени экранирует ядра углеродных атомов с внешней стороны. Следствием этого является доступность ядер углерода при атаке нуклеофильными реагентами и способность алкинов вступать в реакции нуклеофильного присоединения.
Связь атома водорода с углеродом в sp-гибридизованном состоянии значительно более полярна по сравнению сС–Н-связями в алканах и алкенах. Это объясняется различным вкладом в гибридизованное состояние s-орбитали, которая более прочно, чем р-АО, удерживает электроны (сравните форму и энергию s- и р-АО). Доля s-АО в sp3-состоянии составляет 25%, в sp2 – 33%, а в sp – 50%. Чем больше вклад s-АО, тем выше способность атома удерживать внешние электроны, т.е. его электроотрицательность. Повышенная полярность связи С(sp)–Н приводит к возможности её гетеролитического разрыва с отщеплением протона (Н+). Таким образом, алкины с концевой тройной связью (алкины-1)проявляют кислотные свойства и способны, вступая в реакции с активными металлами, образовывать соли.
Слайд 96.4.1. Реакции присоединения к алкинам
1. Гидрирование
В присутствии металлических катализаторов (Pt, Ni)
При использовании менее активного катализатора [Pd/CaCO3/Pb(CH3COO)2] гидрирование останавливается на стадии образования алкенов.
2. Галогенирование
Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая π-связь разрывается труднее, чем вторая):
Алкины обесцвечивают бромную воду (качественная реакция).
Слайд 10
3. Гидрогалогенирование
Присоединение галогеноводородов также идет по электрофильному механизму. Продукты присоединения к
Гидрохлорирование ацетилена используется в одном из промышленных способов получения винилхлорида:
Винилхлорид является исходным веществом (мономером) в производстве поливинилхлорида (ПВХ).
Слайд 114. Гидратация (реакция Кучерова)
Присоединение воды происходит в присутствии катализатора соли ртути (II) и
или в кетон (в случае других алкинов):
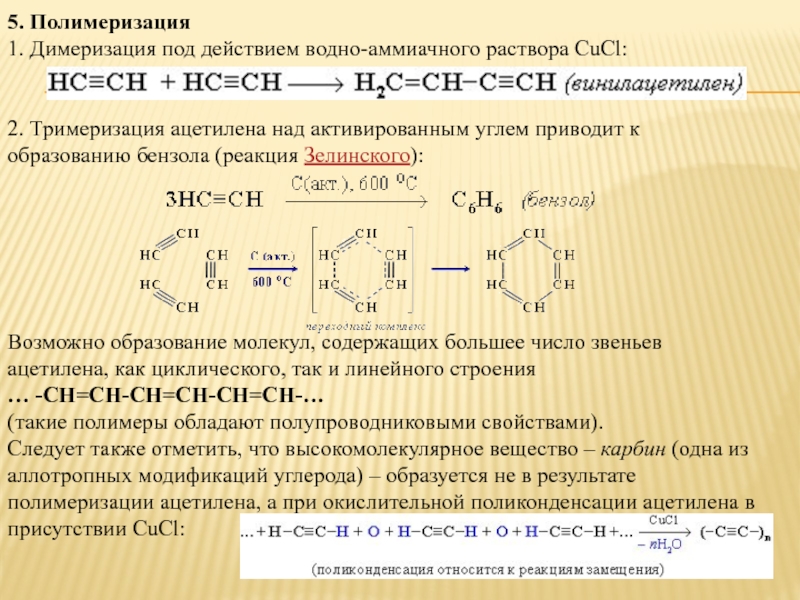
Слайд 125. Полимеризация
1. Димеризация под действием водно-аммиачного раствора CuCl:
2. Тримеризация ацетилена
Возможно образование молекул, содержащих большее число звеньев ацетилена, как циклического, так и линейного строения
… -СН=СН-СН=СН-СН=СН-…
(такие полимеры обладают полупроводниковыми свойствами).
Следует также отметить, что высокомолекулярное вещество – карбин (одна из аллотропных модификаций углерода) – образуется не в результате полимеризации ацетилена, а при окислительной поликонденсации ацетилена в присутствии CuCl:
Слайд 136.4.2. Образование солей
Ацетилен и его гомологи с концевой тройной связью R–C≡C–H (алкины-1) вследствие
Ацетилениды щелочных и щелочноземельных металлов используются для получения гомологов ацетилена.
При взаимодействии ацетилена (или R–C≡C–H) с аммиачными растворами оксида серебра или хлорида меди (I) выпадают осадки нерастворимых ацетиленидов:
Слайд 14ОБРАЗОВАНИЕ СЕРОВАТО-БЕЛОГО ОСАДКА АЦЕТИЛЕНИДА СЕРЕБРА (ИЛИ КРАСНО-КОРИЧНЕВОГО – АЦЕТИЛЕНИДА МЕДИ RC≡CCU)
В сухом состоянии ацетилениды тяжелых металлов неустойчивы и легко взрываются.
Ацетилениды разлагаются при действии кислот:
Если тройная связь находится не на конце углеродной цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются:
Слайд 156.4.3. Окисление алкинов
Ацетилен и его гомологи легко окисляются различными окислителями (перманганатом
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:
Алкины обесцвечивают разбавленный раствор перманганата калия, что используется для доказательства их ненасыщенности. В этих условиях происходит мягкое окисление без разрыва σ-связи С–С (разрушаются только π-связи). Например, при взаимодействии ацетилена с разбавленным раствором KMnO4 при комнатной температуре возможны следующие превращения с образованием щавелевой кислоты HOOC–COOH:
Слайд 16При сгорании алкинов происходит их полное окисление до CO2 и H2O. Горение ацетилена сопровождается
Температура ацетиленово-кислородного пламени достигает 2800-3000 °С. На этом основано применение ацетилена для сварки и резки металла.
Ацетилен образует с воздухом и кислородом взрывоопасные смеси. В сжатом, и особенно в сжиженном, состоянии ацетилен способен взрываться от удара. Поэтому он хранится в стальных баллонах в виде растворов в ацетоне, которым пропитывают асбест или кизельгур.
Слайд 17
6.5. Получение алкинов
Ацетилен является важнейшим исходным продуктом в производстве многих органических
Пиролиз метана:
Реакцию проводят электродуговым способом, пропуская метан между электродами с временем контакта 0,1-0,01 секунды. Столь малое время нагревания обусловлено тем, что ацетилен при такой температуре может разлагаться на углерод и водород.
Пиролиз этана или этилена:
Слайд 18
Гидролиз карбида кальция:
Карбид кальция образуется при нагревании смеси оксида кальция
Вследствие большой энергоемкости этот метод экономически менее выгоден.
Для синтеза гомологов ацетилена применяют следующие методы:
1) дегидрогалогенирование дигалогеналканов спиртовым раствором щелочи (щелочь и спирт берутся в избытке)
2) удлинение цепи (алкилирование ацетиленидов) при действии на ацетилениды алкилгалогенидами