- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Атмосфера. Строение атмосферы. Озоновый слой презентация
Содержание
- 1. Атмосфера. Строение атмосферы. Озоновый слой
- 2. ПЛАНЕТАРНЫЕ ГРАНИЦЫ КЛИМАТ 350 ppm СО2 +1
- 3. Rockström, J. et al., 2009. Nature, 461:
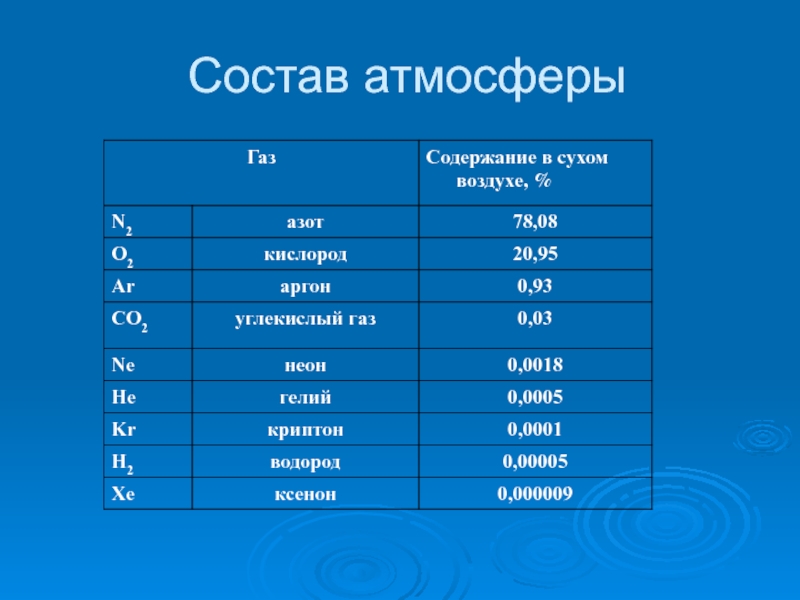
- 4. Состав атмосферы
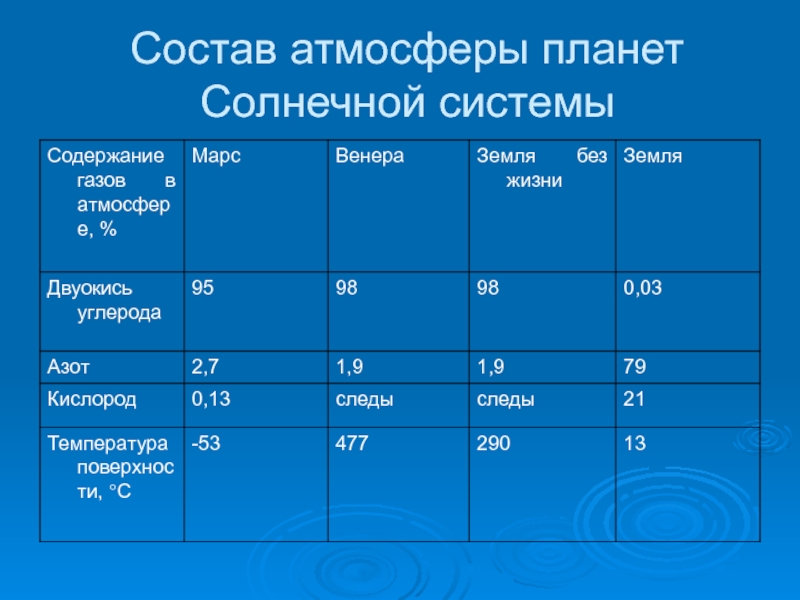
- 5. Состав атмосферы планет Солнечной системы
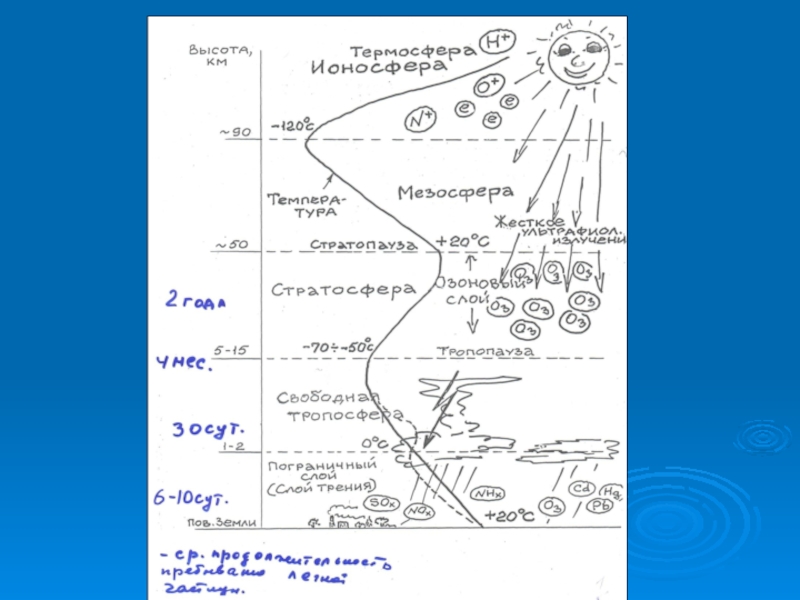
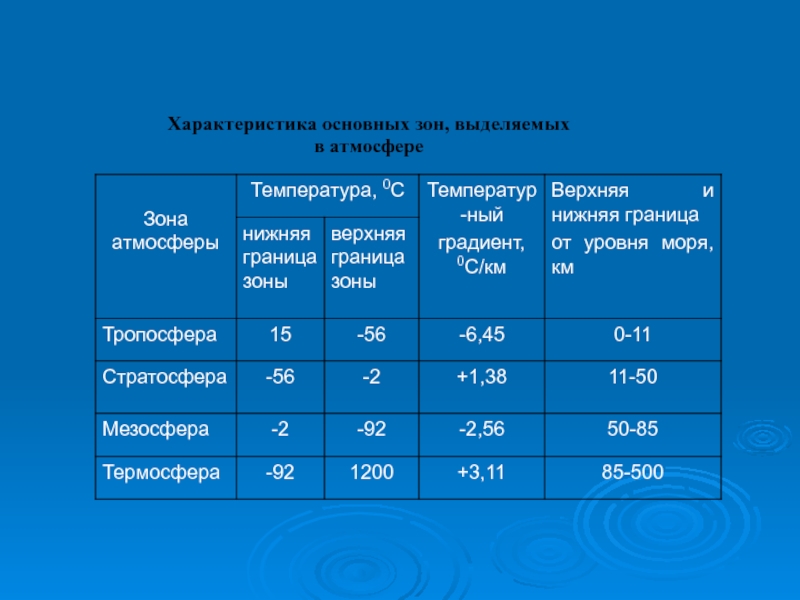
- 7. Характеристика основных зон, выделяемых в атмосфере
- 8. Способы выражения концентрации примесей в
- 9. Тропосфера Тропосфера – нижний, непосредственно соприкасающийся
- 13. Ультрафиолет – излучение с длиной волны
- 15. 1 нм = 10 Å 1А = 0,1 нм Стратосферный
- 16. Уменьшение плотности озонового слоя на 10%
- 18. UV-B излучение . составляет всего лишь
- 19. UV-B А поскольку молекулы ДНК поглощают излучение
- 20. Для человечества важно и то, что
- 21. Свойства молекулы озона Энергия связи атомов в
- 22. Озон в стратосфере образуется в результате фотохимической
- 23. Поскольку кислород в атмосфере представлен почти
- 24. Опасность представляют только образующиеся непосредственно в
- 25. Cl + O3 → ClO +
- 26. На высоте около 25 км вследствие
- 27. Нобелевская премия по химии вручается с 1901
- 28. Нобелевская премия по химии, 1995 «за
- 29. В столбе Земной атмосферы прослойка чистого
- 30. Механизм образования «озоновых дыр» Антарктида со всех
- 31. Механизм образования «озоновых дыр» В стратосфере при
- 32. Механизм образования «озоновых дыр» В темноте антарктической
- 33. Механизм образования «озоновых дыр» Когда наступает
- 34. Использование ХФУ( хлорфторуглеродов) охладители в
- 35. В 1987 года представители 24 стран в
- 36. В Монреале была принята система, по которой
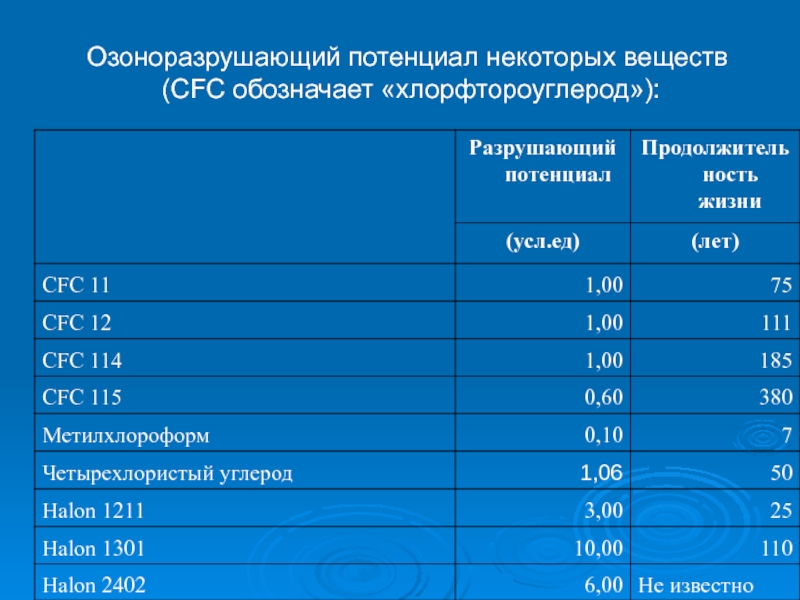
- 37. Озоноразрушающий потенциал некоторых веществ (CFC обозначает «хлорфтороуглерод»):
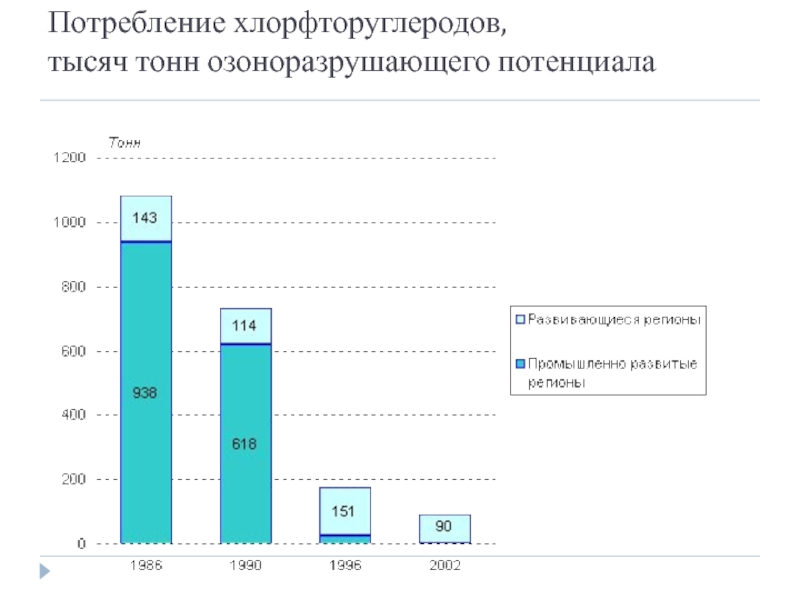
- 38. Потребление хлорфторуглеродов, тысяч тонн озоноразрушающего потенциала
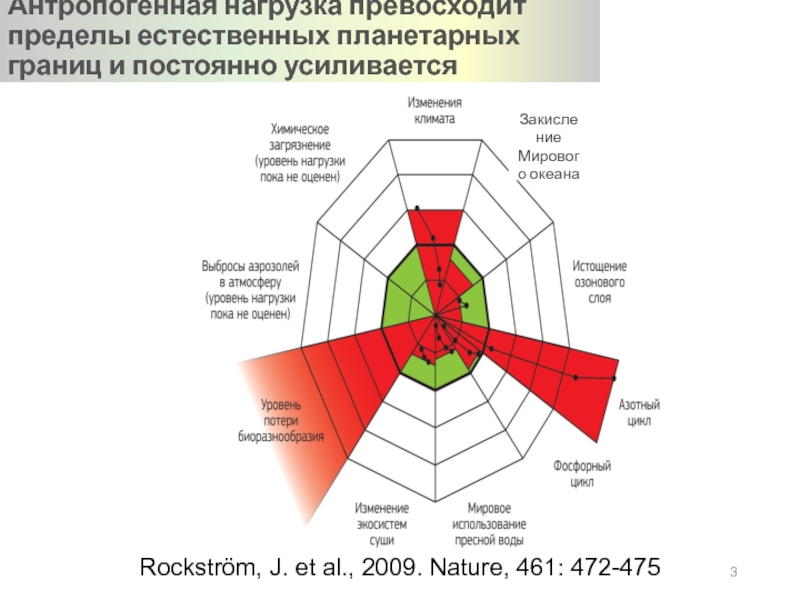
Слайд 2ПЛАНЕТАРНЫЕ ГРАНИЦЫ
КЛИМАТ
350 ppm СО2
+1 W/m2
БИОГЕОХИМИЧЕСКИЕ ЦИКЛЫ
35 MT N/yr
11 MT P/yr
ПОТЕРЯ БИОРАЗНООБРАЗИЯ
10
С/Х ЗЕМЛИ
15%
ХИМИЧЕСКОЕ ЗАГРЯЗНЕНИЕ
TBD
ПРЕСНАЯ ВОДА
4000 km3/yr
ЗАКИСЛЕНИЕ ОКЕАНА
Aragonite saturation ratio > 2.75
АТМОСФЕРНЫЙ АЭРОЗОЛЬ
TBD
ОЗОНОВЫЙ СЛОЙ
276 DU
Слайд 3Rockström, J. et al., 2009. Nature, 461: 472-475
Антропогенная нагрузка превосходит пределы
Закисление Мирового океана
Слайд 8 Способы выражения концентрации примесей в воздухе
Объемная доля – a
a
где v – объем примеси, V – объем газа, в котором она находится.
% об. = a * 100
ppm = млн -1 = a * 106
ppb = млрд-1 = a * 109
Слайд 9Тропосфера
Тропосфера – нижний, непосредственно соприкасающийся с земной поверхностью, слой атмосферы. Именно
Слайд 11
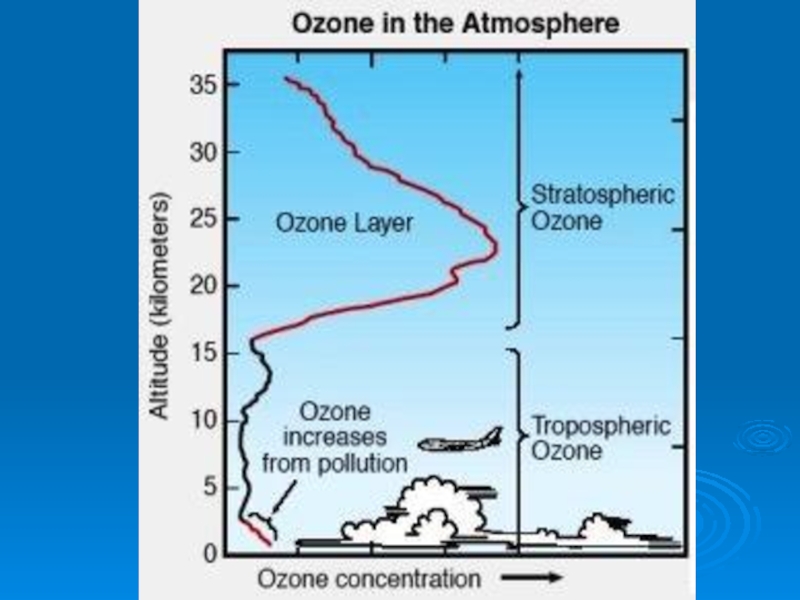
Основная масса озона сосредоточена в слое 15 - 35 км
с
20 - 25 км
Даже в самом озоновом слое только одна молекула из 100 000 является молекулой озона.
Слайд 13
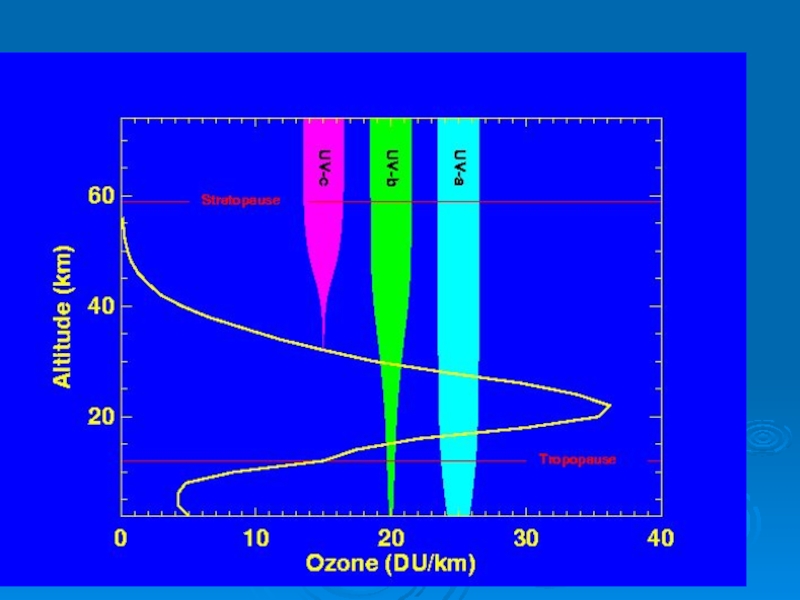
Ультрафиолет – излучение с длиной волны 10 ≤ λ ≤ 400
Ультрафиолет с длиной волны 200 ≤ λ - вакуумный, задерживается на высоте ок. 50 км
ультрафиолет В - излучение с длиной волны 200 ≤ λ ≤ 320 нм,
ультрафиолет А – излучение с длиной волны 320 ≤ λ ≤ 400 нм,
Слайд 151 нм = 10 Å
1А = 0,1 нм
Стратосферный озон поглощает ультрафиолетовое излучение в диапазоне волн
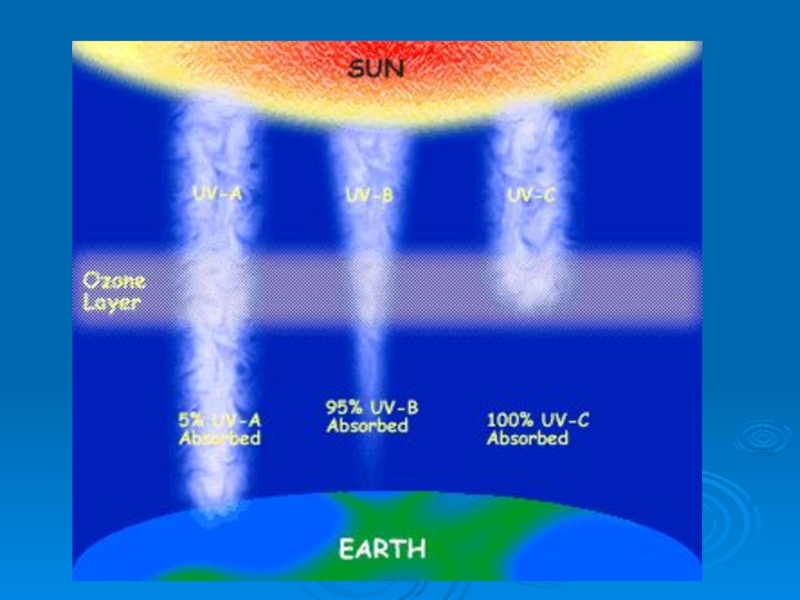
В результате при истощении озонового слоя возрастает именно UV-B излучение.
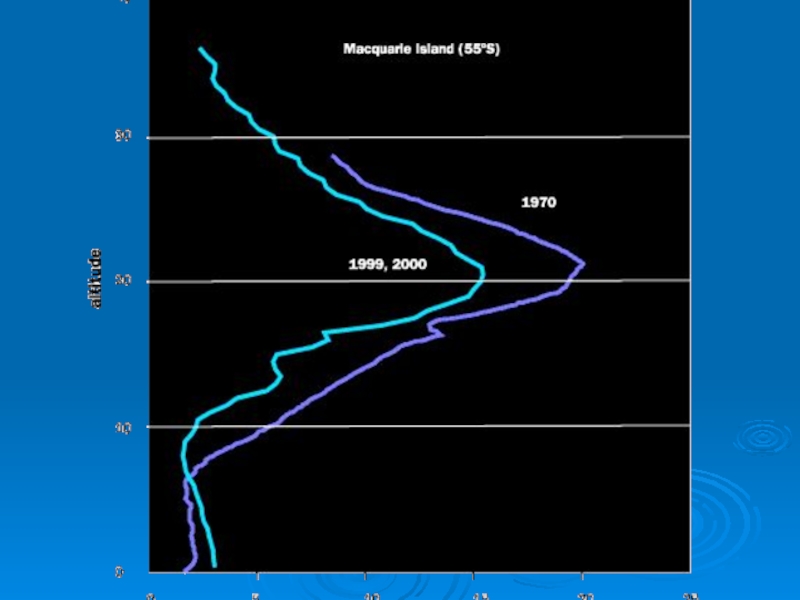
Слайд 16Уменьшение плотности озонового слоя на 10%
(сегодняшняя ситуация) приводит к увеличению
Слайд 18UV-B излучение
. составляет всего лишь 2% полного солнечного излучения, причём
однако именно это излучение определяет загар, вызывает рак кожи, ухудшение зрения.
Слайд 19UV-B
А поскольку молекулы ДНК поглощают излучение в том же диапазоне длин
Слайд 20
Для человечества важно и то, что повышение UV-B излучения пагубно для
Слайд 21Свойства молекулы озона
Энергия связи атомов в молекуле озона составляет 23, 9
Это приводит к тому, что молекула озона разваливается под действием даже видимого солнечного излучения.
Слайд 22Озон в стратосфере образуется в результате фотохимической диссоциации молекулярного кислорода под
О2 + hλ → O + O
2 [O + O2 + M → O3 + M ]
где M - любая молекула (обычно азота или кислорода), уносящая из реакции избыток энергии.
Реакция была открыта в 1930 г. Сиднеем Чепманом
Слайд 23Поскольку кислород в атмосфере представлен почти
исключительно как О2 , ясно,
NO + O3 → NO 2+ O2
O + NO2→NO + O2
О3 + hλ → O + O2
Азотный цикл
Слайд 24
Опасность представляют только образующиеся непосредственно в стратосфере оксид и диоксид азота.
Из
Исключение гемиоксид азота N2O
Слайд 25
Cl + O3 → ClO + O2
ClO + O → Cl
О3 + hλ → O + O2
Один атом хлора может разрушить 105 молекул озона.
Хлорный цикл
Слайд 26
На высоте около 25 км вследствие высокой интенсивности солнечной радиации происходит
Слайд 27Нобелевская премия по химии вручается с 1901 года
Крутцен, Роуленд и
Слайд 28 Нобелевская премия по химии, 1995
«за работу по химии атмосферы, особенно
Пауль Крутцен
Марио Молина
Шервуд Роуленд
Слайд 29
В столбе Земной атмосферы прослойка чистого озона имела бы толщину около
Слайд 30Механизм образования «озоновых дыр»
Антарктида со всех сторон окружена океаном и ветры
Слайд 31Механизм образования «озоновых дыр»
В стратосфере при температуре ниже -100°С происходит конденсация
Слайд 32Механизм образования «озоновых дыр»
В темноте антарктической зимы атомы хлора не сразу
Слайд 33Механизм образования «озоновых дыр»
Когда наступает весна, солнечная радиация разрушает накопившийся димер,
Слайд 34Использование ХФУ( хлорфторуглеродов)
охладители в холодильных установках и кондиционерах.
для производства
в баллонах для распыления аэрозолей
для промывания электрооборудования.
Слайд 35В 1987 года представители 24 стран в Монреале подписали соглашение, по
Однако в связи с ухудшающейся ситуацией в 1990-м году в Лондоне были приняты поправки к Монреальскому протоколу.
Согласно Лондонским поправкам в список регулируемых ХФУ вошли еще 10 веществ и было принято решение прекратить использование ХФУ, галогенов и четыреххлористого углерода к 2000-х тысячному, а метилхлороформа - к 2005-му году
Слайд 36В Монреале была принята система, по которой озоноразрушающие вещества подразделялись по
способность разрушать озон
продолжительность их жизни