- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ядерно-химические свойства презентация
Содержание
- 1. Ядерно-химические свойства
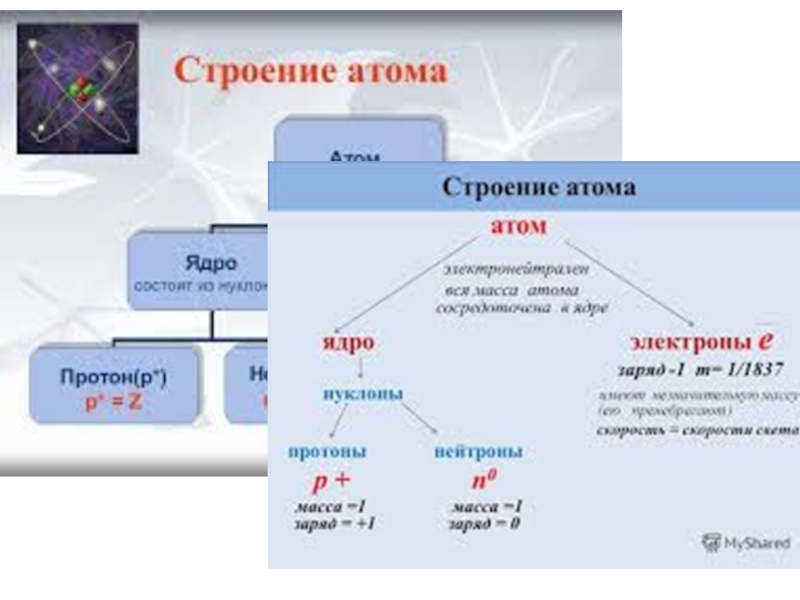
- 2. АТОМ от греч. ἄτομος – неделимый - мельчайшая частица химического элемента, сохраняющая его свойства.
- 4. ХАРАКТЕРИСТИКИ АТОМА Размер порядка 10-8 см.
- 6. Характеристики атомного ядра Основные величины, характеризующие
- 8. Явление радиоактивности ЗНАТЬ!!!!!! Открытие радиоактивности, история
- 9. Из истории открытия 1896 г. Анри Беккерель
- 10. Из истории открытия М. Склодовская-Кюри - назвала
- 11. РАДИОАКТИВНОСТЬ - свойство некоторых нестабильных атомов подвергаться
- 12. Радиоактивный элемент – химический
- 13. РАДИОАКТИВНЫЙ РАСПАД самопроизвольное превращение нестабильных атомных
- 14. Процесс радиоактивного распада происходит до тех
- 15. ОСОБЕННОСТИ РАДИОАКТИВ НЫХ ПРЕВРАЩЕНИЙ Делают их более
- 16. ТИПЫ РАДИОАКТИВНЫХ РАСПАДОВ 1. α-распад 2. β-распад
- 17. N(t) =N0 exp(-λt) Статистика
- 18. КИНЕТИЧЕСКИЙ ЗАКОН РАДИОАКТИВНОГО РАСПАДА
- 19. Постоянные радиоактивного распада: λ, Т1/2
- 20. Т1/2 - период полураспада промежуток времени,
- 21. правило десяти полураспадов, т.е. промежуток
- 22. СРЕДНЕЕ ВРЕМЯ ЖИЗНИ τ
- 23. т1/2= τln2=0,693τ - взаимосвязь между средней
- 24. АКТИВНОСТЬ dN/dt – активность образца (мера радиоактивности).
- 25. Зависимость активности от времени
- 26. Единицы измерения и виды активности Измеряют в
- 27. Кюри русское обозначение: Ки; международное: Ci
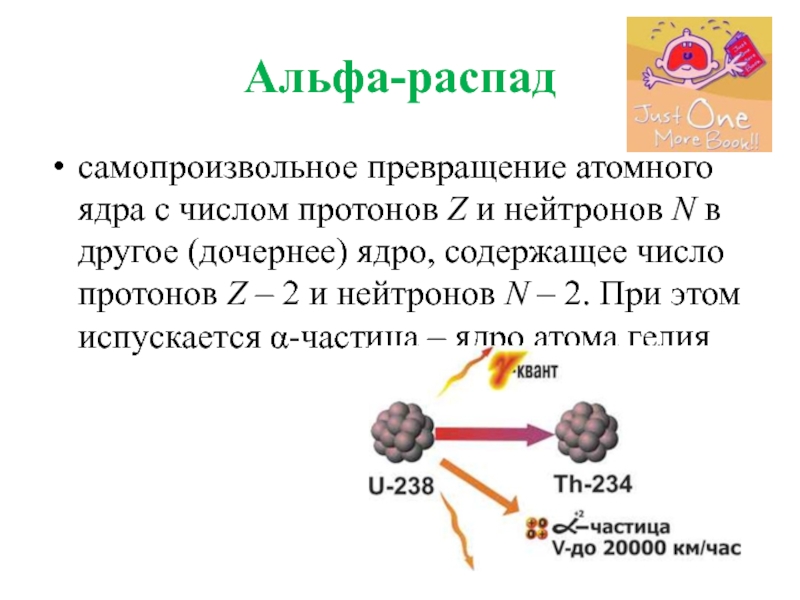
- 28. Альфа-распад самопроизвольное превращение атомного ядра с числом
- 29. Схематическое и математическое изображение α -распада
- 30. Правило сдвига ФаянсА-Содди элемент, образовавшийся из другого
- 31. β- -распаду подвергаются ядра, имеющие избыток
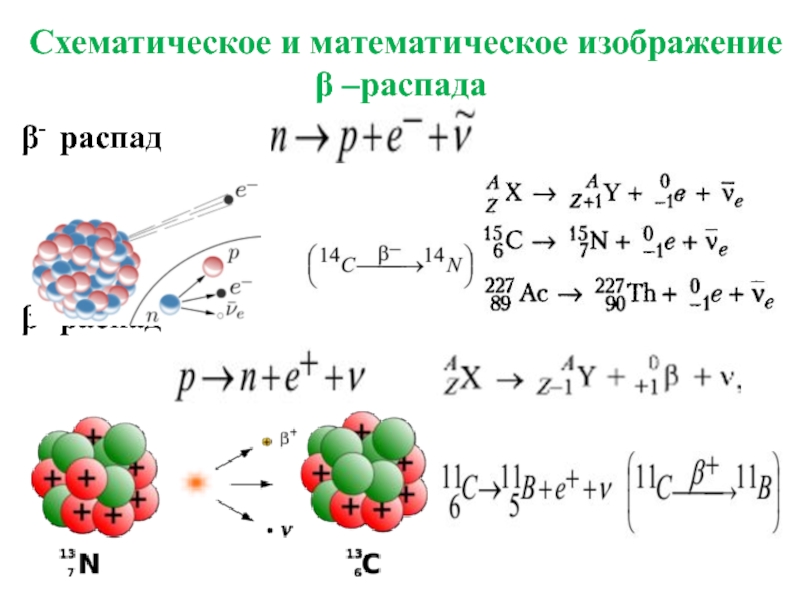
- 32. Схематическое и математическое изображение β –распада β- распад β+ распад
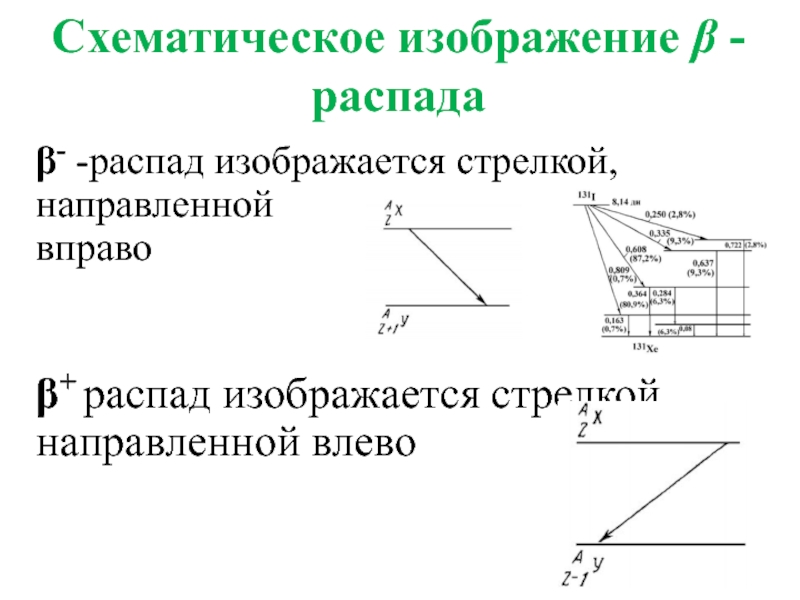
- 33. Схематическое изображение β -распада β- -распад изображается
- 34. γ−распад Ядро атома, как и электрон в
- 35. ПС в соответствии с Т1/2 стабильных изотопов
- 36. Периодическая система химических элементов с элементами, раскрашенными
- 39. К семинару 1. Рассмотреть особенности строения тяжелых
- 40. К семинару 6. Радиоактивный распад. Виды распада
Слайд 2АТОМ
от греч. ἄτομος – неделимый - мельчайшая частица химического элемента, сохраняющая
Слайд 4ХАРАКТЕРИСТИКИ АТОМА
Размер
порядка 10-8 см.
Масса атома
(обычно выражают в атомных
Слайд 6 Характеристики атомного ядра
Основные величины, характеризующие атомное ядро:
зарядовое число Z (атомный
массовое число А определяет число нуклонов в ядре. Число нейтронов в ядре N=A-Z
Слайд 8Явление радиоактивности
ЗНАТЬ!!!!!!
Открытие радиоактивности, история
Радиоактивный распад- определение, особенности, виды
Кинетический закон радиоактивного распада
Постоянные
Активность – определение, единицы
Специфика накопления продуктов распада. Вековое и подвижное равновесие.
Виды радиоактивного распада и их характеристики
Слайд 9Из истории открытия
1896 г. Анри Беккерель (франц.) открыл
явление радиоактивности.
Радиоактивность
способность атомов к самопроизвольному излучению.
(«лучи Беккереля»)
1899 г. Эрнест Резерфорд обнаружил, что это излучение неоднородно.
Слайд 10Из истории открытия
М. Склодовская-Кюри - назвала «лучи Беккереля» радиацией
М. Склодовская-Кюри и
открыли полоний и радий (лучистый)
Слайд 11РАДИОАКТИВНОСТЬ
- свойство некоторых нестабильных атомов подвергаться спонтанному (самопроизвольному) распаду и изменению
Слайд 12
Радиоактивный элемент –
химический элемент, все изотопы
которого радиоактивны,
радиоактивный элемент –
имеющих одинаковое массовое число. 219Rn-актинон 220Rn – торон 222Rn - радон
Слайд 13РАДИОАКТИВНЫЙ
РАСПАД
самопроизвольное превращение нестабильных атомных ядер в другие ядра, сопровождаемое испусканием
(РН) – нуклид, испускающий
ионизирующее излучение.
Слайд 14
Процесс радиоактивного распада происходит до тех пор, пока не образуется стабильное
Последовательность РН,
возникающих при этом –
радиоактивный ряд
(радиоактивная цепочка)
Слайд 15ОСОБЕННОСТИ РАДИОАКТИВ НЫХ ПРЕВРАЩЕНИЙ
Делают их более простыми по сравнению с химическими
1. Справедлив один кинетический закон для всех типов р/а-превращений
2. Ограниченное число р/а-превращений
Слайд 16ТИПЫ РАДИОАКТИВНЫХ РАСПАДОВ
1. α-распад
2. β-распад
3. γ-распад
4. ē-захват (электронный)
5. n-распад (нейтронный)
6. p-распад
7. спонтанное деление
8. экзотические типы распада
Слайд 17
N(t) =N0 exp(-λt)
Статистика радиоактивного распада описывается распределением Пуассона.
вытекает экспоненциальный закон радиоактивного
Слайд 19
Постоянные радиоактивного распада: λ, Т1/2 и τ.
λ (лямбда) постоянная
λ является величиной, показывающей, какая часть атомов данного радиоэлемента распадается в единицу времени
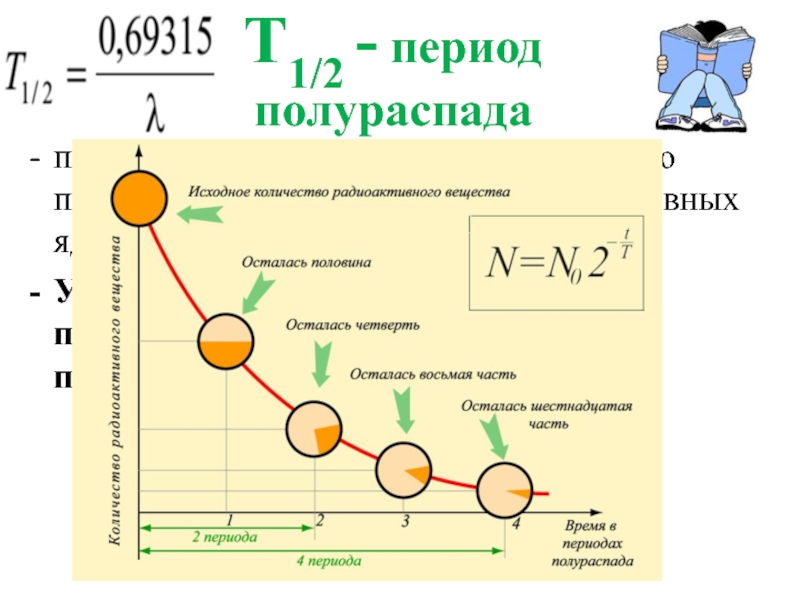
Слайд 20Т1/2 - период
полураспада
промежуток времени, в течение которого происходит распад половины
Убывание количества радионуклида происходит по экспоненте. Поэтому, полностью он не исчезнет никогда
Слайд 21
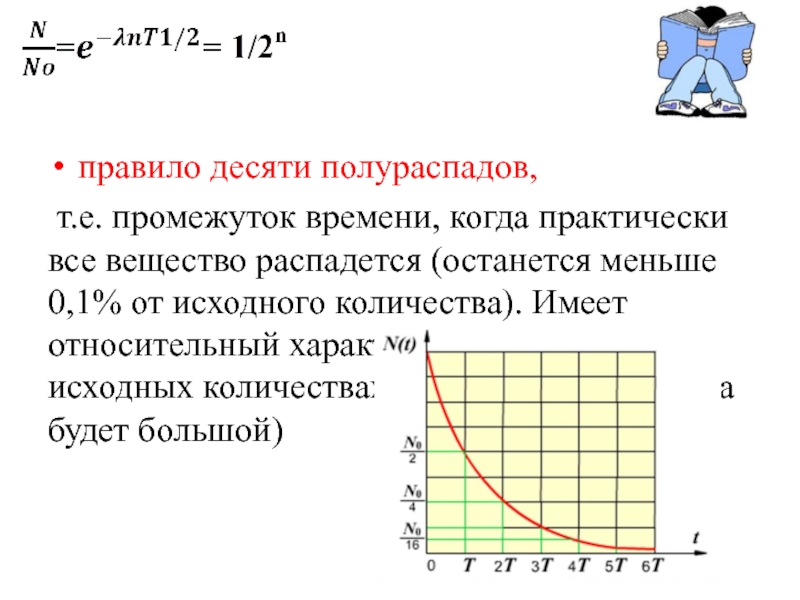
правило десяти полураспадов,
т.е. промежуток времени, когда практически все вещество распадется
Слайд 23
т1/2= τln2=0,693τ - взаимосвязь между средней продолжительностью жизни атома и периодом
Взаимосвязь между тремя постоянными радиоактивного распада
Слайд 24АКТИВНОСТЬ
dN/dt – активность образца (мера радиоактивности).
Характеризует число распадов за одну
A=-dN/dt
Слайд 26Единицы измерения и виды активности
Измеряют в расп/c.
Системная единица – Беккерель
Внесистемные – кюри, банановый эквивалент, махе, резерфорд, эман.
Слайд 27Кюри
русское обозначение: Ки;
международное: Ci
Единица кюри — существительное мужского рода
Активность вещества равна 1 Ки, если в нём каждую секунду происходит 3,7·1010 радиоактивных распадов .
1 Ки = 3,7·1010 Бк (точно)
1 Бк ≈ 2,7027·10−11 Ки.
Значение 1 кюри изначально было определено как активность эманации радия (т. е. радона -222), находящейся в радиоактивном равновесии с 1 г 226Ra
Слайд 28Альфа-распад
самопроизвольное превращение атомного ядра с числом протонов Z и нейтронов N
Слайд 30Правило сдвига ФаянсА-Содди
элемент, образовавшийся из другого элемента при испускании α-лучей, по
Слайд 31
β- -распаду подвергаются ядра, имеющие избыток нейтронов,
причиной β+ -распада является избыток
Правила смещения при:
β- распаде
β+ распаде
Слайд 33Схематическое изображение β -распада
β- -распад изображается стрелкой, направленной
вправо
β+ распад изображается стрелкой,
Слайд 34γ−распад
Ядро атома, как и электрон в атомной оболочке, может находиться в
В таком случае избыточная энергия выделяется в виде электромагнитного () излучения. Так как разность энергетических уровней ядра велика, то излучение, выходящее из ядра, будет очень коротковолновым. Речь идет о жестких рентгеновских лучах, которые называются γ
Слайд 36Периодическая система химических элементов с элементами, раскрашенными в соответствии с периодом
Mg Элементы, содержащие как минимум один стабильный изотоп;
U Радиоактивные элементы: наиболее стабильный изотоп имеет очень большой период полураспада, 4 млн. лет;
Am Радиоактивные элементы: наиболее стабильный изотоп имеет период полураспада от 800 до 34 000 лет;
Ac Радиоактивные элементы: наиболее стабильный изотоп имеет период полураспада от одного дня до 103 лет; \
No Высокорадиоактивные элементы: наиболее стабильный изотоп имеет период полураспада от нескольких минут до одного дня;
118 (Og) Экстремально радиоактивные элементы: наиболее стабильный изотоп имеет период полураспада менее нескольких минут. Ввиду их нестабильности и, как следствие, радиоактивности об этих элементах известно очень мало.
Слайд 39К семинару
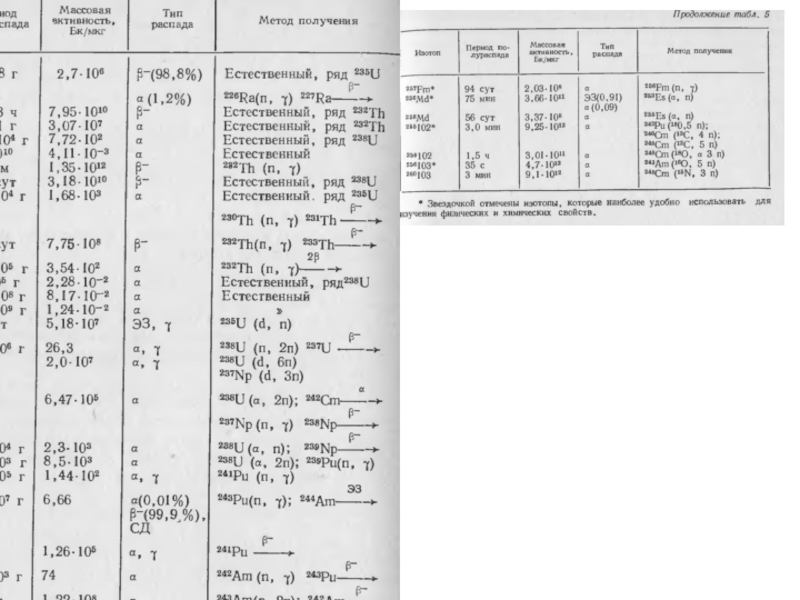
1. Рассмотреть особенности строения тяжелых элементов и трансурановых (по Сиборгу)
2.
3. Сравнить гипотезы и теории расположения актиноидов в ПС. Оценить достоинства и недостатки.
4. Общие физические и химические свойства актиноидов. Сравнение по валентным возможностям элементов.
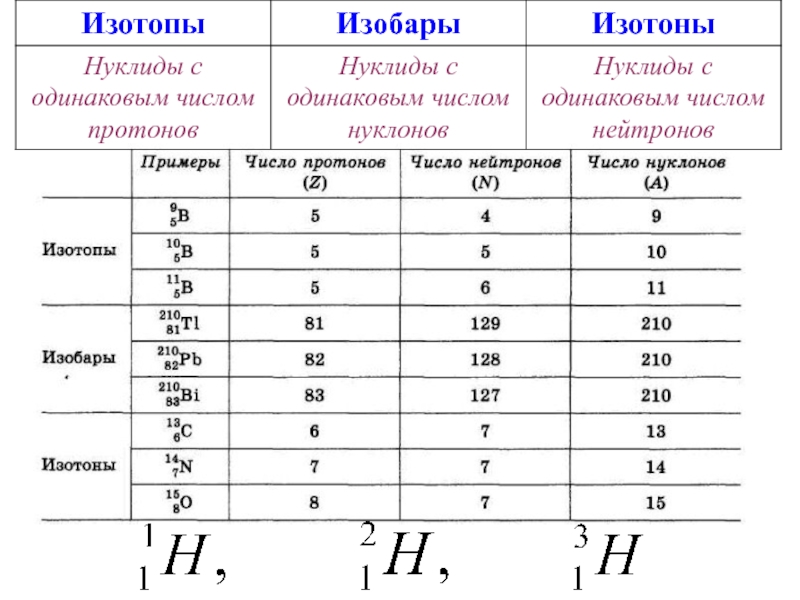
5. Строение атома. Изотопы, изотоны, изобары, нуклиды.
Слайд 40К семинару
6. Радиоактивный распад. Виды распада и их характеристики. Правила смещения
7. Радиоактивность. Единицы измерения. Основные характеристики. Решение расчетных задач.
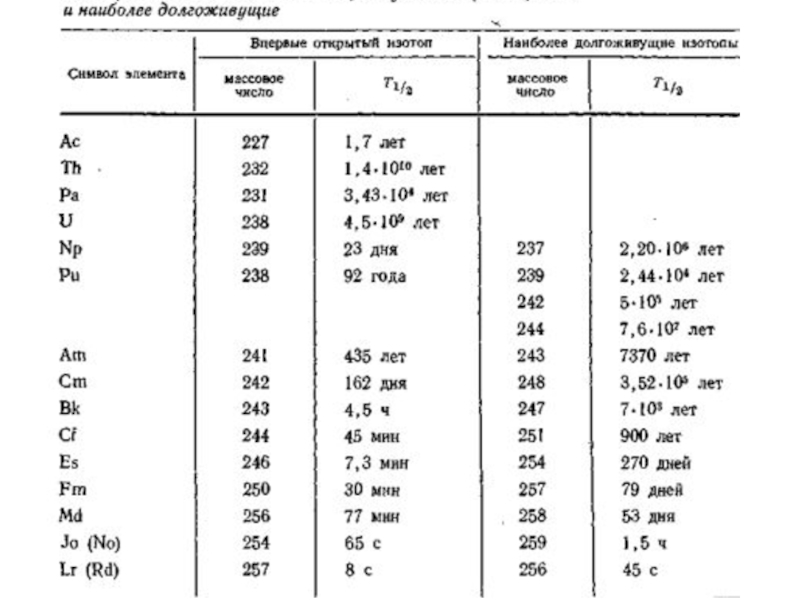
8. Составить таблицу с Т1/2 для основных изотопов актиноидов.