- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Второй закон термодинамики, понятие о циклах и энтропии газа презентация
Содержание
- 1. Второй закон термодинамики, понятие о циклах и энтропии газа
- 2. 2. КРУГОВОЙ ПРОЦЕСС Круговым процессом
- 4. В диаграммах состояния P, V и других
- 5. Цикл, совершаемый идеальным газом, можно разбить на
- 6. Если за цикл совершается положительная работа (цикл
- 7. Прямой цикл
- 8. Круговые процессы лежат в основе
- 9. Т.о. работа, совершаемая за цикл, равна
- 10. Термический коэффициент полезного действия для кругового
- 11. Процесс называют обратимым, если он протекает
- 12. Пример обратимого процесса в механике Падение упругого
- 13. Но при сжатии и расширении газа Быстро
- 14. Процесс называется необратимым, если он
- 15. Свойством обратимости обладают только равновесные процессы.
- 16. При адиабатическом расширении газа условие теплоизолированности системы
- 17. Конечно, в реальных условиях и в этом
- 18. Максимальным КПД обладают машины у
- 19. - многие процессы в природе и
- 20. 2. ПОНЯТИЕ ОБ ЭНТРОПИИ
- 21. Тогда
- 22. Для адиабатного процесса dS = 0,
- 23. W – термодинамическая вероятность данного состояния
- 24. 3. Второй закон термодинамики
- 25. Второе начало термодинамики Невозможен процесс, единственным результатом
- 26. 4. Цикл Карно и его термодинамическое значение
- 27. Тепловые машины Тепловой машиной называется
- 28. Принцип действия тепловых двигателей
- 29. Реактивный двигатель
- 32. КПД тепловых двигателей
- 33. КПД тепловых двигателей
- 34. КПД тепловых двигателей
- 35. КПД тепловых двигателей
- 36. КПД тепловых двигателей
- 37. КПД тепловых двигателей
- 38. КПД тепловых двигателей
- 39. Идеальная тепловая машина Наибольшим КПД при заданных
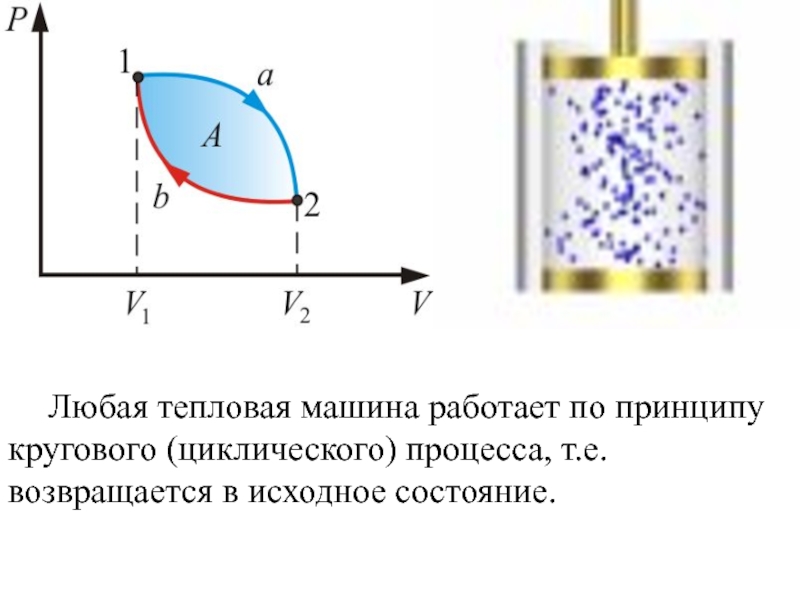
- 40. Любая тепловая машина работает по принципу кругового (циклического) процесса, т.е. возвращается в исходное состояние.
- 41. Но чтобы при этом была
- 43. Зачем холодильник? Так как в
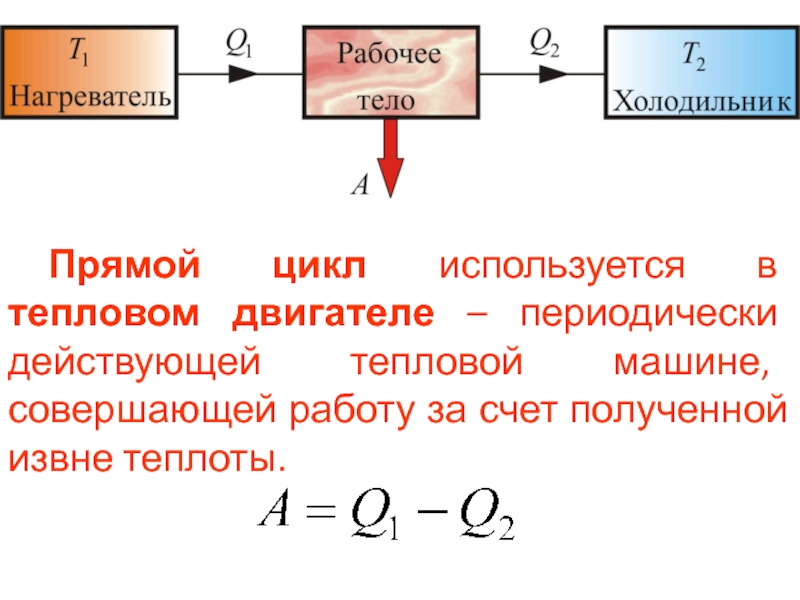
- 44. Прямой цикл используется в тепловом двигателе –
- 45. От термостата с более высокой температурой Т1,
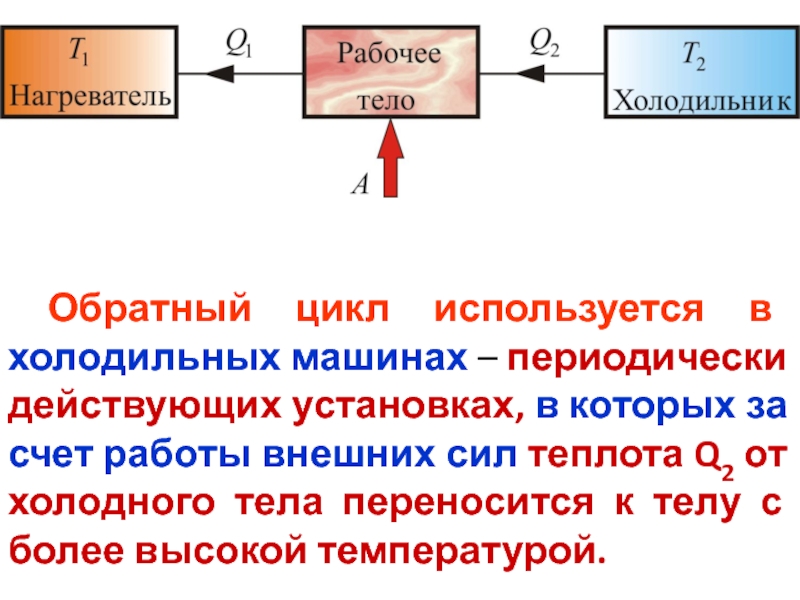
- 46. Обратный цикл используется в холодильных машинах –
- 47. Цикл Карно (обратимый)
- 49. Основываясь на втором начале термодинамики, Карно вывел теорему, носящую теперь его имя:
- 50. ТЕОРЕМА КАРНО Из всех периодически действующих
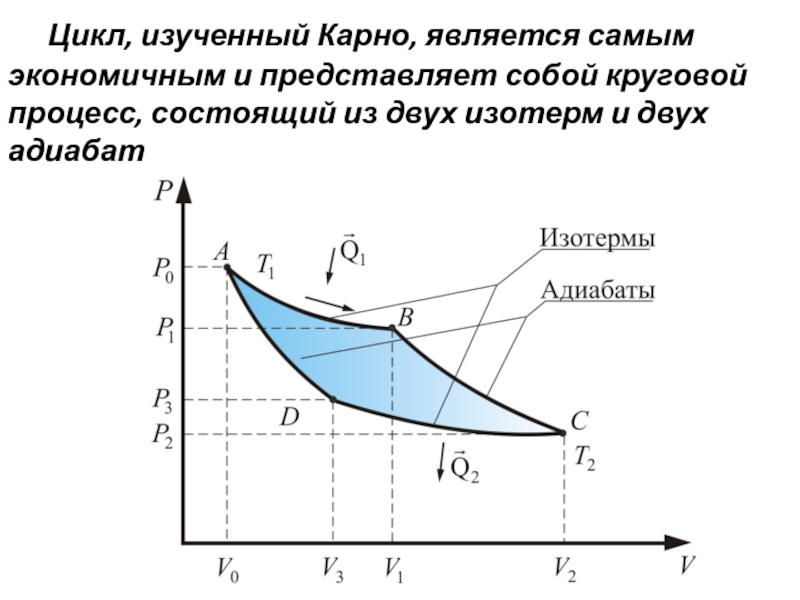
- 51. Цикл, изученный Карно, является самым экономичным и
- 52. Рассмотрим круговой процесс, при котором тепло можно
- 53. Напомню, что тепловой машиной называется периодически действующий
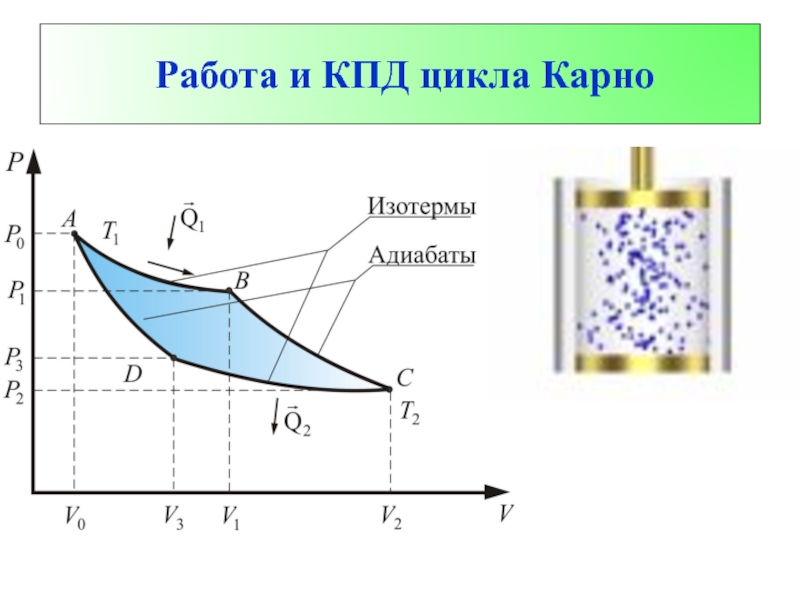
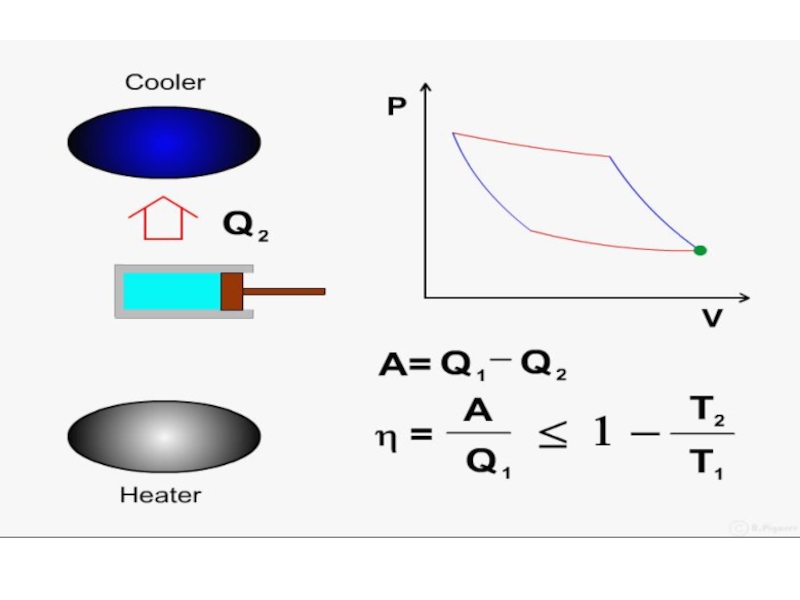
- 54. Работа и КПД цикла Карно
- 55. Рассмотрим процесс сначала качественно.
- 56. В изотермическом процессе dU =
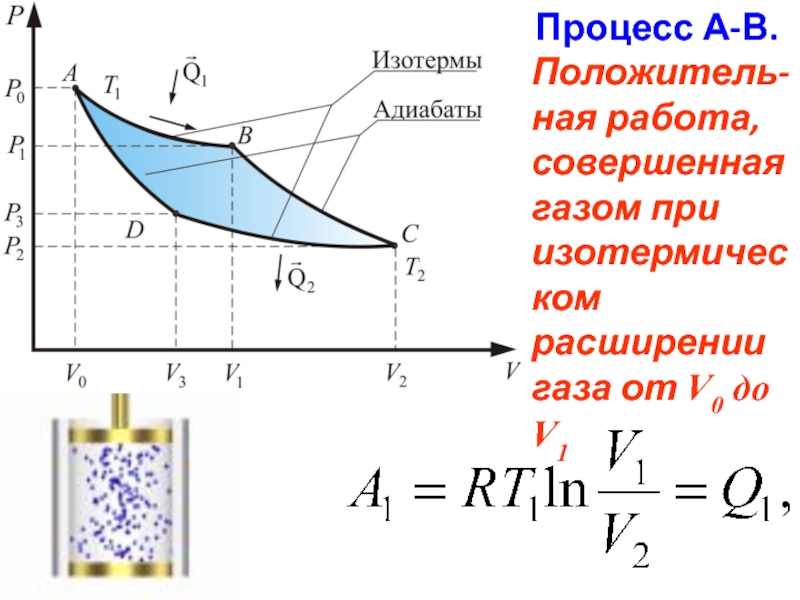
- 57. Процесс А-В. Положитель-ная работа, совершенная
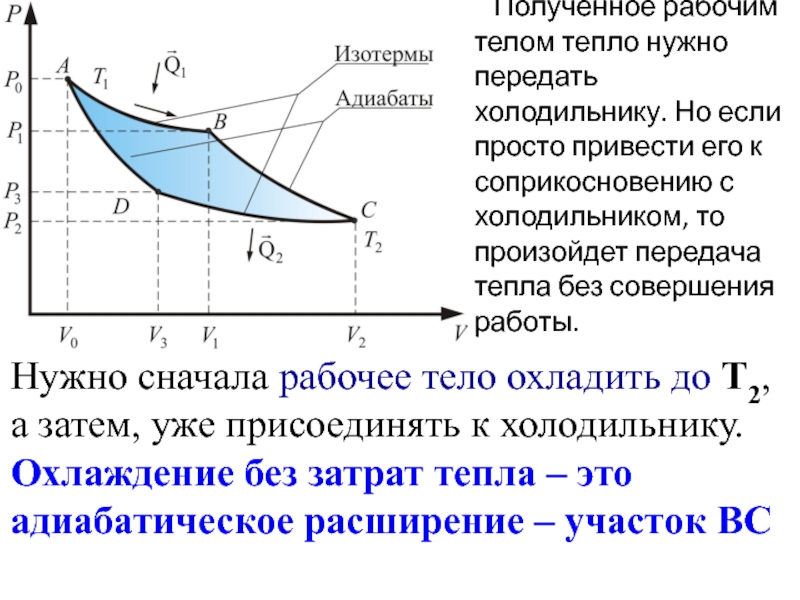
- 58. Полученное рабочим телом тепло нужно
- 59. Процесс В-С – адиабатическое расширение. При адиабатическом
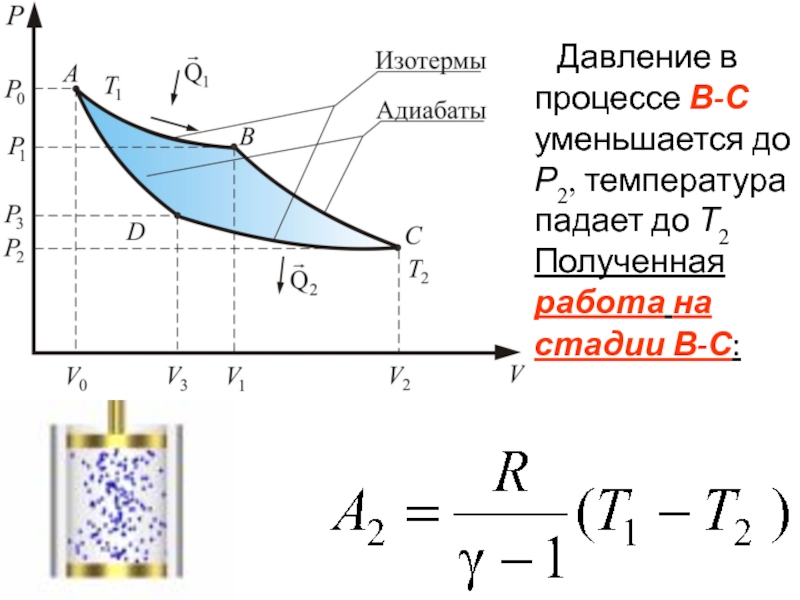
- 60. Давление в процессе В-С уменьшается
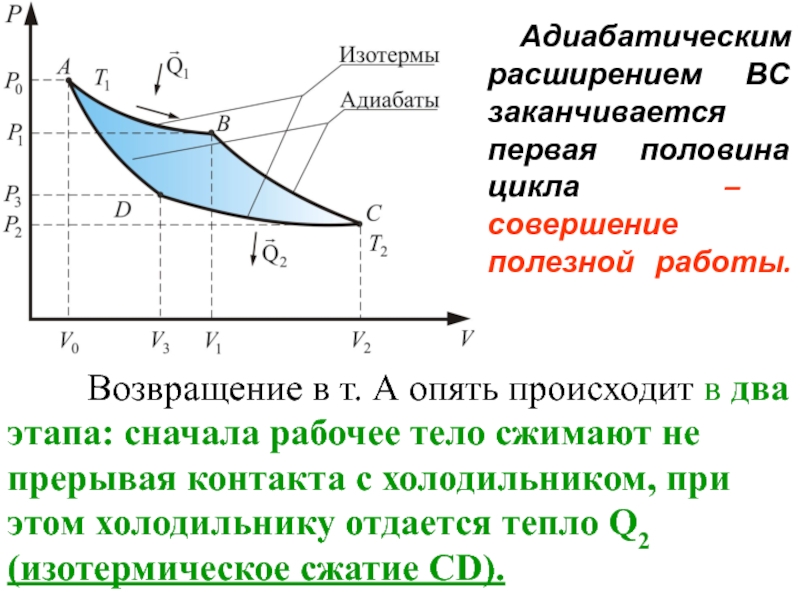
- 61. Адиабатическим расширением ВС заканчивается первая
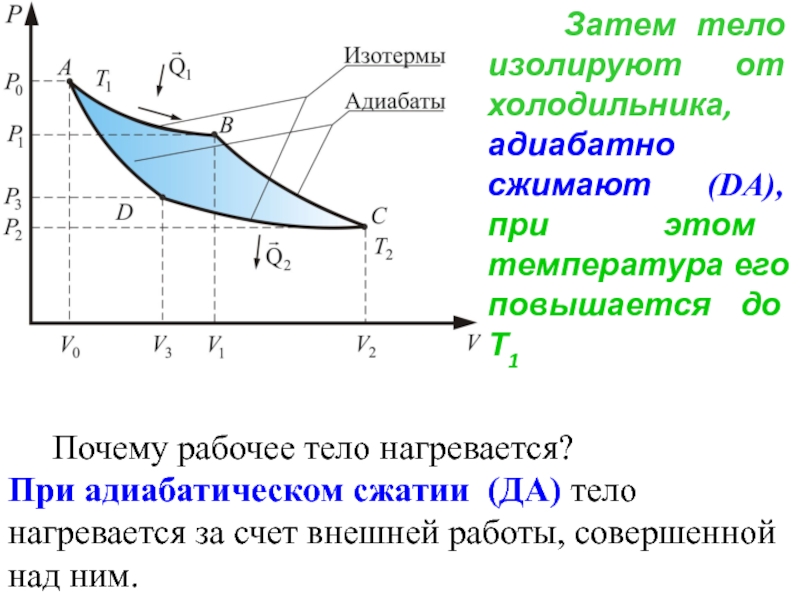
- 62. Затем тело изолируют от холодильника,
- 63. Процесс C-D -изотермическое сжатие На третьем этапе
- 64. Процесс D-А – адиабатическое сжатие.
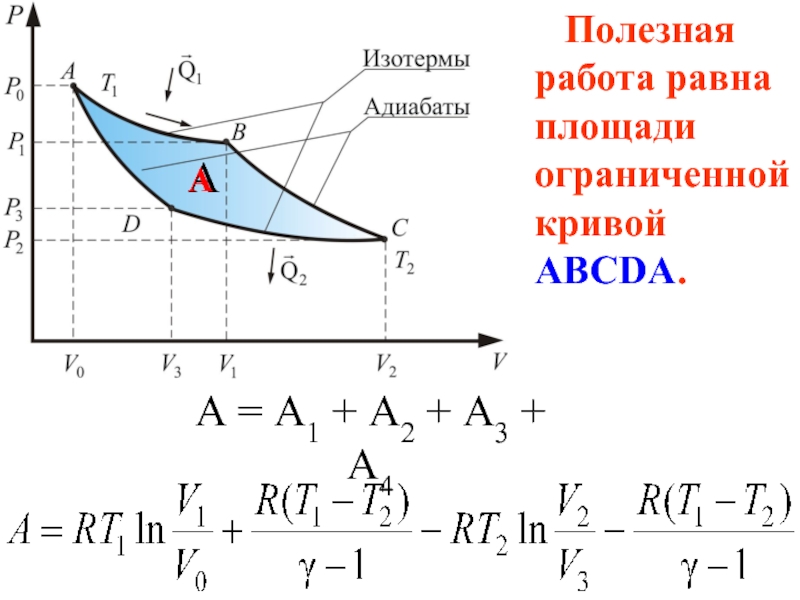
- 65. А = А1 + А2 + А3
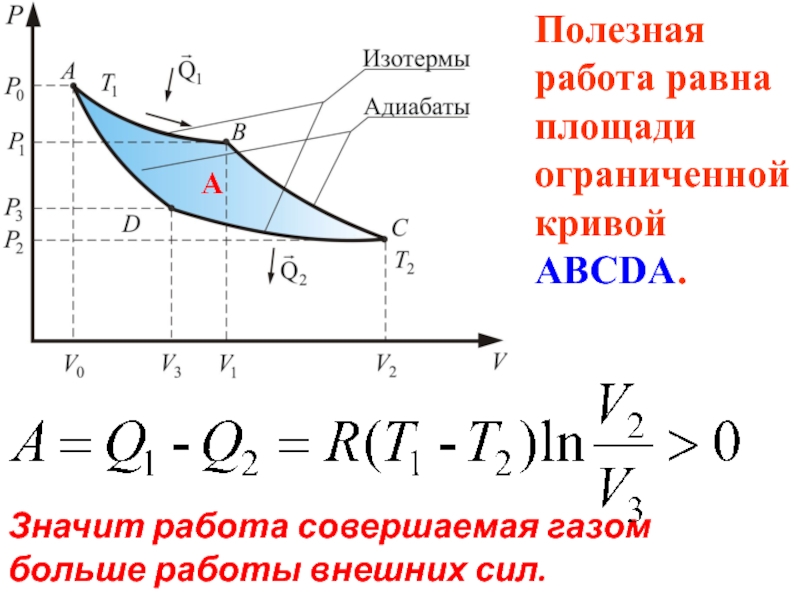
- 66. Значит работа совершаемая газом больше работы
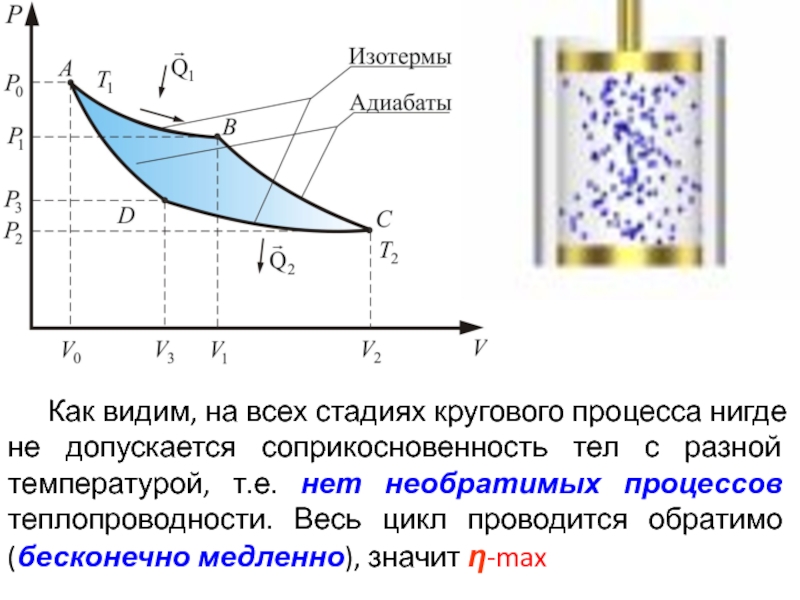
- 67. Как видим, на всех стадиях кругового процесса
- 68. Итак, полезная работа
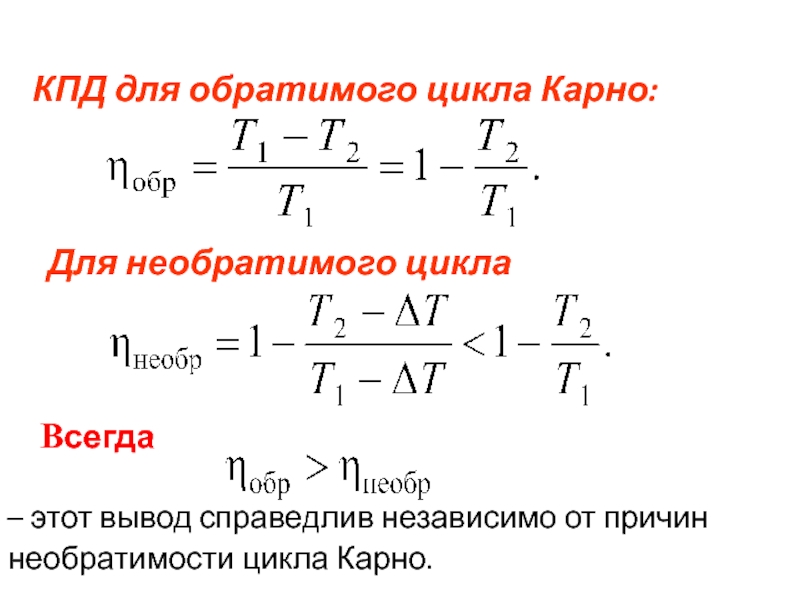
- 70. Видно, что η
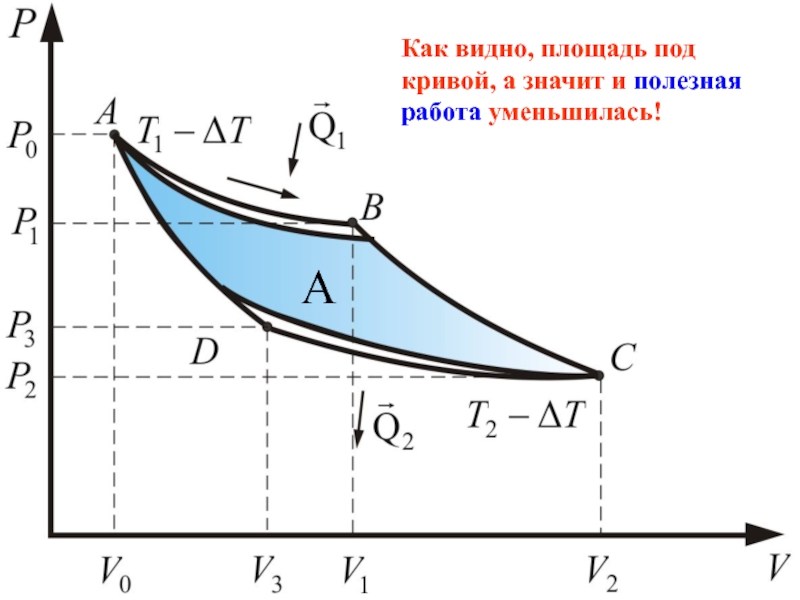
- 71. Необратимый цикл Предположим
- 72. Любой процесс, не удовлетворяющий условию обратимости, мы
- 73. Для продолжения движения необходим компенсирующий процесс охлаждения
- 74. Как видно, площадь под кривой, а значит и полезная работа уменьшилась! А
- 75. КПД для обратимого цикла
- 76. Формулировка второго начала термодинамики В изолированной
- 77. Второе начало термодинамики – закон возрастания энтропии
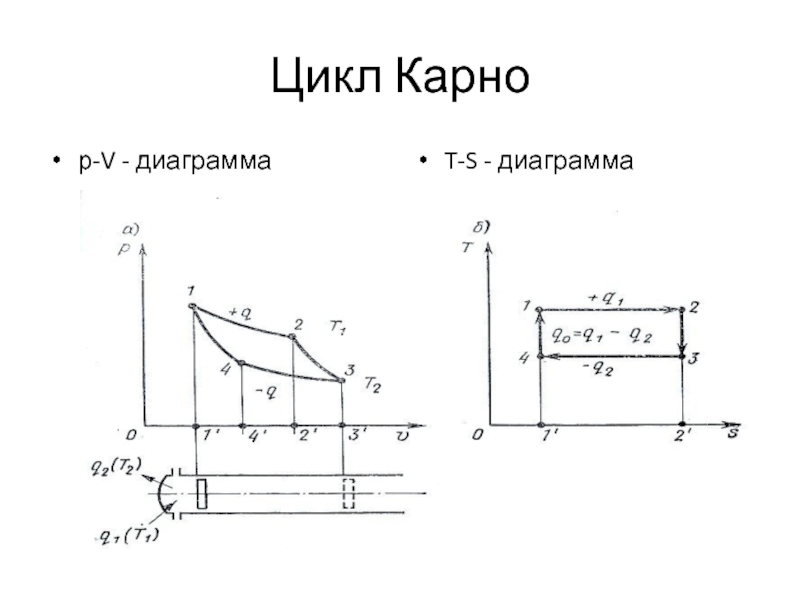
- 78. 5.Понятие о TS-диаграмме
- 79. Цикл Карно р-V - диаграмма T-S - диаграмма
Слайд 1Второй закон термодинамики, понятие о циклах и энтропии газа
Понятие о круговом
Понятие об энтропии газа
Цикл Карно и его термодинамическое значение
Понятие о TS-диаграмме
Слайд 22. КРУГОВОЙ ПРОЦЕСС
Круговым процессом (циклом) называется процесс, в результате
Изменение внутренней энергии за цикл равно нулю .
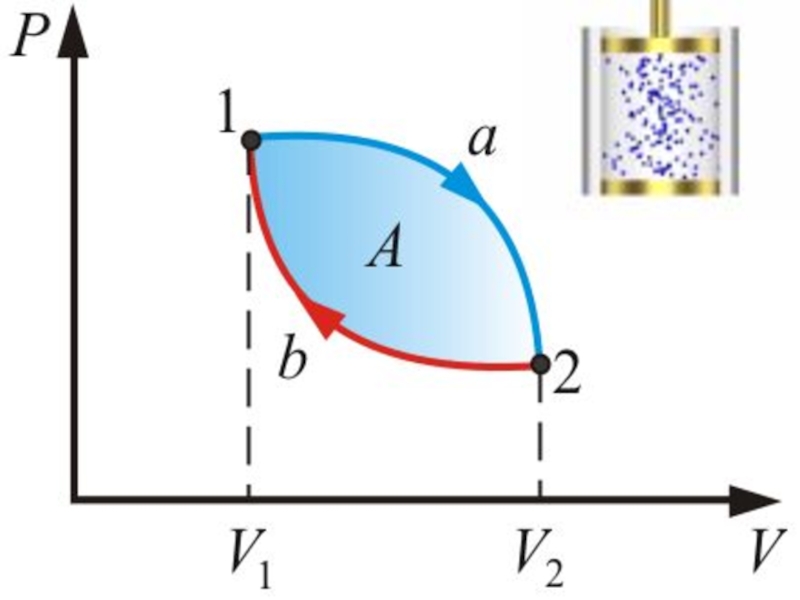
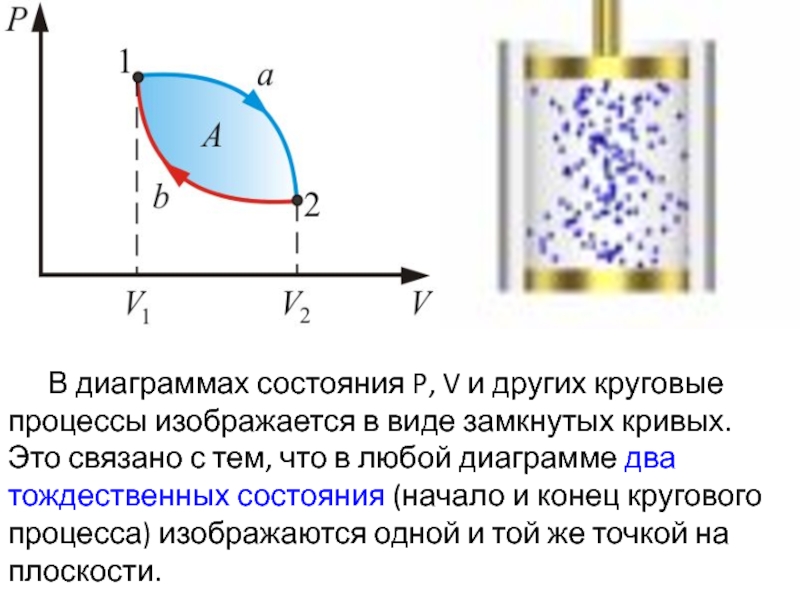
Слайд 4 В диаграммах состояния P, V и других круговые процессы изображается в
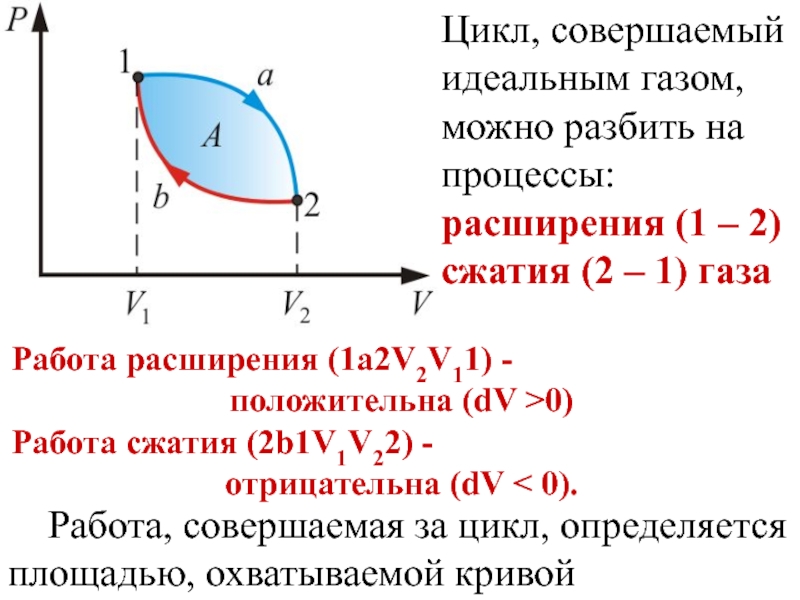
Слайд 5Цикл, совершаемый идеальным газом, можно разбить на процессы:
расширения (1 –
сжатия (2 – 1) газа
Работа расширения (1a2V2V11) -
положительна (dV >0)
Работа сжатия (2b1V1V22) -
отрицательна (dV < 0).
Работа, совершаемая за цикл, определяется площадью, охватываемой кривой
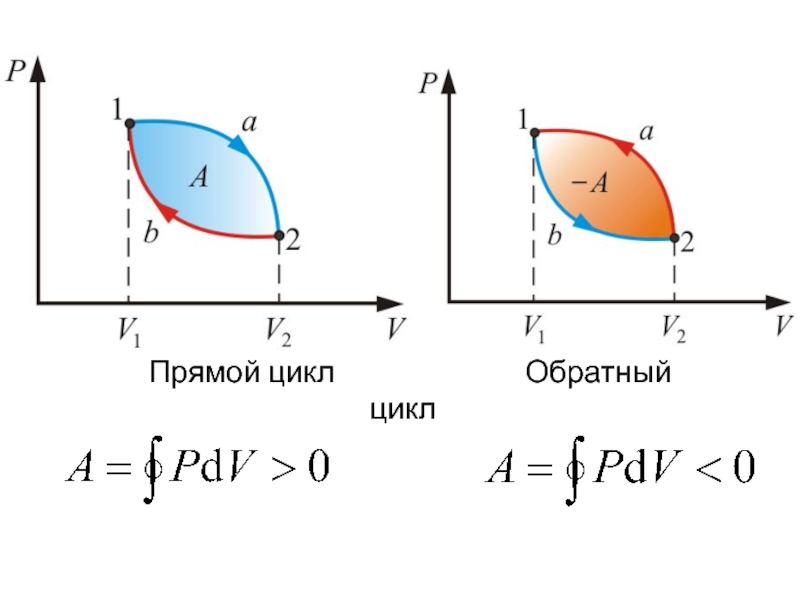
Слайд 6Если за цикл совершается положительная работа (цикл протекает по часовой стрелке), то
Слайд 8 Круговые процессы лежат в основе всех тепловых машин: двигателей
Слайд 9 Т.о. работа, совершаемая за цикл, равна количеству полученной извне теплоты.
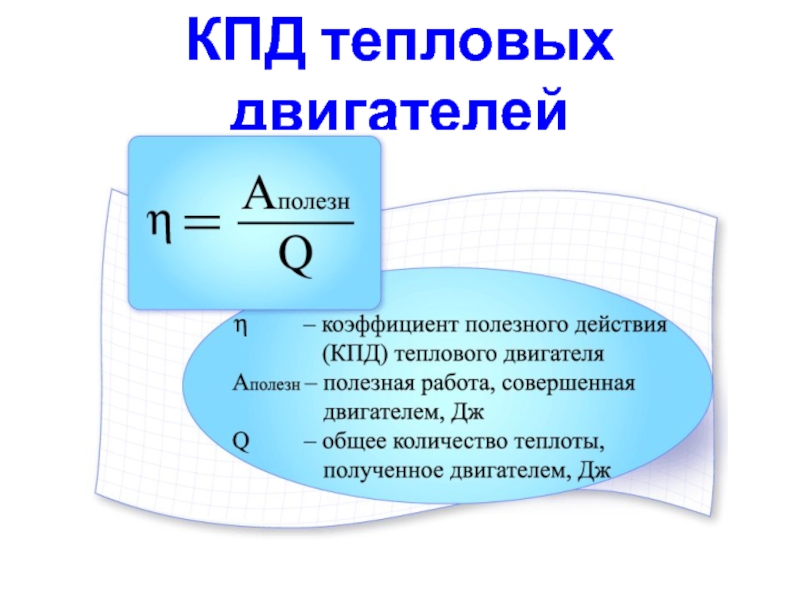
Слайд 10 Термический коэффициент полезного действия для кругового процесса
Слайд 11 Процесс называют обратимым, если он протекает таким образом, что после окончания
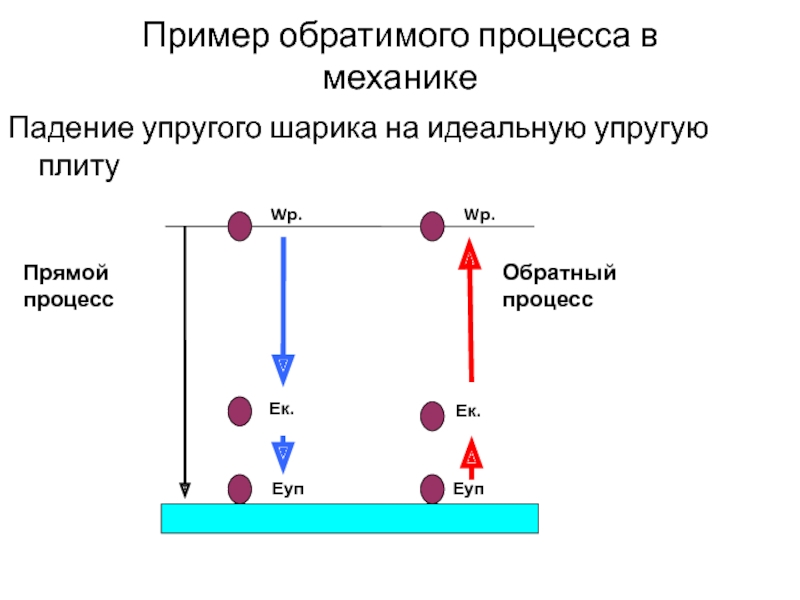
Слайд 12Пример обратимого процесса в механике
Падение упругого шарика на идеальную упругую плиту
Прямой
Обратный процесс
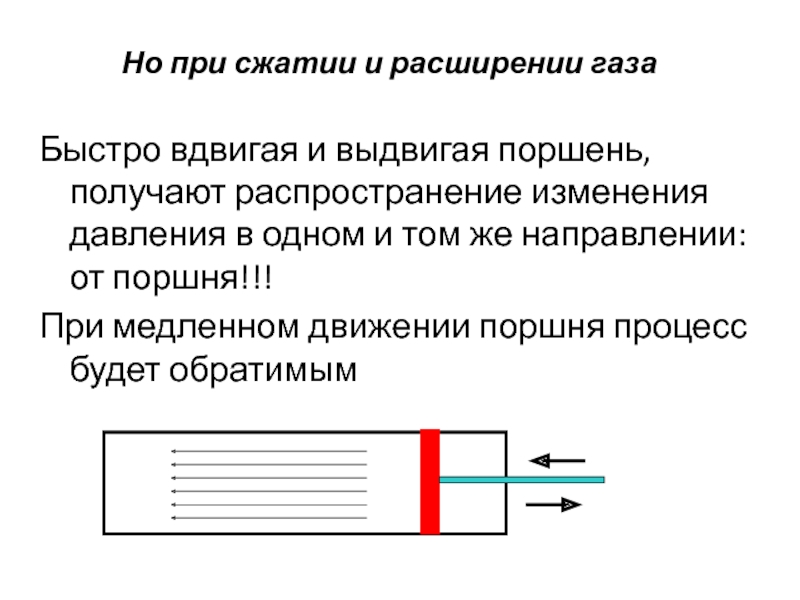
Слайд 13Но при сжатии и расширении газа
Быстро вдвигая и выдвигая поршень, получают
При медленном движении поршня процесс будет обратимым
Слайд 14 Процесс называется необратимым, если он протекает так, что после
Слайд 15 Свойством обратимости обладают только равновесные процессы. Каждое промежуточное состояние является состоянием
Например, обратимым можно считать процесс адиабатического расширения или сжатия газа.
Слайд 16 При адиабатическом расширении газа условие теплоизолированности системы исключает непосредственный теплообмен между
Слайд 17 Конечно, в реальных условиях и в этом случае всегда имеется некоторая
Слайд 18 Максимальным КПД обладают машины у которых только обратимые процессы. Реальные
Слайд 19 - многие процессы в природе и технике практически обратимы; -
Обратимые процессы – это в какой-то степени идеализация реальных процессов. Их рассмотрение важно по двум причинам:
Слайд 202. ПОНЯТИЕ ОБ ЭНТРОПИИ
Энтропия – функция состояния термодинамической системы.
Слайд 21 Тогда
Применяя первое начало термодинамики, получим
Слайд 22 Для адиабатного процесса dS = 0, то есть S =
Физический смысл энтропии устанавливается в статистической физике.
Закон Больцмана:
Слайд 23 W – термодинамическая вероятность данного состояния системы.
Это - число
k – постоянная Больцмана
Слайд 25Второе начало термодинамики
Невозможен процесс, единственным результатом которого была бы передача теплоты
Невозможен круговой процесс, единственным результатом которого было бы производство работы за счёт охлаждения теплового резервуара (В. Томсон (лорд Кельвин), 1851 г.)
Невозможно построить периодически действующую машину, единственным результатом которой было бы поднятие груза за счёт охлаждения теплового резервуара (Планк)
Невозможен вечный двигатель второго рода (т.е. двигатель, работающий только за счёт охлаждения теплового резервуара).(В. Оствальд)
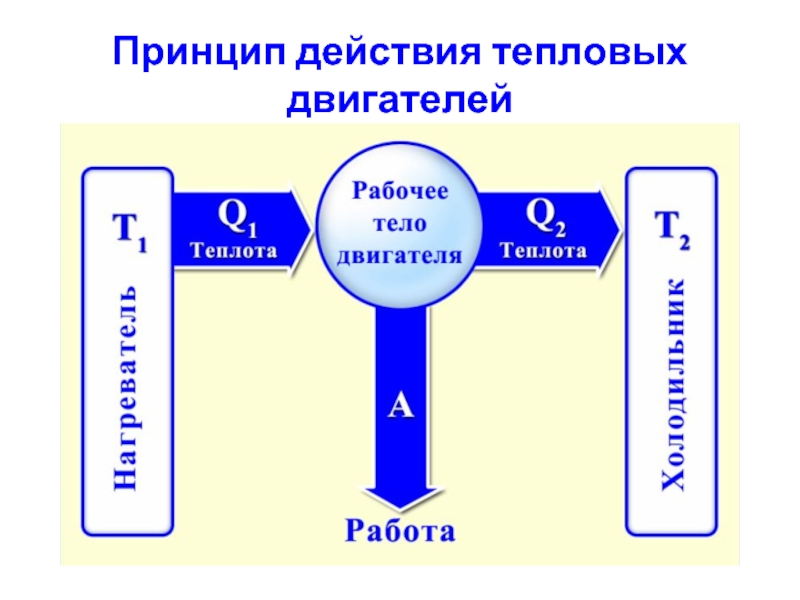
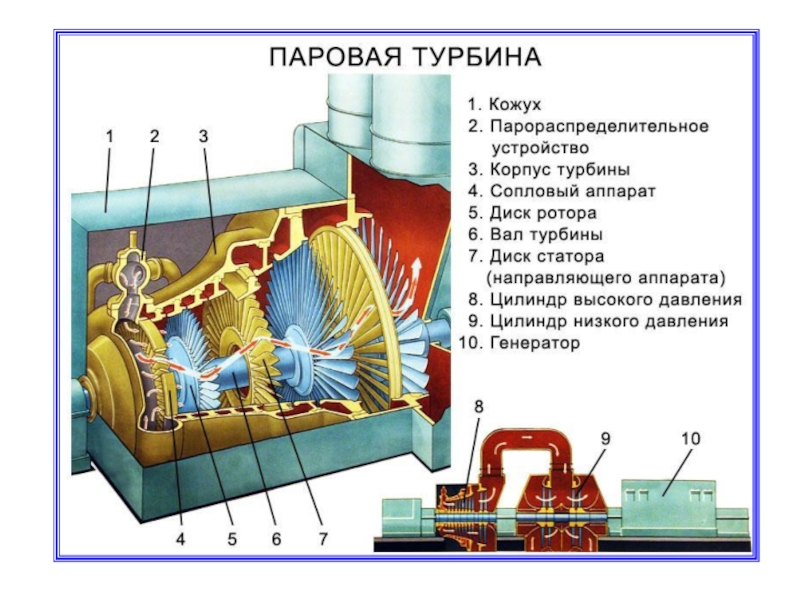
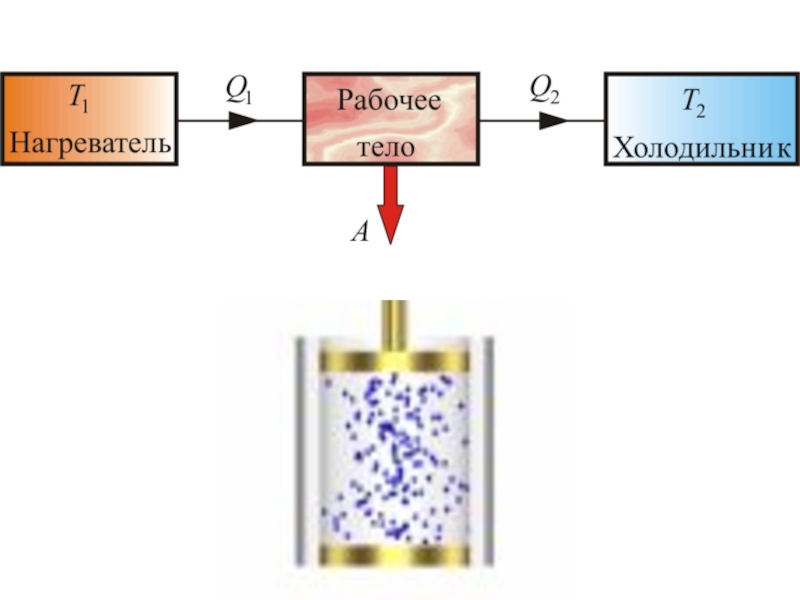
Слайд 27 Тепловые машины
Тепловой машиной называется периодический действующий двигатель, совершающий работу
Слайд 39Идеальная тепловая машина
Наибольшим КПД при заданных температурах нагревателя T1 и холодильника
Сади Карно (1796 – 1832)
Слайд 40 Любая тепловая машина работает по принципу кругового (циклического) процесса, т.е. возвращается
Слайд 41 Но чтобы при этом была совершена полезная работа, возврат
Слайд 43 Зачем холодильник? Так как в тепловой машине реализуется круговой
Слайд 44 Прямой цикл используется в тепловом двигателе – периодически действующей тепловой машине,
Слайд 45 От термостата с более высокой температурой Т1, называемого нагревателем, за цикл
Слайд 46 Обратный цикл используется в холодильных машинах – периодически действующих установках, в
Слайд 48
Слайд 50ТЕОРЕМА КАРНО Из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей
Слайд 51 Цикл, изученный Карно, является самым экономичным и представляет собой круговой процесс,
Слайд 52 Рассмотрим круговой процесс, при котором тепло можно превратить в работу, притом,
Рассмотрим прямой цикл Карно, в котором в качестве рабочего тела используется идеальный газ, заключенный в сосуд с подвижным поршнем. Определим его КПД.
Слайд 53 Напомню, что тепловой машиной называется периодически действующий двигатель, совершающий работу за
Слайд 55 Рассмотрим процесс сначала качественно. Начнем процесс из т.
Слайд 56 В изотермическом процессе dU = 0, значит все тепло
Слайд 57 Процесс А-В. Положитель-ная работа, совершенная газом при изотермическом расширении
Слайд 58 Полученное рабочим телом тепло нужно передать холодильнику. Но если
Нужно сначала рабочее тело охладить до Т2, а затем, уже присоединять к холодильнику. Охлаждение без затрат тепла – это адиабатическое расширение – участок ВС
Слайд 59Процесс В-С – адиабатическое расширение. При адиабатическом расширении теплообмен с окружающей
Слайд 60 Давление в процессе В-С уменьшается до Р2, температура падает
Слайд 61 Адиабатическим расширением ВС заканчивается первая половина цикла – совершение
Возвращение в т. А опять происходит в два этапа: сначала рабочее тело сжимают не прерывая контакта с холодильником, при этом холодильнику отдается тепло Q2
(изотермическое сжатие СD).
Слайд 62 Затем тело изолируют от холодильника, адиабатно сжимают (DА), при
Почему рабочее тело нагревается?
При адиабатическом сжатии (ДА) тело нагревается за счет внешней работы, совершенной над ним.
Слайд 63Процесс C-D -изотермическое сжатие На третьем этапе газ изотермически сжимается V2
Слайд 64 Процесс D-А – адиабатическое сжатие. Работа сжатия на
Слайд 66Значит работа совершаемая газом
больше работы внешних сил.
Полезная работа равна площади
А
Слайд 67 Как видим, на всех стадиях кругового процесса нигде не допускается соприкосновенность
Слайд 70 Видно, что η < 1 зависит от
Слайд 71 Необратимый цикл
Предположим для простоты, что необратимость цикла
Слайд 72 Любой процесс, не удовлетворяющий условию обратимости, мы называем необратимым процессом. Примером необратимого
Слайд 73 Для продолжения движения необходим компенсирующий процесс охлаждения тела и среды.
Слайд 75 КПД для обратимого цикла Карно:
Слайд 76Формулировка второго начала термодинамики
В изолированной системе все процессы протекают так,
То есть изолированная система стремится перейти в равновесное состояние, вероятность такого состояния максимальна.
Слайд 77Второе начало термодинамики – закон возрастания энтропии
В замкнутой системе энтропия S
для обратимых процессов. ΔS = 0
В состоянии равновесия S → max энтропия замкнутой системы достигает максимума и никакие макроскопические процессы в такой системе невозможны.