- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Второй закон термодинамики. Энтропия презентация
Содержание
- 1. Второй закон термодинамики. Энтропия
- 2. Основное содержание II начала термодинамики: -
- 3. Примеры: 1.Fe+O2 2FeO 2.
- 4. Графическое изображение обратимого процесса (кривые прямого и
- 5. Пример - расширение газа Обратимый процесс Необратимый
- 6. Формулировки II начала термодинамики 1.
- 7. Идеальная тепловая машина: Работает без трения Рабочее
- 8. Тепло может быть превращено в работу
- 9. Т.к. в термодинамике Q2
- 10. ТЕОРЕМА (в математике): Если интеграл
- 11. Условия равновесия в изолированных системах 1-2
- 12. Реальные , в том числе наблюдаемые
- 13. Энтропия и термодинамическая вероятность S – экстенсивный
- 14. Способы расчета изменения энтропии (для обратимых
- 15. Фазовые переходы (T=const) 2) Изобарный процесс (P=const)
Слайд 1II Закон термодинамики. Энтропия
“S”- термодинамическая функция состояния [Дж/моль К](Клаузиус)
Это количественный
Слайд 2Основное содержание II начала термодинамики:
- это закономерность, позволяющая решать вопросы о
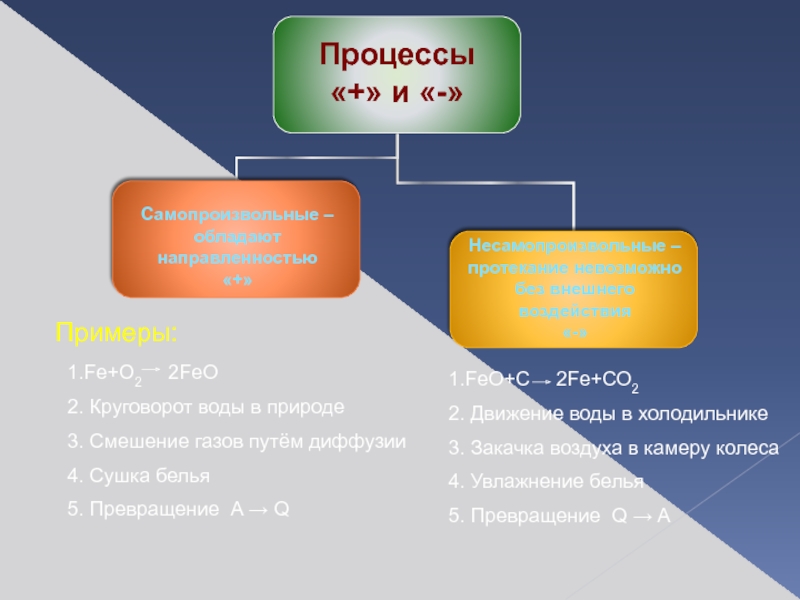
Слайд 3Примеры:
1.Fe+O2 2FeO
2. Круговорот воды в природе
3. Смешение газов
4. Сушка белья
5. Превращение A → Q
1.FeO+С 2Fe+СО2
2. Движение воды в холодильнике
3. Закачка воздуха в камеру колеса
4. Увлажнение белья
5. Превращение Q → A
Процессы
«+» и «-»
Самопроизвольные –
обладают направленностью
«+»
Несамопроизвольные –
протекание невозможно
без внешнего воздействия
«-»
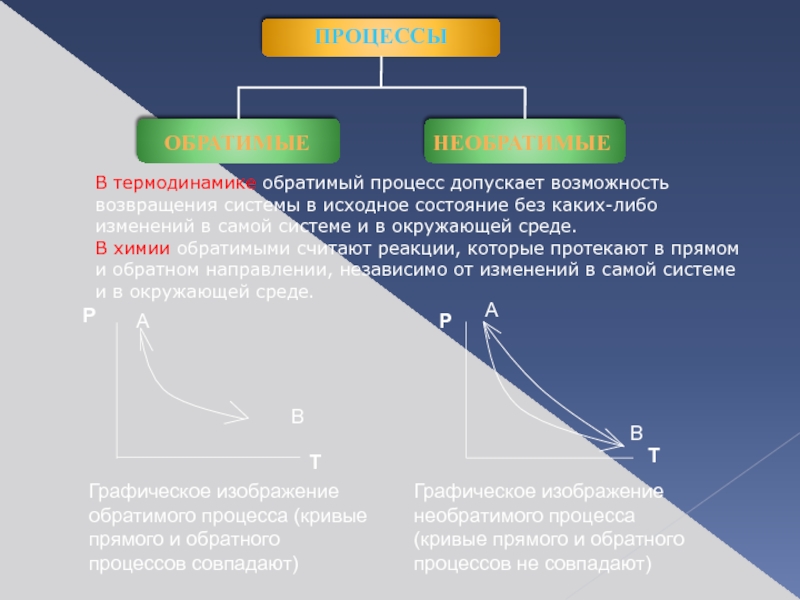
Слайд 4Графическое изображение обратимого процесса (кривые прямого и обратного процессов совпадают)
Графическое изображение
В термодинамике обратимый процесс допускает возможность
возвращения системы в исходное состояние без каких-либо
изменений в самой системе и в окружающей среде.
В химии обратимыми считают реакции, которые протекают в прямом
и обратном направлении, независимо от изменений в самой системе
и в окружающей среде.
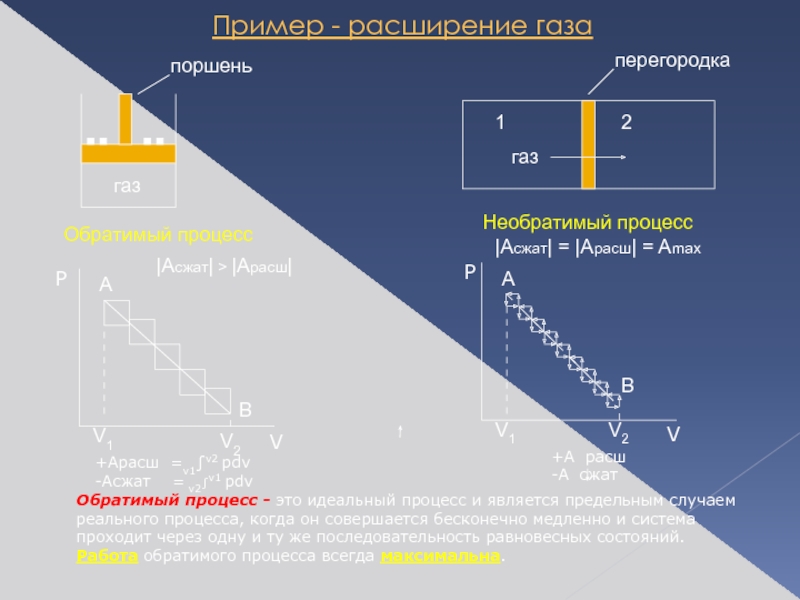
Слайд 5Пример - расширение газа
Обратимый процесс
Необратимый процесс
|Асжат| > |Арасш|
+Арасш =v1∫v2 pdv
-Асжат
Обратимый процесс - это идеальный процесс и является предельным случаем реального процесса, когда он совершается бесконечно медленно и система проходит через одну и ту же последовательность равновесных состояний.
Работа обратимого процесса всегда максимальна.
|Асжат| = |Арасш| = Amax
Слайд 6Формулировки II начала термодинамики
1. «Тепло не может переходить от
2. «Единственным результатом процессов не может быть только превращение теплоты в работу, а превращение работы в теплоту может быть» (Томсон)
3. «Невозможно построить машину, которая бы получала работу за счет энергии источника, если температура источника и машины одинакова» (Оствальд)
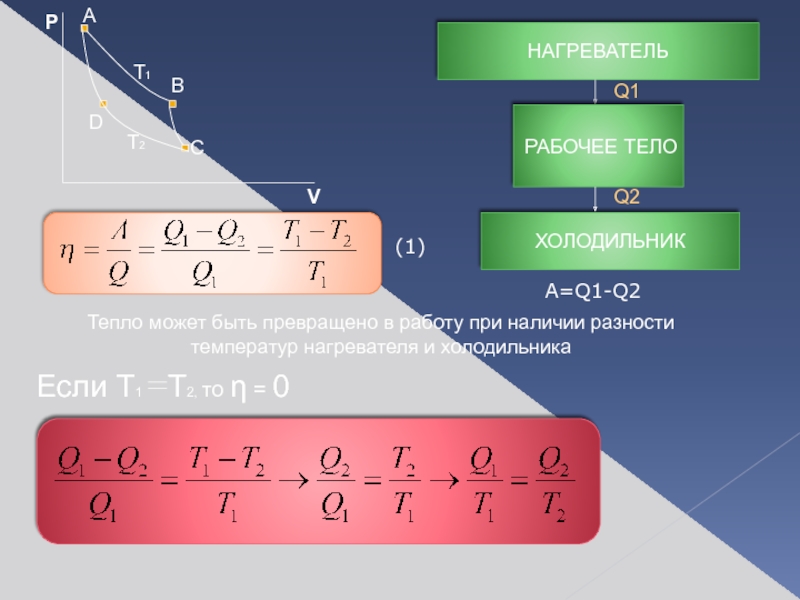
Слайд 7Идеальная тепловая машина:
Работает без трения
Рабочее вещество – идеальный газ ABCD
Работает по
- кпд тепловой машины
Слайд 8
Тепло может быть превращено в работу при наличии разности температур нагревателя
Если T1 T2, то η = 0
(1)
Слайд 10
ТЕОРЕМА (в математике): Если интеграл по замкнутому контуру равен нулю, то
Математическое выражение II начала термодинамики для обратимого процесса
Для любого процесса
Математическое выражение II начала термодинамики для необратимого процесса
Слайд 11
Условия равновесия в изолированных системах
1-2 самопроизвольный процесс
2 состояние равновесия
2-3
Слайд 12
Реальные , в том числе наблюдаемые в природе, самопроизвольные процессы-необратимые, протекающие
Энтропия – это критерий для изолированных систем
Подавляющее большинство реальных систем, в том числе и биосистем, являются открытыми и охарактеризовать протекающие в них процессы с помощью энтропии невозможно.
Статистический Характер II начала термодинамики
I начало – абсолютный закон (не зависит от числа частиц в системе)
II начало – вероятностный закон (зависит от числа частиц, т.е. имеет статистический характер).
Слайд 13Энтропия и термодинамическая вероятность
S – экстенсивный параметр
Пример:
n=10 книг(4 полки); W1=1260(N-общее число
n=106молекул; W2=1260◦105=1,26 ◦ 108
- Уравнение Больцмана
Слайд 14Способы расчета изменения энтропии
(для обратимых процессов)
1) Изотермический процесс (Т=const)
I начало
II начало термодинамики
Объединенное уравнение
Слайд 15Фазовые переходы (T=const)
2) Изобарный процесс (P=const)
- молей
3) Изохорный процесс (V=const)
4) Изобарно
5) Изохорно – изотермический (V=const; T=const )
Это количественный критерий оценки направления протекания](/img/tmb/3/285257/f51a28f0f34143b5460d4dc732c8739e-800x.jpg)