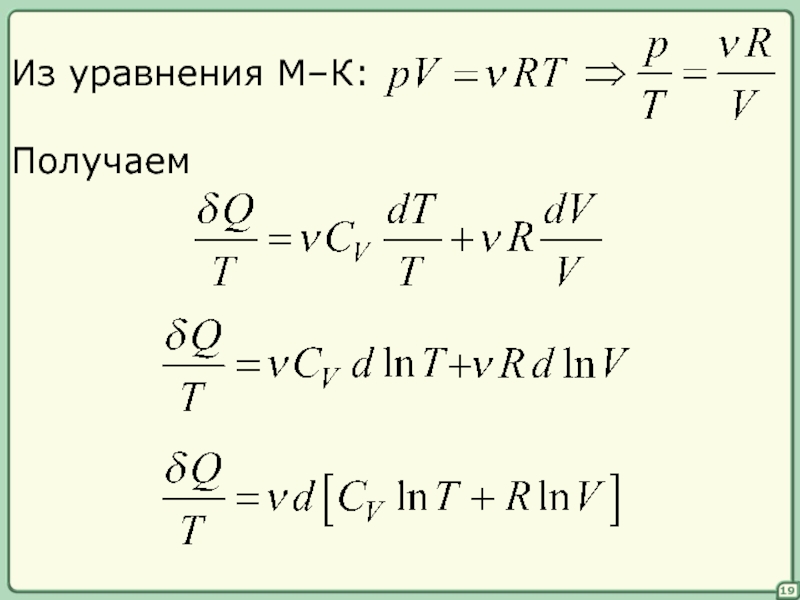- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Второе начало термодинамики. Циклы. (Лекция 10) презентация
Содержание
- 1. Второе начало термодинамики. Циклы. (Лекция 10)
- 2. §§ Циклы 02 Круговым процессом (циклом) называется
- 3. 03 A < 0 – обратный
- 4. §§ КПД цикла 04 Тепловая
- 5. 05 Для кругового процесса т.е. работа
- 6. 06 Пусть Q1 – количество энергии, полученное
- 7. 07 Существует бесконечное множество циклов и у
- 8. §§ Цикл Карно 08 Рассмотрим наиболее эффективный
- 9. 09 1→2 – изотермическое расширение – за
- 10. 10 Аналогично следовательно
- 11. 11 Работа за цикл Вычислим КПД:
- 12. КПД всякой ТМ не может превосходить
- 13. §§ Обратимые процессы 13 Обратимым называется процесс,
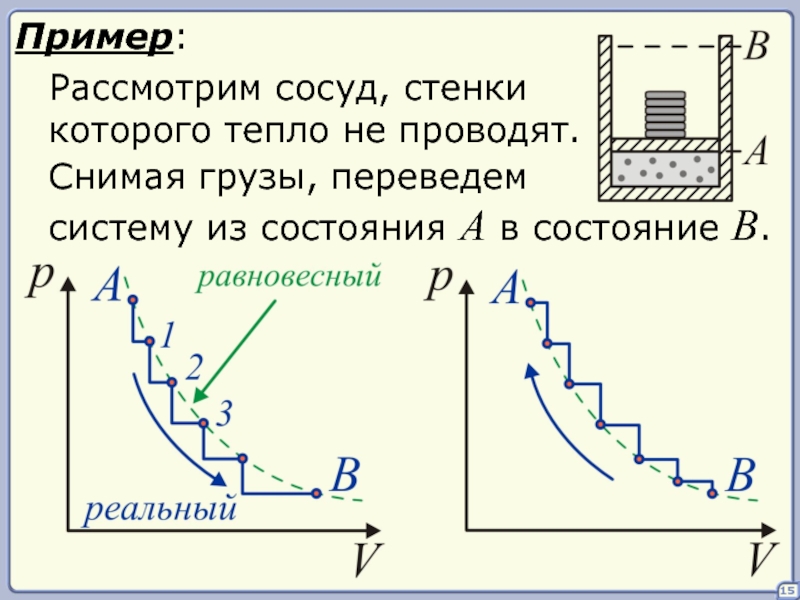
- 15. 15 Пример: Рассмотрим сосуд, стенки которого тепло
- 16. 16 Все реальные процессы протекают с конечной
- 17. 17 Сравним КПД неравновесной и равновесной
- 18. §§ Энтропия идеального газа I-е начало
- 19. 19 Из уравнения М–К: Получаем
- 20. 20 тогда правая часть – дифференциал
- 21. 21 §§ Основное уравнение ТД Согласно первому
- 22. §§ Физический смысл S 22 Рассмотрим идеальный
- 23. 23 Вычислим Г – число микросостояний, которое
- 24. 24 ≈ Для идеального газа
- 26. §§ II-е начало термодинамики 26 Система, предоставленная
- 27. 27 Пусть замкнутая система переходит из состояния
- 28. 28 Следовательно, При переходе замкнутой системы
- 29. §§ Тепловая теорема Нернста 29 Первое утверждение
- 30. 30 Второе утверждение Все процессы при абсолютном
Слайд 2§§ Циклы
02
Круговым процессом (циклом)
называется процесс, при котором
система,
возвращается в начальное состояние
A > 0 – прямой цикл
Работа совершается
системой за счет
подводимого тепла Q
(тепловой двигатель)
Слайд 303
A < 0 – обратный
цикл
Работа
над системой
(холодильная машина)
Происходит превращение работы в
теплоту
, т.к. выходит энергии больше,
чем входит.
(в каждой точке цикла выполняется УС)
Слайд 4§§ КПД цикла
04
Тепловая машина
термодинамически действующее
устройство,
за счет подводимого из вне тепла
Элементы тепловой машины
1) нагреватель
2) рабочее тело
3) холодильник
тела с очень
большой
теплоемкостью
Слайд 505
Для кругового процесса
т.е. работа совершается за счет
поступающей энергии
На участке цикла
получать энергию:
и отдавать:
Слайд 606
Пусть
Q1 – количество энергии, полученное
системой от нагревателя
Q2
холодильнику
Тогда эффективность машины (КПД):
Слайд 707
Существует бесконечное множество
циклов и у каждого свой КПД.
В механике циклы используют
преобразования энергии (превращения
теплоты в работу).
На практике используется всего
несколько десятков циклов.
Слайд 8§§ Цикл Карно
08
Рассмотрим наиболее эффективный цикл,
состоящий из двух изотерм T1 и
двух адиабат
Вычислим работу
тела за цикл:
Слайд 12
КПД всякой ТМ не может превосходить
КПД идеальной ТМ,
12
Теорема Карно–Клаузиуса
КПД тепловой машины,
по циклу Карно,
зависит только
от температур T1 и T2 нагревателя
и холодильника,
но не зависит
от устройства машины и вида
рабочего тела
Теорема Карно (2)
работающей по
циклу Карно,
с теми же самыми
температурами нагревателя и
холодильника
Слайд 13§§ Обратимые процессы
13
Обратимым называется процесс,
для которого возможен обратный
переход из конечного состояния
в
через те же
промежуточные состояния,
что и в прямом процессе
или если систему можно вернуть в
исходное состояние
хотя бы одним
способом и притом так, чтобы состояние
тел вне системы осталось неизменным.
Слайд 14
проходит ряд непрерывно следующих
друг за другом равновесных состояний
14
Процесс – равновесный,
Условия равновесности:
1) непрерывность всех величин,
характеризующих процесс
2) бесконечно малая скорость
изменений в системе
Необходимое и достаточное условие
обратимости – равновесность.
Слайд 1515
Пример:
Рассмотрим сосуд, стенки
которого тепло не проводят.
Снимая грузы, переведем
систему из состояния A
Слайд 1616
Все реальные процессы протекают с
конечной скоростью и являются
необратимыми и неравновесными.
Это приводит
процессе газ совершит большую
работу, чем в прямом.
При любом возмущении в системе
требуется время для установления
равновесия.
Слайд 1717
Сравним КПД неравновесной и
равновесной машины, работающей
по циклу Карно:
– неравенство Клаузиуса
приведенная
§§ Неравенство Клаузиуса
Слайд 18
§§ Энтропия идеального газа
I-е начало в дифференциальной форме
18
функция состояния
полный дифференциал
(Q –
Разделим на T левую и правую части:
бесконечно малое приращение
Слайд 2020
тогда правая часть – дифференциал
новой функции состояния
S – энтропия
Это выражение
равновесных (обратимых) процессов.
Оно позволяет вычислить разность S,
но не абсолютное значение.
Левая часть – полный дифференциал,
Слайд 2121
§§ Основное уравнение ТД
Согласно первому началу
и для равновесного процесса получаем
основное
уравнение
термодинамики
Оно справедливо
реакциях и при фазовых переходах.
В физике имеет множество следствий.
Слайд 22§§ Физический смысл S
22
Рассмотрим идеальный газ,
ν = 1 моль, в объеме
N – число ячеек
NA – число занятых ячеек
(NA << N)
Слайд 2323
Вычислим Г – число микросостояний,
которое может реализоваться в системе
Оно равно числу
NA молекул по N ячейкам:
Формула Стирлинга:
≈
Слайд 25
считают, что энтропия пропорциональна
25
и
const часто полагают равной нулю
логарифму числа пространственных
микросостояний
Энтропия является мерой беспорядка
(разупорядочения) в системе.
Следовательно, при T = const
Слайд 26§§ II-е начало термодинамики
26
Система, предоставленная самой себе,
приходит к равновесному состоянию,
т.е. энтропия
предоставленной самой себе системе.
I-е начало говорит о соотношении между
величинами, характеризующими систему
II-е начало указывает направление
изменений в системе, если они должны
произойти.
Слайд 2727
Пусть замкнутая система переходит из
состояния 1 в состояние 2.
Возвратим систему в
состояние 1 с помощью
обратимого процесса
т.к. система
изолирована
Слайд 28
28
Следовательно,
При переходе замкнутой системы
энтропия либо увеличивается,
либо не изменяется
из состояния 1 (с
Замечание: о «тепловой смерти»
Клаузиус, рассматривая Вселенную
как замкнутую систему, утверждал:
«энтропия Вселенной стремится
к максимуму»
Слайд 29§§ Тепловая теорема Нернста
29
Первое утверждение
При приближении к абсолютному нулю
энтропия стремится к
конечному пределу
– т.е. этот интеграл сходится.
Слайд 3030
Второе утверждение
Все процессы при абсолютном нуле
температур,
из одного равновесного состояния
в другое,
происходят без изменения
энтропии
Классическое описание системы при
абсолютном нуле неприменимо, т.к.
оно допускает бесконечное множество
состояний.
Необходимо рассмотрение с квантовых
позиций.