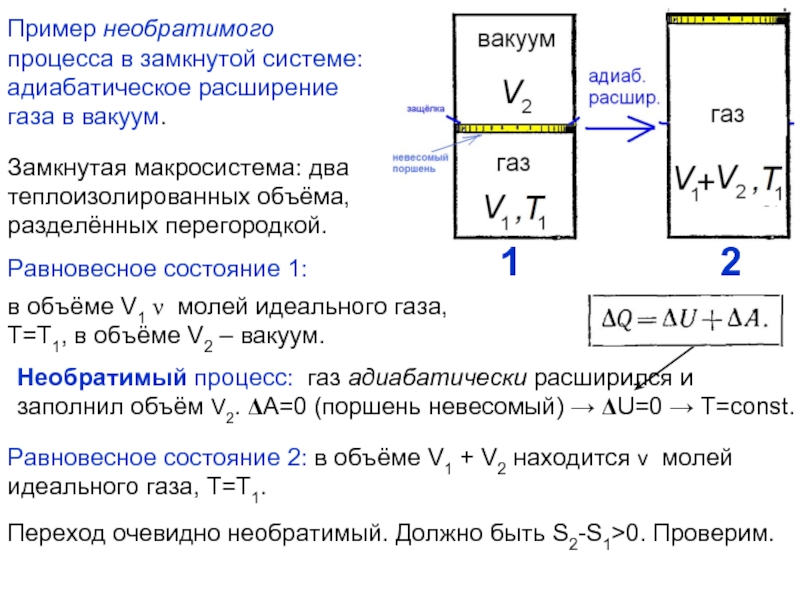
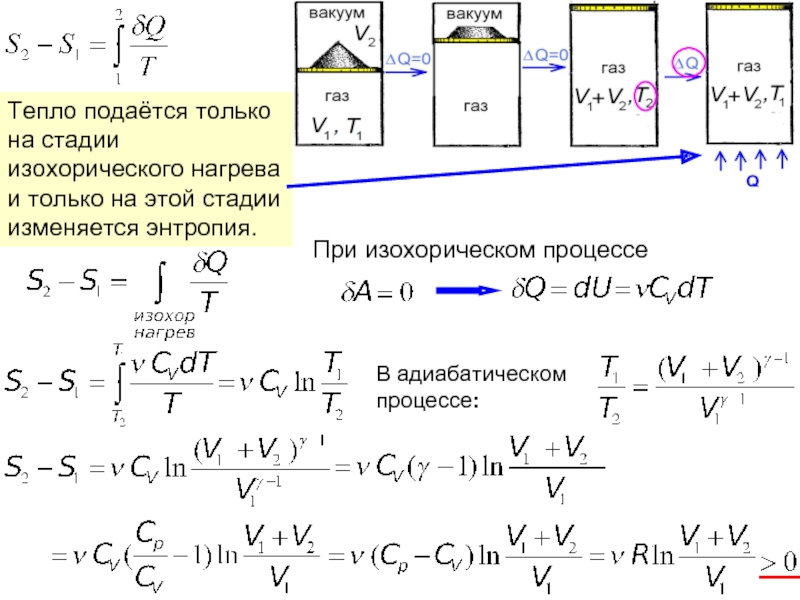
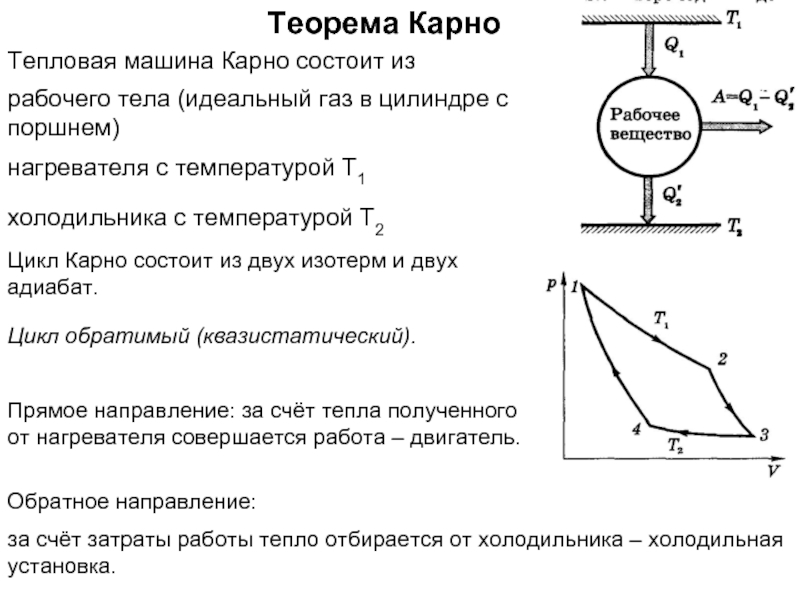
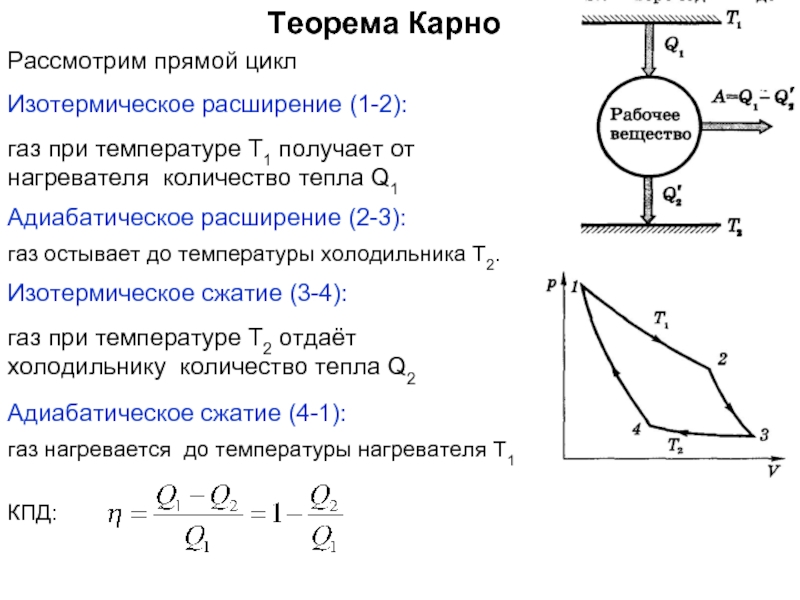
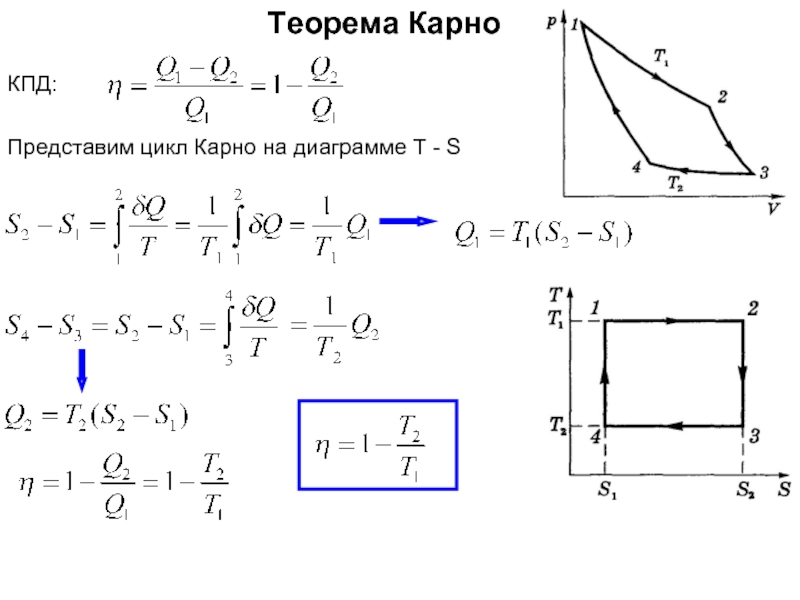
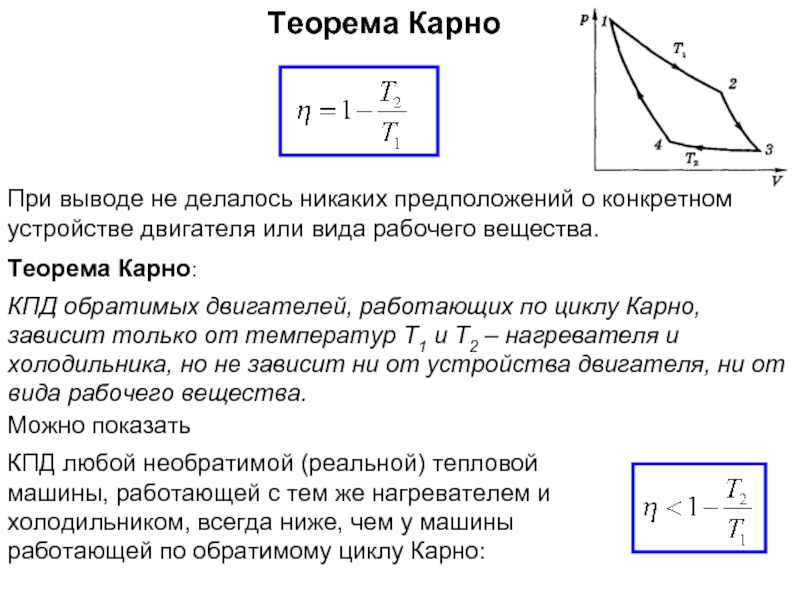
Энтропия замкнутой (теплоизолированной, внешние силы не совершают работу) макросистемы не уменьшается – она либо возрастает, либо остаётся постоянной.
В замкнутых системах:
Ещё одна формулировка 2-го начала
В случае обратимых процессов энтропия замкнутой макросистемы не меняется
В случае необратимых процессов энтропия замкнутой макросистемы возрастает