- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термохимия. Расчетные задачи. (Лекция 4.2) презентация
Содержание
- 1. Термохимия. Расчетные задачи. (Лекция 4.2)
- 2. Термохимия - раздел химии, в котором
- 3. Теплота – количественная мера хаотического движения молекул в данной системе.
- 4. При изобарно-изотермическом процессе ∆Н характеризует энергетическое состояние системы
- 5. Термохимическое уравнение – включает Q
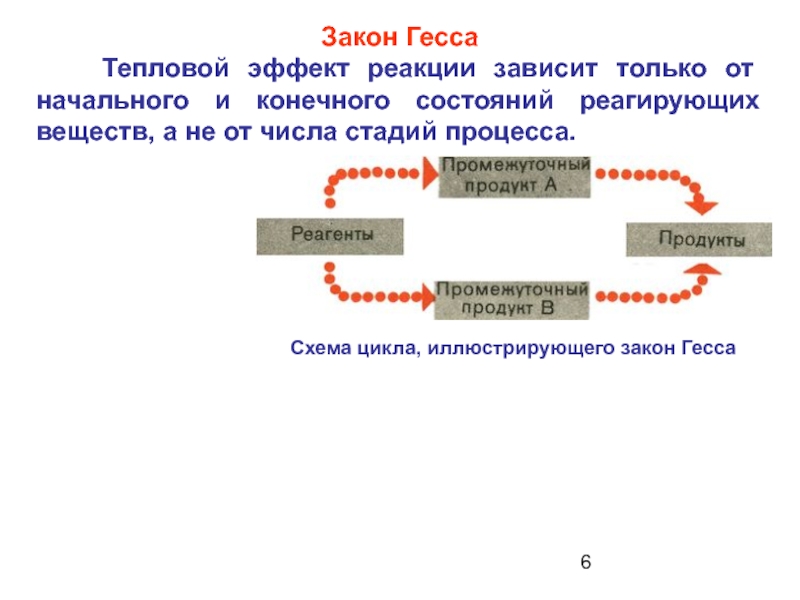
- 6. Закон Гесса Тепловой эффект реакции
- 7. Следствия из закона Гесса: 1. Тепловой
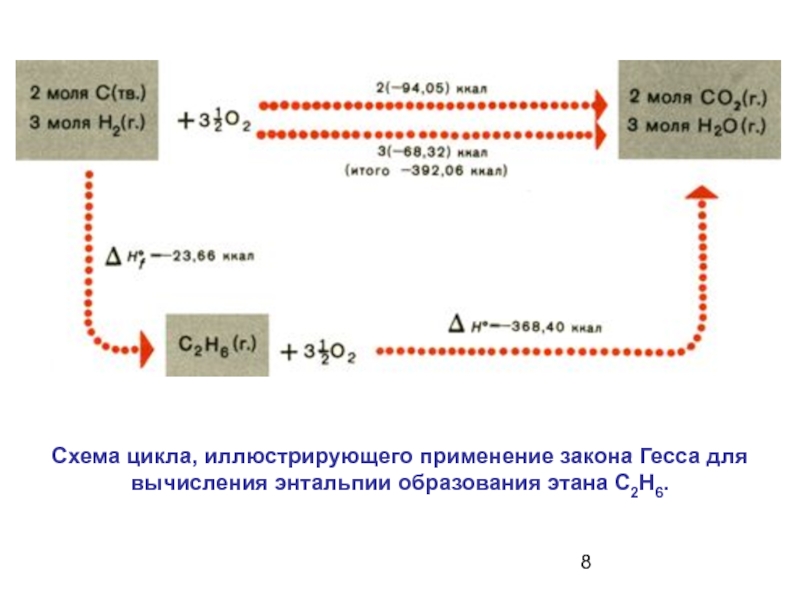
- 8. Схема цикла, иллюстрирующего применение закона Гесса для вычисления энтальпии образования этана С2Н6.
- 9. 2. Тепловой эффект реакции при стандартных условиях
- 11. Теплота нейтрализации Изменение энергии в экзотермической
- 12. Окисление сернистого газа – 2-я стадия
- 13. Промышленный способ получения аммиака (Р=200 атм; t°=
- 14. Конверсия метана СН4 + Н2О = СО + 3Н2 - Q
- 15. Газификация твердого топлива Химический процесс газификации представляет
- 16. Человеческий организм, является открытой,
- 17. Главными компонентами пищи являются: углеводы, жиры,
- 18. Углеводы – CnH2nOn (сахар, хлеб, крупы, макаронные
- 19. Белки - основной строительный материал клеток
- 20. Жиры - сложные эфиры глицерина и жирных
- 21. Тест 19 Термохимия (один вариант ответа)
- 22. 1. Реакция, сопровождающаяся выделением
- 23. 2. Реакция, сопровождающаяся поглощением
- 24. 3. Процесс
- 25. 4. Процесс 4Cr
- 26. 5. Процесс NH4Cl
- 27. 6. Процесс C
- 28. 7. Процесс C
- 29. 8. Процесс Na2S
- 30. 9. Процесс CdO
- 31. 10. Процесс 2KI
- 32. 11. При протекании химической
- 33. Ответы Тест 19 Термохимия
- 34. Тест 19а Термохимические уравнения. Расчет.
- 35. 1.В соответствии с термохимическим уравнением С6Н12О6(тв)
- 36. 2.В соответствии с термохимическим уравнением С6Н12О6(тв)
- 37. 3.В соответствии с термохимическим уравнением С6Н12О6(тв)
- 38. 4.В соответствии с термохимическим уравнением С6Н12О6(тв)
- 39. 5.В соответствии с термохимическим уравнением 2Na(тв)
- 40. 6.В соответствии с термохимическим уравнением 2Na(тв)
- 41. 7.Согласно термохимическому уравнению ZnS(тв.) +2НСl(г) →ZnCl2( тв.)
- 42. 8.Теплота образования 1 моль жидкой воды из
- 43. 9.Теплота образования 1 моль SO2 (г) из
- 44. 10. Теплота образования 1 моль SO2 (г)
- 45. 11. При соединении 12 г алюминия с
- 46. Ответы Тест 19 Термохимия
- 47. Спасибо за внимание!
Слайд 2Термохимия
- раздел химии, в котором изучаются тепловые эффекты реакции
Тепловой эффект
Слайд 5 Термохимическое уравнение – включает Q
2Н2(г) + О2(г) → 2Н2О(ж) +
Термодинамическое уравнение – включает ∆Н
2Н2(г) + О2(г) → 2Н2О(ж) - 570 кДж (∆Н)
Слайд 6Закон Гесса
Тепловой эффект реакции зависит только от начального и
Слайд 7Следствия из закона Гесса:
1. Тепловой эффект реакции при стандартных условиях равен
Слайд 8Схема цикла, иллюстрирующего применение закона Гесса для вычисления энтальпии образования этана
Слайд 92. Тепловой эффект реакции при стандартных условиях равен разности между суммой
Подавляющее большинство органических соединений нельзя синтезировать непосредственно из простых веществ и одновременно определить теплоту образования этих соединений.
Поэтому за основу для расчета берут экспериментально легко определяемые теплоты (энтальпии) сгорания.
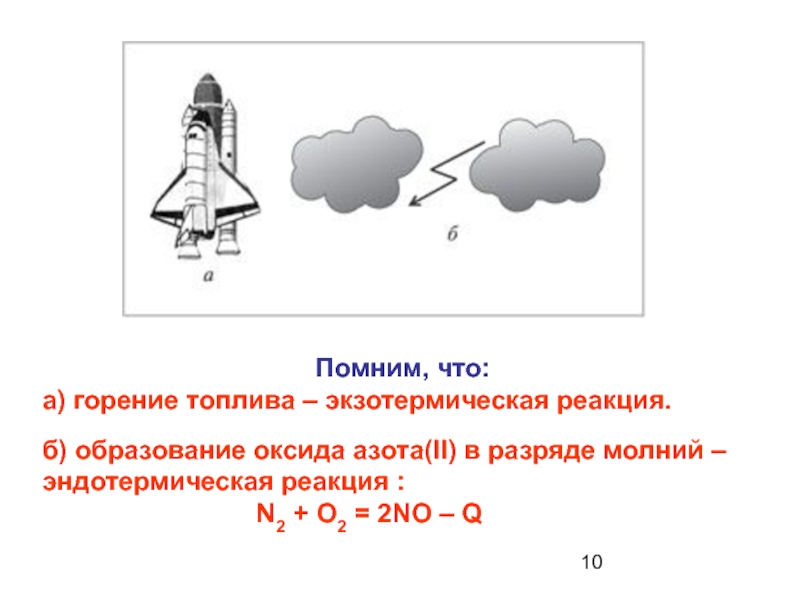
Слайд 10
а) горение топлива – экзотермическая реакция.
б) образование оксида азота(II) в разряде молний –
эндотермическая реакция : N2 + O2 = 2NO – Q
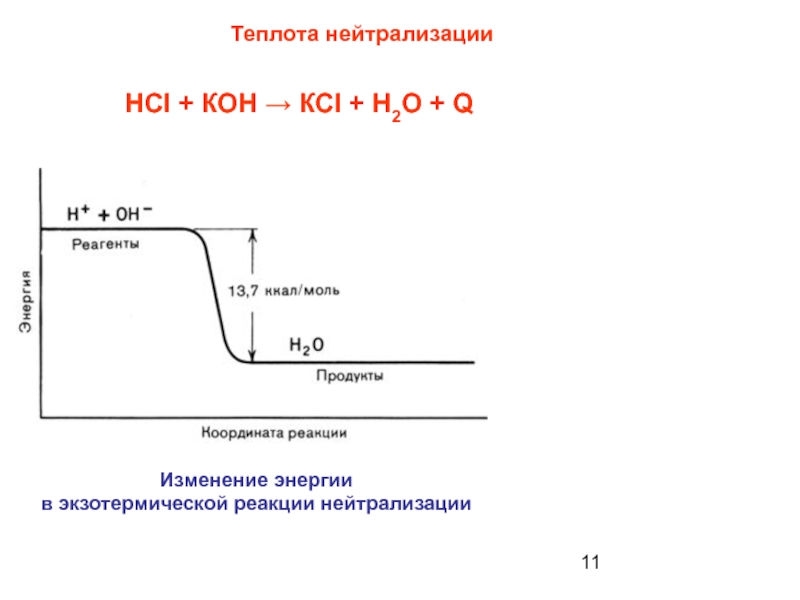
Слайд 11Теплота нейтрализации
Изменение энергии
в экзотермической реакции нейтрализации
НCI + КОН → КCI
Слайд 12Окисление сернистого газа –
2-я стадия в производстве серной кислоты
(450°С
2SO2 + O2 ↔ 2SO3 + Q
Слайд 13Промышленный способ получения аммиака
(Р=200 атм; t°= 400°C; kat = Fe +
N2 + 3H2 ↔ 2NH3 - Q
Слайд 15Газификация твердого топлива
Химический процесс газификации представляет собой сочетание химического процесса сжигания
Уголь, полученный в результате пиролиза, реагирует с паром или диоксидом углерода с образованием «синтез-газа»:
С + Н2О = СО + Н2 - Q
С + СО2 = 2СО - Q
Слайд 16 Человеческий организм, является открытой, стационарной термодинамической системой. Основным
совершение работы внутри организма, связанной с дыханием, кровообращением, перемещением метаболитов, секрецией соков ;
нагревание вдыхаемого воздуха, потребляемой воды и пищи;
покрытие потерь теплоты в окружающую среду при непосредственной радиации и испарении влаги с поверхности тела и с выдыхаемым воздухом и с продуктами жизнедеятельности;
совершение внешней работы, связанной со всеми перемещениями человека и его трудовой деятельностью.
Биоэнергетика
Слайд 17Главными компонентами пищи являются:
углеводы, жиры, белки
Калорийность составляет в среднем:
Углеводы: 16,5 -17,2 кДж/г (4,0 - 4,1 ккал/г)
Белки: 16,5 - 17,2 кДж/г (4 – 4.2 ккал/г)
Жиры: 37,7- 39,8 кДж/г (9,0 - 9,5 ккал/г).
Слайд 18Углеводы – CnH2nOn
(сахар, хлеб, крупы, макаронные изделия)
В процессе усвоения
При правильном питании суточное потребление углеводов должно по массе в 4-5 раз превышать количество белков или жиров
Слайд 19Белки - основной строительный материал клеток
(рыба, творог, сыр, говядина, крупы)
Вещества,
Конечными продуктами окисления являются СО2 и Н2О, а также мочевина, аммонийные соли, мочевая кислота, аспарагин и некоторые другие, выводимые из организма с мочой и потом.
покрытие энергетических затрат - 15–20 %.
Слайд 20Жиры - сложные эфиры глицерина и жирных кислот.
где R, R' и
Покрытие энергетических затрат - 20–25 %
(масло растительное и животное, яйцо, говядина)
Слайд 22
1. Реакция, сопровождающаяся
выделением теплоты называется:
1) обратимой
2) эндотермической
3)
4) экзотермической
Слайд 23
2. Реакция, сопровождающаяся поглощением теплоты называется:
1) обратимой
2) эндотермической
3)
4) экзотермической
Слайд 24
3. Процесс
2PCl3 =2P + 3Cl2 – Q
называется:
1) эндотермической реакцией соединения
2) экзотермической реакцией разложения
3) экзотермической реакцией соединения
4) эндотермической реакцией разложения
Слайд 25
4. Процесс
4Cr + 3O2 = 2Cr2O3 + Q
называется:
1) эндотермической реакцией
2) экзотермической реакцией разложения
3) экзотермической реакцией соединения
4) эндотермической реакцией разложения
Слайд 26
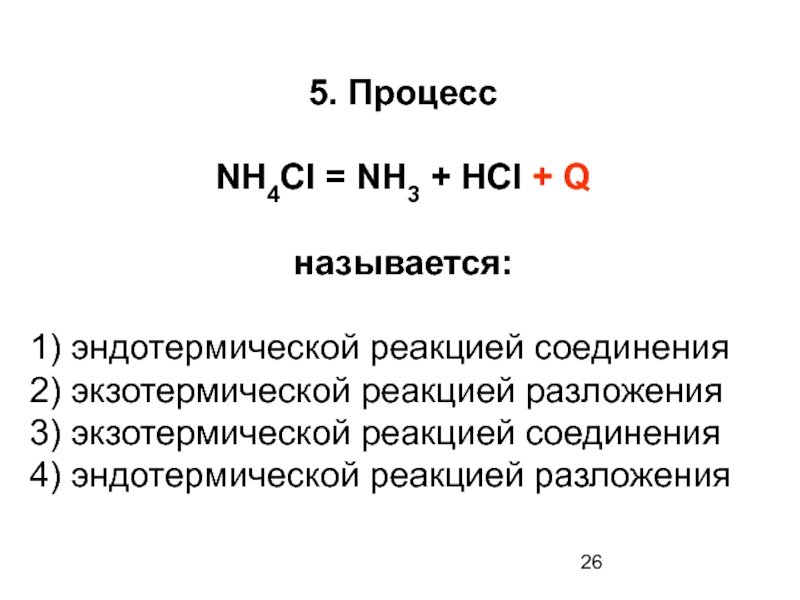
5. Процесс
NH4Cl = NH3 + HCl + Q
называется:
1) эндотермической реакцией соединения
2)
3) экзотермической реакцией соединения
4) эндотермической реакцией разложения
Слайд 27
6. Процесс
C + 2S = CS2 – Q
называется:
1) эндотермической реакцией соединения
2)
3) экзотермической реакцией соединения
4) эндотермической реакцией разложения
Слайд 28
7. Процесс
C + CuO = CO + Cu – Q
называется:
1) экзотермической
2) экзотермической реакцией обмена
3) эндотермической реакцией замещения
4) эндотермической реакцией обмена
Слайд 29
8. Процесс
Na2S + H2O = NaHS + NaOH – Q
называется:
1) экзотермической
2) экзотермической реакцией обмена
3) эндотермической реакцией замещения
4) эндотермической реакцией обмена
Слайд 30
9. Процесс
CdO + H2S = CdS + H2O + Q
называется:
1) экзотермической
2) экзотермической реакцией обмена
3) эндотермической реакцией замещения
4) эндотермической реакцией обмена
Слайд 31
10. Процесс
2KI + Cl2 = I2↓+ 2KCl + Q
называется:
1) экзотермической реакцией
2) экзотермической реакцией обмена
3) эндотермической реакцией замещения
4) эндотермической реакцией обмена
Слайд 32
11. При протекании химической реакции теплота:
1) поглощается или выделяется
2) обязательно поглощается
3)
4) условие недостаточно для однозначного ответа