- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термодинамика. Законы термодинамики презентация
Содержание
- 1. Термодинамика. Законы термодинамики
- 2. Внутренняя энергия определяется суммой кинетических энергий
- 3. Кинетическая энергия частиц определяется температурой тела.
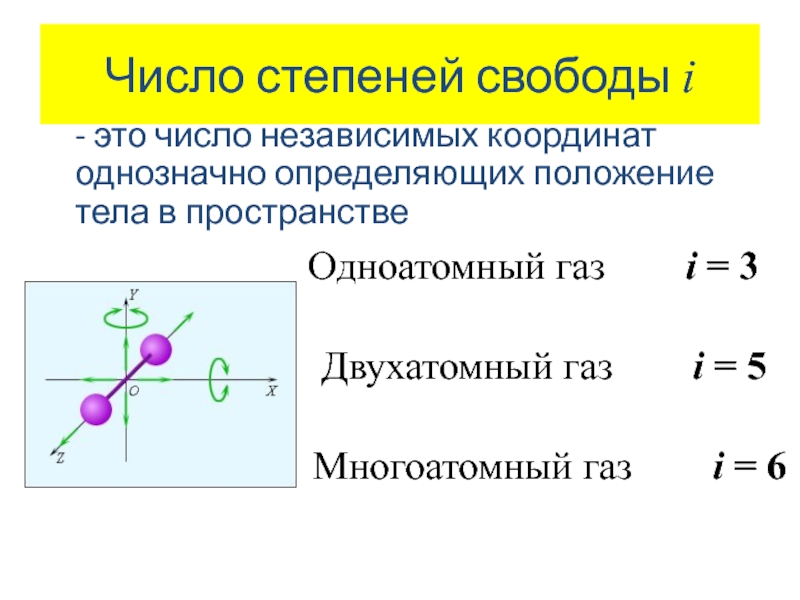
- 4. Число степеней свободы i - это число
- 5. Внутренняя энергия идеального газа определяется только кинетической энергией движения молекул Для одноатомного идеального газа:
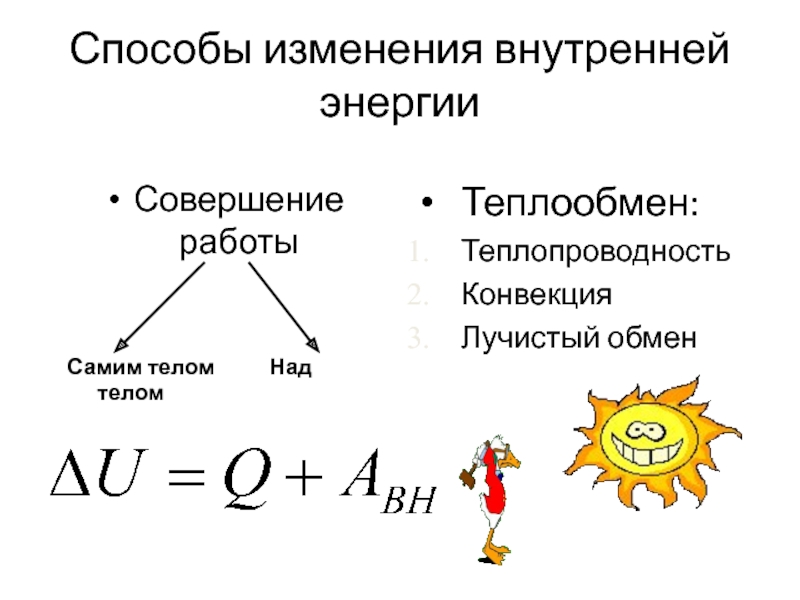
- 6. Способы изменения внутренней энергии Совершение работы
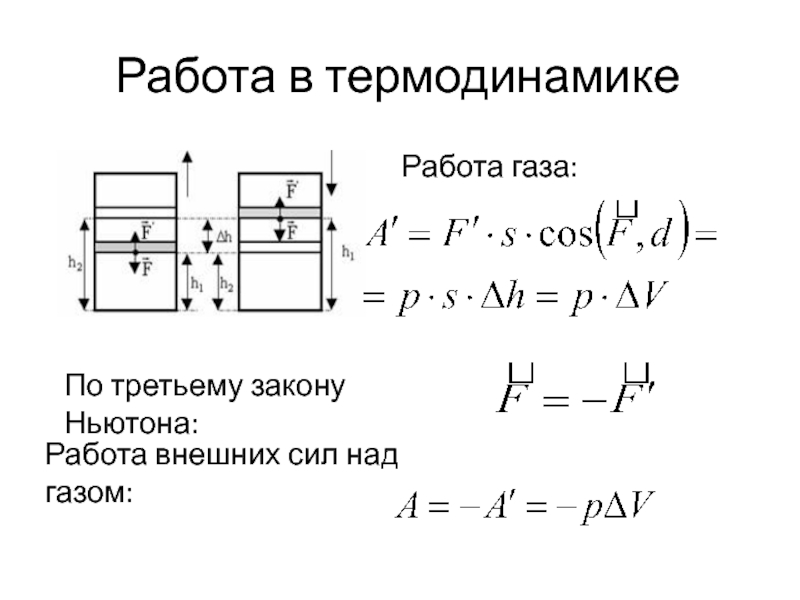
- 7. Работа в термодинамике По третьему закону Ньютона: Работа внешних сил над газом: Работа газа:
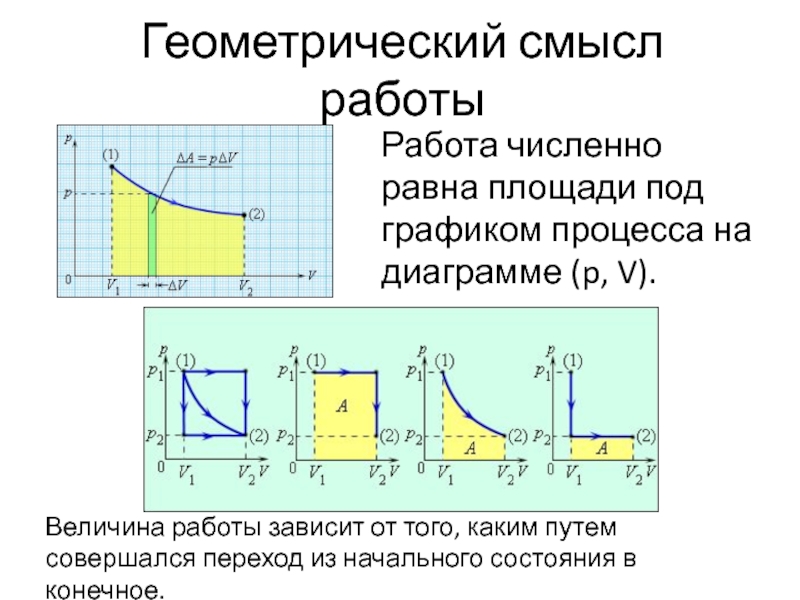
- 8. Геометрический смысл работы Работа численно равна площади
- 9. Работа газа при изобарном нагревании ΔV >
- 10. Первый закон термодинамики Подводимая к системе теплота
- 11. Применение первого закона термодинамики к изобарному процессу
- 12. Применение первого закона термодинамики к изохорному процессу
- 13. Теорема Майера Газовая постоянная численно равна работе
- 14. Применение первого закона термодинамики к изотермическому процессу
- 15. Адиабатный процесс протекает без теплообмена с окружающей средой
Слайд 1Термодинамика
- это раздел физики, изучающий тепловые свойства макро-скопических систем, не обращаясь
Слайд 2Внутренняя энергия
определяется суммой кинетических энергий хаотического движения всех частиц тела
Слайд 3Кинетическая энергия частиц определяется температурой тела.
Меняется только при изменении температуры
Потенциальная
Если система молекул находится в тепловом равновесии при температуре T, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна
Слайд 4Число степеней свободы i
- это число независимых координат однозначно определяющих положение
Одноатомный газ i = 3
Двухатомный газ i = 5
Многоатомный газ i = 6
Слайд 5Внутренняя энергия идеального газа
определяется только кинетической энергией движения молекул
Для одноатомного идеального
Слайд 6Способы изменения внутренней энергии
Совершение работы
Самим телом
Теплообмен:
Теплопроводность
Конвекция
Лучистый обмен
Слайд 8Геометрический смысл работы
Работа численно равна площади под графиком процесса на диаграмме
Величина работы зависит от того, каким путем совершался переход из начального состояния в конечное.
Слайд 9Работа газа при изобарном нагревании
ΔV > 0, работу совершает газ
ΔV
Слайд 10Первый закон термодинамики
Подводимая к системе теплота расходуется на совершение газом работы
с - удельная теплоемкость вещества
С – теплоемкость системы
Сm – молярная теплоемкость вещества