- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термодинамика. Работа и теплопередача. (Лекция 7) презентация
Содержание
- 1. Термодинамика. Работа и теплопередача. (Лекция 7)
- 2. Если газ, расширяясь, передвигает поршень на расстояние
- 3. Графическое представление работы Работа газа зависит от траектории перехода из начального состояния в конечное:
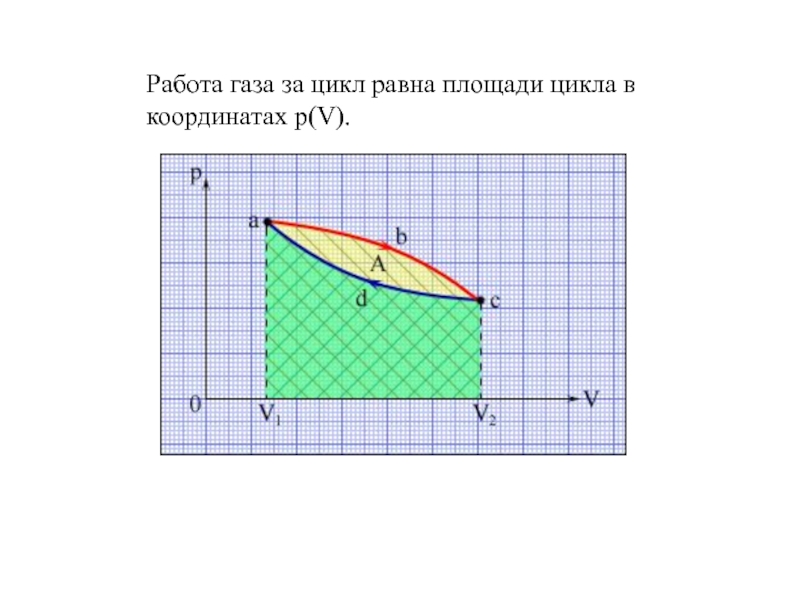
- 4. Работа газа за цикл равна площади цикла в координатах p(V).
- 5. Теплопередача - процесс обмена энергией между системой
- 6. Выражение для средней энергии молекул E =
- 7. Число степеней свободы материального объекта - это
- 8. Материальная точка. Положение материальной точки в пространстве
- 9. Две материальные точки с жесткой связью.
- 10. Три материальные точки с жесткой связью.
- 11. Две материальные точки с упругой
- 12. ЗАКОН РАВНОМЕРНОГО РАСПРЕДЕЛЕНИЯ ЭНЕРГИИ ПО СТЕПЕНЯМ СВОБОДЫ
- 13. На колебательную степень свободы приходится удвоенная энергия,
- 14. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА. Энергия, связанная с
- 15. Определим внутреннюю энергию идеального газа: Внутренняя энергия - функция температуры.
- 16. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ I начало термодинамики говорит
- 17. I начало термодинамики в дифференциальной форме:
- 18. Изобарический процесс: δQ = dU +
- 19. Изохорический процесс: δQ = dU
- 20. Изотермический процесс: δQ = δA
- 21. ТЕПЛОЕМКОСТЬ
- 22. Удельной теплоемкостью вещества называется физическая величина, численно
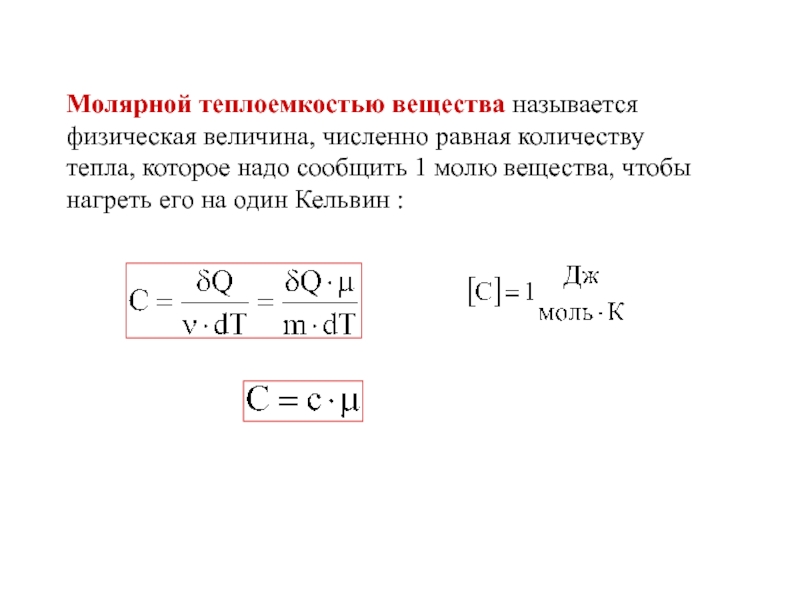
- 23. Молярной теплоемкостью вещества называется физическая величина, численно
- 24. Различают теплоемкость для случаев, когда
- 25. Тогда молярная теплоемкость при постоянном объеме равна:
- 26. Теплоемкость при постоянном давлении. Если нагревание
- 27. Определим соотношение между теплоемкостями при постоянном давлении и объеме:
- 28. для одноатомного газа для двухатомного газа
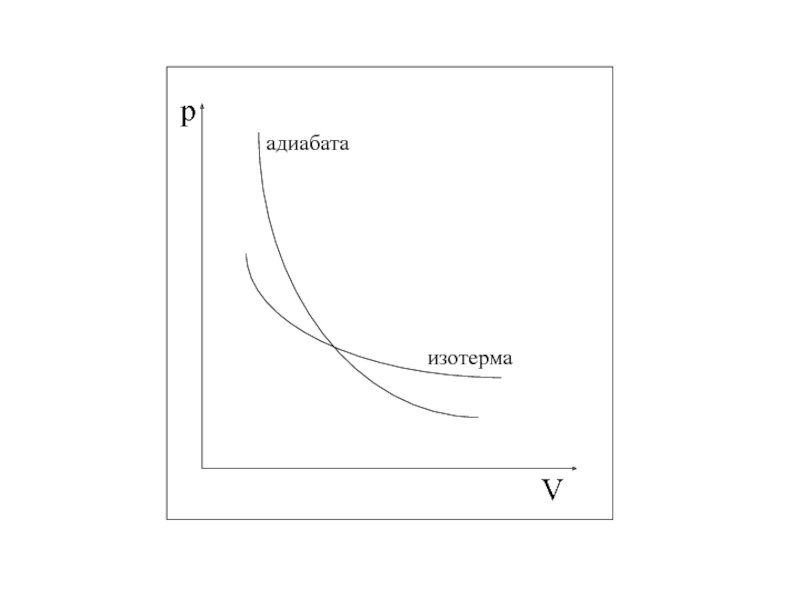
- 29. АДИАБАТИЧЕСКИЙ ПРОЦЕСС
- 30. показатель адиабаты или коэффициент Пуассона: Из уравнения можно получить:
- 31. Уравнение Пуассона (или уравнение адиабатного процесса) Уравнение, связывающее параметры идеального газа при адиабатном процессе.
- 33. Определим работу газа в ходе адиабатного процесса:
Слайд 1ТЕРМОДИНАМИКА
РАБОТА И ТЕПЛОПЕРЕДАЧА
Рассмотрим газ, находящийся в цилиндрическом сосуде, и отделенный от
Слайд 2Если газ, расширяясь, передвигает поршень на расстояние dL, то он производит
где dV = S⋅dL - изменение объема газа.
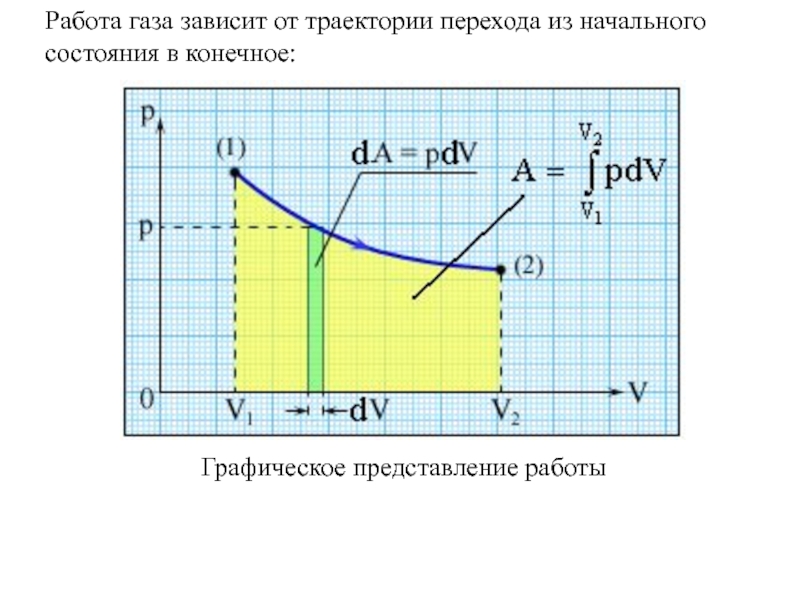
Слайд 3Графическое представление работы
Работа газа зависит от траектории перехода из начального состояния
Слайд 5Теплопередача - процесс обмена энергией между системой и окружающими ее телами,
Энергия, получаемая или отдаваемая системой в процессе теплопередачи называется количеством тепла Q (1 Дж).
Передача энергии от системы к внешним телам с изменением внешних макроскопических параметров называется работой.
Слайд 6Выражение для средней энергии молекул E = 3/2 kT учитывает только
СТЕПЕНИ СВОБОДЫ СИСТЕМЫ. РАСПРЕДЕЛЕНИЕ ЭНЕРГИИ ХАОТИЧЕСКОГО ДВИЖЕНИЯ МОЛЕКУЛ ПО СТЕПЕНЯМ СВОБОДЫ.
Слайд 7Число степеней свободы материального объекта - это число независимых координат, которые
i = iпост. + iвращ. + iколеб.
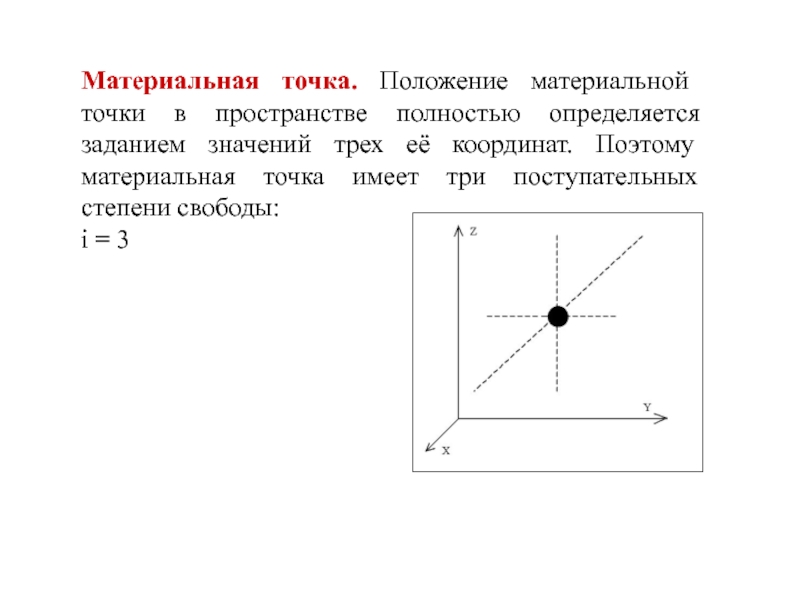
Слайд 8Материальная точка. Положение материальной точки в пространстве полностью определяется заданием значений
i = 3
Слайд 9Две материальные точки с жесткой связью.
Такая система может совершать поступательное
i = 5
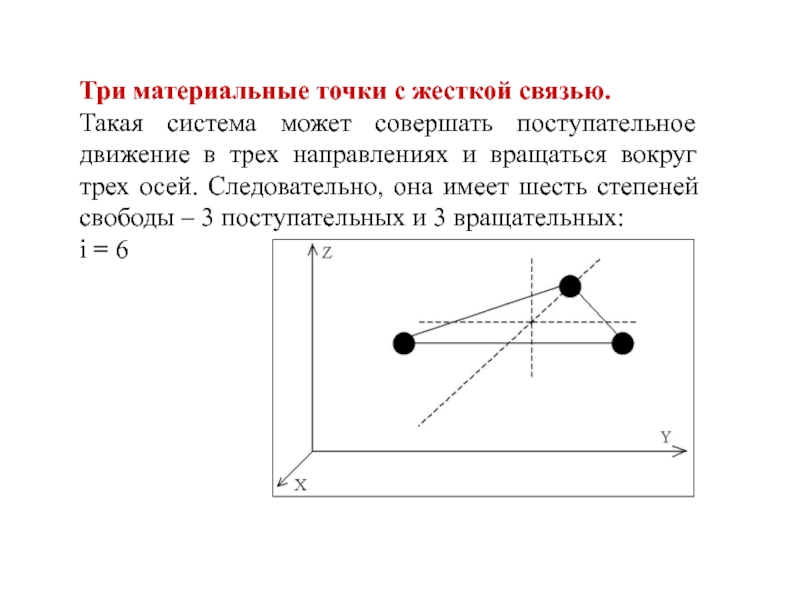
Слайд 10Три материальные точки с жесткой связью.
Такая система может совершать поступательное
i = 6
Слайд 11
Две материальные точки с упругой связью. Такая система имеет шесть
Слайд 12ЗАКОН РАВНОМЕРНОГО РАСПРЕДЕЛЕНИЯ ЭНЕРГИИ ПО СТЕПЕНЯМ СВОБОДЫ МОЛЕКУЛ
Выражение для
Энергия, приходящаяся на каждую поступательную степень свободы равна:
Слайд 13На колебательную степень свободы приходится удвоенная энергия, так как колеблющаяся частица
Средняя энергия хаотического теплового движения одной молекулы равна:
Закон Больцмана о равномерном распределении энергии по степеням свободы:
На каждую поступательную и вращательную степень свободы приходится в среднем энергия kT/2, а на каждую колебательную степень свободы - энергия kT.
Слайд 14ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА.
Энергия, связанная с внутренними движениями частиц системы и
Слайд 16ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
I начало термодинамики говорит о сохранении полной энергии.
Количество тепла,
Количество теплоты Q - мера переданной энергии при теплообмене.
Слайд 17 I начало термодинамики в дифференциальной форме:
dQ = dU +
dQ и dA нельзя рассматривать как приращения величин Q и A.
Для записи элементарного количества тепла и элементарной работы будем использовать другие символы δQ и δA соответственно: δQ = dU + δA
Слайд 18Изобарический процесс: δQ = dU + δA
Подводимое к газу тепло
Рассмотрим применение I начала термодинамики к изопроцессам в газах:
Слайд 19Изохорический процесс: δQ = dU (δA = 0,
При изохорическом процессе подводимое к газу тепло затрачивается на изменение внутренней энергии газа. Работа расширения равна нулю.
Слайд 20Изотермический процесс: δQ = δA (dU = 0, т.к.
Подводимое к газу тепло при изотермическом процессе затрачивается только на совершение работы.
Слайд 22Удельной теплоемкостью вещества называется физическая величина, численно равная количеству тепла, которое
Слайд 23Молярной теплоемкостью вещества называется физическая величина, численно равная количеству тепла, которое
Слайд 24
Различают теплоемкость для случаев, когда нагревание происходит при постоянном объеме
Теплоемкость при постоянном объеме.
Если нагревание происходит при постоянном объеме, система не совершает работы над внешними телами и, следовательно, согласно первому началу термодинамики, все тепло идет на приращение внутренней энергии тела:
δQ = dU + δA δА = 0 δQ = dU