- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термодинамика. Основные понятия и определения. Теплота и работа как форма передачи энергии презентация
Содержание
- 1. Термодинамика. Основные понятия и определения. Теплота и работа как форма передачи энергии
- 2. Литература 1. Луканин В.Н., Шатров М.Г. Теплотехника:
- 3. Техническая термодинамика Изучает закономерности взаимного превращения теплоты
- 4. Рабочее тело Посредник, с помощью которого
- 5. Термодинамическая система (ТДС) Совокупность рабочих тел, обменивающихся
- 6. Классификация ТДС Изолированные – отсутствует обмен веществом
- 7. Состояния рабочего тела Стационарное (равновесное) состояние системы
- 8. Макропараметры При взаимодействии с окружающей средой рабочее
- 9. Интенсивные – не зависят от количества вещества
- 10. Термодинамические параметры Макроскопические физические величины, характеризующие систему в состоянии равновесия, − термодинамические параметры состояния системы.
- 11. Основные параметры Абсолютное давление – ,
- 12. Термическое уравнение состояния рабочего тела Характеризует термодинамическое
- 13. Идеальный и реальный газ Идеальный газ –
- 14. Термическое уравнение состояния идеальных газов
- 15. Уравнение состояния реальных газов Межмолекулярные силы отталкивания
- 16. Уравнение состояния реальных газов Сила притяжения по
- 17. Уравнение Ван-дер-Ваальса При больших удельных объемах и
- 18. Законы идеальных газов Закон Дальтона –
- 19. Состав смеси Массовая доля: Мольная
- 20. Соотношения для расчёта смесей идеальных газов
- 21. Теплоёмкость Теплоёмкость C − количество теплоты, необходимой
- 22. Теплоёмкость Теплоёмкость газов величина переменная, зависит от
- 23. Теплоёмкость изохорная − удельная изохорная
- 24. Теплоёмкость Массовая (удельная) теплоёмкость Объёмная теплоёмкость Связь объёмной и массовой теплоёмкостей
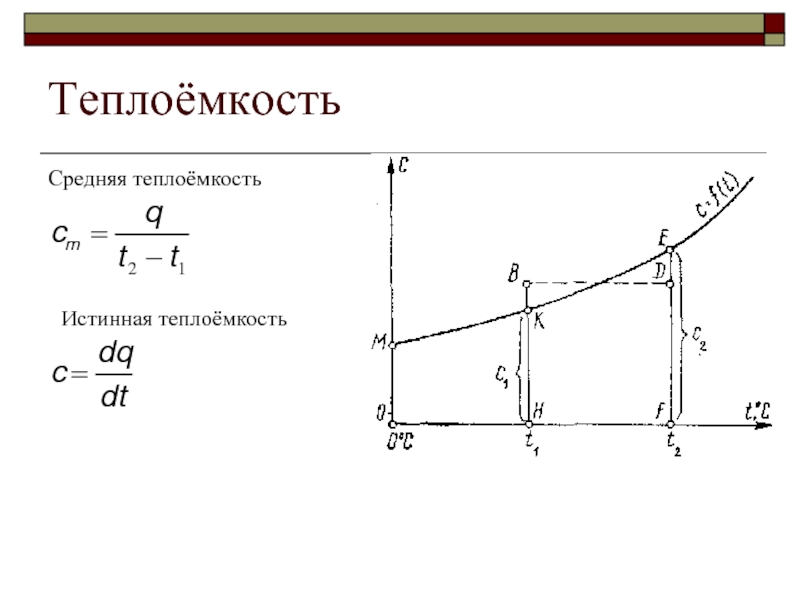
- 25. Теплоёмкость Средняя теплоёмкость Истинная теплоёмкость
- 26. Теплоёмкость
- 27. Теплоёмкость Теплоёмкость газов изменяется с изменением температуры,
- 28. Нелинейную зависимость истинной теплоёмкости от температуры представляют
- 31. Теплоёмкость газовой смеси Массовая теплоёмкость Объёмная теплоёмкость Мольная теплоёмкость
- 32. Теплота и работа Теплота и работа представляют
- 33. Различия Работа Макроскопический процесс; Пополняет запас
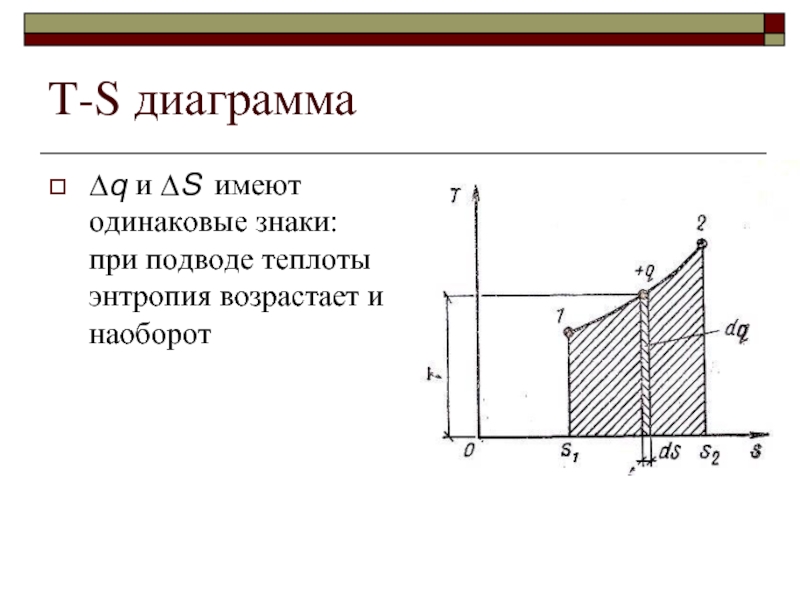
- 34. T-S диаграмма и
- 35. Эквивалентность теплоты и работы Эквивалентность теплоты и
- 36. Внутренняя энергия Совокупность всех видов энергии тела
- 37. Внутренняя энергия Идеальные газы – энергия взаимодействия
- 38. Энтальпия Тепловая функция: Удельная энтальпия:
- 39. Энтропия Удельная энтропия: Энтропия –
Слайд 1Термодинамика
Основные понятия и определения. Теплота и работа как форма передачи энергии.
Слайд 2Литература
1. Луканин В.Н., Шатров М.Г. Теплотехника: Учебник для вузов. − М:
2. Михеев М.А., Михеева И.М. Основы теплопередачи. − Минск: Высшая школа А, 2010. − 320 с.
3. Белоусов Н.А., Задирей В.Н. Термодинамика и теплопередача (основы теории, типовые задачи, задания и методические указания): учебное пособие. − Ухта: УГТУ, 2008. − 91 с.
Слайд 3Техническая термодинамика
Изучает закономерности взаимного превращения теплоты и работы, происходящие в макроскопических
Изучает свойства тел, участвующих в этих превращениях;
Свойства процессов, протекающих в тепловом оборудовании;
Слайд 4Рабочее тело
Посредник, с помощью которого в тепловых машинах, установках получают
Рабочее тело может состоять из одного или нескольких веществ, быть гомогенным или гетерогенным.
Рабочие тела в термодинамике – газы и пары.
Слайд 5Термодинамическая система (ТДС)
Совокупность рабочих тел, обменивающихся энергией и веществом между собой
Окружающая среда – все, что не включено в систему, но может с ней взаимодействовать.
ТДС отделяется от окружающей среды реальной или мысленной границей
Слайд 6Классификация ТДС
Изолированные – отсутствует обмен веществом и энергией с окружающей средой;
Закрытые
Открытые – присутствует обмен веществом (поток пара или газа в турбинах);
Термодинамически изолированные или адиабатная – отсутствует обмен теплотой.
Слайд 7Состояния рабочего тела
Стационарное (равновесное) состояние системы – это такое состояние, при
Неравновесное состояние – …
Слайд 8Макропараметры
При взаимодействии с окружающей средой рабочее тело переходит из одного состояния
Макропараметры поддаются прямому измерению.
Физические величины, свойственные конкретному состоянию рабочего тела, подразделяются на интенсивные и экстенсивные.
Слайд 9Интенсивные – не зависят от количества вещества в системе;
Экстенсивные – изменяются
Удельные – отнесенные к единице количества вещества (относятся к интенсивным)
, энергия, масса
Удельный объем
Удельная теплота
Удельная работа
Слайд 10Термодинамические параметры
Макроскопические физические величины, характеризующие систему в состоянии равновесия, − термодинамические
Слайд 11Основные параметры
Абсолютное давление – , Па;
Абсолютная температура – ,
Удельный объем – , м3/кг.
Слайд 12Термическое уравнение состояния рабочего тела
Характеризует термодинамическое состояние вещества, находящегося в состоянии
Слайд 13Идеальный и реальный газ
Идеальный газ – отсутствуют силы взаимодействия между молекулами;
Реальный газ – нельзя пренебречь силами взаимодействия между молекулами и объемом молекул.
Слайд 14Термическое уравнение состояния идеальных газов
где – газовая постоянная, Дж/(кг⋅К);
– универсальна газовая
постоянная.
Для идеальной смеси газов, химически не взаимодействующих друг с другом,:
Слайд 15Уравнение состояния реальных газов
Межмолекулярные силы отталкивания позволяют молекулам сближаться до некоторого
Свободный для движения молекул объем − ,
где – наименьший объем, до которого можно сжать газ.
Длина свободного пробега молекул уменьшается и давление увеличивается:
Слайд 16Уравнение состояния реальных газов
Сила притяжения по направлению совпадает с внешним давлением
Уравнение Ван-дер-Ваальса
Слайд 17Уравнение Ван-дер-Ваальса
При больших удельных объемах и невысоких давлениях реального газа уравнение
Уравнение не учитывает склонность молекул к ассоциации в отдельные группы.
Слайд 18Законы идеальных газов
Закон Дальтона – давление смеси газов равно сумме парциальных
Закон Амаго – объем смеси равен сумме парциальных объемов компонентов. Парциальный объем – объем, который занимал бы компонент, если бы он один находился при параметрах смеси ( ):
Слайд 21Теплоёмкость
Теплоёмкость C − количество теплоты, необходимой для изменения на 1 градус
Дж/К.
Различают:
Удельную теплоёмкость – , Дж/(кг⋅К);
Мольную теплоёмкость − , Дж/(моль⋅К);
Объемную теплоёмкость − , Дж/(м3⋅К).
Слайд 22Теплоёмкость
Теплоёмкость газов величина переменная, зависит от температуры:
истинная;
средняя.
Теплоёмкость газов зависит от протекания
изохорная;
изобарная.
Слайд 23Теплоёмкость
изохорная
− удельная изохорная теплоёмкость
− объёмная
− мольная (молярная) изохорная теплоёмкость
изобарная
− удельная изобарная теплоёмкость
− объёмная изобарная теплоёмкость
− мольная (молярная) изобарная теплоёмкость
Слайд 24Теплоёмкость
Массовая (удельная) теплоёмкость
Объёмная теплоёмкость
Связь объёмной и массовой теплоёмкостей
Слайд 27Теплоёмкость
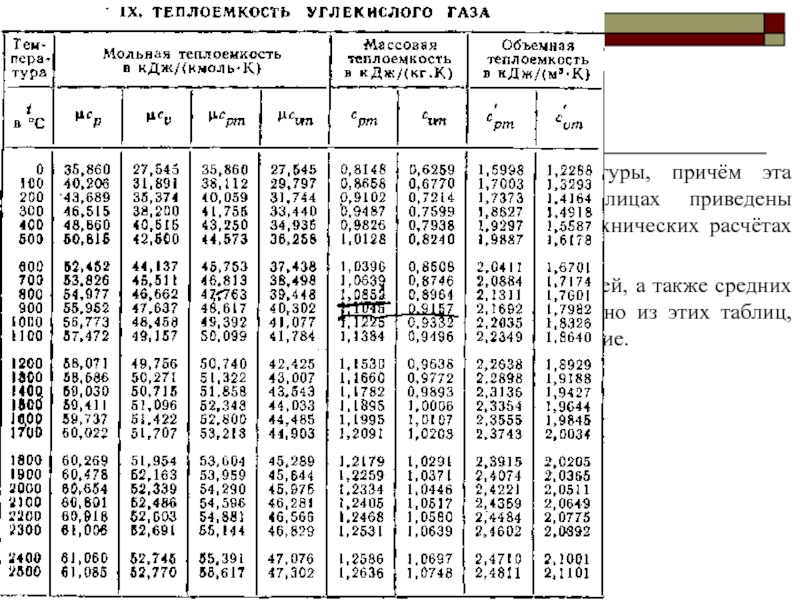
Теплоёмкость газов изменяется с изменением температуры, причём эта зависимость имеет криволинейный
При пользовании таблицами значения истинных теплоёмкостей, а также средних теплоёмкостей в пределах от 0°С до t берут непосредственно из этих таблиц, причём в необходимых случаях производится интерполирование.
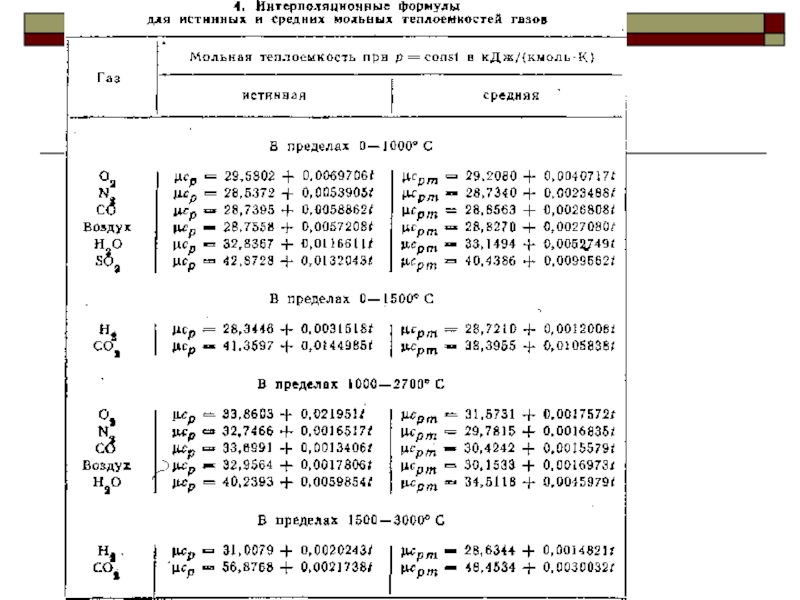
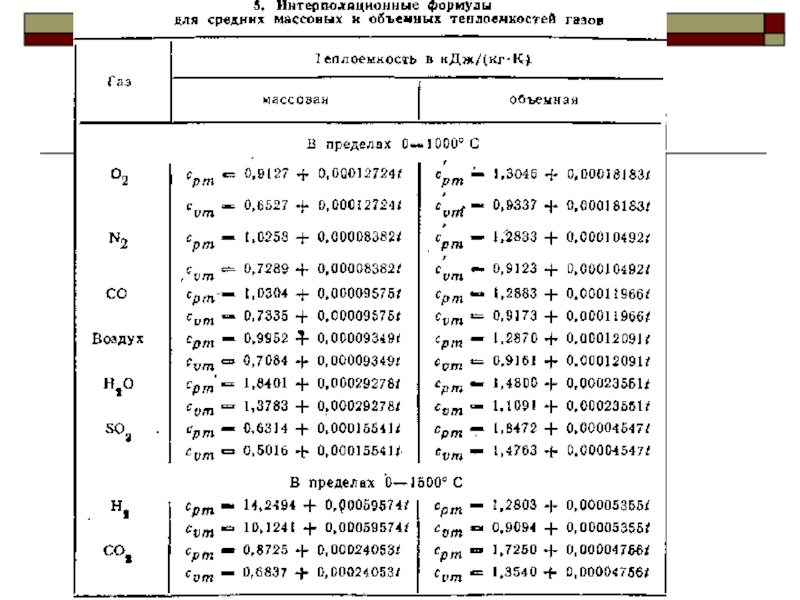
Слайд 28Нелинейную зависимость истинной теплоёмкости от температуры представляют обычно уравнением вида
Линейная зависимость
Средняя теплоёмкость при изменении температуры от t1 до t2
Средняя теплоёмкость при изменении температуры от 0°С до t
Средняя теплоёмкость при нелинейной зависимости
Слайд 32Теплота и работа
Теплота и работа представляют две формы передачи энергии от
Необходимо два тела;
Пополняется запас энергии.
Мерой энергии, передаваемой этими двумя формами передачи энергии от одного тела к другому, является количество теплоты и работы.
Слайд 33Различия
Работа
Макроскопический процесс;
Пополняет запас любого вида энергии;
Теплота
Совокупность микроскопических процессов;
Пополняет только внутреннюю энергию;
Слайд 35Эквивалентность теплоты и работы
Эквивалентность теплоты и работы численно установлена Ю.Майером и
1 ккал=4,18 кДж
Слайд 36Внутренняя энергия
Совокупность всех видов энергии тела или системы в данном состоянии,
Включает энергию теплового движения молекул и потенциальную энергию их взаимодействия.
Слайд 37Внутренняя энергия
Идеальные газы – энергия взаимодействия равна нулю, энергия их теплового
Слайд 38Энтальпия
Тепловая функция:
Удельная энтальпия:
При постоянном давлении изменение энтальпии равно количеству теплоты, подведенной
Изменение энтальпии определяется только начальным и конечным состоянием газа и не зависит от характера процесса.
Слайд 39Энтропия
Удельная энтропия:
Энтропия – параметр, изменяющийся от количества переданной теплоты.
Энтропию нельзя измерить,